|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Альдегиды и кетоны. Реферат на тему альдегиды
Реферат Альдегиды
скачатьРеферат на тему:
План:
- Введение
- 1 Методы синтеза
- 2 Важнейшие альдегиды
- 3 Химические свойства
- 4 Биологическое действие Примечания
Введение
Альдегиды
Альдегиды (от лат. alcohol dehydrogenatum — спирт, лишённый водорода) — класс органических соединений, содержащих карбонильную группу (С=О) с одним алкильным или арильным заместителем.
Альдегиды и кетоны весьма схожи, различие заключается в том, что последние имеют при карбонильной группе два заместителя. Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:
С=О ↔ С+—О−
Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов, как выраженных электрофилов. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная:
RC(O)H → RC(OH)2H, где R — Н, любой алкильный или арильный радикал.
Простейшие альдегиды имеют резкий характерный запах (например, бензальдегид — запах миндаля).
Под действием гидроксиламина превращаются в оксимы: СН3СНО + Nh3OH = Ch4C(=NOH)H + h3O
Обратите внимание: формулы следует писать в виде R-CHO или R-HC=O. Если писать в виде R-COH, можно подумать, что "OH" - гидроксогруппа.1. Методы синтеза
- Окислением первичных спиртов.
- Окислением виц-диолов йодной кислотой.
2. Важнейшие альдегиды
| Формальдегид | HCHO | −92 °C | −19 °C |
| Ацетальдегид | Ch4CHO | −123 °C | 20,8 °C |
| Пропаналь | Ch4Ch3CHO | −81 °C | 48,8 °C |
| Бутаналь | Ch4Ch3Ch3CHO | −97 °C | 75 °C |
| Акролеин | Ch3=CH-CHO | −88 °C | 52,5 °C |
| Кротоновый альдегид | Ch4-CH=CH-CHO | −76,5 °C | 104 °C |
| Бензальдегид | C6H5-CHO | −56 °C | 179 °C |
| Салициловый альдегид | 1,6 °C | 197 °C | |
| Фурфурол | −36.5 °C | 161.7 °C |
3. Химические свойства
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2Ag.
Реакция «медного зеркала». Окислителем здесь выступает Cu(OH)2, гидроксид меди (II)
R—CHO + 2Cu(OH)2 → R—COOH + Cu2O + 2h3O
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
R—CHO + HCN → R-CH(OH)-CN
Присоединение гидросульфита натрия. Используется для выделения альдегидов из растворов.
R—CHO + NaHSO3 → R-CH(OH)-SO3Na
Проявляют свойства органических оснований.
4. Биологическое действие
Токсичны. Способны накапливаться в организме. Кроме общетоксичного, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами. [1]
С другой стороны — входят в состав пищевых продуктов и эссенций (например, ананасовой [2]). Любое вещество, даже самое необходимое, может вызывать токсические эффекты. Действие вещества определяется дозой. В силу сходства химического строения все альдегиды обладают указанными у Лойта свойствами, только чтобы они проявились нужно принять дозу вещества много бо́льшую, чем содержится в пачке миндального печенья. Среднесмертельная доза ароматизатора бензальдегида (для крыс при пероральном введении) составляет 1300 мг на килограмм массы тела (для сравнения: у хлорида натрия среднесмертельная доза — 3000 мг/кг). У «настоящего яда» формальдегида LD50=100 мг/кг.
Альдегиды
wreferat.baza-referat.ru
Альдегиды, Химия - Реферат
Реферат по предмету: Химия (Пример)
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ 3
ЛИТЕРАТУРНЫЙ ОБЗОР 4
1. НОМЕНКЛАТУРА И СТРОЕНИЕ 4
2. СПОСОБЫ ПОЛУЧЕНИЯ 6
3. ФИЗИЧЕСКИЕ СВОЙСТВА 8
4. ХИМИЧЕСКИЕ СВОЙСТВА 9
ПРАКТИЧЕСКАЯ ЧАСТЬ 15
ВЫВОДЫ 16
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: 17
Содержание
Выдержка из текста
).
Альдегиды вступают в реакцию диспропорционирования с концентрированными водными растворами щелочей, которая называется реакцией Канницаро. Одна молекула альдегида окисляется, другая — восстанавливается: формиат калияАльдольная конденсация (присоединение) в присутствии разбавленных растворов NaOHдает β-гидроксиальдегиды:альдоль (альдегид-алкоголь)Главное условия возможности реакции — наличие в молекуле альдегида атома водорода в α-положении к карбонильной группе. Продукты альдольной конденсации, имеющие водород при α-углеродном атоме, в присутствии оснований при слабом нагреве легко отщепляют воду. Образуются α, β-ненасыщенные алльдегиды. Данный процесс носит название кротоновой конденсации: кротоновый альдегидЭлектроноакцепторный эффект карбонильной группы объясняет высокую CH-кислотность альдегидов.
Для альдегидов характерно нахождение в двух формах: кетонной и енольной, при этом равновесие смещено в сторону кето-формы:Кетонная и енольная формы являются изомерами. Такой вид изомерии называется таутомерией.
Хотя енольная форма в альдегидах содержится в малом количестве, возможность перехода и нахождения альдегидов в енольной форме сказывается на их химическом поведении.α-Галогенирование альдегидов протекает с замещением атомов водорода при α-углеродном атоме. ПРАКТИЧЕСКАЯ ЧАСТЬАльдегиды играют важную роль как в промышленности и сельском хозяйстве, так и в медицине и повседневной жизни. Некоторые альдегиды содержатся в растениях, вырабатываются в организмах животных и влияют на их жизнедеятельность. Доказана зависимость ацетальдегида с никотином, которая усиливает пристрастие к табакокурению.
Формальдегид. Производство формальдегида составляет 6 млн тонн/год. Он применяется при производстве полимеров: фенолоформальдегидных смол, лекарств, синтетического каучука, в производстве важных продуктов органического синтеза, а также при дублении кожи, консервировании биопрепаратов. Формальдегид транспортируется в виде формалина, который служит антисептиком. При длительном стоянии водных растворов формальдегида, особенно при низких температурах, а также при упаривании в них осаждается параформ. Параформальдегид с большим молекулярным весом — ценный синтетический материал, используемый в качестве заменителя металлов. Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирте получают различные лаки. Особенно широко применение альдегидов в медицине: формалин, формидрон (жидкость для протирания кожи при повышенной потливости), мазь формальдегидная, лизоформ (применяют в гинекологии), уротропин (при инфекционных процессах мочевыводящих путей), уросал, кальцекс, циминаль (при лечении ран, ожогов).
Ацетальдегид. Основное количество вырабатываемого ацетальдегида идет на производство уксусной кислоты и ангидрида. Также из него получают этиловый спирт, бутиловый спирт, ацетали и ряд других веществ, в том числе полимеры. ВЫВОДЫАльдегиды — ценные продукты органического синтеза, вырабатываемые в больших количествах, при этом они сами являются сырьем для производства различных веществ. Они необходимы для получения пластмасс, лаков, лекарственных веществ, красителей, карбоновых кислот и т. д. Незаменимы альдегиды в медицине и электротехнике, парфюмерии и кулинарии. Формальдегид используется в составе косметических препаратов, в качестве консерванта и антисептика. Формалин широко применяется в качестве дезинфицирующего вещества для дезинфекции зерно- и овощехранилищ, парников, теплиц, для протравливания семян и т. д. [4].
Ацетальдегид — один из наиболее важных альдегидов, широко встречающийся в природе и синтезирующийся в промышленности. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма, вырабатывается в печени животных. Он токсичен и является канцерогеном первой группы. Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т. / В.Ф. Травень. — М.: ИКЦ «Академкнига», 2006. — Т. 2. — 2006. 582 с.: ил. Моррисон Р., Бойд Р. Органическая химия: перевод с англ. — М.: Издательство «МИР», 1974. — 1133 с. Нейланд О.Я. Органическая химия: Учеб. для хим. спец. вузов. — М.: Высш. шк., 1990. — 751 с: ил.ПетровА.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов. // Под ред. Стадничука М.Д. — 5-е изд., перераб. И доп. — СПб. «Иван Федоров», 2002. — 624 с., илл.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ:
1. Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т. / В.Ф. Травень. — М.: ИКЦ «Академкнига», 2006. — Т. 2. — 2006. 582 с.: ил.
2. Моррисон Р., Бойд Р. Органическая химия: перевод с англ. — М.: Издательство «МИР», 1974. — 1133 с.
3. Нейланд О.Я. Органическая химия: Учеб. для хим. спец. вузов. — М.: Высш. шк., 1990. — 751 с: ил.
4. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов. // Под ред. Стадничука М.Д. — 5-е изд., перераб. И доп. — СПб. «Иван Федоров», 2002. — 624 с., илл.
список литературы
referatbooks.ru
Реферат - Альдегиды и кетоны
Введение
Это единения, содержащие карбонильную группу = С = О. У альдегидов карбонил связан радикалом и водородом. Общая формула альдегидов:
/>R – C = O
H
У кетонов карбонил связан с двумя радикалами. Общая формула кетонов:
/>R 1– C = O
R2
Альдегиды являются более активными, чем кетоны (у кетонов карбонил как бы блокирован радикалами с обеих сторон).
Классификация
1.по углеводородному радикалу (предельные, непредельные, ароматические, циклические).
2.по числу карбонильных групп (одна, две и тд.)
Изомерия и номенклатура
Изомерия альдегидов обусловлена изомерией углеродного скелета. У кетонов помимо изомерии углеродного скелета наблюдается изомерия положения карбонильной группы. По тривиальной номенклатуре альдегиды называют соответственно карбоновым кислотам, в которые они переходят при окислении. По научной номенклатуре названия альдегидов складываются из названий соответствующих углеводородов с добавлением окончания аль. Атом углерода альдегидной группы определяет начало нумерации. По эмпирической номенклатуре кетон называют по радикалам, связанным с карбоксилом с добавлением слова кетон. По научной номенклатуре названия кетонов складываются из названий соответствующих углеводородов с добавлением окончания ОН, в конце ставят номер углеродного атома, при котором стоит карбонил. Нумерацию начинают от ближайшего к кетонной группе конца цепи.
/>Представители предельных альдегидов. Cnh3n+1C=O
H
Формула
Тривиальное название
Научное название
/>Н – С = О
Н
Муравьиный
Формальдегид
метаналь
/>СН3 – С = О
Н
Уксусный
Ацетальдегид
Этаналь
/>СН3 – СН2 – С = О
Н
Пропионовый
Пропаналь
/>СН3 – СН2 – СН2 – С = О
Н
Масляный
Бутаналь
/>СН3 – (СН2)3 – С = О
Н
Валериановый
Пентаналь
/>СН3 – (СН2)4 – С = О
Н
Капроновый
Гексаналь
Представители предельных кетонов
Формула
Эмпирическое название
Научное название
/>СН3 – С = О
СН3
Диметилкетон
Пропанон
/>СН3 – С = О
СН2 – СН3
Метилэтилкетон
Бутенон
/>СН3 – С = О
СН2 – СН2 – СН3
Метилпропилкетон
Пентанон -2
/>СН3 – СН2 – С = О
СН2 – СН3
Диэтилкетон
Пентанон -3
/>СН3 – С = О
/>СН – СН3
СН3
метилпропилкетон
3-метилбутанон-2
Способы получения
1) Путем окисления спиртов. Из первичных спиртов получаются альдегиды, из вторичных кетоны. Окисление спиртов происходит при действии сильных окислителей (хромовая смесь) при небольшом нагревании. В промышленности в качестве окисления используют кислород воздуха в присутствии катализатора – меди (Cu) при t0= 300-5000С
/>/>СН3 – СН2 – СН2 – ОН + О К2Cr2O7Ch4 – Ch3 – C =O + HOH
пропанол -1 H
пропаналь
/>/>/>СН3 – СН – СН3 + О К2Cr2O7 СН3 – С – СН3
ОН О
пропанол -2 пропанон
2) Термическое разложение кальциевых солей карбоновых кислот, причем, если взть соль муравьиной кислоты, то образуются альдегиды, а если других кислот, то кетоны.
--PAGE_BREAK--/>СН3 – С = О
/>/>/>/>О – Са прокаливание СаСО3 + СН3 – С = О
/>Н –С – О Н
О уксусный альдегид
/>СН3 – С = О
/>/>/>/>О – Са прокаливание СаСО3 + СН3 – С = О
/>СН3 –С – О СН3
О ацетон
Это лабораторные способы получения.
3) По реакции Кучерова (из алкинов и воды, катализатор – соли ртути в кислой среде). Из ацетилена образуются альдегиды, из любых других алкинов – кетоны.
/>/>/>/>СН = СН + НОН СН2 = СН – ОН СН3 – С = О
ацетилен виниловый СН3
спирт уксусный альдегид
/>/>/>/>/>СН3 – С = СН + НОН СН3 – С = СН2 СН3 – С = О
пропин ОН СН3
пропенол – 2 ацетон
4) Оксосинтез. Это прямое взаимодействие алкенов с водным газом (СО+Н2) в присутствии кобальтового или никелевого катализаторов под давлением 100- 200 атмосфер при t0= 100-2000С. По этому способу получают альдегиды
/>
/>/>/>СН3 – СН2 – СН2 – С = О
бутаналь Н
/>СН3 – СН = СН2 + СО + Н2
/>/>/>СН3 – СН – С = О
СН3 Н
2-метилпропаналь
5) Гидролиз дигалогенпроизводных. Если оба галогена находятся при первичном углеродном атоме, то образуется альдегид, если при вторичном – кетон.
/>/>/>СН3– СН2– С– CL2+ HOH 2HCL + Ch4– Ch3– C = O
H H
1,1-дихлорпропенпропеналь
/>/>/>/>СН3– С– Ch4+ HOH 2HCL + Ch4– C = O
CL CL Ch4
2,2-дихлорпропан пропанон
Муравьиный альдегид – газ, другие низшие альдегиды и кетоны – жидкости, легко растворимые в воде; альдегиды обладают удушливым запахом, который при сильном разведении становится приятным(цветочным или фруктовым). Кетоны пахнут довольно приятно. Следовательно карбонил = С =О носитель запаха, поэтому альдегиды и кетоны применяются в парфюмерной промышленности. температура кипения альдегидов и кетонов возрастает по мере увеличения молекулярного веса.
Природа карбонильной группы
/>Большинство реакций альдегидов и кетонов обусловлено присутствием карбонильной группы. рассмотрим природу карбонила = С =О. например,
/>R – C = O
H
1.углерод с кислородом в карбониле связаны двойной связью: одна сигма — связь, другая пи – связь. За счет разрыва П- связи у альдегидов и кетонов идут реакции присоединения (нуклеофильного типа):
/>/>/>R – C = O R – C – O :
H H
Кислород является более электроотрицательным элементом, чем углерод, и поэтому электронная плотность у атома кислорода больше, чем у атома углерода. При реакциях присоединения к углероду будет присоединяться нуклеофильная часть реагента, к кислороду – электрофильная часть.
2.приреакциях замещения может замещаться кислород карбонила. При этом происходит разрыв двойной связи между С и О
3.карбонил влияет на связи С – Н в радикале, ослабляя их, особенно в альфа-положении, то есть рядом с карбонильной группой.
/>/>/>Н Н Н
/>/>/>/>Н – αС –βС – γС – С = О
Н Н Н Н
При действии свободных галогенов будет замещаться водород в углеродном радикале при альфа- углеродном атоме.
/>/>/>/>СН3 – СН2 – СН2 – С = О + СL2Ch4 – Ch3 – CH – C = O + HCL
ОН CL OH
α–хлормасляный альдегид
Химические свойства
Из всех классов органических соединений альдегиды и кетоны самые реакционноспособные. Причем в химическом отношении альдегиды более активны, чем кетоны. Для них характерны следующие реакции: окисления, присоединения, замещения, полимеризации, конденсации. Для кетонов не характерны реакции полимеризации.
Реакции окисления
Альдегиды окисляются легко, даже слабыми окислителями HBrO, [Ag(Nh4)2]OH, раствор Фелинга. При окислении альдегидов образуются карбоновые кислоты.
продолжение --PAGE_BREAK--/>/>/>СН3 – С = О + О СН3 – С = О – уксусная кислота
Н ОН
Если окислителем является [Ag(Nh4)2]OH, то выделяется свободное серебро (реакция «серебряного зеркала» — это качественная реакция на альдегиды).
/>
/>/>/>/>СН3 – С = О + 2[Ag(Nh4)2]OH СН3 – С = О + 2 Ag + 4 Nh4 + Н2О
Н ОН
Окисление кетонов происходит гораздо труднее и только сильными окислителями. Продуктами окисления являются карбоновые кислоты. При окислении кетона образуется спиртокетон, затем дикетон, который, разрываясь, образует кислоты.
/>/>/>/>/>/>/>/>/>СН3 – СН2 – С – СН2 – СН3+ О СН3 – СН – С – СН2 – СН -Н2О+О СН3 – С – С – СН2 – СН3+О +Н2О
О ОН О О О
диэтилкетон спиртокетон дикетон
/>/>/>СН3 – С = О + О = С – СН2 – СН3
ОН ОН
уксусная к-та пропионовая к-та
В случае смешанного кетона окисление протекает по правилу Попова – Вагнера, то есть главное направление реакции – окисление соседнего с карбонилом наименее гидрированного атома углерода. Но помимо с главным направлением будет и побочное направление реакции, то есть окислится углеродный атом с другой стороны карбонила. При этом образуется смесь различных карбоновых кислот.
/>/>/>/>/>/>СН3 – С – СН – СН3 – спиртокетон +О — Н2О
О ОН
/>/>/>/>/>/>СН3 – С – СН2 – СН3 ОН О
/>/>О СН2 – С – СН2 – СН3 + О – Н2О
Бутанон-2 спиртокетон
/>/>/>/>/>/>/>СН3 – С – С – СН3+О +Н2О 2 СН3 – С = О
О О ОН
дикетон уксусная кислота
/>/>/>/>/>/>/>/>СН–С – СН2 – СН3 + О +Н2О НС = О + СН3 – СН2 – С = О
О О ОН ОН
дикетон муравьиная к-та пропионовая к-та
Реакции присоединения
Протекают за счет разрыва пи-связи в карбониле. Эти реакции нуклеофильного присоединения, то есть сначала к положительно заряженному углероду карбонила присоединяется нуклеофильная часть реагента со свободной электронной парой (протекает медленно):
/>/>= С+ = О- +: Х — = С – О –
Х
Вторая стадия – присоединение протона или другого катиона к образовавшемуся аниону (протекает быстро):
/>/>/>= С – О – + Н + = С – ОН
Х Х
1.Присоединение водорода.
При этом из альдегидов получаются первичные спирты, из кетонов – вторичные. Реакция протекает в присутствии катализаторов Ni, Pt и др.
/>/>/>/>СН3 – С = О + Н +: Н — СН3 – С – Н
ОН Н ОН
уксусный альдегид этанол
/>/>/>/>СН3 – С – СН3 + Н+: Н — СН3 – СН – СН3
О ОН
пропанон пропанол -2
2.Присоединение бисульфата натрия (гидросульфата):
/>/>/>/>R – C = O + HSO3Na R – C – SO3Na
H OH H
При этом образуются бисульфитные производные. Эту реакцию используют для очистки альдегидов и кетонов и выделения их из примесей.
3.Присоединение синильной кислоты. При этом образуются α- оксинитрилы, которые являются промежуточными продуктами синтеза оксикислот, аминокислот:
/>OH
/>/>/>/>R – C = O + HCN R – C – C =N
H H
α- оксинитрил
4. Присоединение аммиака Nh4. При этом образуются оксиамины.
/>/>/>R – C = O + H – Nh3Ch4– CH – Nh3
H OH
Оксиамин
5. Присоединение магнийгалогенорганических соединений (реактив Гриньяра). Реакцию используют для получения спиртов.
6.Присоединение спиртов (безводных). При этом первоначально образуются полуацетали (как обычная реакция присоединения). Затем при нагревании с избытком спирта образуются ацетали (как простые эфиры).
/>/>/>/>/>/>R – C = O + СН3 – ОН R – CН – О – СН3+СН3ОНR – CН – О – СН3
H ОН О – СН3
полуацеталь ацеталь
В природе очень много соединений полуацетального и ацетального характера, особенно среди углеводов (сахаров).
продолжение --PAGE_BREAK--Реакции замещения
Кислород карбонильных групп может замещаться на галогены и некоторые азотсодержащие соединения.
1.Замещение галогенами. Происходит при действии на альдегиды и кетоны фосфорных соединений галогенов PCL3и PCL5. При действии же свободными галогенами замещается водород в углеводородном радикале при α-углеродном атоме.
/>/>+ PCL5Ch4– Ch3– CH –CL2+ POCL3
/>/>СН3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)
/>/>Н+CL2Ch4– CH – CH = O + HCL
пропаналь CL
α-монохлорпропионовый альдегид
2.Реакция с гидроксиамином Nh3OH. При этом образуются окислы альдегидов (альдоксилы) и кетонов (кетоксины).
/>СН3 – СН = О + Н2N – OH Ch4 – CH – N – OH + h3O
уксусный альдегид оксиэтаналь
Эту реакцию применяют для количественного определения карбоксильных соединений.
3.Реакция с гидразином Nh3 – Nh3. Продуктами реакции являются гидразины (когда реагирует одна молекула альдегида или кетона) и азины (когда реагируют две молекулы).
/>СН3 – СН = О + Nh3 – Nh3 СН3 – СН = N – Nh3
этаналь гидразин гидразин этаналь
/>СН3 – СН = N – Nh3 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
азин этаналь (альдазин)
4.Реакции с фенилгидразином. С6Н5 – NH – Nh3. Продуктами реакции являются фенилгидразины.
/>СН3 – СН = О + Н2N – NH – C6H5Ch4 – CH = N – NH – C6H5
Фенилгидразонэтаналь
Окислы, гидразины, азины, фенилгидразины – твердые кристаллические вещества с характерными температурами плавления, по которым определяют природу (строение) карбонильного соединения.
Реакции полимеризации
Характерны только для альдегидов. Но и то, только газообразные и летучие альдегиды (муравьиный, уксусный) подвергаются полимеризации. Это очень удобно при хранении этих альдегидов. муравьиный альдегид полимеризуется в присутствии серной кислоты или соляной, при нормальной температуре. Коэффициент полимеризации n=10-50. Продукт полимеризации – твердое вещество, называется – полиоксиметилен (формалин).
/>/>/>/>/>/>/>/>Н Н Н Н
/>/>/>/>/>/>/>Н – С = О – С – О – С – О – ...– С – … – С – О –
/>/>Н Н Н Н Н n
Полиоксиметилен
Это твердое вещество, но его можно превратить в муравьиный альдегид, разбавляя водой и слегка подогревая.
Уксусный альдегид под влиянием кислот образует жидкий циклический триммер- паральдозу и твердый тетрамер – метальдозу («сухой спирт»).
/>/>3 СН3 – СН = О О
СН3 — НС СН – СН3
О О
СН – СН3
паральдегид
/>/>/>/>4 СН3 – СН = О СН3 – НС О
/>/>О СН – СН3
/>/>СН5 – НС О
/>О СН – СН3
Метальдегид
Реакции конденсации
1.Альдегиды в слабо основной среде (в присутствии ацетона калия, поташа, сульфата калия) подвергаются альдольной конденсации с образованием альдегидо — спиртов, сокращенно называемых альдолями. Разработана эта реакция химиком А.П. Бородиным (он же композитор). В реакции участвует одна молекула своей карбонильной группой, а другая молекула водородом при α- углеродном атоме.
/>/>СН3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
ОН альдоль
(3 – оксибутаналь или β-оксимасляный альдегид)
/>/>/>/>СН3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
ОН ОН ОН
гексенциол-3,5-аль
С каждым разом увеличивается число групп ОН. Получается альдегидная смола при уплотнении большого числа молекул.
2. Кротоновая конденсация. для альдегидов она является продолжением альдольной конденсации, то есть при нагревании альдоль отщепляет воду с образованием непредельного альдегида.
/>/>/>СН3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
ОН ОН
кротоновый альдегид
Рассмотрим эти реакции для кетонов.
/>/>/>/>/>/>/>/>/>СН3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
СН3 СН3 ОН СН3 СН3 СН3 СН3
4 – окси – 4 – метилпентанон-2 4 – метилпентан -3-он-2
3.Сложноэфирная конденсация. Характерна только для альдегидов. Разработана В.Е.Тищенко. протекает в присутствии катализаторов алкоголятов алюминия (Ch4 – Ch3 – O)3AL.
/>/>Ch4 – CH = O + O = HC – Ch4Ch4 – СН2 – О – С = О
СН3
уксусноэтиловый эфир
Они содержат в углеводородном радикале двойную связь. Представители:
1.СН2 = СН – СН =О – пропен-2-аль — акриловый альдегид или акролеин
2.СН3 – СН = СН – СН = О – бутен – 2 – аль — кротоновый альдегид
Акролеин иначе называют чад, он получается при нагревании горении жиров. В химическом отношении непредельные альдегиды обладают всеми свойствами предельных по карбонильной группе, а за счет двойной связи в радикале могут вступать в реакции присоединения.
У этих альдегидов сопряженная система двойных связей, поэтому в химическом отношении они отличаются реакциями присоединения. Присоединение водорода, галогенов, галогенводородов происходит по концам сопряженной системы.
Электронная плотность смещена к кислороду и к нему направляются положительно заряженная часть реагента, а к положительно поляризованному углероду – отрицательная часть реагента.
/>/>/>/>СН2+= СН-– СН+= О-+ Н+: Br-Ch3– CH = CH – OH Ch3– Ch3– CH = O
Br Br
3-бромпропаналь
Образующаяся при этом енольная форма альдегида немедленно превращается в более устойчивую карбонильную форму. Таким образом присоединение галогенводородов в радикал идет против правила Марковникова.
Ароматические альдегиды
Представители С6Н5 –СН = О – бензойный альдегид. Это жидкость с запахом горького миндаля, содержится в косточках слив, вишен, диких абрикос и других плодах.
Список использованной литературы
Гранберг И.И. Органическая химия. — М., 2002
Ким А.М. Органическая химия. — Новосибирск, 2007
www.ronl.ru
Реферат - Альдегиды и кетоны
Введение
Это единения, содержащие карбонильную группу = С = О. У альдегидов карбонил связан радикалом и водородом. Общая формула альдегидов:
 R – C = O
R – C = O
H
У кетонов карбонил связан с двумя радикалами. Общая формула кетонов:
 R1 – C = O
R1 – C = O
R2
Альдегиды являются более активными, чем кетоны (у кетонов карбонил как бы блокирован радикалами с обеих сторон).
Классификация
1.по углеводородному радикалу (предельные, непредельные, ароматические, циклические).
2.по числу карбонильных групп (одна, две и тд.)
Изомерия и номенклатура
Изомерия альдегидов обусловлена изомерией углеродного скелета. У кетонов помимо изомерии углеродного скелета наблюдается изомерия положения карбонильной группы. По тривиальной номенклатуре альдегиды называют соответственно карбоновым кислотам, в которые они переходят при окислении. По научной номенклатуре названия альдегидов складываются из названий соответствующих углеводородов с добавлением окончания аль. Атом углерода альдегидной группы определяет начало нумерации. По эмпирической номенклатуре кетон называют по радикалам, связанным с карбоксилом с добавлением слова кетон. По научной номенклатуре названия кетонов складываются из названий соответствующих углеводородов с добавлением окончания ОН, в конце ставят номер углеродного атома, при котором стоит карбонил. Нумерацию начинают от ближайшего к кетонной группе конца цепи.
 Представители предельных альдегидов. Cn h3n+1 C=O
Представители предельных альдегидов. Cn h3n+1 C=O
H
| Формула | Тривиальное название | Научное название |
Н | Муравьиный Формальдегид | метаналь |
Н | Уксусный Ацетальдегид | Этаналь |
Н | Пропионовый | Пропаналь |
Н | Масляный | Бутаналь |
Н | Валериановый | Пентаналь |
Н | Капроновый | Гексаналь |
Представители предельных кетонов
| Формула | Эмпирическое название | Научное название |
СН3 | Диметилкетон | Пропанон |
СН2 – СН3 | Метилэтилкетон | Бутенон |
СН2 – СН2 – СН3 | Метилпропилкетон | Пентанон -2 |
СН2 – СН3 | Диэтилкетон | Пентанон -3 |
СН3 | метилпропилкетон | 3-метилбутанон-2 |
Способы получения
1) Путем окисления спиртов. Из первичных спиртов получаются альдегиды, из вторичных кетоны. Окисление спиртов происходит при действии сильных окислителей (хромовая смесь) при небольшом нагревании. В промышленности в качестве окисления используют кислород воздуха в присутствии катализатора – меди (Cu) при t0= 300-5000С

 СН3 – СН2 – СН2 – ОН + О К2Cr2O7 Ch4 – Ch3 – C =O+ HOH
СН3 – СН2 – СН2 – ОН + О К2Cr2O7 Ch4 – Ch3 – C =O+ HOH
пропанол -1 H
пропаналь


 СН3 – СН – СН3 + О К2Cr2O7 СН3 – С – СН3
СН3 – СН – СН3 + О К2Cr2O7 СН3 – С – СН3
ОН О
пропанол -2 пропанон
2) Термическое разложение кальциевых солей карбоновых кислот, причем, если взть соль муравьиной кислоты, то образуются альдегиды, а если других кислот, то кетоны.
 СН3 – С = О
СН3 – С = О



 О – Са прокаливание СаСО3 + СН3 – С = О
О – Са прокаливание СаСО3 + СН3 – С = О
 Н –С – О Н
Н –С – О Н
О уксусный альдегид
 СН3 – С = О
СН3 – С = О



 О – Са прокаливание СаСО3 + СН3 – С = О
О – Са прокаливание СаСО3 + СН3 – С = О
 СН3 –С – О СН3
СН3 –С – О СН3
О ацетон
Это лабораторные способы получения.
3) По реакции Кучерова (из алкинов и воды, катализатор – соли ртути в кислой среде). Из ацетилена образуются альдегиды, из любых других алкинов – кетоны.



 СН = СН + НОН СН2 = СН – ОН СН3 – С = О
СН = СН + НОН СН2 = СН – ОН СН3 – С = О
ацетилен виниловый СН3
спирт уксусный альдегид




 СН3 – С = СН + НОН СН3 – С = СН2 СН3 – С = О
СН3 – С = СН + НОН СН3 – С = СН2 СН3 – С = О
пропин ОН СН3
пропенол – 2 ацетон
4) Оксосинтез. Это прямое взаимодействие алкенов с водным газом (СО+Н2 ) в присутствии кобальтового или никелевого катализаторов под давлением 100- 200 атмосфер при t0= 100-2000С. По этому способу получают альдегиды
 |


 СН3 – СН2 – СН2 – С = О
СН3 – СН2 – СН2 – С = О
бутаналь Н
 СН3 – СН = СН2 + СО + Н2
СН3 – СН = СН2 + СО + Н2


 СН3 – СН – С = О
СН3 – СН – С = О
СН3 Н
2-метилпропаналь
5) Гидролиз дигалогенпроизводных. Если оба галогена находятся при первичном углеродном атоме, то образуется альдегид, если при вторичном – кетон.


 СН3 – СН2 – С – CL2 + HOH 2HCL + Ch4 – Ch3 – C = O
СН3 – СН2 – С – CL2 + HOH 2HCL + Ch4 – Ch3 – C = O
H H
1,1-дихлорпропенпропеналь



 СН3 – С – Ch4 + HOH 2HCL + Ch4 – C = O
СН3 – С – Ch4 + HOH 2HCL + Ch4 – C = O
CLCLCh4
2,2-дихлорпропан пропанон
Муравьиный альдегид – газ, другие низшие альдегиды и кетоны – жидкости, легко растворимые в воде; альдегиды обладают удушливым запахом, который при сильном разведении становится приятным(цветочным или фруктовым). Кетоны пахнут довольно приятно. Следовательно карбонил = С =О носитель запаха, поэтому альдегиды и кетоны применяются в парфюмерной промышленности. температура кипения альдегидов и кетонов возрастает по мере увеличения молекулярного веса.
Природа карбонильной группы
 Большинство реакций альдегидов и кетонов обусловлено присутствием карбонильной группы. рассмотрим природу карбонила = С =О. например,
Большинство реакций альдегидов и кетонов обусловлено присутствием карбонильной группы. рассмотрим природу карбонила = С =О. например,
 R – C = O
R – C = O
H
1.углерод с кислородом в карбониле связаны двойной связью: одна сигма — связь, другая пи – связь. За счет разрыва П- связи у альдегидов и кетонов идут реакции присоединения (нуклеофильного типа):


 R – C = OR – C – O :
R – C = OR – C – O :
HH
Кислород является более электроотрицательным элементом, чем углерод, и поэтому электронная плотность у атома кислорода больше, чем у атома углерода. При реакциях присоединения к углероду будет присоединяться нуклеофильная часть реагента, к кислороду – электрофильная часть.
2.приреакциях замещения может замещаться кислород карбонила. При этом происходит разрыв двойной связи между С и О
3.карбонил влияет на связи С – Н в радикале, ослабляя их, особенно в альфа-положении, то есть рядом с карбонильной группой.


 Н Н Н
Н Н Н



 Н – α С –β С – γ С – С = О
Н – α С –β С – γ С – С = О
Н Н Н Н
При действии свободных галогенов будет замещаться водород в углеродном радикале при альфа- углеродном атоме.



 СН3 – СН2 – СН2 – С = О + СL2 Ch4 – Ch3 – CH – C = O + HCL
СН3 – СН2 – СН2 – С = О + СL2 Ch4 – Ch3 – CH – C = O + HCL
ОН CLOH
α–хлормасляный альдегид
Химические свойства
Из всех классов органических соединений альдегиды и кетоны самые реакционноспособные. Причем в химическом отношении альдегиды более активны, чем кетоны. Для них характерны следующие реакции: окисления, присоединения, замещения, полимеризации, конденсации. Для кетонов не характерны реакции полимеризации.
Реакции окисления
Альдегиды окисляются легко, даже слабыми окислителями HBrO, [Ag(Nh4 )2 ]OH, раствор Фелинга. При окислении альдегидов образуются карбоновые кислоты.


 СН3 – С = О + О СН3 – С = О – уксусная кислота
СН3 – С = О + О СН3 – С = О – уксусная кислота
Н ОН
Если окислителем является [Ag(Nh4 )2 ]OH, то выделяется свободное серебро (реакция «серебряного зеркала» — это качественная реакция на альдегиды).
 |



 СН3 – С = О + 2[Ag(Nh4 )2 ]OH СН3 – С = О + 2 Ag + 4 Nh4 + Н2 О
СН3 – С = О + 2[Ag(Nh4 )2 ]OH СН3 – С = О + 2 Ag + 4 Nh4 + Н2 О
Н ОН
Окисление кетонов происходит гораздо труднее и только сильными окислителями. Продуктами окисления являются карбоновые кислоты. При окислении кетона образуется спиртокетон, затем дикетон, который, разрываясь, образует кислоты.








 СН3 – СН2 – С – СН2 – СН3+ О СН3 – СН – С – СН2 – СН -Н2О+О СН3 – С – С – СН2 – СН3+О +Н2О
СН3 – СН2 – С – СН2 – СН3+ О СН3 – СН – С – СН2 – СН -Н2О+О СН3 – С – С – СН2 – СН3+О +Н2О
О ОН О О О
диэтилкетон спиртокетон дикетон


 СН3 – С = О + О = С – СН2 – СН3
СН3 – С = О + О = С – СН2 – СН3
ОН ОН
уксусная к-та пропионовая к-та
В случае смешанного кетона окисление протекает по правилу Попова – Вагнера, то есть главное направление реакции – окисление соседнего с карбонилом наименее гидрированного атома углерода. Но помимо с главным направлением будет и побочное направление реакции, то есть окислится углеродный атом с другой стороны карбонила. При этом образуется смесь различных карбоновых кислот.





 СН3 – С – СН – СН3 – спиртокетон +О — Н2 О
СН3 – С – СН – СН3 – спиртокетон +О — Н2 О
О ОН





 СН3 – С – СН2 – СН3 ОН О
СН3 – С – СН2 – СН3 ОН О

 О СН2 – С – СН2 – СН3 + О – Н2 О
О СН2 – С – СН2 – СН3 + О – Н2 О
Бутанон-2 спиртокетон






 СН3 – С – С – СН3+О +Н2О 2 СН3 – С = О
СН3 – С – С – СН3+О +Н2О 2 СН3 – С = О
О О ОН
дикетон уксусная кислота







 СН–С – СН2 – СН3 + О +Н2О НС = О + СН3 – СН2 – С = О
СН–С – СН2 – СН3 + О +Н2О НС = О + СН3 – СН2 – С = О
О О ОН ОН
дикетон муравьиная к-та пропионовая к-та
Реакции присоединения
Протекают за счет разрыва пи-связи в карбониле. Эти реакции нуклеофильного присоединения, то есть сначала к положительно заряженному углероду карбонила присоединяется нуклеофильная часть реагента со свободной электронной парой (протекает медленно):

 = С+ = О- +: Х - = С – О –
= С+ = О- +: Х - = С – О –
Х
Вторая стадия – присоединение протона или другого катиона к образовавшемуся аниону (протекает быстро):


 = С – О – + Н + = С – ОН
= С – О – + Н + = С – ОН
Х Х
1.Присоединение водорода.
При этом из альдегидов получаются первичные спирты, из кетонов – вторичные. Реакция протекает в присутствии катализаторов Ni, Pt и др.


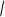
 СН3 – С = О + Н +: Н - СН3 – С – Н
СН3 – С = О + Н +: Н - СН3 – С – Н
ОН Н ОН
уксусный альдегид этанол



 СН3 – С – СН3 + Н+: Н - СН3 – СН – СН3
СН3 – С – СН3 + Н+: Н - СН3 – СН – СН3
О ОН
пропанон пропанол -2
2.Присоединение бисульфата натрия (гидросульфата):



 R – C = O + HSO3 Na R – C – SO3 Na
R – C = O + HSO3 Na R – C – SO3 Na
HOHH
При этом образуются бисульфитные производные. Эту реакцию используют для очистки альдегидов и кетонов и выделения их из примесей.
3.Присоединение синильной кислоты. При этом образуются α- оксинитрилы, которые являются промежуточными продуктами синтеза оксикислот, аминокислот:
 OH
OH



 R – C = O + HCNR – C – C=N
R – C = O + HCNR – C – C=N
HH
α- оксинитрил
4. Присоединение аммиака Nh4. При этом образуются оксиамины.


 R – C = O + H – Nh3 Ch4 – CH – Nh3
R – C = O + H – Nh3 Ch4 – CH – Nh3
HOH
Оксиамин
5. Присоединение магнийгалогенорганических соединений (реактив Гриньяра). Реакцию используют для получения спиртов.
6.Присоединение спиртов (безводных). При этом первоначально образуются полуацетали (как обычная реакция присоединения). Затем при нагревании с избытком спирта образуются ацетали (как простые эфиры).




 R – C = O + СН3 – ОН R – CН – О – СН3+СН3ОН
R – C = O + СН3 – ОН R – CН – О – СН3+СН3ОН R – CН – О – СН3
R – CН – О – СН3
HОН О – СН3
полуацеталь ацеталь
В природе очень много соединений полуацетального и ацетального характера, особенно среди углеводов (сахаров).
Реакции замещения
Кислород карбонильных групп может замещаться на галогены и некоторые азотсодержащие соединения.
1.Замещение галогенами. Происходит при действии на альдегиды и кетоны фосфорных соединений галогенов PCL3 и PCL5. При действии же свободными галогенами замещается водород в углеводородном радикале при α-углеродном атоме.

 + PCL5 Ch4 – Ch3 – CH –CL2 + POCL3
+ PCL5 Ch4 – Ch3 – CH –CL2 + POCL3

 СН3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)
СН3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)

 Н +CL2 Ch4 – CH – CH = O + HCL
Н +CL2 Ch4 – CH – CH = O + HCL
пропаналь CL
α-монохлорпропионовый альдегид
2.Реакция с гидроксиамином Nh3 OH. При этом образуются окислы альдегидов (альдоксилы) и кетонов (кетоксины).
 СН3 – СН = О + Н2 N – OHCh4 – CH – N – OH+ h3 O
СН3 – СН = О + Н2 N – OHCh4 – CH – N – OH+ h3 O
уксусный альдегид оксиэтаналь
Эту реакцию применяют для количественного определения карбоксильных соединений.
3.Реакция с гидразином Nh3 – Nh3. Продуктами реакции являются гидразины (когда реагирует одна молекула альдегида или кетона) и азины (когда реагируют две молекулы).
 СН3 – СН = О + Nh3 – Nh3 СН3 – СН = N – Nh3
СН3 – СН = О + Nh3 – Nh3 СН3 – СН = N – Nh3
этаналь гидразин гидразин этаналь
 СН3 – СН = N – Nh3 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
СН3 – СН = N – Nh3 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
азин этаналь (альдазин)
4.Реакции с фенилгидразином. С6 Н5 – NH – Nh3. Продуктами реакции являются фенилгидразины.
 СН3 – СН = О + Н2 N – NH – C6 H5 Ch4 – CH = N – NH – C6 H5
СН3 – СН = О + Н2 N – NH – C6 H5 Ch4 – CH = N – NH – C6 H5
Фенилгидразонэтаналь
Окислы, гидразины, азины, фенилгидразины – твердые кристаллические вещества с характерными температурами плавления, по которым определяют природу (строение) карбонильного соединения.
Реакции полимеризации
Характерны только для альдегидов. Но и то, только газообразные и летучие альдегиды (муравьиный, уксусный) подвергаются полимеризации. Это очень удобно при хранении этих альдегидов. муравьиный альдегид полимеризуется в присутствии серной кислоты или соляной, при нормальной температуре. Коэффициент полимеризации n=10-50. Продукт полимеризации – твердое вещество, называется – полиоксиметилен (формалин).







 Н Н Н Н
Н Н Н Н






 Н – С = О – С – О – С – О – ...– С – … – С – О –
Н – С = О – С – О – С – О – ...– С – … – С – О –

 Н Н Н Н Н n
Н Н Н Н Н n
Полиоксиметилен
Это твердое вещество, но его можно превратить в муравьиный альдегид, разбавляя водой и слегка подогревая.
Уксусный альдегид под влиянием кислот образует жидкий циклический триммер- паральдозу и твердый тетрамер – метальдозу («сухой спирт»).

 3 СН3 – СН = О О
3 СН3 – СН = О О
СН3 — НС СН – СН3
О О
СН – СН3
паральдегид



 4 СН3 – СН = О СН3 – НС О
4 СН3 – СН = О СН3 – НС О

 О СН – СН3
О СН – СН3

 СН5 – НС О
СН5 – НС О
 О СН – СН3
О СН – СН3
Метальдегид
Реакции конденсации
1.Альдегиды в слабо основной среде (в присутствии ацетона калия, поташа, сульфата калия) подвергаются альдольной конденсации с образованием альдегидо — спиртов, сокращенно называемых альдолями. Разработана эта реакция химиком А.П. Бородиным (он же композитор). В реакции участвует одна молекула своей карбонильной группой, а другая молекула водородом при α- углеродном атоме.

 СН3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
СН3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
ОН альдоль
(3 – оксибутаналь или β-оксимасляный альдегид)



 СН3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
СН3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
ОН ОН ОН
гексенциол-3,5-аль
С каждым разом увеличивается число групп ОН. Получается альдегидная смола при уплотнении большого числа молекул.
2. Кротоновая конденсация. для альдегидов она является продолжением альдольной конденсации, то есть при нагревании альдоль отщепляет воду с образованием непредельного альдегида.


 СН3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
СН3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
ОН ОН
кротоновый альдегид
Рассмотрим эти реакции для кетонов.








 СН3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
СН3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
СН3 СН3 ОН СН3 СН3 СН3 СН3
4 – окси – 4 – метилпентанон-2 4 – метилпентан -3-он-2
3.Сложноэфирная конденсация. Характерна только для альдегидов. Разработана В.Е.Тищенко. протекает в присутствии катализаторов алкоголятов алюминия (Ch4 – Ch3 – O)3 AL.

 Ch4 – CH = O + O = HC – Ch4 Ch4 – СН2 – О – С = О
Ch4 – CH = O + O = HC – Ch4 Ch4 – СН2 – О – С = О
СН3
уксусноэтиловый эфир
Они содержат в углеводородном радикале двойную связь. Представители:
1.СН2 = СН – СН =О – пропен-2-аль — акриловый альдегид или акролеин
2.СН3 – СН = СН – СН = О – бутен – 2 – аль — кротоновый альдегид
Акролеин иначе называют чад, он получается при нагревании горении жиров. В химическом отношении непредельные альдегиды обладают всеми свойствами предельных по карбонильной группе, а за счет двойной связи в радикале могут вступать в реакции присоединения.
У этих альдегидов сопряженная система двойных связей, поэтому в химическом отношении они отличаются реакциями присоединения. Присоединение водорода, галогенов, галогенводородов происходит по концам сопряженной системы.
Электронная плотность смещена к кислороду и к нему направляются положительно заряженная часть реагента, а к положительно поляризованному углероду – отрицательная часть реагента.



 СН2+ = СН- – СН+ = О- + Н+: Br- Ch3 – CH = CH – OH Ch3 – Ch3 – CH = O
СН2+ = СН- – СН+ = О- + Н+: Br- Ch3 – CH = CH – OH Ch3 – Ch3 – CH = O
BrBr
3-бромпропаналь
Образующаяся при этом енольная форма альдегида немедленно превращается в более устойчивую карбонильную форму. Таким образом присоединение галогенводородов в радикал идет против правила Марковникова.
Ароматические альдегиды
Представители С6 Н5 –СН = О – бензойный альдегид. Это жидкость с запахом горького миндаля, содержится в косточках слив, вишен, диких абрикос и других плодах.
Список использованной литературы
1) Гранберг И.И. Органическая химия. — М., 2002
2) Ким А.М. Органическая химия. — Новосибирск, 2007
www.ronl.ru
Реферат : Альдегиды и кетоны
Введение
Это единения, содержащие карбонильную группу = С = О . У альдегидов карбонил связан радикалом и водородом. Общая формула альдегидов:
R – C = O
– C = O
H
У кетонов карбонил связан с двумя радикалами. Общая формула кетонов:
R 1– C = O
1– C = O
R2
Альдегиды являются более активными, чем кетоны (у кетонов карбонил как бы блокирован радикалами с обеих сторон).
Классификация
1.по углеводородному радикалу (предельные, непредельные, ароматические, циклические).
2.по числу карбонильных групп (одна, две и тд.)
Изомерия и номенклатура
Изомерия альдегидов обусловлена изомерией углеродного скелета. У кетонов помимо изомерии углеродного скелета наблюдается изомерия положения карбонильной группы. По тривиальной номенклатуре альдегиды называют соответственно карбоновым кислотам, в которые они переходят при окислении. По научной номенклатуре названия альдегидов складываются из названий соответствующих углеводородов с добавлением окончания аль. Атом углерода альдегидной группы определяет начало нумерации. По эмпирической номенклатуре кетон называют по радикалам, связанным с карбоксилом с добавлением слова кетон. По научной номенклатуре названия кетонов складываются из названий соответствующих углеводородов с добавлением окончания ОН, в конце ставят номер углеродного атома, при котором стоит карбонил. Нумерацию начинают от ближайшего к кетонной группе конца цепи.
П редставители предельных альдегидов. Cnh3n+1C=O
редставители предельных альдегидов. Cnh3n+1C=O
H
| Формула | Тривиальное название | Научное название |
| Н | Муравьиный Формальдегид | метаналь |
| Н | Уксусный Ацетальдегид | Этаналь |
| Н | Пропионовый | Пропаналь |
| Н | Масляный | Бутаналь |
| Н | Валериановый | Пентаналь |
| Н | Капроновый | Гексаналь |
Представители предельных кетонов
| Формула | Эмпирическое название | Научное название |
| СН3 | Диметилкетон | Пропанон |
| СН2 – СН3 | Метилэтилкетон | Бутенон |
| СН2 – СН2 – СН3 | Метилпропилкетон | Пентанон -2 |
| СН2 – СН3 | Диэтилкетон | Пентанон -3 |
| СН3 | метилпропилкетон | 3-метилбутанон-2 |
Способы получения
1) Путем окисления спиртов. Из первичных спиртов получаются альдегиды, из вторичных кетоны. Окисление спиртов происходит при действии сильных окислителей (хромовая смесь) при небольшом нагревании. В промышленности в качестве окисления используют кислород воздуха в присутствии катализатора – меди (Cu) при t0= 300-5000С
С
 Н3 – СН2 – СН2 – ОН + О К2Cr2O7Ch4 – Ch3 – C =O + HOH
Н3 – СН2 – СН2 – ОН + О К2Cr2O7Ch4 – Ch3 – C =O + HOH
пропанол -1 H
пропаналь
С

 Н3 – СН – СН3 + О К2Cr2O7 СН3 – С – СН3
Н3 – СН – СН3 + О К2Cr2O7 СН3 – С – СН3
ОН О
пропанол -2 пропанон
2) Термическое разложение кальциевых солей карбоновых кислот, причем, если взть соль муравьиной кислоты, то образуются альдегиды, а если других кислот, то кетоны.
С Н3 – С = О
Н3 – С = О



 О – Са прокаливание СаСО3 + СН3 – С = О
О – Са прокаливание СаСО3 + СН3 – С = О
 Н –С – О Н
Н –С – О Н
О уксусный альдегид
 СН3 – С = О
СН3 – С = О



 О – Са прокаливание СаСО3 + СН3 – С = О
О – Са прокаливание СаСО3 + СН3 – С = О
С Н3 –С – О СН3
Н3 –С – О СН3
О ацетон
Это лабораторные способы получения.
3) По реакции Кучерова (из алкинов и воды, катализатор – соли ртути в кислой среде). Из ацетилена образуются альдегиды, из любых других алкинов – кетоны.
С


 Н = СН + НОН СН2 = СН – ОН СН3 – С = О
Н = СН + НОН СН2 = СН – ОН СН3 – С = О
ацетилен виниловый СН3
спирт уксусный альдегид
С



 Н3 – С = СН + НОН СН3 – С = СН2 СН3 – С = О
Н3 – С = СН + НОН СН3 – С = СН2 СН3 – С = О
пропин ОН СН3
пропенол – 2 ацетон
4) Оксосинтез. Это прямое взаимодействие алкенов с водным газом (СО+Н2) в присутствии кобальтового или никелевого катализаторов под давлением 100- 200 атмосфер при t0 = 100-2000С. По этому способу получают альдегиды



 СН3 – СН2 – СН2 – С = О
СН3 – СН2 – СН2 – С = О
бутаналь Н
С Н3 – СН = СН2 + СО + Н2
Н3 – СН = СН2 + СО + Н2


 СН3 – СН – С = О
СН3 – СН – С = О
СН3 Н
2-метилпропаналь
5) Гидролиз дигалогенпроизводных. Если оба галогена находятся при первичном углеродном атоме, то образуется альдегид, если при вторичном – кетон.
С

 Н3 – СН2 – С – CL2 + HOH 2HCL + Ch4 – Ch3 – C = O
Н3 – СН2 – С – CL2 + HOH 2HCL + Ch4 – Ch3 – C = O
H H
1,1-дихлорпропен пропеналь
С


 Н3 – С – Ch4 + HOH 2HCL + Ch4 – C = O
Н3 – С – Ch4 + HOH 2HCL + Ch4 – C = O
CL CL Ch4
2,2-дихлорпропан пропанон
Муравьиный альдегид – газ, другие низшие альдегиды и кетоны – жидкости, легко растворимые в воде; альдегиды обладают удушливым запахом, который при сильном разведении становится приятным(цветочным или фруктовым). Кетоны пахнут довольно приятно. Следовательно карбонил = С =О носитель запаха, поэтому альдегиды и кетоны применяются в парфюмерной промышленности. температура кипения альдегидов и кетонов возрастает по мере увеличения молекулярного веса.
Природа карбонильной группы
Б ольшинство реакций альдегидов и кетонов обусловлено присутствием карбонильной группы. рассмотрим природу карбонила = С =О. например,
ольшинство реакций альдегидов и кетонов обусловлено присутствием карбонильной группы. рассмотрим природу карбонила = С =О. например,
R – C = O
– C = O
H
1.углерод с кислородом в карбониле связаны двойной связью : одна сигма - связь, другая пи – связь. За счет разрыва П- связи у альдегидов и кетонов идут реакции присоединения (нуклеофильного типа):
R

 – C = O R – C – O :
– C = O R – C – O :
H H
Кислород является более электроотрицательным элементом, чем углерод, и поэтому электронная плотность у атома кислорода больше, чем у атома углерода. При реакциях присоединения к углероду будет присоединяться нуклеофильная часть реагента, к кислороду – электрофильная часть.
2.приреакциях замещения может замещаться кислород карбонила. При этом происходит разрыв двойной связи между С и О
3.карбонил влияет на связи С – Н в радикале, ослабляя их, особенно в альфа-положении, то есть рядом с карбонильной группой.


 Н Н Н
Н Н Н
Н


 – αС –β С – γС – С = О
– αС –β С – γС – С = О
Н Н Н Н
При действии свободных галогенов будет замещаться водород в углеродном радикале при альфа- углеродном атоме.
С


 Н3 – СН2 – СН2 – С = О + СL2Ch4 – Ch3 – CH – C = O + HCL
Н3 – СН2 – СН2 – С = О + СL2Ch4 – Ch3 – CH – C = O + HCL
ОН CL OH
α–хлормасляный альдегид
Химические свойства
Из всех классов органических соединений альдегиды и кетоны самые реакционноспособные. Причем в химическом отношении альдегиды более активны, чем кетоны. Для них характерны следующие реакции: окисления, присоединения, замещения, полимеризации, конденсации. Для кетонов не характерны реакции полимеризации.
Реакции окисления
Альдегиды окисляются легко, даже слабыми окислителями HBrO, [Ag(Nh4)2]OH, раствор Фелинга. При окислении альдегидов образуются карбоновые кислоты.
С

 Н3 – С = О + О СН3 – С = О – уксусная кислота
Н3 – С = О + О СН3 – С = О – уксусная кислота
Н ОН
Если окислителем является [Ag(Nh4)2]OH , то выделяется свободное серебро (реакция «серебряного зеркала» - это качественная реакция на альдегиды).

С


 Н3 – С = О + 2[Ag(Nh4)2]OH СН3 – С = О + 2 Ag + 4 Nh4 + Н2О
Н3 – С = О + 2[Ag(Nh4)2]OH СН3 – С = О + 2 Ag + 4 Nh4 + Н2О
Н ОН
Окисление кетонов происходит гораздо труднее и только сильными окислителями. Продуктами окисления являются карбоновые кислоты. При окислении кетона образуется спиртокетон, затем дикетон, который, разрываясь, образует кислоты.
С







 Н3 – СН2 – С – СН2 – СН3+ О СН3 – СН – С – СН2 – СН -Н2О+О СН3 – С – С – СН2 – СН3+О +Н2О
Н3 – СН2 – С – СН2 – СН3+ О СН3 – СН – С – СН2 – СН -Н2О+О СН3 – С – С – СН2 – СН3+О +Н2О
О ОН О О О
диэтилкетон спиртокетон дикетон


 СН3 – С = О + О = С – СН2 – СН3
СН3 – С = О + О = С – СН2 – СН3
ОН ОН
уксусная к-та пропионовая к-та
В случае смешанного кетона окисление протекает по правилу Попова – Вагнера, то есть главное направление реакции – окисление соседнего с карбонилом наименее гидрированного атома углерода. Но помимо с главным направлением будет и побочное направление реакции, то есть окислится углеродный атом с другой стороны карбонила. При этом образуется смесь различных карбоновых кислот.





 СН3 – С – СН – СН3 – спиртокетон +О - Н2О
СН3 – С – СН – СН3 – спиртокетон +О - Н2О
О ОН
С




 Н3 – С – СН2 – СН3 ОН О
Н3 – С – СН2 – СН3 ОН О

 О СН2 – С – СН2 – СН3 + О – Н2О
О СН2 – С – СН2 – СН3 + О – Н2О
Бутанон-2 спиртокетон






 СН3 – С – С – СН3+О +Н2О 2 СН3 – С = О
СН3 – С – С – СН3+О +Н2О 2 СН3 – С = О
О О ОН
дикетон уксусная кислота







 СН–С – СН2 – СН3 + О +Н2О НС = О + СН3 – СН2 – С = О
СН–С – СН2 – СН3 + О +Н2О НС = О + СН3 – СН2 – С = О
О О ОН ОН
дикетон муравьиная к-та пропионовая к-та
Реакции присоединения
Протекают за счет разрыва пи-связи в карбониле. Эти реакции нуклеофильного присоединения, то есть сначала к положительно заряженному углероду карбонила присоединяется нуклеофильная часть реагента со свободной электронной парой (протекает медленно):
=
 С+ = О - + :Х - = С – О –
С+ = О - + :Х - = С – О –
Х
Вторая стадия – присоединение протона или другого катиона к образовавшемуся аниону (протекает быстро):
=

 С – О – + Н + = С – ОН
С – О – + Н + = С – ОН
Х Х
1.Присоединение водорода.
При этом из альдегидов получаются первичные спирты, из кетонов – вторичные. Реакция протекает в присутствии катализаторов Ni, Pt и др.
С


 Н3 – С = О + Н + : Н - СН3 – С – Н
Н3 – С = О + Н + : Н - СН3 – С – Н
ОН Н ОН
уксусный альдегид этанол



 СН3 – С – СН3 + Н+ : Н - СН3 – СН – СН3
СН3 – С – СН3 + Н+ : Н - СН3 – СН – СН3
О ОН
пропанон пропанол -2
2.Присоединение бисульфата натрия (гидросульфата):
R


 – C = O + HSO3Na R – C – SO3Na
– C = O + HSO3Na R – C – SO3Na
H OH H
При этом образуются бисульфитные производные. Эту реакцию используют для очистки альдегидов и кетонов и выделения их из примесей.
3.Присоединение синильной кислоты. При этом образуются α- оксинитрилы, которые являются промежуточными продуктами синтеза оксикислот, аминокислот:
 OH
OH
R


 – C = O + HCN R – C – C =N
– C = O + HCN R – C – C =N
H H
α- оксинитрил
4. Присоединение аммиака Nh4. При этом образуются оксиамины.
R

 – C = O + H – Nh3 Ch4 – CH – Nh3
– C = O + H – Nh3 Ch4 – CH – Nh3
H OH
Оксиамин
5. Присоединение магнийгалогенорганических соединений (реактив Гриньяра). Реакцию используют для получения спиртов.
6.Присоединение спиртов (безводных). При этом первоначально образуются полуацетали (как обычная реакция присоединения). Затем при нагревании с избытком спирта образуются ацетали (как простые эфиры).
R



 – C = O + СН3 – ОН R – CН – О – СН3+СН3ОНR
– C = O + СН3 – ОН R – CН – О – СН3+СН3ОНR – CН – О – СН3
– CН – О – СН3
H ОН О – СН3
полуацеталь ацеталь
В природе очень много соединений полуацетального и ацетального характера, особенно среди углеводов (сахаров).
Реакции замещения
Кислород карбонильных групп может замещаться на галогены и некоторые азотсодержащие соединения.
1.Замещение галогенами. Происходит при действии на альдегиды и кетоны фосфорных соединений галогенов PCL3 и PCL5. При действии же свободными галогенами замещается водород в углеводородном радикале при α-углеродном атоме.

 + PCL5 Ch4 – Ch3 – CH –CL2 + POCL3
+ PCL5 Ch4 – Ch3 – CH –CL2 + POCL3
С
 Н3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)
Н3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)

 Н +CL2 Ch4 – CH – CH = O + HCL
Н +CL2 Ch4 – CH – CH = O + HCL
пропаналь CL
α-монохлорпропионовый альдегид
2.Реакция с гидроксиамином Nh3OH. При этом образуются окислы альдегидов (альдоксилы) и кетонов (кетоксины).
С Н3 – СН = О + Н2N – OH Ch4 – CH – N – OH + h3O
Н3 – СН = О + Н2N – OH Ch4 – CH – N – OH + h3O
уксусный альдегид оксиэтаналь
Эту реакцию применяют для количественного определения карбоксильных соединений.
3.Реакция с гидразином Nh3 – Nh3 . Продуктами реакции являются гидразины (когда реагирует одна молекула альдегида или кетона) и азины (когда реагируют две молекулы).
С Н3 – СН = О + Nh3 – Nh3 СН3 – СН = N – Nh3
Н3 – СН = О + Nh3 – Nh3 СН3 – СН = N – Nh3
этаналь гидразин гидразин этаналь
С Н3 – СН = N – Nh3 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
Н3 – СН = N – Nh3 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
азин этаналь (альдазин)
4.Реакции с фенилгидразином. С6Н5 – NH – Nh3 . Продуктами реакции являются фенилгидразины.
С Н3 – СН = О + Н2N – NH – C6H5Ch4 – CH = N – NH – C6H5
Н3 – СН = О + Н2N – NH – C6H5Ch4 – CH = N – NH – C6H5
Фенилгидразонэтаналь
Окислы, гидразины, азины, фенилгидразины – твердые кристаллические вещества с характерными температурами плавления, по которым определяют природу (строение) карбонильного соединения.
Реакции полимеризации
Характерны только для альдегидов. Но и то, только газообразные и летучие альдегиды (муравьиный, уксусный) подвергаются полимеризации. Это очень удобно при хранении этих альдегидов. муравьиный альдегид полимеризуется в присутствии серной кислоты или соляной, при нормальной температуре. Коэффициент полимеризации n=10-50. Продукт полимеризации – твердое вещество, называется – полиоксиметилен (формалин).







 Н Н Н Н
Н Н Н Н
Н





 – С = О – С – О – С – О – ...– С – … – С – О –
– С = О – С – О – С – О – ...– С – … – С – О –

 Н Н Н Н Н n
Н Н Н Н Н n
Полиоксиметилен
Это твердое вещество, но его можно превратить в муравьиный альдегид, разбавляя водой и слегка подогревая.
Уксусный альдегид под влиянием кислот образует жидкий циклический триммер- паральдозу и твердый тетрамер – метальдозу («сухой спирт»).
3
 СН3 – СН = О О
СН3 – СН = О О
СН3 - НС СН – СН3
О О
СН – СН3
паральдегид
4


 СН3 – СН = О СН3 – НС О
СН3 – СН = О СН3 – НС О

 О СН – СН3
О СН – СН3

 СН5 – НС О
СН5 – НС О
 О СН – СН3
О СН – СН3
Метальдегид
Реакции конденсации
1.Альдегиды в слабо основной среде (в присутствии ацетона калия, поташа, сульфата калия) подвергаются альдольной конденсации с образованием альдегидо - спиртов, сокращенно называемых альдолями. Разработана эта реакция химиком А.П. Бородиным (он же композитор). В реакции участвует одна молекула своей карбонильной группой, а другая молекула водородом при α- углеродном атоме.
С
 Н3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
Н3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
ОН альдоль
(3 – оксибутаналь или β-оксимасляный альдегид)
С


 Н3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
Н3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
ОН ОН ОН
гексенциол-3,5-аль
С каждым разом увеличивается число групп ОН. Получается альдегидная смола при уплотнении большого числа молекул.
2. Кротоновая конденсация . для альдегидов она является продолжением альдольной конденсации, то есть при нагревании альдоль отщепляет воду с образованием непредельного альдегида.
С

 Н3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
Н3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
ОН ОН
кротоновый альдегид
Рассмотрим эти реакции для кетонов.
С







 Н3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
Н3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
СН3 СН3 ОН СН3 СН3 СН3 СН3
4 – окси – 4 – метилпентанон-2 4 – метилпентан -3-он-2
3.Сложноэфирная конденсация. Характерна только для альдегидов. Разработана В.Е.Тищенко. протекает в присутствии катализаторов алкоголятов алюминия (Ch4 – Ch3 – O)3AL.
C
 h4 – CH = O + O = HC – Ch4Ch4 – СН2 – О – С = О
h4 – CH = O + O = HC – Ch4Ch4 – СН2 – О – С = О
СН3
уксусноэтиловый эфир
Они содержат в углеводородном радикале двойную связь. Представители:
1.СН2 = СН – СН =О – пропен-2-аль - акриловый альдегид или акролеин
2.СН3 – СН = СН – СН = О – бутен – 2 – аль - кротоновый альдегид
Акролеин иначе называют чад, он получается при нагревании горении жиров. В химическом отношении непредельные альдегиды обладают всеми свойствами предельных по карбонильной группе, а за счет двойной связи в радикале могут вступать в реакции присоединения.
У этих альдегидов сопряженная система двойных связей, поэтому в химическом отношении они отличаются реакциями присоединения. Присоединение водорода, галогенов, галогенводородов происходит по концам сопряженной системы.
Электронная плотность смещена к кислороду и к нему направляются положительно заряженная часть реагента, а к положительно поляризованному углероду – отрицательная часть реагента.
С


 Н2+ = СН- – СН+= О- + Н+: Br- Ch3 – CH = CH – OH Ch3 – Ch3 – CH = O
Н2+ = СН- – СН+= О- + Н+: Br- Ch3 – CH = CH – OH Ch3 – Ch3 – CH = O
Br Br
3-бромпропаналь
Образующаяся при этом енольная форма альдегида немедленно превращается в более устойчивую карбонильную форму. Таким образом присоединение галогенводородов в радикал идет против правила Марковникова.
Ароматические альдегиды
Представители С6Н5 –СН = О – бензойный альдегид. Это жидкость с запахом горького миндаля, содержится в косточках слив, вишен, диких абрикос и других плодах.
Список использованной литературы
Гранберг И.И. Органическая химия. - М., 2002
Ким А.М. Органическая химия. - Новосибирск, 2007
topref.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


 Н – С = О
Н – С = О СН3 – С = О
СН3 – С = О СН3 – СН2 – С = О
СН3 – СН2 – С = О СН3 – СН2 – СН2 – С = О
СН3 – СН2 – СН2 – С = О СН3 – (СН2)3 – С = О
СН3 – (СН2)3 – С = О  СН3 – (СН2)4 – С = О
СН3 – (СН2)4 – С = О СН3 – С = О
СН3 – С = О СН3 – С = О
СН3 – С = О СН3 – С = О
СН3 – С = О СН3 – СН2 – С = О
СН3 – СН2 – С = О СН3 – С = О
СН3 – С = О СН – СН3
СН – СН3 Н – С = О
Н – С = О СН3 – С = О
СН3 – С = О СН3 – СН2 – СН2 – С = О
СН3 – СН2 – СН2 – С = О СН3 – (СН2)3 – С = О
СН3 – (СН2)3 – С = О  СН3 – С = О
СН3 – С = О СН3 – С = О
СН3 – С = О СН3 – СН2 – С = О
СН3 – СН2 – С = О СН – СН3
СН – СН3