|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Творческая работа по химии: кислород. Реферат кислород по химии
Доклад - Творческая работа по химии: кислород
МОУСОШ № 112
Творческая работа
по химии:
на тему: Кислород
Выполнил: ученик 97 класса
Соложенцев Андрей
Проверила: учительница химии
Кудрявцева Наталья Михайловна
Челябинск, 2003 г.
Содержание
1. Открытие элемента кислород… 3
2. Нахождение кислорода в природе… 6
а) в составе простых веществ… 6
в) в составе сложных веществ… 7
3. Положение в таблице Д.И. Менделеева, строение… 9
4. Сравнение окисление, восстановление и размер атома кислорода с элементами стоящими с ним в этойже группе и подгруппе, в томже периоде… 10
5.Физические свойства алотропных видоизменений в кислороде… 11
6. Получение кислорода… 12
а) в лаборатории… 12
в) в промышленности… 12
7. Химические свойства кислорода с позиции О.В. реакции, особенности реакции горения простых и сложных… 16
8. Биологическое значение кислорода… 18
9. Применение кислорода… 19
10. Творческое задание… 20
11. Список использованной литературы… 21
Открытие элемента кислорода
1 августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению.
Джозеф Пристли
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие.
Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в. швед Карл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат «О воздухе и огне», содержавший информацию о кислороде, был опубликован позже, чем сообщение об открытии Пристли.
И все-таки главная фигура в истории открытия кислорода не Шееле и не Пристли. Они открыли новый газ и только. Открыли кислород и до конца дней своих остались ревностными защитниками теории флогистона! Теории некогда полезной, но к концу XVIII в. ставшей уже «кандалами на ногах науки».
Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно… Собственно открывшим кислород, поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают».
Великий французский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал о кислороде от самого Пристли. Спустя два месяца после открытия «дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал о том, как было сделано это открытие и из каких веществ (ртутная и свинцовая окалины) новый «воздух» выделяется.
До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазье наблюдал образование красных чешуек «ртутной окалины» и уменьшение объема воздуха при нагревании ртути в запаянной реторте. В другой реторте, применив высокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 С «ртутной окалины» и получил 2,5 С ртути и 8 кубических дюймов того самого газа, о котором рассказывал Пристли. В первом опыте, в котором часть ртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймов воздуха, а остаток его стал «азотом» – не жизненным, не поддерживающим ни дыхания, ни горения. Газ, выделенный при разложении окалины, проявлял противоположные свойства, и потому Лавуазье вначале назвал его «жизненным газом». Лавуазье выяснил сущность горения. И надобность в флогистоне – «огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе №8 современной науке известно абсолютно все.
Нахождение кислорода в природе
.
Кислород самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает 2 /з поверхности земного шара, образуя его водную оболочку гидросферу. Кислород вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Как вы уже знаете, обычный кислород существует в форме О2. Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
а) В составе простых веществ.
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксиды М2 О и пер оксиды М2 О2; с железом, образуя железную окалину Ге3 О4; с алюминием, образуя оксид А12 О3 .
Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением реакции горения. Вспомните горение серы с образованием SО2, фосфора с образованием Р2 О5 или угля с образованием СО2 .
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:

 N2 + O2 2NO –Q
N2 + O2 2NO –Q
в) в составе сложных веществ
Кислород энергично окисляет не только простые, но и сложные вещества, при этом образуется оксиды элементов, из которых они построены.
СН4 + 2О2 = 2Н2 О + СО2
Метан
2Н2 S + ЗО2= 2SО2 + 2Н2 О
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных.
Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Положение в таблице Д.И. Менделеева, строение.
В центре атома кислорода находится ядро с зарядом +8, ядро состоит из 8 протонов и (16-8)= 8 нейтронов вокруг ядра вращается 12 электронов.
О-О;
О О
1) 
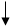
 1 S2
1 S2
2) 








 2 S2 P4
2 S2 P4
Для завершения внешнего энергетического уровня кислороду не хватает двух электронов. Энергично принимая их кислород проявляет степень окисления, равную –2. Однако в соединениях кислорода со фтором, общая электронная пара смещена по фтору как к более электроотрицательному элементу, В этом случае степень окисления кислорода равна + 2, а фтора + 2. в пер оксиде водорода h3 O2 и его производных степеней окисления равна – 1. В соединениях со всеми другими электронами окислительность кислорода отрицательна и равна – 2.
Сравнение окислительно-восстановительных свойств и размера ядра кислорода с элементами стоящими с ним в той же подгруппе, группе и периоде.
В своей группе у кислорода самая маленькая орбита. Принять электроны ему легче всех, отдать труднее. Самая маленькая орбита у него потому, что он стоит во 2 периоде и следовательно у него меньше всех электронных слоев. Принять недостающих электрон легче потому что, у него лучше связь атома с электроном, чем у остальных элементов этой группы. И отдать труднее потому что, тоже связь с электрона с ядром на последнем слое сильней, чем у остальных элементов этой группы.
У кислорода ядро меньше чем у Li, Be, B, C, N, но больше чем у F, потому что число элекроных слоев у них одинаковы, а количество электронов на последнем слое разное. У кислорода электроны больше чем у Li, Be, B, C, N значит связь электронов с ядром больше и радиус меньше. У кислорода восстановительные свойства больше, чем у Li, Be, B, C, N и принять недостающий электрон ему легче, по меньше чем у фтора, которому принять недостающий электрон еще легче, чем кислороду.
Физические свойства аллотропных видоизменений кислорода.
Аллотпропным видоизменениям кислорода является озон. В отличии от бесцветного кислорода, не имеющего запаха, озон – это светло синий газ с сильным запахом. Озон в полтора тяжелее кислорода, лучше его растворяется в воде. Как окислитель озона само воспламеняющее горящие жидкости, например этан. При обычной температуре озон окисляет даже серебро. Поэтому дышать воздухом со значительным содержанием озона нельзя, т.к. он разрушает ткани дыхательных путей.
Большая окислительная активность озона объясняется его термической неустойчивостью. Он при комнатной температуре медленно, но при 100-1500. С быстро разлагается на кислород и атомарный О0, которой является чрезвычайно сильным окислителем по с сравнению с кислородом, он мгновенно вступает в химическую реакцию. В воздушной атмосфере над Землей на высоте около 25 километров находится озоновый слой, который защищает все живое от ультрофиалетовых лучей.
Получение кислорода
a) в лаборатории
Кислород в лаборатории получают путем разложения пероксида водорода (h3 O2 ) в присутствии катализатора- диоксида марганца (MnO2 ), а также разложением перманганата калия (KMnO4 ) при нагревание.
b) в промышленности
Так как горением в таком газе можно получить очень высокие температуры, полезные во многих… применениях, то быть может, что придет время, когда указанным путем станут на заводах и вообще для промышленности обогащать воздух кислородом.
Д.И. Менделеев
Попытки создать более или менее мощную кислородную промышленность предпринимались еще в прошлом веке в. многих странах. Но от идеи до технического воплощения часто лежит «дистанция; огромного размера»...
В Советском Союзе особенно быстрое развитие кислородной промышленности началось в годы Великой Отечественной войны, после изобретения академиком Л.П.Капицей турбодетандера и создания мощных воздухоразделительных установок.
Еще Карл Шееле получал кислород, по меньшей мере, пятью способами: из окиси ртути, сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчас получают кислород, разлагая богатые этим элементом хлораты и перхлораты. В любой школьной лаборатории демонстрируют опыт – разложение воды на кислород и водород электролизом. Но ни один из этих способов не может удовлетворить потребности промышленности в кислороде.
Энергетически проще всего получить элемент №8 из воздуха, поскольку воздух – не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8°C. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить до минус 196°C. Можно сказать, что проблема получения кислорода – это проблема получения холода.
Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться и при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, в которых это происходит, называют детандерами.
До 1938г. для получения жидкого воздуха пользовались только поршневыми детандерами. По существу, такой детандер – это аналог паровой машины, только работает в нем не пар, а сжатый воздух. Чтобы получить жидкий воздух с помощью таких детандеров, нужны были давления порядка 200 атм., причем по неизбежным техническим причинам на разных стадиях процесса давление было не одинаковым: от 45 до 200 атм. КПД установки был немногим выше, чем у паровой машины. Установка получилась сложной, громоздкой, дорогой.
В конце 30-х годов советский физик академик П.Л. Капица предложил использовать в качестве детандера турбину. Идея – не новая, ее еще в конце прошлого века высказывал Дж. Рэлей, но к.п.д. «докапицынских» турбин для сжижения воздуха был невысок. Поэтому небольшие турбодетандеры лишь выполняли кое-какую подсобную работу при поршневых детандерах.
Капица создал новую конструкцию, которая, по словам изобретателя, была «как бы компромиссом между водяной и паровой турбиной». Главная особенность турбодетандера Капицы в том, что воздух в ней расширяется не только в сопловом аппарате, но и на лопатках рабочего колеса. При этом газ движется от периферии колеса к центру, работая против центробежных сил.
Такая конструкция турбины позволила поднять к.п.д. установки с 0,5 до 0,8. И, кроме того, турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь до нескольких атмосфер. Очевидно, что 6 атм. получить намного проще и дешевле, чем 200. Немаловажно для экономики и то, что энергия, которую отдает расширяющийся воздух, не пропадает напрасно, она используется для вращения ротора генератора электрического тока.
Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода. Они работают не только у нас, но и во всем мире.
Первый опытный образец турбодетандера был невелик. Его ротор восьми сантиметров в диаметре весил всего 250г. Но, как писал П.Л. Капица в 1939г., «экспериментальная эксплуатация этого турбодетандера показала, что он является надежным и очень простым механизмом. Технический к.п.д. получается 0,79...0,83». И этот турбодетандер стал «сердцем» первой установки для получения кислорода новым методом.
В 1942г. построили подобную, но уже намного более мощную установку, которая производила до 200кг жидкого кислорода в час. В конце 1944г. вводится в строй самая мощная в мире турбо кислородная установка, производящая в 6...7 раз больше жидкого кислорода, чем установка старого типа, и при этом занимающая в 3...4 раза меньшую площадь.
Современный блок разделения воздуха БР-2, в конструкции которого также использован турбодетандер, мог бы за сутки работы снабдить тремя литрами газообразного кислорода каждого жителя СССР.
30 апреля 1945 г. Михаил Иванович Калинин подписал Указ о присвоении академику П. Л. Капице звания Героя Социалистического Труда «за успешную разработку нового турбинного метода получения кислорода и за создание мощной турбо кислородной установки».
Химические свойства кислорода с позиции О/В реакции, особенности горения органических и не органических веществ, простых и сложных.
Реакции окисления, сопровождающиеся выделениям теплоты и света, называются горением. Расплавленная сера горит в кислороде ярким синим пламенем, при этом образуется газ с резким запахом – диоксид серы, или оксид серы 4 (SO2 ). Запах, его мы ощущаем, когда зажигаем спички.
Внесенный в сосуд, с кислородом горящий красный фосфор горит ослепительным пламенем с образованием твердого белого вещества – оксида фосфора 5 (P2 O5 )
При внесении в сосуд с кислородом раскаленной стальной проволоки вы можете наблюдать горение железа, сопровождаемое треском и разбрызгиванием ярких искр–расплавленных капель железной окалины ( Fe5 O4 )
Это явление можно увидеть при разливе жидкого чугуна и стали на металлургических заводах.
Большое практическое значение имеют процессы горения сложных веществ, как, например: метан, ацетилена. В результате таких реакций получается оксиды элементов, входящих в состав сложного вещества. Например, схему реакции горения ацетилена можно записать так.

 2 C2 h3 + 5 O2 4 CO2 2h3 O
2 C2 h3 + 5 O2 4 CO2 2h3 O
Если экзотермическая реакция окисления происходит медленно, то ее горение не называют. Так, медленно окисляются на воздухе многие металлы, покрываясь пленкой оксидов. Сравнительно медленно происходит в живом организме реакция окисления глюкозы – одного из основных источников энергии в организме.
Само горение представляет собой экзотермическую реакцию окисления, происходящею с достаточно небольшой скоростью.
Биологическое значение кислорода.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Применение кислорода.
Кислород применяют в металлургической и химической промышленности для ускорения производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавном производстве на много ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, на пример, при газовой сварке и резке металлов.
Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Творческое задание.
Список используемой литературы.
1. Учебник за 9 класс по химии О.С. Габриелян.
2. Энциклопедия по химии.
3. Интернет <Популярная библиотека химических элементов>.
www.ronl.ru
Творческая работа по химии: кислород
МОУСОШ № 112
Творческая работа
по химии:
на тему: Кислород
Выполнил: ученик 97класса
Соложенцев Андрей
Проверила: учительница химии
Кудрявцева Наталья Михайловна
Челябинск, 2003 г.
Содержание
а) в составе простых веществ........................................................ 6
в) в составе сложных веществ....................................................... 7
3. Положение в таблице Д.И. Менделеева, строение.................... 9
4. Сравнение окисление, восстановление и размер атома кислорода с элементами стоящими с ним в этойже группе и подгруппе, в томже периоде..................................................................................... 10
5.Физические свойства алотропных видоизменений в кислороде................................................................................................................ 11
6. Получение кислорода..................................................................... 12
а) в лаборатории............................................................................. 12
в) в промышленности.................................................................... 12
7. Химические свойства кислорода с позиции О.В. реакции, особенности реакции горения простых и сложных...................... 16
8. Биологическое значение кислорода............................................. 18
9. Применение кислорода.................................................................. 19
10. Творческое задание....................................................................... 20
11. Список использованной литературы......................................... 21
Открытие элемента кислорода
1 августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению.
Джозеф Пристли
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие.
Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в. швед Карл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат «О воздухе и огне», содержавший информацию о кислороде, был опубликован позже, чем сообщение об открытии Пристли.
И все-таки главная фигура в истории открытия кислорода не Шееле и не Пристли. Они открыли новый газ и только. Открыли кислород и до конца дней своих остались ревностными защитниками теории флогистона! Теории некогда полезной, но к концу XVIII в. ставшей уже «кандалами на ногах науки».
Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно... Собственно открывшим кислород, поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают».
Великий французский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал о кислороде от самого Пристли. Спустя два месяца после открытия «дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал о том, как было сделано это открытие и из каких веществ (ртутная и свинцовая окалины) новый «воздух» выделяется.
До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазье наблюдал образование красных чешуек «ртутной окалины» и уменьшение объема воздуха при нагревании ртути в запаянной реторте. В другой реторте, применив высокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 С «ртутной окалины» и получил 2,5 С ртути и 8 кубических дюймов того самого газа, о котором рассказывал Пристли. В первом опыте, в котором часть ртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймов воздуха, а остаток его стал «азотом» – не жизненным, не поддерживающим ни дыхания, ни горения. Газ, выделенный при разложении окалины, проявлял противоположные свойства, и потому Лавуазье вначале назвал его «жизненным газом». Лавуазье выяснил сущность горения. И надобность в флогистоне – «огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе №8 современной науке известно абсолютно все.
Нахождение кислорода в природе
.
Кислород самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает2/з поверхности земного шара, образуя его водную оболочку гидросферу. Кислород вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Как вы уже знаете, обычный кислород существует в форме О2. Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
а) В составе простых веществ.
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксиды М2О и пер оксиды М2О2; с железом, образуя железную окалину Ге3О4; с алюминием, образуя оксид А12О3.
Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением реакции горения. Вспомните горение серы с образованием SО2, фосфора с образованием Р2О5или угля с образованием СО2.
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:

 N2+ O22NO –Q
N2+ O22NO –Q
в) в составе сложных веществ
Кислород энергично окисляет не только простые, но и сложные вещества, при этом образуется оксиды элементов, из которых они построены.
СН4+ 2О2= 2Н2О + СО2
Метан
2Н2S + ЗО2=2SО2 + 2Н2О
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных.
Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Положение в таблице Д.И. Менделеева, строение.
В центре атома кислорода находится ядро с зарядом +8, ядро состоит из 8 протонов и (16-8)= 8 нейтронов вокруг ядра вращается 12 электронов.
О-О;
О О
1)

 1 S2
1 S2
2)








 2 S2P4
2 S2P4
Для завершения внешнего энергетического уровня кислороду не хватает двух электронов. Энергично принимая их кислород проявляет степень окисления, равную –2. Однако в соединениях кислорода со фтором, общая электронная пара смещена по фтору как к более электроотрицательному элементу, В этом случае степень окисления кислорода равна + 2, а фтора + 2 . в пер оксиде водорода h3O2и его производных степеней окисления равна – 1. В соединениях со всеми другими электронами окислительность кислорода отрицательна и равна – 2.
Сравнение окислительно-восстановительных свойств и размера ядра кислорода с элементами стоящими с ним в той же подгруппе, группе и периоде.
В своей группе у кислорода самая маленькая орбита. Принять электроны ему легче всех, отдать труднее. Самая маленькая орбита у него потому, что он стоит во 2 периоде и следовательно у него меньше всех электронных слоев. Принять недостающих электрон легче потому что, у него лучше связь атома с электроном, чем у остальных элементов этой группы. И отдать труднее потому что, тоже связь с электрона с ядром на последнем слое сильней, чем у остальных элементов этой группы.
У кислорода ядро меньше чем у Li, Be, B, C, N, но больше чем у F, потому что число элекроных слоев у них одинаковы, а количество электронов на последнем слое разное. У кислорода электроны больше чем у Li, Be, B, C, N значит связь электронов с ядром больше и радиус меньше. У кислорода восстановительные свойства больше, чем у Li, Be, B, C, N и принять недостающий электрон ему легче, по меньше чем у фтора, которому принять недостающий электрон еще легче, чем кислороду.
Физические свойства аллотропных видоизменений кислорода.
Аллотпропным видоизменениям кислорода является озон. В отличии от бесцветного кислорода, не имеющего запаха, озон – это светло синий газ с сильным запахом. Озон в полтора тяжелее кислорода, лучше его растворяется в воде. Как окислитель озона само воспламеняющее горящие жидкости, например этан. При обычной температуре озон окисляет даже серебро. Поэтому дышать воздухом со значительным содержанием озона нельзя, т.к. он разрушает ткани дыхательных путей.
Большая окислительная активность озона объясняется его термической неустойчивостью. Он при комнатной температуре медленно, но при 100-1500.С быстро разлагается на кислород и атомарный О0, которой является чрезвычайно сильным окислителем по с сравнению с кислородом, он мгновенно вступает в химическую реакцию. В воздушной атмосфере над Землей на высоте около 25 километров находится озоновый слой, который защищает все живое от ультрофиалетовых лучей.
Получение кислорода
a)в лаборатории
Кислород в лаборатории получают путем разложения пероксида водорода (h3O2) в присутствии катализатора- диоксида марганца (MnO2) , а также разложением перманганата калия (KMnO4) при нагревание.
b)в промышленности
Так как горением в таком газе можно получить очень высокие температуры, полезные во многих... применениях, то быть может, что придет время, когда указанным путем станут на заводах и вообще для промышленности обогащать воздух кислородом.
Д.И. Менделеев
Попытки создать более или менее мощную кислородную промышленность предпринимались еще в прошлом веке в. многих странах. Но от идеи до технического воплощения часто лежит «дистанция; огромного размера»...
В Советском Союзе особенно быстрое развитие кислородной промышленности началось в годы Великой Отечественной войны, после изобретения академиком Л.П.Капицей турбодетандера и создания мощных воздухоразделительных установок.
Еще Карл Шееле получал кислород, по меньшей мере, пятью способами: из окиси ртути, сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчас получают кислород, разлагая богатые этим элементом хлораты и перхлораты. В любой школьной лаборатории демонстрируют опыт – разложение воды на кислород и водород электролизом. Но ни один из этих способов не может удовлетворить потребности промышленности в кислороде.
Энергетически проще всего получить элемент №8 из воздуха, поскольку воздух – не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8°C. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить до минус 196°C. Можно сказать, что проблема получения кислорода – это проблема получения холода.
Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться и при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, в которых это происходит, называют детандерами.
До 1938г. для получения жидкого воздуха пользовались только поршневыми детандерами. По существу, такой детандер – это аналог паровой машины, только работает в нем не пар, а сжатый воздух. Чтобы получить жидкий воздух с помощью таких детандеров, нужны были давления порядка 200 атм., причем по неизбежным техническим причинам на разных стадиях процесса давление было не одинаковым: от 45 до 200 атм. КПД установки был немногим выше, чем у паровой машины. Установка получилась сложной, громоздкой, дорогой.
В конце 30-х годов советский физик академик П.Л. Капица предложил использовать в качестве детандера турбину. Идея – не новая, ее еще в конце прошлого века высказывал Дж. Рэлей, но к.п.д. «докапицынских» турбин для сжижения воздуха был невысок. Поэтому небольшие турбодетандеры лишь выполняли кое-какую подсобную работу при поршневых детандерах.
Капица создал новую конструкцию, которая, по словам изобретателя, была «как бы компромиссом между водяной и паровой турбиной». Главная особенность турбодетандера Капицы в том, что воздух в ней расширяется не только в сопловом аппарате, но и на лопатках рабочего колеса. При этом газ движется от периферии колеса к центру, работая против центробежных сил.
Такая конструкция турбины позволила поднять к.п.д. установки с 0,5 до 0,8. И, кроме того, турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь до нескольких атмосфер. Очевидно, что 6 атм. получить намного проще и дешевле, чем 200. Немаловажно для экономики и то, что энергия, которую отдает расширяющийся воздух, не пропадает напрасно, она используется для вращения ротора генератора электрического тока.
Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода. Они работают не только у нас, но и во всем мире.
Первый опытный образец турбодетандера был невелик. Его ротор восьми сантиметров в диаметре весил всего 250г. Но, как писал П.Л. Капица в 1939г., «экспериментальная эксплуатация этого турбодетандера показала, что он является надежным и очень простым механизмом. Технический к.п.д. получается 0,79...0,83». И этот турбодетандер стал «сердцем» первой установки для получения кислорода новым методом.
В 1942г. построили подобную, но уже намного более мощную установку, которая производила до 200кг жидкого кислорода в час. В конце 1944г. вводится в строй самая мощная в мире турбо кислородная установка, производящая в 6...7 раз больше жидкого кислорода, чем установка старого типа, и при этом занимающая в 3...4 раза меньшую площадь.
Современный блок разделения воздуха БР-2, в конструкции которого также использован турбодетандер, мог бы за сутки работы снабдить тремя литрами газообразного кислорода каждого жителя СССР.
30 апреля 1945 г. Михаил Иванович Калинин подписал Указ о присвоении академику П. Л. Капице звания Героя Социалистического Труда «за успешную разработку нового турбинного метода получения кислорода и за создание мощной турбо кислородной установки».
Химические свойства кислорода с позиции О/В реакции, особенности горения органических и не органических веществ, простых и сложных.
Реакции окисления, сопровождающиеся выделениям теплоты и света, называются горением. Расплавленная сера горит в кислороде ярким синим пламенем, при этом образуется газ с резким запахом – диоксид серы, или оксид серы 4 (SO2). Запах, его мы ощущаем, когда зажигаем спички.
Внесенный в сосуд, с кислородом горящий красный фосфор горит ослепительным пламенем с образованием твердого белого вещества – оксида фосфора 5 (P2O5)
При внесении в сосуд с кислородом раскаленной стальной проволоки вы можете наблюдать горение железа, сопровождаемое треском и разбрызгиванием ярких искр–расплавленных капель железной окалины ( Fe5O4)
Это явление можно увидеть при разливе жидкого чугуна и стали на металлургических заводах.
Большое практическое значение имеют процессы горения сложных веществ, как, например: метан, ацетилена. В результате таких реакций получается оксиды элементов, входящих в состав сложного вещества. Например, схему реакции горения ацетилена можно записать так.

 2 C2h3+ 5 O24 CO22h3O
2 C2h3+ 5 O24 CO22h3O
Если экзотермическая реакция окисления происходит медленно, то ее горение не называют. Так, медленно окисляются на воздухе многие металлы, покрываясь пленкой оксидов. Сравнительно медленно происходит в живом организме реакция окисления глюкозы – одного из основных источников энергии в организме.
Само горение представляет собой экзотермическую реакцию окисления, происходящею с достаточно небольшой скоростью.
Биологическое значение кислорода.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Применение кислорода.
Кислород применяют в металлургической и химической промышленности для ускорения производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавном производстве на много ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, на пример, при газовой сварке и резке металлов.
Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Творческое задание.
Список используемой литературы.
1. Учебник за 9 класс по химии О.С. Габриелян.
2. Энциклопедия по химии.
3. Интернет <Популярная библиотека химических элементов>.
superbotanik.net
Реферат - Кислород - Химия
Министерство образования и науки РФ
РЕФЕРАТ
ПО ТЕМЕ
«КИСЛОРОД»
Выполнил:
Проверил:
-2007-
Общая характеристика кислорода.
КИСЛОРОД (лат. Oxygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева кислород расположен во втором периоде в группе VIA.
Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2 – при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления –2 (валентность II) и, реже, –1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора).
В свободном виде кислород — газ без цвета, запаха и вкуса.
Особенности строения молекулы О2: атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону.
Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль.
Физические и химические свойства
Физические и химические свойства: в свободном виде встречается в виде двух модификаций О2 («обычный» кислород) и О3 (озон). О2 — газ без цвета и запаха. При нормальных условиях плотность газа кислорода 1,42897 кг/м3. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) равна –182,9°C. При температурах от –218,7°C до –229,4°C существует твердый кислород с кубической решеткой (-модификация), при температурах от –229,4°C до –249,3°C — -модификация с гексагональной решеткой и при температурах ниже –249,3°C — кубическая -модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода.
При 20°C растворимость газа О2: 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая.
Высокая прочность химической связи между атомами в молекуле О2 приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином крови (точнее с железом II гема), что обеспечивает перенос кислорода от органов дыхания к другим органам.
Со многими веществами кислород вступает во взаимодействие без нагревания, например, со щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2 O, CaO и др., пероксиды типа Na2 O2, BaO2 и др. и супероксиды типа КО2, RbO2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами.
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует с взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ. Известно, что при нагревании в атмосфере кислорода или на воздухе многие простые и сложные вещества сгорают, причем образуются различные оксиды, например:
S+O2 = SO2; С + O2 = СО2
4Fe + 3O2 = 2Fe2 O3; 2Cu + O2 = 2CuO
4Nh4 + 3O2 = 2N2 + 6h3 O; 2h3 S + 3O2 = 2h3 O + 2SO2
Если смесь кислорода и водорода хранить в стеклянном сосуде при комнатной температуре, то экзотермическая реакция образования воды
2Н2 + О2 = 2Н2 О + 571 кДж
протекает крайне медленно; по расчету, первые капельки воды должны появиться в сосуде примерно через миллион лет. Но при внесении в сосуд со смесью этих газов платины или палладия (играющих роль катализатора), а также при поджигании реакция протекает с взрывом.
С азотом N2 кислород реагирует или при высокой температуре (около 1500-2000°C), или при пропускании через смесь азота и кислорода электрического разряда. При этих условиях обратимо образуется оксид азота (II):
N2 + O2 = 2NO
Возникший NO затем реагирует с кислородом с образованием бурого газа (диоксида азота):
2NO + О2 = 2NO2
Из неметаллов кислород напрямую ни при каких условиях не взаимодействует с галогенами, из металлов — с благородными металлами серебром, золотом, платиной и др.
Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна –2, называют оксидами (прежнее название — окислы). Примеры оксидов: оксид углерода (IV) CO2, оксид серы (VI) SO3, оксид меди (I) Cu2 O, оксид алюминия Al2 O3, оксид марганца (VII) Mn2 O7.
Кислород образует также соединения, в которых его степень окисления равна –1. Это — пероксиды (старое название — перекиси), например, пероксид водорода Н2 О2, пероксид бария ВаО2, пероксид натрия Na2 O2 и другие. В этих соединениях содержится пероксидная группировка — О — О —. С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода –1/2. Можно отметить, что часто формулы супероксидов записывают как К2 О4, Rb2 O4 и т.д.
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2 F2 степень окисления кислорода +1, а в соединении O2 F — +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН.
История открытия
История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая — нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе — Леонардо да Винчи. В 1665 английский естествоиспытатель Р. Гук писал, что воздух состоит из газа, содержащегося в селитре, а также из неактивного газа, составляющего большую часть воздуха. О том, что воздух содержит элемент, поддерживающий жизнь, в 18 веке было известно многим химикам. Шведский аптекарь и химик Карл Шееле начал изучать состав воздуха в 1768. В течение трех лет он разлагал нагреванием селитры (KNO3, NaNO3 ) и другие вещества и получал «огненный воздух», поддерживающий дыхание и горение. Но результаты своих опытов Шееле обнародовал только в 1777 году в книге «Химический трактат о воздухе и огне». В 1774 английский священник и натуралист Дж. Пристли нагреванием «жженой ртути» (оксида ртути HgO) получил газ, поддерживающий горение. Будучи в Париже, Пристли, не знавший, что полученный им газ входит в состав воздуха, сообщил о своем открытии А. Лавуазье и другим ученым. К этому времени был открыт и азот. В 1775 Лавуазье пришел к выводу, что обычный воздух состоит из двух газов — газа, необходимого для дыхания и поддерживающего горение, и газа «противоположного характера» — азота. Лавуазье назвал поддерживающий горение газ oxygene — «образующий кислоты» (от греч. oxys — кислый и gennao — рождаю; отсюда и русское название «кислород»), так как он тогда считал, что все кислоты содержат кислород. Давно уже известно, что кислоты бывают как кислородсодержащими, так и бескислородными, но название, данное элементу Лавуазье, осталось неизменным. На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс).
Нахождение в природе: кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8% (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры.
Получение:
В настоящее время кислород в промышленности получают за счет разделения воздуха при низких температурах. Сначала воздух сжимают компрессором, при этом воздух разогревается. Сжатому газу дают охладиться до комнатной температуры, а затем обеспечивают его свободное расширение. При расширении температура газа резко понижается. Охлажденный воздух, температура которого на несколько десятков градусов ниже температуры окружающей среды, вновь подвергают сжатию до 10-15 МПа. Затем снова отбирают выделившуюся теплоту. Через несколько циклов «сжатие—расширение» температура падает ниже температуры кипения и кислорода, и азота. Образуется жидкий воздух, который затем подвергают перегонке (дистилляции). Температура кипения кислорода (–182,9°C) более чем на 10 градусов выше, чем температура кипения азота (–195,8°C). Поэтому из жидкости азот испаряется первым, а в остатке накапливается кислород. За счет медленной (фракционной) дистилляции удается получить чистый кислород, в котором содержание примеси азота составляет менее 0,1 объемного процента.
Еще более чистый кислород можно получить при электролизе водных растворов щелочей (NaOH или KOH) или солей кислородсодержащих кислот (обычно используют раствор сульфата натрия Na2SO4). В лаборатории небольшие количества не очень чистого кислорода можно получить при нагревании перманганата калия KMnO4:
2KMnO4 = K2 MnO4 + MnO2 + O2.
Более чистый кислород получают разложением пероксида водорода Н2 О2 в присутствии каталитических количеств твердого диоксида марганца MnO2:
2Н2О2 = 2Н2О + О2.
Кислород образуется при сильном (выше 600°C) прокаливании нитрата натрия NaNO3:
2NaNO3 =2NaNO2 + О2,
при нагревании некоторых высших оксидов:
4CrO3 = 2Cr2 O3 + 3О2;
2PbO2 = 2PbO + О2;
3MnO2 = Mn3 O4 + О2.
Ранее кислород получали разложением бертолетовой соли KClO3 в присутствии каталитических количеств диоксида марганца MnO2:
2KClO3 = 2KCl + 3О2.
Однако бертолетова соль образует взрывчатые смеси, поэтому ее для получения кислорода в лабораториях теперь не используют. Разумеется, сейчас никому в голову не придет использовать для получения кислорода прокаливание оксида ртути HgO, так как образующийся в этой реакции кислород загрязнен ядовитыми парами ртути.
Источником кислорода в космических кораблях, подводных лодках и т. п. замкнутых помещениях служит смесь пероксида натрия Na2 O2 и супероксида калия KO2. При взаимодействии этих соединений с углекислым газом освобождается кислород:
2Na2 O2 + 2CO2 = 2Na2 CO3 + O2,
4КО2 + 2СО2 = 2К2 СО3 + 3О2.
Если использовать смесь Na2 O2 и КО2, взятых в молярном отношении 1:1, то на каждый моль поглощенного из воздуха углекислого газа будет выделяться 1 моль кислорода, так что состав воздуха не будет изменяться за счет поглощения при дыхании кислорода и выделения СО2.
Применение:
Применение кислорода очень разнообразно. Основные количества получаемого из воздуха кислорода используются в металлургии. Кислородное (а не воздушное) дутье в домнах позволяет существенно повышать скорость доменного процесса, экономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переделе чугуна в сталь. Чистый кислород или воздух, обогащенный кислородом, используется при получении и многих других металлов (меди, никеля, свинца и др.). Кислород используют при резке и сварке металлов. При этом применяют «баллонный» кислород. В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет.
Жидкий кислород — мощный окислитель, его используют как компонент ракетного топлива. Пропитанные жидким кислородом такие легко окисляющиеся материалы, как древесные опилки, вата, угольный порошок и др. (эти смеси называют оксиликвитами), используют как взрывчатые вещества, применяемые, например, при прокладке дорог в горах.
Биологическая роль:
Кислород в атмосфере Земли начал накапливаться в результате деятельности первичных фотосинтезирующих организмов, появившихся, вероятно, около 2,8 млрд. лет назад. Полагают, что 2 млрд. лет назад атмосфера уже содержала около 1% кислорода; постепенно из восстановительной она превращалась в окислительную и примерно 400 млн. лет назад приобрела современный состав. Наличие в атмосфере кислорода в значительной степени определило характер биологической эволюции. Аэробный (с участием О2 ) обмен веществ возник позже анаэробного (без участия О2 ), но именно реакции биологического окисления, более эффективные, чем древние энергетические процессы брожения и гликолиза, снабжают живые организмы большей частью необходимой им энергии. Исключение составляют облигатные анаэробы, например, некоторые паразиты, для которых кислород является ядом. Использование кислорода, обладающего высоким окислительно-восстановительным потенциалом, в качестве конечного акцептора электронов в цепи дыхательных ферментов, привело к возникновению биохимического механизма дыхания современного типа. Этот механизм и обеспечивает энергией аэробные организмы.
Кислород — основной биогенный элемент, входящий в состав молекул всех важнейших веществ, обеспечивающих структуру и функции клеток — белков, нуклеиновых кислот, углеводов, липидов, а также множества низкомолекулярных соединений. В каждом растении или животном кислорода гораздо больше, чем любого другого элемента (в среднем около 70%). Мышечная ткань человека содержит 16% кислорода, костная ткань — 28.5%; всего в организме среднего человека (масса тела 70 кг) содержится 43 кг кислорода. В организм животных и человека кислород поступает в основном через органы дыхания (свободный кислород) и с водой (связанный кислород). Потребность организма в кислороде определяется уровнем (интенсивностью) обмена веществ, который зависит от массы и поверхности тела, возраста, пола, характера питания, внешних условий и др. В экологии как важную энергетическую характеристику определяют отношение суммарного дыхания (то есть суммарных окислительных процессов) сообщества организмов к его суммарной биомассе.
Небольшие количества кислорода используют в медицине: кислородом (из так называемых кислородных подушек) дают некоторое время дышать больным, у которых затруднено дыхание. Нужно, однако, иметь в виду, что длительное вдыхание воздуха, обогащенного кислородом, опасно для здоровья человека. Высокие концентрации кислорода вызывают в тканях образование свободных радикалов, нарушающих структуру и функции биополимеров. Сходным действием на организм обладают и ионизирующие излучения. Поэтому понижение содержания кислорода (гипоксия) в тканях и клетках при облучении организма ионизирующей радиацией обладает защитным действием — так называемый кислородный эффект. Этот эффект используют в лучевой терапии: повышая содержание кислорода в опухоли и понижая его содержание в окружающих тканях усиливают лучевое поражение опухолевых клеток и уменьшают повреждение здоровых. При некоторых заболеваниях применяют насыщение организма кислородом под повышенным давлением — гипербарическую оксигенацию.
www.ronl.ru
Реферат - Творческая работа по химии: кислород
МОУСОШ № 112
Творческая работа
по химии:
на тему: Кислород
Выполнил: ученик 97 класса
Соложенцев Андрей
Проверила: учительница химии
Кудрявцева Наталья Михайловна
Челябинск, 2003 г.
Содержание
1. Открытие элемента кислород… 3
2. Нахождение кислорода в природе… 6
а) в составе простых веществ… 6
в) в составе сложных веществ… 7
3. Положение в таблице Д.И. Менделеева, строение… 9
4. Сравнение окисление, восстановление и размер атома кислорода с элементами стоящими с ним в этойже группе и подгруппе, в томже периоде… 10
5.Физические свойства алотропных видоизменений в кислороде… 11
6. Получение кислорода… 12
а) в лаборатории… 12
в) в промышленности… 12
7. Химические свойства кислорода с позиции О.В. реакции, особенности реакции горения простых и сложных… 16
8. Биологическое значение кислорода… 18
9. Применение кислорода… 19
10. Творческое задание… 20
11. Список использованной литературы… 21
Открытие элемента кислорода
1 августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению.
Джозеф Пристли
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие.
Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в. швед Карл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат «О воздухе и огне», содержавший информацию о кислороде, был опубликован позже, чем сообщение об открытии Пристли.
И все-таки главная фигура в истории открытия кислорода не Шееле и не Пристли. Они открыли новый газ и только. Открыли кислород и до конца дней своих остались ревностными защитниками теории флогистона! Теории некогда полезной, но к концу XVIII в. ставшей уже «кандалами на ногах науки».
Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно… Собственно открывшим кислород, поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают».
Великий французский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал о кислороде от самого Пристли. Спустя два месяца после открытия «дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал о том, как было сделано это открытие и из каких веществ (ртутная и свинцовая окалины) новый «воздух» выделяется.
До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазье наблюдал образование красных чешуек «ртутной окалины» и уменьшение объема воздуха при нагревании ртути в запаянной реторте. В другой реторте, применив высокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 С «ртутной окалины» и получил 2,5 С ртути и 8 кубических дюймов того самого газа, о котором рассказывал Пристли. В первом опыте, в котором часть ртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймов воздуха, а остаток его стал «азотом» – не жизненным, не поддерживающим ни дыхания, ни горения. Газ, выделенный при разложении окалины, проявлял противоположные свойства, и потому Лавуазье вначале назвал его «жизненным газом». Лавуазье выяснил сущность горения. И надобность в флогистоне – «огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе №8 современной науке известно абсолютно все.
Нахождение кислорода в природе
.
Кислород самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает 2 /з поверхности земного шара, образуя его водную оболочку гидросферу. Кислород вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Как вы уже знаете, обычный кислород существует в форме О2. Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
а) В составе простых веществ.
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксиды М2 О и пер оксиды М2 О2; с железом, образуя железную окалину Ге3 О4; с алюминием, образуя оксид А12 О3 .
Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением реакции горения. Вспомните горение серы с образованием SО2, фосфора с образованием Р2 О5 или угля с образованием СО2 .
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:

 N2 + O2 2NO –Q
N2 + O2 2NO –Q
в) в составе сложных веществ
Кислород энергично окисляет не только простые, но и сложные вещества, при этом образуется оксиды элементов, из которых они построены.
СН4 + 2О2 = 2Н2 О + СО2
Метан
2Н2 S + ЗО2= 2SО2 + 2Н2 О
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных.
Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Положение в таблице Д.И. Менделеева, строение.
В центре атома кислорода находится ядро с зарядом +8, ядро состоит из 8 протонов и (16-8)= 8 нейтронов вокруг ядра вращается 12 электронов.
О-О;
О О
1) 
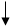
 1 S2
1 S2
2) 








 2 S2 P4
2 S2 P4
Для завершения внешнего энергетического уровня кислороду не хватает двух электронов. Энергично принимая их кислород проявляет степень окисления, равную –2. Однако в соединениях кислорода со фтором, общая электронная пара смещена по фтору как к более электроотрицательному элементу, В этом случае степень окисления кислорода равна + 2, а фтора + 2. в пер оксиде водорода h3 O2 и его производных степеней окисления равна – 1. В соединениях со всеми другими электронами окислительность кислорода отрицательна и равна – 2.
Сравнение окислительно-восстановительных свойств и размера ядра кислорода с элементами стоящими с ним в той же подгруппе, группе и периоде.
В своей группе у кислорода самая маленькая орбита. Принять электроны ему легче всех, отдать труднее. Самая маленькая орбита у него потому, что он стоит во 2 периоде и следовательно у него меньше всех электронных слоев. Принять недостающих электрон легче потому что, у него лучше связь атома с электроном, чем у остальных элементов этой группы. И отдать труднее потому что, тоже связь с электрона с ядром на последнем слое сильней, чем у остальных элементов этой группы.
У кислорода ядро меньше чем у Li, Be, B, C, N, но больше чем у F, потому что число элекроных слоев у них одинаковы, а количество электронов на последнем слое разное. У кислорода электроны больше чем у Li, Be, B, C, N значит связь электронов с ядром больше и радиус меньше. У кислорода восстановительные свойства больше, чем у Li, Be, B, C, N и принять недостающий электрон ему легче, по меньше чем у фтора, которому принять недостающий электрон еще легче, чем кислороду.
Физические свойства аллотропных видоизменений кислорода.
Аллотпропным видоизменениям кислорода является озон. В отличии от бесцветного кислорода, не имеющего запаха, озон – это светло синий газ с сильным запахом. Озон в полтора тяжелее кислорода, лучше его растворяется в воде. Как окислитель озона само воспламеняющее горящие жидкости, например этан. При обычной температуре озон окисляет даже серебро. Поэтому дышать воздухом со значительным содержанием озона нельзя, т.к. он разрушает ткани дыхательных путей.
Большая окислительная активность озона объясняется его термической неустойчивостью. Он при комнатной температуре медленно, но при 100-1500. С быстро разлагается на кислород и атомарный О0, которой является чрезвычайно сильным окислителем по с сравнению с кислородом, он мгновенно вступает в химическую реакцию. В воздушной атмосфере над Землей на высоте около 25 километров находится озоновый слой, который защищает все живое от ультрофиалетовых лучей.
Получение кислорода
a) в лаборатории
Кислород в лаборатории получают путем разложения пероксида водорода (h3 O2 ) в присутствии катализатора- диоксида марганца (MnO2 ), а также разложением перманганата калия (KMnO4 ) при нагревание.
b) в промышленности
Так как горением в таком газе можно получить очень высокие температуры, полезные во многих… применениях, то быть может, что придет время, когда указанным путем станут на заводах и вообще для промышленности обогащать воздух кислородом.
Д.И. Менделеев
Попытки создать более или менее мощную кислородную промышленность предпринимались еще в прошлом веке в. многих странах. Но от идеи до технического воплощения часто лежит «дистанция; огромного размера»...
В Советском Союзе особенно быстрое развитие кислородной промышленности началось в годы Великой Отечественной войны, после изобретения академиком Л.П.Капицей турбодетандера и создания мощных воздухоразделительных установок.
Еще Карл Шееле получал кислород, по меньшей мере, пятью способами: из окиси ртути, сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчас получают кислород, разлагая богатые этим элементом хлораты и перхлораты. В любой школьной лаборатории демонстрируют опыт – разложение воды на кислород и водород электролизом. Но ни один из этих способов не может удовлетворить потребности промышленности в кислороде.
Энергетически проще всего получить элемент №8 из воздуха, поскольку воздух – не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8°C. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить до минус 196°C. Можно сказать, что проблема получения кислорода – это проблема получения холода.
Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться и при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, в которых это происходит, называют детандерами.
До 1938г. для получения жидкого воздуха пользовались только поршневыми детандерами. По существу, такой детандер – это аналог паровой машины, только работает в нем не пар, а сжатый воздух. Чтобы получить жидкий воздух с помощью таких детандеров, нужны были давления порядка 200 атм., причем по неизбежным техническим причинам на разных стадиях процесса давление было не одинаковым: от 45 до 200 атм. КПД установки был немногим выше, чем у паровой машины. Установка получилась сложной, громоздкой, дорогой.
В конце 30-х годов советский физик академик П.Л. Капица предложил использовать в качестве детандера турбину. Идея – не новая, ее еще в конце прошлого века высказывал Дж. Рэлей, но к.п.д. «докапицынских» турбин для сжижения воздуха был невысок. Поэтому небольшие турбодетандеры лишь выполняли кое-какую подсобную работу при поршневых детандерах.
Капица создал новую конструкцию, которая, по словам изобретателя, была «как бы компромиссом между водяной и паровой турбиной». Главная особенность турбодетандера Капицы в том, что воздух в ней расширяется не только в сопловом аппарате, но и на лопатках рабочего колеса. При этом газ движется от периферии колеса к центру, работая против центробежных сил.
Такая конструкция турбины позволила поднять к.п.д. установки с 0,5 до 0,8. И, кроме того, турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь до нескольких атмосфер. Очевидно, что 6 атм. получить намного проще и дешевле, чем 200. Немаловажно для экономики и то, что энергия, которую отдает расширяющийся воздух, не пропадает напрасно, она используется для вращения ротора генератора электрического тока.
Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода. Они работают не только у нас, но и во всем мире.
Первый опытный образец турбодетандера был невелик. Его ротор восьми сантиметров в диаметре весил всего 250г. Но, как писал П.Л. Капица в 1939г., «экспериментальная эксплуатация этого турбодетандера показала, что он является надежным и очень простым механизмом. Технический к.п.д. получается 0,79...0,83». И этот турбодетандер стал «сердцем» первой установки для получения кислорода новым методом.
В 1942г. построили подобную, но уже намного более мощную установку, которая производила до 200кг жидкого кислорода в час. В конце 1944г. вводится в строй самая мощная в мире турбо кислородная установка, производящая в 6...7 раз больше жидкого кислорода, чем установка старого типа, и при этом занимающая в 3...4 раза меньшую площадь.
Современный блок разделения воздуха БР-2, в конструкции которого также использован турбодетандер, мог бы за сутки работы снабдить тремя литрами газообразного кислорода каждого жителя СССР.
30 апреля 1945 г. Михаил Иванович Калинин подписал Указ о присвоении академику П. Л. Капице звания Героя Социалистического Труда «за успешную разработку нового турбинного метода получения кислорода и за создание мощной турбо кислородной установки».
Химические свойства кислорода с позиции О/В реакции, особенности горения органических и не органических веществ, простых и сложных.
Реакции окисления, сопровождающиеся выделениям теплоты и света, называются горением. Расплавленная сера горит в кислороде ярким синим пламенем, при этом образуется газ с резким запахом – диоксид серы, или оксид серы 4 (SO2 ). Запах, его мы ощущаем, когда зажигаем спички.
Внесенный в сосуд, с кислородом горящий красный фосфор горит ослепительным пламенем с образованием твердого белого вещества – оксида фосфора 5 (P2 O5 )
При внесении в сосуд с кислородом раскаленной стальной проволоки вы можете наблюдать горение железа, сопровождаемое треском и разбрызгиванием ярких искр–расплавленных капель железной окалины ( Fe5 O4 )
Это явление можно увидеть при разливе жидкого чугуна и стали на металлургических заводах.
Большое практическое значение имеют процессы горения сложных веществ, как, например: метан, ацетилена. В результате таких реакций получается оксиды элементов, входящих в состав сложного вещества. Например, схему реакции горения ацетилена можно записать так.

 2 C2 h3 + 5 O2 4 CO2 2h3 O
2 C2 h3 + 5 O2 4 CO2 2h3 O
Если экзотермическая реакция окисления происходит медленно, то ее горение не называют. Так, медленно окисляются на воздухе многие металлы, покрываясь пленкой оксидов. Сравнительно медленно происходит в живом организме реакция окисления глюкозы – одного из основных источников энергии в организме.
Само горение представляет собой экзотермическую реакцию окисления, происходящею с достаточно небольшой скоростью.
Биологическое значение кислорода.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Применение кислорода.
Кислород применяют в металлургической и химической промышленности для ускорения производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавном производстве на много ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, на пример, при газовой сварке и резке металлов.
Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Творческое задание.
Список используемой литературы.
1. Учебник за 9 класс по химии О.С. Габриелян.
2. Энциклопедия по химии.
3. Интернет <Популярная библиотека химических элементов>.
www.ronl.ru
Реферат - Творческая работа по химии: кислород
МОУСОШ №112
Творческаяработа
по химии:
на тему:Кислород
Выполнил: ученик 97класса
Соложенцев Андрей
Проверила: учительницахимии
Кудрявцева НатальяМихайловна
Челябинск, 2003 г.
Содержание1.Открытие элемента кислород… 32.Нахождение кислорода в природе… 6а) в составе простыхвеществ… 6
в) в составе сложныхвеществ… 7
3.Положение в таблице Д.И. Менделеева, строение… 9
4. Сравнение окисление, восстановление и размер атомакислорода с элементами стоящими с ним в этойже группе и подгруппе, в томжепериоде… 10
5.Физическиесвойства алотропных видоизменений в кислороде 11
6. Получениекислорода… 12
а) влаборатории… 12
в) впромышленности… 12
7. Химическиесвойства кислорода с позиции О.В. реакции, особенности реакции горения простыхи сложных… 16
8.Биологическое значение кислорода… 18
9. Применениекислорода… 19
10.Творческое задание… 20
11. Списокиспользованной литературы… 21
Открытие элемента кислорода
1августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, чтовоздух легко может быть изгнан из нее посредством линзы. Этот воздух непоглощался водой. Каково же было мое изумление, когда я обнаружил, что свечагорит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найтиобъяснение этому явлению.
Джозеф Пристли
То,что кислород невидим, безвкусен, лишен запаха, газообразен при обычныхусловиях, надолго задержало его открытие.
Многиеученые прошлого догадывались, что существует вещество со свойствами, которые,как мы теперь знаем, присущи кислороду.
Изобретательподводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснилроль этого газа для дыхания и использовал его в своей подводной лодке. Ноработы Дреббеля практически не повлияли на развитие химии. Его изобретениеносило военный характер, и все, что было так или иначе связано с ним,постарались своевременно засекретить.
Кислородоткрыли почти одновременно два выдающихся химика второй половины XVIII в. шведКарл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше,но его трактат «О воздухе и огне», содержавший информацию о кислороде, былопубликован позже, чем сообщение об открытии Пристли.
Ивсе-таки главная фигура в истории открытия кислорода не Шееле и не Пристли.Они открыли новый газ и только. Открыли кислород и до конца дней своих осталисьревностными защитниками теории флогистона! Теории некогда полезной, но к концуXVIII в. ставшей уже «кандалами на ногах науки».
ПозжеФридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у нихв руках. Элемент, которому суждено было революционизировать химию, пропадал вих руках бесследно… Собственно открывшим кислород, поэтому остается Лавуазье,а не те двое, которые только описали кислород, даже не догадываясь, что ониописывают».
Великийфранцузский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал окислороде от самого Пристли. Спустя два месяца после открытия«дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал отом, как было сделано это открытие и из каких веществ (ртутная и свинцоваяокалины) новый «воздух» выделяется.
Довстречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участиетолько часть воздуха. Теперь он по-новому поставил начатые двумя годами раньшеисследования горения. Для них характерен скрупулезный количественный подход:все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазьенаблюдал образование красных чешуек «ртутной окалины» и уменьшение объемавоздуха при нагревании ртути в запаянной реторте. В другой реторте, примениввысокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 С «ртутной окалины» и получил 2,5 С ртути и 8 кубических дюймов тогосамого газа, о котором рассказывал Пристли. В первом опыте, в котором частьртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймоввоздуха, а остаток его стал «азотом» – не жизненным, не поддерживающим нидыхания, ни горения. Газ, выделенный при разложении окалины, проявлялпротивоположные свойства, и потому Лавуазье вначале назвал его «жизненнымгазом». Лавуазье выяснил сущность горения. И надобность в флогистоне –«огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислороднаятеория горения пришла на смену теории флогистона. За два века, прошедших современи открытия, теория Лавуазье не только не была опровергнута, но еще болееукрепилась.
Этоне значит, конечно, что об элементе №8 современной науке известно абсолютновсе.
Нахождение кислорода в природе.
Кислород самый распространенный элемент на нашейпланете. Он входит в состав воды (88,9%), а ведь она покрывает 2/зповерхности земного шара, образуя его водную оболочку гидросферу. Кислородвторая по количеству и первая по значению для жизни составная часть воздушнойоболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15%(по массе). Кислород входит в состав многочисленных минералов твердой оболочкиземной коры литосферы: из каждых 100 атомов земной коры на долю кислородаприходится 58 атомов.
Как вы уже знаете, обычный кислород существует вформе О2. Это газ без цвета, запаха и вкуса. В жидком состоянииимеет светло-голубую окраску, в твердом синюю. В воде газообразный кислородрастворим лучше, чем азот и водород.
а) В составе простыхвеществ.
Кислород взаимодействует почти со всеми простымивеществами, кроме галогенов, благородных газов, золота и платиновых металлов.Например, энергично реагирует с металлами: щелочными, образуя оксиды М2Ои пер оксиды М2О2; с железом, образуя железную окалину Ге3О4;с алюминием, образуя оксид А12О3.
Реакции неметаллов скислородом протекают очень часто с выделением большого количества тепла исопровождаются воспламенением реакции горения. Вспомните горение серы собразованием SО2, фосфора с образованием Р2О5или угля с образованием СО2.
Почти все реакции сучастием кислорода экзотермические. Исключение составляет взаимодействие азотас кислородом: это эндотермическая реакция, которая протекает при температуревыше 1200 °С или при электрическом разряде:
/>/>N2+ O2 2NO –Q
в) всоставе сложных веществ
Кислород энергично окисляет не только простые, но и сложныевещества, при этом образуется оксиды элементов, из которых они построены.
СН4 + 2О2 = 2Н2О + СО2
Метан2Н2S<sub/> + ЗО2= 2SО2 + 2Н2О
Высокая окислительнаяспособность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и впроцессах медленного окисления различных веществ при обычной температуре. Этипроцессы не менее важны, чем реакции горения. Так, медленное окисление пищи внашем организме является источником энергии, за счет которой живет организм.Кислород для этой цели доставляется гемоглобином крови, который способенобразовывать с ним непрочное соединение уже при комнатной температуре.Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организмакислород, который окисляет белки, жиры и углеводы (составные части пищи),образуя при этом углекислый газ и воду и освобождая энергию, необходимую длядеятельности организма.
Исключительно важна ролькислорода в процессе дыхания человека и животных.
Растения также поглощаютатмосферный кислород. Но если в темноте идет только процесс поглощениярастениями кислорода, то на свету протекает еще один противоположный емупроцесс — фотосинтез, в результате которого растения поглощают углекислый гази выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то витоге на свету растения выделяют гораздо больше кислорода, чем поглощают егопри дыхании. Таким образом, содержание свободного кислорода Земли сохраняетсяблагодаря жизнедеятельности зеленых растений.
Положение в таблице Д.И.Менделеева, строение.
В центре атома кислороданаходится ядро с зарядом +8, ядро состоит из 8 протонов и (16-8)= 8 нейтроноввокруг ядра вращается 12 электронов.
О-О;
О О
1) />/>/>1 S2
2) />/>/>/>/>/>/>/>/>/>2S2 P4
Для завершения внешнегоэнергетического уровня кислороду не хватает двух электронов. Энергично принимаяих кислород проявляет степень окисления, равную –2. Однако в соединенияхкислорода со фтором, общая электронная пара смещена по фтору как к болееэлектроотрицательному элементу, В этом случае степень окисления кислорода равна+ 2, а фтора + 2. в пер оксиде водорода h3O2 и его производных степеней окисления равна –1. В соединениях со всеми другими электронами окислительность кислорода отрицательнаи равна – 2.
Сравнениеокислительно-восстановительных свойств и размера ядра кислорода с элементамистоящими с ним в той же подгруппе, группе и периоде.
В своей группе укислорода самая маленькая орбита. Принять электроны ему легче всех, отдатьтруднее. Самая маленькая орбита у него потому, что он стоит во 2 периоде иследовательно у него меньше всех электронных слоев. Принять недостающихэлектрон легче потому что, у него лучше связь атома с электроном, чем уостальных элементов этой группы. И отдать труднее потому что, тоже связь сэлектрона с ядром на последнем слое сильней, чем у остальных элементов этойгруппы.
У кислорода ядро меньшечем у Li, Be, B,C, N, но больше чем у F, потому что число элекроных слоев у них одинаковы, а количествоэлектронов на последнем слое разное. У кислорода электроны больше чем у Li, Be, B, C, N значит связь электронов с ядромбольше и радиус меньше. У кислорода восстановительные свойства больше, чем у Li, Be, B, C, N и принять недостающий электронему легче, по меньше чем у фтора, которому принять недостающий электрон ещелегче, чем кислороду.
Физические свойствааллотропных видоизменений кислорода.
Аллотпропнымвидоизменениям кислорода является озон. В отличии от бесцветного кислорода, неимеющего запаха, озон – это светло синий газ с сильным запахом. Озон в полторатяжелее кислорода, лучше его растворяется в воде. Как окислитель озона самовоспламеняющее горящие жидкости, например этан. При обычной температуре озонокисляет даже серебро. Поэтому дышать воздухом со значительным содержаниемозона нельзя, т.к. он разрушает ткани дыхательных путей.
Большая окислительнаяактивность озона объясняется его термической неустойчивостью. Он при комнатнойтемпературе медленно, но при 100-1500. С быстро разлагается накислород и атомарный О0, которой является чрезвычайно сильнымокислителем по с сравнению с кислородом, он мгновенно вступает в химическуюреакцию. В воздушной атмосфере над Землей на высоте около 25 километровнаходится озоновый слой, который защищает все живое от ультрофиалетовых лучей.
Получениекислорода
a) в лаборатории
Кислород в лабораторииполучают путем разложения пероксида водорода (h3O2) в присутствии катализатора- диоксида марганца(Mn O2), а также разложением перманганата калия (KMn O4) при нагревание.
b) в промышленности
Так как горением в таком газеможно получить очень высокие температуры, полезные во многих… применениях, тобыть может, что придет время, когда указанным путем станут на заводах и вообщедля промышленности обогащать воздух кислородом.
Д.И. Менделеев
Попыткисоздать более или менее мощную кислородную промышленность предпринимались еще впрошлом веке в. многих странах. Но от идеи до технического воплощения частолежит «дистанция; огромного размера»...
ВСоветском Союзе особенно быстрое развитие кислородной промышленности началось вгоды Великой Отечественной войны, после изобретения академиком Л.П.Капицейтурбодетандера и создания мощных воздухоразделительных установок.
ЕщеКарл Шееле получал кислород, по меньшей мере, пятью способами: из окиси ртути,сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчасполучают кислород, разлагая богатые этим элементом хлораты и перхлораты. Влюбой школьной лаборатории демонстрируют опыт – разложение воды на кислород иводород электролизом. Но ни один из этих способов не может удовлетворитьпотребности промышленности в кислороде.
Энергетическипроще всего получить элемент №8 из воздуха, поскольку воздух – не соединение, иразделить воздух не так уж трудно. Температуры кипения азота и кислородаотличаются (при атмосферном давлении) на 12,8°C. Следовательно, жидкий воздухможно разделить на компоненты в ректификационных колоннах так же, как делят,например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить доминус 196°C. Можно сказать, что проблема получения кислорода – это проблемаполучения холода.
Чтобыполучать холод с помощью обыкновенного воздуха, последний нужно сжать, а затемдать ему расшириться и при этом заставить его производить механическую работу.Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, вкоторых это происходит, называют детандерами.
До1938г. для получения жидкого воздуха пользовались только поршневымидетандерами. По существу, такой детандер – это аналог паровой машины, толькоработает в нем не пар, а сжатый воздух. Чтобы получить жидкий воздух с помощьютаких детандеров, нужны были давления порядка 200 атм., причем понеизбежным техническим причинам на разных стадиях процесса давление было не одинаковым:от 45 до 200 атм. КПД установки был немногим выше, чем у паровой машины.Установка получилась сложной, громоздкой, дорогой.
Вконце 30-х годов советский физик академик П.Л. Капица предложилиспользовать в качестве детандера турбину. Идея – не новая, ее еще в концепрошлого века высказывал Дж. Рэлей, но к.п.д. «докапицынских» турбин длясжижения воздуха был невысок. Поэтому небольшие турбодетандеры лишь выполняликое-какую подсобную работу при поршневых детандерах.
Капицасоздал новую конструкцию, которая, по словам изобретателя, была «как быкомпромиссом между водяной и паровой турбиной». Главная особенностьтурбодетандера Капицы в том, что воздух в ней расширяется не только в сопловомаппарате, но и на лопатках рабочего колеса. При этом газ движется от периферииколеса к центру, работая против центробежных сил.
Такаяконструкция турбины позволила поднять к.п.д. установки с 0,5 до 0,8. И, крометого, турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь донескольких атмосфер. Очевидно, что 6 атм. получить намного проще идешевле, чем 200. Немаловажно для экономики и то, что энергия, которую отдаетрасширяющийся воздух, не пропадает напрасно, она используется для вращенияротора генератора электрического тока.
Современныеустановки для разделения воздуха, в которых холод получают с помощьютурбодетандеров, дают промышленности, прежде всего металлургии и химии, сотнитысяч кубометров газообразного кислорода. Они работают не только у нас, но и вовсем мире.
Первыйопытный образец турбодетандера был невелик. Его ротор восьми сантиметров вдиаметре весил всего 250г. Но, как писал П.Л. Капица в 1939г.,«экспериментальная эксплуатация этого турбодетандера показала, что он являетсянадежным и очень простым механизмом. Технический к.п.д. получается 0,79...0,83».И этот турбодетандер стал «сердцем» первой установки для получения кислородановым методом.
В1942г. построили подобную, но уже намного более мощную установку, котораяпроизводила до 200кг жидкого кислорода в час. В конце 1944г. вводится в строй самаямощная в мире турбо кислородная установка, производящая в 6...7 раз большежидкого кислорода, чем установка старого типа, и при этом занимающая в 3...4раза меньшую площадь.
Современныйблок разделения воздуха БР-2, в конструкции которого также использовантурбодетандер, мог бы за сутки работы снабдить тремя литрами газообразногокислорода каждого жителя СССР.
30апреля 1945 г. Михаил Иванович Калинин подписал Указ о присвоении академику П.Л. Капице звания Героя Социалистического Труда «за успешную разработку новоготурбинного метода получения кислорода и за создание мощной турбо кислороднойустановки».
Химические свойствакислорода с позиции О/В реакции, особенности горения органических и неорганических веществ, простых и сложных.
Реакции окисления,сопровождающиеся выделениям теплоты и света, называются горением. Расплавленнаясера горит в кислороде ярким синим пламенем, при этом образуется газ с резкимзапахом – диоксид серы, или оксид серы 4 (SO2).Запах, его мы ощущаем, когда зажигаем спички.
Внесенный в сосуд, скислородом горящий красный фосфор горит ослепительным пламенем с образованиемтвердого белого вещества – оксида фосфора 5 (P2O5)
При внесении в сосуд скислородом раскаленной стальной проволоки вы можете наблюдать горение железа,сопровождаемое треском и разбрызгиванием ярких искр–расплавленных капельжелезной окалины ( Fe5O4)
Это явление можно увидетьпри разливе жидкого чугуна и стали на металлургических заводах.
Большое практическоезначение имеют процессы горения сложных веществ, как, например: метан,ацетилена. В результате таких реакций получается оксиды элементов, входящих всостав сложного вещества. Например, схему реакции горения ацетилена можнозаписать так.
/>/>2 C2h3+ 5 O2 4 CO2 2h3O
Если экзотермическаяреакция окисления происходит медленно, то ее горение не называют. Так, медленноокисляются на воздухе многие металлы, покрываясь пленкой оксидов. Сравнительномедленно происходит в живом организме реакция окисления глюкозы – одного изосновных источников энергии в организме.
Само горение представляетсобой экзотермическую реакцию окисления, происходящею с достаточно небольшойскоростью.
Биологическоезначение кислорода.
Высокая окислительнаяспособность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и впроцессах медленного окисления различных веществ при обычной температуре. Этипроцессы не менее важны, чем реакции горения. Так, медленное окисление пищи внашем организме является источником энергии, за счет которой живет организм.Кислород для этой цели доставляется гемоглобином крови, который способенобразовывать с ним непрочное соединение уже при комнатной температуре.Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организмакислород, который окисляет белки, жиры и углеводы (составные части пищи),образуя при этом углекислый газ и воду и освобождая энергию, необходимую длядеятельности организма.
Исключительно важна ролькислорода в процессе дыхания человека и животных. Растения также поглощаютатмосферный кислород. Но если в темноте идет только процесс поглощениярастениями кислорода, то на свету протекает еще один противоположный емупроцесс — фотосинтез, в результате которого растения поглощают углекислый гази выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то витоге на свету растения выделяют гораздо больше кислорода, чем поглощают егопри дыхании. Таким образом, содержание свободного кислорода Земли сохраняетсяблагодаря жизнедеятельности зеленых растений.
Применениекислорода.
Кислород применяют вметаллургической и химической промышленности для ускорения производственныхпроцессов. Так, замена воздушного дутья кислородным в доменном и сталеплавномпроизводстве на много ускоряет выплавку металла. Чистый кислород применяюттакже для получения высоких температур, на пример, при газовой сварке и резкеметаллов.
Его используют дляжизнеобеспечения на подводных и космических кораблях, при работах водолазов,пожарных.
В медицине кислородприменяют в случаях временного затруднения дыхания, связанного с некоторымизаболеваниями.
Творческое задание.
Списокиспользуемой литературы.
1. Учебник за 9 класс по химии О.С. Габриелян.
2. Энциклопедия по химии.
3. Интернет <Популярная библиотека химических элементов>.
www.ronl.ru
Доклад - Творческая работа по химии: кислород
МОУСОШ №112
Творческаяработа
по химии:
на тему:Кислород
Выполнил: ученик 97класса
Соложенцев Андрей
Проверила: учительницахимии
Кудрявцева НатальяМихайловна
Челябинск, 2003 г.
Содержание1.Открытие элемента кислород… 32.Нахождение кислорода в природе… 6а) в составе простыхвеществ… 6
в) в составе сложныхвеществ… 7
3.Положение в таблице Д.И. Менделеева, строение… 9
4. Сравнение окисление, восстановление и размер атомакислорода с элементами стоящими с ним в этойже группе и подгруппе, в томжепериоде… 10
5.Физическиесвойства алотропных видоизменений в кислороде 11
6. Получениекислорода… 12
а) влаборатории… 12
в) впромышленности… 12
7. Химическиесвойства кислорода с позиции О.В. реакции, особенности реакции горения простыхи сложных… 16
8.Биологическое значение кислорода… 18
9. Применениекислорода… 19
10.Творческое задание… 20
11. Списокиспользованной литературы… 21
Открытие элемента кислорода
1августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, чтовоздух легко может быть изгнан из нее посредством линзы. Этот воздух непоглощался водой. Каково же было мое изумление, когда я обнаружил, что свечагорит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найтиобъяснение этому явлению.
Джозеф Пристли
То,что кислород невидим, безвкусен, лишен запаха, газообразен при обычныхусловиях, надолго задержало его открытие.
Многиеученые прошлого догадывались, что существует вещество со свойствами, которые,как мы теперь знаем, присущи кислороду.
Изобретательподводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснилроль этого газа для дыхания и использовал его в своей подводной лодке. Ноработы Дреббеля практически не повлияли на развитие химии. Его изобретениеносило военный характер, и все, что было так или иначе связано с ним,постарались своевременно засекретить.
Кислородоткрыли почти одновременно два выдающихся химика второй половины XVIII в. шведКарл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше,но его трактат «О воздухе и огне», содержавший информацию о кислороде, былопубликован позже, чем сообщение об открытии Пристли.
Ивсе-таки главная фигура в истории открытия кислорода не Шееле и не Пристли.Они открыли новый газ и только. Открыли кислород и до конца дней своих осталисьревностными защитниками теории флогистона! Теории некогда полезной, но к концуXVIII в. ставшей уже «кандалами на ногах науки».
ПозжеФридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у нихв руках. Элемент, которому суждено было революционизировать химию, пропадал вих руках бесследно… Собственно открывшим кислород, поэтому остается Лавуазье,а не те двое, которые только описали кислород, даже не догадываясь, что ониописывают».
Великийфранцузский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал окислороде от самого Пристли. Спустя два месяца после открытия«дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал отом, как было сделано это открытие и из каких веществ (ртутная и свинцоваяокалины) новый «воздух» выделяется.
Довстречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участиетолько часть воздуха. Теперь он по-новому поставил начатые двумя годами раньшеисследования горения. Для них характерен скрупулезный количественный подход:все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазьенаблюдал образование красных чешуек «ртутной окалины» и уменьшение объемавоздуха при нагревании ртути в запаянной реторте. В другой реторте, примениввысокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 С «ртутной окалины» и получил 2,5 С ртути и 8 кубических дюймов тогосамого газа, о котором рассказывал Пристли. В первом опыте, в котором частьртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймоввоздуха, а остаток его стал «азотом» – не жизненным, не поддерживающим нидыхания, ни горения. Газ, выделенный при разложении окалины, проявлялпротивоположные свойства, и потому Лавуазье вначале назвал его «жизненнымгазом». Лавуазье выяснил сущность горения. И надобность в флогистоне –«огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислороднаятеория горения пришла на смену теории флогистона. За два века, прошедших современи открытия, теория Лавуазье не только не была опровергнута, но еще болееукрепилась.
Этоне значит, конечно, что об элементе №8 современной науке известно абсолютновсе.
Нахождение кислорода в природе.
Кислород самый распространенный элемент на нашейпланете. Он входит в состав воды (88,9%), а ведь она покрывает 2/зповерхности земного шара, образуя его водную оболочку гидросферу. Кислородвторая по количеству и первая по значению для жизни составная часть воздушнойоболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15%(по массе). Кислород входит в состав многочисленных минералов твердой оболочкиземной коры литосферы: из каждых 100 атомов земной коры на долю кислородаприходится 58 атомов.
Как вы уже знаете, обычный кислород существует вформе О2. Это газ без цвета, запаха и вкуса. В жидком состоянииимеет светло-голубую окраску, в твердом синюю. В воде газообразный кислородрастворим лучше, чем азот и водород.
а) В составе простыхвеществ.
Кислород взаимодействует почти со всеми простымивеществами, кроме галогенов, благородных газов, золота и платиновых металлов.Например, энергично реагирует с металлами: щелочными, образуя оксиды М2Ои пер оксиды М2О2; с железом, образуя железную окалину Ге3О4;с алюминием, образуя оксид А12О3.
Реакции неметаллов скислородом протекают очень часто с выделением большого количества тепла исопровождаются воспламенением реакции горения. Вспомните горение серы собразованием SО2, фосфора с образованием Р2О5или угля с образованием СО2.
Почти все реакции сучастием кислорода экзотермические. Исключение составляет взаимодействие азотас кислородом: это эндотермическая реакция, которая протекает при температуревыше 1200 °С или при электрическом разряде:
/>/>N2+ O2 2NO –Q
в) всоставе сложных веществ
Кислород энергично окисляет не только простые, но и сложныевещества, при этом образуется оксиды элементов, из которых они построены.
СН4 + 2О2 = 2Н2О + СО2
Метан2Н2S<sub/> + ЗО2= 2SО2 + 2Н2О
Высокая окислительнаяспособность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и впроцессах медленного окисления различных веществ при обычной температуре. Этипроцессы не менее важны, чем реакции горения. Так, медленное окисление пищи внашем организме является источником энергии, за счет которой живет организм.Кислород для этой цели доставляется гемоглобином крови, который способенобразовывать с ним непрочное соединение уже при комнатной температуре.Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организмакислород, который окисляет белки, жиры и углеводы (составные части пищи),образуя при этом углекислый газ и воду и освобождая энергию, необходимую длядеятельности организма.
Исключительно важна ролькислорода в процессе дыхания человека и животных.
Растения также поглощаютатмосферный кислород. Но если в темноте идет только процесс поглощениярастениями кислорода, то на свету протекает еще один противоположный емупроцесс — фотосинтез, в результате которого растения поглощают углекислый гази выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то витоге на свету растения выделяют гораздо больше кислорода, чем поглощают егопри дыхании. Таким образом, содержание свободного кислорода Земли сохраняетсяблагодаря жизнедеятельности зеленых растений.
Положение в таблице Д.И.Менделеева, строение.
В центре атома кислороданаходится ядро с зарядом +8, ядро состоит из 8 протонов и (16-8)= 8 нейтроноввокруг ядра вращается 12 электронов.
О-О;
О О
1) />/>/>1 S2
2) />/>/>/>/>/>/>/>/>/>2S2 P4
Для завершения внешнегоэнергетического уровня кислороду не хватает двух электронов. Энергично принимаяих кислород проявляет степень окисления, равную –2. Однако в соединенияхкислорода со фтором, общая электронная пара смещена по фтору как к болееэлектроотрицательному элементу, В этом случае степень окисления кислорода равна+ 2, а фтора + 2. в пер оксиде водорода h3O2 и его производных степеней окисления равна –1. В соединениях со всеми другими электронами окислительность кислорода отрицательнаи равна – 2.
Сравнениеокислительно-восстановительных свойств и размера ядра кислорода с элементамистоящими с ним в той же подгруппе, группе и периоде.
В своей группе укислорода самая маленькая орбита. Принять электроны ему легче всех, отдатьтруднее. Самая маленькая орбита у него потому, что он стоит во 2 периоде иследовательно у него меньше всех электронных слоев. Принять недостающихэлектрон легче потому что, у него лучше связь атома с электроном, чем уостальных элементов этой группы. И отдать труднее потому что, тоже связь сэлектрона с ядром на последнем слое сильней, чем у остальных элементов этойгруппы.
У кислорода ядро меньшечем у Li, Be, B,C, N, но больше чем у F, потому что число элекроных слоев у них одинаковы, а количествоэлектронов на последнем слое разное. У кислорода электроны больше чем у Li, Be, B, C, N значит связь электронов с ядромбольше и радиус меньше. У кислорода восстановительные свойства больше, чем у Li, Be, B, C, N и принять недостающий электронему легче, по меньше чем у фтора, которому принять недостающий электрон ещелегче, чем кислороду.
Физические свойствааллотропных видоизменений кислорода.
Аллотпропнымвидоизменениям кислорода является озон. В отличии от бесцветного кислорода, неимеющего запаха, озон – это светло синий газ с сильным запахом. Озон в полторатяжелее кислорода, лучше его растворяется в воде. Как окислитель озона самовоспламеняющее горящие жидкости, например этан. При обычной температуре озонокисляет даже серебро. Поэтому дышать воздухом со значительным содержаниемозона нельзя, т.к. он разрушает ткани дыхательных путей.
Большая окислительнаяактивность озона объясняется его термической неустойчивостью. Он при комнатнойтемпературе медленно, но при 100-1500. С быстро разлагается накислород и атомарный О0, которой является чрезвычайно сильнымокислителем по с сравнению с кислородом, он мгновенно вступает в химическуюреакцию. В воздушной атмосфере над Землей на высоте около 25 километровнаходится озоновый слой, который защищает все живое от ультрофиалетовых лучей.
Получениекислорода
a) в лаборатории
Кислород в лабораторииполучают путем разложения пероксида водорода (h3O2) в присутствии катализатора- диоксида марганца(Mn O2), а также разложением перманганата калия (KMn O4) при нагревание.
b) в промышленности
Так как горением в таком газеможно получить очень высокие температуры, полезные во многих… применениях, тобыть может, что придет время, когда указанным путем станут на заводах и вообщедля промышленности обогащать воздух кислородом.
Д.И. Менделеев
Попыткисоздать более или менее мощную кислородную промышленность предпринимались еще впрошлом веке в. многих странах. Но от идеи до технического воплощения частолежит «дистанция; огромного размера»...
ВСоветском Союзе особенно быстрое развитие кислородной промышленности началось вгоды Великой Отечественной войны, после изобретения академиком Л.П.Капицейтурбодетандера и создания мощных воздухоразделительных установок.
ЕщеКарл Шееле получал кислород, по меньшей мере, пятью способами: из окиси ртути,сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчасполучают кислород, разлагая богатые этим элементом хлораты и перхлораты. Влюбой школьной лаборатории демонстрируют опыт – разложение воды на кислород иводород электролизом. Но ни один из этих способов не может удовлетворитьпотребности промышленности в кислороде.
Энергетическипроще всего получить элемент №8 из воздуха, поскольку воздух – не соединение, иразделить воздух не так уж трудно. Температуры кипения азота и кислородаотличаются (при атмосферном давлении) на 12,8°C. Следовательно, жидкий воздухможно разделить на компоненты в ректификационных колоннах так же, как делят,например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить доминус 196°C. Можно сказать, что проблема получения кислорода – это проблемаполучения холода.
Чтобыполучать холод с помощью обыкновенного воздуха, последний нужно сжать, а затемдать ему расшириться и при этом заставить его производить механическую работу.Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, вкоторых это происходит, называют детандерами.
До1938г. для получения жидкого воздуха пользовались только поршневымидетандерами. По существу, такой детандер – это аналог паровой машины, толькоработает в нем не пар, а сжатый воздух. Чтобы получить жидкий воздух с помощьютаких детандеров, нужны были давления порядка 200 атм., причем понеизбежным техническим причинам на разных стадиях процесса давление было не одинаковым:от 45 до 200 атм. КПД установки был немногим выше, чем у паровой машины.Установка получилась сложной, громоздкой, дорогой.
Вконце 30-х годов советский физик академик П.Л. Капица предложилиспользовать в качестве детандера турбину. Идея – не новая, ее еще в концепрошлого века высказывал Дж. Рэлей, но к.п.д. «докапицынских» турбин длясжижения воздуха был невысок. Поэтому небольшие турбодетандеры лишь выполняликое-какую подсобную работу при поршневых детандерах.
Капицасоздал новую конструкцию, которая, по словам изобретателя, была «как быкомпромиссом между водяной и паровой турбиной». Главная особенностьтурбодетандера Капицы в том, что воздух в ней расширяется не только в сопловомаппарате, но и на лопатках рабочего колеса. При этом газ движется от периферииколеса к центру, работая против центробежных сил.
Такаяконструкция турбины позволила поднять к.п.д. установки с 0,5 до 0,8. И, крометого, турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь донескольких атмосфер. Очевидно, что 6 атм. получить намного проще идешевле, чем 200. Немаловажно для экономики и то, что энергия, которую отдаетрасширяющийся воздух, не пропадает напрасно, она используется для вращенияротора генератора электрического тока.
Современныеустановки для разделения воздуха, в которых холод получают с помощьютурбодетандеров, дают промышленности, прежде всего металлургии и химии, сотнитысяч кубометров газообразного кислорода. Они работают не только у нас, но и вовсем мире.
Первыйопытный образец турбодетандера был невелик. Его ротор восьми сантиметров вдиаметре весил всего 250г. Но, как писал П.Л. Капица в 1939г.,«экспериментальная эксплуатация этого турбодетандера показала, что он являетсянадежным и очень простым механизмом. Технический к.п.д. получается 0,79...0,83».И этот турбодетандер стал «сердцем» первой установки для получения кислородановым методом.
В1942г. построили подобную, но уже намного более мощную установку, котораяпроизводила до 200кг жидкого кислорода в час. В конце 1944г. вводится в строй самаямощная в мире турбо кислородная установка, производящая в 6...7 раз большежидкого кислорода, чем установка старого типа, и при этом занимающая в 3...4раза меньшую площадь.
Современныйблок разделения воздуха БР-2, в конструкции которого также использовантурбодетандер, мог бы за сутки работы снабдить тремя литрами газообразногокислорода каждого жителя СССР.
30апреля 1945 г. Михаил Иванович Калинин подписал Указ о присвоении академику П.Л. Капице звания Героя Социалистического Труда «за успешную разработку новоготурбинного метода получения кислорода и за создание мощной турбо кислороднойустановки».
Химические свойствакислорода с позиции О/В реакции, особенности горения органических и неорганических веществ, простых и сложных.
Реакции окисления,сопровождающиеся выделениям теплоты и света, называются горением. Расплавленнаясера горит в кислороде ярким синим пламенем, при этом образуется газ с резкимзапахом – диоксид серы, или оксид серы 4 (SO2).Запах, его мы ощущаем, когда зажигаем спички.
Внесенный в сосуд, скислородом горящий красный фосфор горит ослепительным пламенем с образованиемтвердого белого вещества – оксида фосфора 5 (P2O5)
При внесении в сосуд скислородом раскаленной стальной проволоки вы можете наблюдать горение железа,сопровождаемое треском и разбрызгиванием ярких искр–расплавленных капельжелезной окалины ( Fe5O4)
Это явление можно увидетьпри разливе жидкого чугуна и стали на металлургических заводах.
Большое практическоезначение имеют процессы горения сложных веществ, как, например: метан,ацетилена. В результате таких реакций получается оксиды элементов, входящих всостав сложного вещества. Например, схему реакции горения ацетилена можнозаписать так.
/>/>2 C2h3+ 5 O2 4 CO2 2h3O
Если экзотермическаяреакция окисления происходит медленно, то ее горение не называют. Так, медленноокисляются на воздухе многие металлы, покрываясь пленкой оксидов. Сравнительномедленно происходит в живом организме реакция окисления глюкозы – одного изосновных источников энергии в организме.
Само горение представляетсобой экзотермическую реакцию окисления, происходящею с достаточно небольшойскоростью.
Биологическоезначение кислорода.
Высокая окислительнаяспособность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и впроцессах медленного окисления различных веществ при обычной температуре. Этипроцессы не менее важны, чем реакции горения. Так, медленное окисление пищи внашем организме является источником энергии, за счет которой живет организм.Кислород для этой цели доставляется гемоглобином крови, который способенобразовывать с ним непрочное соединение уже при комнатной температуре.Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организмакислород, который окисляет белки, жиры и углеводы (составные части пищи),образуя при этом углекислый газ и воду и освобождая энергию, необходимую длядеятельности организма.
Исключительно важна ролькислорода в процессе дыхания человека и животных. Растения также поглощаютатмосферный кислород. Но если в темноте идет только процесс поглощениярастениями кислорода, то на свету протекает еще один противоположный емупроцесс — фотосинтез, в результате которого растения поглощают углекислый гази выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то витоге на свету растения выделяют гораздо больше кислорода, чем поглощают егопри дыхании. Таким образом, содержание свободного кислорода Земли сохраняетсяблагодаря жизнедеятельности зеленых растений.
Применениекислорода.
Кислород применяют вметаллургической и химической промышленности для ускорения производственныхпроцессов. Так, замена воздушного дутья кислородным в доменном и сталеплавномпроизводстве на много ускоряет выплавку металла. Чистый кислород применяюттакже для получения высоких температур, на пример, при газовой сварке и резкеметаллов.
Его используют дляжизнеобеспечения на подводных и космических кораблях, при работах водолазов,пожарных.
В медицине кислородприменяют в случаях временного затруднения дыхания, связанного с некоторымизаболеваниями.
Творческое задание.
Списокиспользуемой литературы.
1. Учебник за 9 класс по химии О.С. Габриелян.
2. Энциклопедия по химии.
3. Интернет <Популярная библиотека химических элементов>.
www.ronl.ru
Творческая работа по химии: кислород
МОУСОШ № 112
Творческая работа
по химии:
на тему: Кислород
Выполнил: ученик 97класса
Соложенцев Андрей
Проверила: учительница химии
Кудрявцева Наталья Михайловна
Челябинск, 2003 г.
Содержание
1. Открытие элемента кислород3
2. Нахождение кислорода в природе6
а) в составе простых веществ6
в) в составе сложных веществ7
3. Положение в таблице Д.И. Менделеева, строение9
4. Сравнение окисление, восстановление и размер атома кислорода с элементами стоящими с ним в этойже группе и подгруппе, в томже периоде10
5.Физические свойства алотропных видоизменений в кислороде11
6. Получение кислорода12
а) в лаборатории12
в) в промышленности12
7. Химические свойства кислорода с позиции О.В. реакции, особенности реакции горения простых и сложных16
8. Биологическое значение кислорода18
9. Применение кислорода19
10. Творческое задание20
11. Список использованной литературы21
Открытие элемента кислорода
1 августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению.
Джозеф Пристли
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие.
Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVIIв. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в. швед Карл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат О воздухе и огне, содержавший информацию о кислороде, был опубликован позже, чем сообщение об открытии Пристли.
И все-таки главная фигура в истории открытия кислорода не Шееле и не Пристли. Они открыли новый газ и только. Открыли кислород и до конца дней своих остались ревностными защитниками теории флогистона! Теории некогда полезной, но к концу XVIII в. ставшей уже кандалами на ногах науки.
Позже Фридрих Энгельс напишет об этом: Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно... Собственно открывшим кислород, поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают.
Великий французский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал о кислороде от самого Пристли. Спустя два месяца после открытия дефлогистонированного воздуха Пристли приехал в Париж и подробно рассказал о том, как было сделано это открытие и из каких веществ (ртутная и свинцовая окалины) новый воздух выделяется.
До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазье наблюдал образование красных чешуек ртутной окалины и уменьшение объема воздуха при нагревании ртути в запаянной реторте. В другой реторте, применив высокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 С ртутной окалины и получил 2,5 С ртути и 8 кубических дюймов того самого газа, о котором рассказывал Пристли. В первом опыте, в котором часть ртути была превращена в окалину, было потеряно как раз 8 кубических дюймов воздуха, а остаток его стал азотом не жизненным, не поддерживающим ни дыхания, ни горения. Газ, выделенный при разложении окалины, проявлял противоположные свойства, и потому Лавуазье вначале назвал его жизненным газом. Лавуазье выяснил сущность горения. И надобность в флогистоне огненной материи, якобы выделяющейся при сгорании любых горючих, отпала.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе №8 современной науке известно абсолютно все.
Нахождение кислорода в природе
.
Кислород самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает 2/з поверхности земного шара, образуя его водную оболочку гидросферу. Кислород вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атом
www.studsell.com
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


