
Консервационные масла предназначены для консервации внутренних поверхностей машин и механизмов, т.е. для защиты металлических поверхностей от атмосферной коррозии. Используются на заводах изготовителях. В эти масла вводят ингибиторы коррозии. В маркировке указан класс вязкости : К-17. Эти масла должны обеспечивать защиту не менее 5 лет.
Электроизоляционные масла – к ним относятся: трансформаторные, конденсаторные, кабельные, для выключателей. Основные требования: устойчивость к окислению, низкая электропроводность, высокая электрическая прочность, устойчивость в электрическом поле, хорошие вязкостно-температурные свойства. Эти масла перед использованием подвергаются глубокой термовакуумной обработке. Концентрация воздуха в масле, должна быть не более 0,1%(Св ? 0,1%), концентрация воды не более 0,001%. Эти масла изготовляются из нефтепарафинового основания с низким содержанием серы.
Гидравлические масла служат несжимаемой жидкостной средой(или рабочей жидкостью) для передачи энергии в гидравлической системе. От одного узла к другому и превращении этой энергии в полезную работу. Вязкость является одной из основной характеристикой. Обязательные условия: высокая антиокислительная способность, антикоррозионные свойства, устойчивость к пенообразованию.
Технологические масла – представляют собой специфическую группу масел, т.к. используются при производстве различных материалов и продукции в качестве сырьевых компонентов и добавок. Кроме того, могут использоваться в качестве абсорбента. Технологические масла применяют для резинотехнических изделий, для текстильной промышленности(для замасливания хлопка), для производства синтетических волокон, а также используются в качестве классификаторов, в качестве теплоносителей, для производства присадок. Технологические масла изготавливают из мало- и средневязких дистиллятов. Эти масла подвергаются гидроочистке и после этого используются в качестве стандартных у/в сред, при определении свойств резинотехнических изделий. Вакуумные масла. Большая доля приходится на минеральные и синтетические масла. Подвергаются глубокой очистке и проходят I-II ступени тонкой вакуумной дистилляции, удаляют воздух и влагу. Выпускают различных классов вязкости, предназначенных для различных типов вакуумных насосов. К ним предъявляются жесткие требования по антиокислительным и антикоррозионным свойствам, и они должны иметь хорошую вязкостно-температурные характеристики. Индекс вязкости не менее 95.
Пластичные смазки отличаются от нефтяных масел наличием твердого загустителя, образующего структурный каркас, т.е. пластичные масла сочетают свойства твердого тела и жидкости. При отсутствии нагрузок пластичные смазки ведут себя как твердые тела, но при воздействии даже малых нагрузок, структурный каркас разрушается и смазки приобретают вязко-текучее состояние. После прекращения воздействия нагрузок структурный каркас восстанавливается, и смазки приобретают первоначальные свойства. Это явления называют тиксотропия (не характерной для масел). По составу пластичные смазки включают три основные составляющие: - дисперсионная среда; - дисперсная фаза(т.е. твердый загуститель)- 10-13%; - всевозможные добавки от 1 до 15%, они представляют собой присадки, наполнители, модификаторы структуры. Выбор и количество этих добавок выбираются по назначению смазок. Дисперсионная среда представляет собой нефтяные или синтетические масла. Чаще всего из нефтяных масел используют индустриальные масла с V50= 40-60 мм2/с(легкие и средние дистилляты). При использовании синтетических масел получают смазки, имеющие высокие индексы вязкости - более 140. Дисперсная фаза, которую образует твердый загуститель, преимущественно образуется при введении в состав масел солей жирных высокомолекулярных кислот (или их называют металлические мыла). Могут также использоваться неорганические добавки (на основе силигагеля). Также могут использоваться органические загустители (кристаллические полимеры). Добавки – антиокислительные присадки, антифрикционные. Основные свойства пластичных смазок. Наиболее важное значение, придают их реологическим свойствам (объемно- механические).
1. Предел прочности на сдвиг, определяет способность смазок удерживаться на поверхностях трения. Этот показатель должен быть не менее 100-200
2. Вязкость влияет на пусковые характеристики механизмов и на потери энергии при работе различных узлов трения. Принято определять динамическую вязкость при минимальной температуре.
3. Механическая стабильность пластической смазки могут в процессе деформирования изменять свои реологические свойства.
4. Термоупрочнение - это характеристика только пластичных смазок, связанная с тем, что при изменении температуры все показатели меняются. Для некоторых смазок после термообработки, повышается предел прочности на сдвиг. ( на сажевых, на основе солей синтетических жирных кислот).
5. Испаряемость дисперсной среды смазки. Этот показатель характеризует срок службы смазки. При производстве вакуумных смазок – отдают предпочтение синтетическим маслам.
6. Химическая стабильность – используется при температуре 1000С. Только для смазок на основе нефтяных масел.
Пластические смазки подразделяются по типу загустителя на:
1. Мыльные;
2. Немыльные;
3. Углеводородные;
4. Полужидкие.
Мыльные смазки называют в зависимости от металла( литиевые, натриевые, кальциевые, алюминиевые, комплексные смазки).
Литиевые смазки позволяют расширить температурные пределы использования смазок. В России доля литиевых смазок 23%, в США 60%.
Литол-24 – эта смазка позволяет использовать её в широком температурном интервале от –40 до +1300С. Солидол – предел использования 60-700С.
Термостойкие смазки ВНИИНП-207, ВНИИНП-210, униол-1. Температурный предел до 2500С, удовлетворит антифрикционные свойства.
Немыльные смазки на неорганических загустителях (силикагель, сажа, бентонит). Доля производства 0,02% или около 10 тонн в год. Обладает повышенной химической устойчивостью к воздействию агрессивных сред.
На органических загустителях – полиуретановые – готовят на основе полимеров.
Углеводородные смазки( в России производят 3 тыс. тонн в год) готовят на основе у/в смесей.
Полужидкие смазки – используют для герметизации малых зазоров в механизмах. (150 наименований, использование до 1500С).
referat911.ru
Разделы: Химия, Технология
Профессия: 190631 Автомеханик
Профессиональный модуль: Техническое обслуживание и ремонт автотранспорта
Междисциплинарный курс: Устройство, техническое обслуживание и ремонт автомобилей
Формируемые компетенции:
ПК 1.1. Диагностировать автомобиль, его агрегаты и системы.
ПК 1.2. Выполнять работы по различным видам технического обслуживания.
ПК 1.3. Разбирать, собирать узлы и агрегаты автомобиля и устранять неисправности.
ОК 2. Организовать собственную деятельность, исходя из цели и способов её достижения,
определённых руководителем.
ОК 3. Анализировать рабочую ситуацию, осуществлять текущий и итоговый контроль, оценку и коррекцию собственной деятельности, нести ответственность за результаты своей работы.
ОК 6. Работать в команде, эффективно общаться с коллегами, руководством, клиентами.
Задачи урока:
Тип урока: Интегрированный урок химии и устройство, ТО автомобиля. Обобщение знаний.
Вид урока: Урок-игра
Методы:
- обучения: исследовательский,
- преподавания: проблемный,
- учения: частично-поисковый.
Материально техническое оснащение: доска, плакаты, мультимедийное оборудование.
Этапы урока
I. Организационный момент
Приветствие обучающихся, определение готовности группы к уроку, отметка отсутствующий.
Сегодняшний урок мы хотели начать с высказывания М.В.Ломоносова: “Широко распростирает химия руки свои в дела человеческие. Куда не посмотрим, куда не оглянемся – везде перед очами нашими успехи её применения...”
II. Актуализация знаний
- Учитель. Ребята для того чтобы определить какая сегодня тема урока, мы предлагаем вам решить кроссворд (кроссворд на доске и на столах обучающихся).

1.Сложная электонейтральная частица, состоящая из протонов, нейтронов и электронов. (химия)
2. Деталь автомобиля необходимая для воспламенения топливной смеси. (устройство автомобиля)
3. Вещества, растворы которых проводят электрический ток. (химия)
4. Подвижная часть кривошипно-шатунного механизма. (устройство автомобиля)
5. Наука о веществах, их свойствах и превращениях. (химия)
6. Рабочий объём всех цилиндров двигателя. (устройство автомобиля)
7. Химические элементы, атомы которых отдают электроны внешнего электронного слоя, превращаясь в положительные ионы. (химия)
8. Элемент автомобиля, служащий для охлаждения. (устройство автомобиля)
9. Самопроизвольное разрушение металлов и их сплавов под влиянием окружающей среды. (химия)

Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
- Учитель. Как назовём тему сегодняшнего урока? (ответ: Автохимия)
Действительно, тема урока – Автохимия или мы назвали её “Химия в устройстве автомобиля”.
Урок необычный – урок-игра. Он будет проходить виде игры двух команд (команды №1 и №2). За каждый правильный ответ команда получает карточку с буквой, в конце урока, соединив эти буквы вы определите, какое домашнее задание мы вам предложим. (Буквы для команды №1 А.ШИНА и для команды № 2 ШАССИ).
III. Изучение нового материала
- Преподаватель по устройству и ТО автомобиля объявляет 1 конкурс.
Конкурс “Кто лучше знает устройство автомобиля?”
На выполнение этого задания предлагается 3 минуты. За это время обучающиеся должны вспомнить как можно больше деталей автомобиля входящие в состав: кузова, двигателя и трансмиссии и заполнить таблицу 1.
Таблица 1. Задание к конкурсу 1.
| кузов | двигатель | трансмиссия |
| 1 2 3 ... 15 |
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
Конкурс “Зашифрованная таблица”
Проводит преподаватель химии.
- Учитель. Мы вам предлагаем вам пронумерованные детали автомобиля, нужно определить: что за деталь, каков его химический состав, в какой системе автомобиля можно встретить? И заполнить таблицу 2.
Таблица 2. Задание к конкурсу 2.
| № детали | Название детали | химический состав | В какой системе автомобиля встречается |
| 1. | |||
| 2. | |||
| ... | |||
| 7. |
Каждой группе предлагается по 7 разных пронумерованных деталей.
Детали автомобиля: крышка распределителя зажигания, кронштейн энергоаккумулятора, подшипник ступицы, подкабинная рессора, пружина ГРМ, свеча зажигания, компрессионное кольцо, провод высокого напряжения, палец шатунный, плафон для освещения салона, шатун, поршень, втулка шатуна, насос масляной.
Химический состав: сталь низкоуглеродистая, пластмасса, легированная сталь, дюралюминий, латунь, органическое стекло, медь, антифрикционная сталь, серый чугун.
Правильные ответы представлены в таблице 3.
Таблица 3. Правильные ответы к заданию конкурса 2.
| № детали | Название детали | химический состав | В какой системе автомобиля встречается |
| 1 | Пружина ГРМ | Легированная сталь | двигатель |
| 2 | Втулка шатуна | Сталь низкоуглеродная | двигатель |
| 3 | Крышка распределителя | Пластмасса | электрооборудование |
| 4 | Плафон для освещения салона | Органическое стекло | кузов |
| 5 | Подкабинная рессора | Легированная сталь | кузов |
| 6 | Провод высокого напряжения | Медь, латунь | электрооборудование |
| 7 | Свеча зажигания | Легированная сталь | электрооборудование |
| 8 | Насос масляный | Дюралюминий | двигатель |
| 9 | Поршень | Дюралюминий | двигатель |
| 10 | Компрессионное кольцо | Сталь низкоуглеродная | двигатель |
| 11 | Палец шатунный | Антифрикционная сталь | двигатель |
| 12 | Шатун | Серый чугун | двигатель |
| 13 | Подшипник ступицы | Антифрикционная сталь | шасси |
| 14 | Кронштейн энергоаккамулятора | Серый чугун | тормозная система |
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один балл за правильно выполненное задание в рейтинговом листе.
Конкурс “Знаток аккумулятора”
Обучающиеся смотрят видеосюжет о строении аккумалятора, затем должны будут ответить на вопросы:
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
4. Конкурс “ Определите какая жидкость? ”
Проводят преподаватель химии и преподаватель по устройству, ТО автомобиля.
Обучающимся предлагаются 4 мерных стаканчика, в которые налиты 4 разных жидкости. Обучающиеся должны, определить какие вещества находятся в мерных стаканчиках, используя информацию о физико-химических свойствах этих жидкостей.
| №1 Эта жидкость смесь этиленгликоля, воды и различных присадок. Токсическое действие антифриза в основном связано с этиленгликолем. Этиленгликоль – основа ____?_____ - обладает уникальной возможностью не замерзать при пониженных температурах, представляет собой бесцветную прозрачную жидкость, имеющая приятный сладковатый вкус, который может привлечь детей или домашних животных. |
| №2 __?____ - это смесь лёгких углеводородов с температурой кипения от 30°С до 200°C. Плотность составляет около 0,7 г/см?. Теплотворная способность горючего вещества примерно соответствует 10500 ккал/кг.Получается путём перегонки нефти, гидрокрекингом и, при необходимости дальнейшей ароматизации — каталитическим крекингом и риформингом. Для специальных ___?___ характерна дополнительная очистка от нежелательных компонентов и смешение с полезными добавками. |
| №3 __?____ жидкость ( состоит из основы (ее доля 93-98%) и различных присадок (остальные 7-2%). Устаревшие жидкости, например “БСК”, изготовлены на смеси касторового масла и бутилового спирта в пропорции 1:1. Основа современных, наиболее распространенных, в том числе (“Нева”, “Томь” и РосДОТ, она же “Роса”), - полигликоли и их эфиры. В комплексе присадок одни из них препятствуют окислению кислородом воздуха и при сильном нагреве, а другие - защищают металлические детали гидросистем от коррозии. Основные свойства любой __?__ жидкости зависят от сочетания ее компонентов. |
| №4 _____?____ бывают синтетические, полусинтетические и минеральные. Синтетические получают путём каталитического синтеза из газов. Полусинтетические - комбинация минеральных и синтетических основ, при условии не менее 25 % синтетического базового Минеральные получают путём очистки соответствующей фракции нефти. |
Правильные ответы:
№ 1 - тосол, антифриз или охлаждающая жидкость;
№ 2 – бензин;
№ 3 – тормозная жидкость;
№ 4 – моторное масло
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один балл за правильно выполненное задание в рейтинговом листе.
Конкурс “Первая доврачебная помощь ”
Обучающиеся должны рассказать, как они будут оказывать первую медицинскую помощь при:
а) ожог серной кислотой;
б) отравление бензином;
в) отравление при попадании на слизистую тормозной жидкости;
г) отравление тосолом или антифризом или охлаждающей жидкостью;
-Учитель. Как вы думаете, как правильно оказать первую помощь при ожоге серной кислотой?
а) Если вы обожглись серной кислотой, то использовать воду в качестве первой помощи нельзя, т.к. серная кислота при взаимодействии с водой выделяет тепло, которое лишь усугубит ожог. Поэтому место, обожженное серной кислотой, нужно промыть щелочным раствором (вода с мылом или раствор пищевой соды, чайная ложка на стакан воды). Можно посыпать магнезией или мелом. Вызвать скорую.
- Учитель. Как вы думаете, как правильно оказать первую помощь при отравлением бензином и его парами?
б) Первая помощь при отравлении бензином
и его парами: пострадавшего необходимо быстро удалить из помещения, насыщенного парами бензина. При попадании бензина внутрь делают промывание желудка, лучше 2%-ным раствором питьевой соды. При вдыхании паров — обеспечить приток свежего воздуха, желательно дать пострадавшему кислородную подушку. Вызвать скорую помощь.-Учитель. Как вы думаете, как правильно оказать первую помощь при попадании на слизистую тормозной жидкости?
в) При отравлении тормозной жидкостью развивается тяжелая форма интоксикации, в большинстве случаев отравление заканчивается смертью.
При проникновении тормозной жидкости в организм возникают боли в кишечнике и тошнота, затем открывается рвота. Спазмолитики не устраняют боли. Вскоре после отравления возникает слабость и сильное головокружение, рвота становится интенсивнее. Через несколько дней, при условии отсутствия лечения, сокращается и затем полностью останавливается отхождение мочи. Сознание периодически отключается. Лицо пострадавшего отекает и покрывается красными пятнами. Еще через несколько дней возникает желтушность, дыхание сильно затрудненно из-за
отека легочной ткани. После появления таких признаков пострадавшего спасти не удается, поэтому сразу же должна быть госпитализация.
-Учитель. Как вы думаете, как правильно оказать первую помощь при приёме внутрь тосола?
г) Приём внутрь чрезвычайно опасен, (смертельная доза составляет около 100 мл, т.е. стакан антифриза), повреждает центральную нервную систему и почек, органов дыхания, печень. В случае приёма внутрь необходимо вызвать скорую помощь и до её приезда вызвать рвоту, сделать промывание желудка водой или раствором соды. При длительном воздействии паров вызывает раздражение глаз, верхних дыхательных путей, слабость.
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
Конкурс “Угадай слово”
Преподаватель обучающимся предлагает из букв собрать слово. Зашифрованное слово “КОРРОЗИЯ”. Ответьте на следующие вопросы:
1. Что такое коррозия?
2. Что является причиной коррозии?
3. В каких частях автомобиля наиболее часто возникает коррозия?
4. Какие меры защиты от коррозии вы можете предложить?
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один балл за правильно выполненное задание в рейтинговом листе.
IV. Подведение итогов урока.
- Назовите, какое домашнее задание у вас получилось? (после составления карточек с буквами). Группы называют задания
- Учитель. Что осталось непонятного на уроке?
V. Задание на дом
Подготовить сообщение обеим группам:
1. Химический состав резины для изготовления автошин.
2. Устройство шасси грузового автомобиля.
xn--i1abbnckbmcl9fb.xn--p1ai

Химия – основа рабочих профессий технической направленности
В нашем современном мире - в мире технологий самыми востребованными являются специальности технической направленности. А чтобы стать высококлассным специалистом, необходимо еще в школьные годы приложить свои усилия в изучении таких предметов, как физика, математика и химия.
Я являюсь преподавателем предмета «Материаловедение» у мальчишек, получающих рабочие профессии «Сварщик», «Автомеханик», «Электромонтер», «Слесарь по контрольно-измерительным приборам и автоматике», «Слесарь по ремонту и обслуживанию газового оборудования», который очень тесно связан с предметом «Химия».
Практически все технические профессии связаны с изучением металлов, их свойств, с изучением их возможностей, а значит со знанием таблицы Менделеева, с которой мы знакомимся еще в школьные годы на уроках «Химии».
Много веков металлы верно служат человеку, помогая ему покорять стихию, овладевать тайнами природы, создавать замечательные машины и механизмы.
Богат и интересен мир металлов. Среди них есть старые друзья человека: медь, железо, золото, ртуть, серебро, олово. Эта дружба насчитывает уже тысячи лет. Но есть и такие металлы, знакомство с которыми состоялось лишь несколько десятилетий назад.
Свойства металлов чудесны и разнообразны. Ртуть, например не замерзает даже на морозе, а вольфрам не боится самых жарких объятий пламени. Литий мог бы быть отличным пловцом: ведь он вдвое легче воды и при всем желании не сможет утонуть, а осмий – чемпион среди металлов – тяжеловесов – камнем пойдет ко дну. Серебро с «удовольствием» проводит электрический ток, а у «титана» явно не лежит душа к этому занятию: его электропроводность в 300 раз ниже, чем у серебра. Железо мы встречаем на каждом ходу, а гольмий содержится в земной коре в мизерных количествах, что даже крупицы этого металла стоят баснословно дорого: чистый гольмий в несколько сот раз дороже золота.
Но как не различны свойства этих элементов, их роднит то, что они принадлежат к одной большой семье металлов. О судьбах некоторых важнейших металлов я сегодня поведаю вам, мои дорогие слушатели.
История металлов насыщена множеством интересных фактов и замечательных эпизодов, подчас романтических, порой юмористических, а иногда и трагических.
Расскажу, какую громадную роль играет в нашей жизни «великий труженик» - железо. Не будь его, на Земле не могло бы существовать ничто живое: ведь железо входит в кровь всех представителей животного мира нашей планеты. Трехвалентное железо содержится в гемоглобине – веществе, обеспечивающим кислородом ткани живых организмов. Именно железу кровь обязана своим красным цветом. Впрочем, кровь некоторых червей, в состав которой входит двух валентное железо, имеет зеленую окраску. Известен печальный факт, когда влюбленный студент-химик решил подарить избраннице своего сердца кольцо, сделанное из железа собственной крови. Периодически выпуская кровь, юноша получал соединения, из которого он выделял железо. Бедняга погиб от малокровия, так и не собрав железа, нужного для изготовления кольца: ведь общее количество этого элемента в крови человека всего 3-4 грамма.
В таблице Менделеева трудно найти другой металл, с которым так неразрывно связана история цивилизации. Через века и столетия человек пронес уважение к железу и людям, добывающим и обрабатывающим его. В древности у некоторых народов железо ценилось дороже золота. Лишь представители знати могли украшать себя изделиями из железа, причем нередко в золотой оправе. В Древнем Риме из железа изготовляли обручальные кольца. Постепенно по мере развития металлургии, этот металл становился доступнее и дешевле. И думаю, что никого из Вас не удивлю, если скажу, что именно железо входит в состав самого необходимого в нашей жизни сплава – стали.
Название многих элементов в таблице Менделеева говорят сами за себя: водород – «рождающий воду», углерод – «рождающий уголь», менделевий, эйнштейний, фермий, курчатовий, кюрий названы в честь великих ученых, европий, америций, франций, германий - производные географических понятий. Но есть элементы, название которых, нуждается в комментариях – это вольфрам. Даже перевод слова «вольфрам» - волчья пена – вряд ли объяснит происхождение этого названия. В самом деле, что может быть общего у элемента IV группы Периодической системы Менделеева с лесным хищником?
Еще в древние времена металлурги не раз сталкивались со странным явлением: время от времени по совершенно непонятным причинам выплавка олова из руды существенно падала. Поскольку технико-экономические показатели плавки волновали и наших предков, они стали внимательно присматриваться к оловянной руде, идущей на плавку. Вскоре им удалось подметить такую закономерность: неприятности возникали тогда, когда в руде встречались тяжелые камни бурого и желто-серого цвета. Вывод напрашивался сам: камень «пожирает олово, как волк овцу». А коли так, то пусть и называется этот злой камень «вольфрамом».
В 1864 году англичанин Роберт Мюшер впервые ввел вольфрам, всего 5%, как легирующую добавку в сталь. Резцы, изготовленные из этой стали, позволили в полтора раза повысить скорость резания металла. А спустя примерно 40 лет появилась быстрорежущая сталь, содержащая до 8% вольфрама. Чтобы расплавить вольфрам, нужно нагреть его до такой температуры, при которой большинство металлов уже испаряется – 3400оС. Тугоплавкость этого элемента и обеспечили ему применение в одной из важнейших отраслей нашей промышленности – энергетики.
Несметные сокровища волшебных камней-самоцветов таят в себе недра седого Урала. Но, пожалуй, ни с одним из них не связано столько легенд, как с малахитом. Воспетый Бажовым, этот чудесный зеленый камень с неповторимым узором золотые руки мастеров-камнерезов превращали в изумительной красоты изделия. Быть может, не все знают, что малахит является одним из минералов меди, с которым неразрывно связана вся история цивилизации.
Важнейшие свойства меди – ее отличная электропроводность и теплопроводность. Только один металл обладает еще более высокими показателями этих свойств – серебро. Но этот металл дорог и не может широко применяться в технике. По способности проводить электрический ток медь в 5 раз превосходит железо, в 1,5 раз – алюминий, в 3 раза – цинк, в 35 раз – титан. Вот почему медь по праву называют главным металлом электротехники.
Полностью урок можно скачать в начале страницы

Воспроизведение материалов на других сайтах возможно только с использованием гиперссылки на данную страницу или на главную страницу сайта www.moeobrazovanie.ru
moeobrazovanie.ru
Свойства бензинов.
Бензины - легковоспламеняющиеся бесцветные или слегка желтые (при отсутствии специальных добавок) жидкости, имеющие плотность 700-780 кг/м?. Бензины имеют высокую летучесть, и температуру вспышки в пределах 20-40 градусов по Цельсию. Температура кипения бензинов находится в интервале от 30 до 200 C. Температура застывания - ниже минус 60 градусов. При сгорании бензинов образуется вода и углекислый газ. При концентрациях паров в воздухе 70—120 г/м? образуются взрывчатые смеси.
Автомобильные бензины в силу своих физико-химических характеристик должны обладать следующими свойствами:
• Однородность смеси
• Плотность топлива - при +20 "С должна составлять 690...750 кг/м;
• Небольшую вязкость - с ее увеличением затрудняется протекание топлива через жиклеры, что ведет к обеднению смеси. Вязкость в значительной степени зависит от температуры. При изменении температуры от +40 до —40 °С расход бензина через жиклер меняется на 20...30%;
• Испаряемость - способность переходить из жидкого состояния в газообразное. Автомобильные бензины должны обладать такой испаряемостью, чтобы обеспечивались легкий пуск двигателя (особенно чвзимой), его быстрый прогрев, полное сгорание топлива, а также исключалось образование паровых пробок в топливной системе
• Давление насыщенных паров - чем выше давление паров при испарении топлива в замкнутом пространстве, тем интенсивнее процесс их конденсации. Стандартом ограничивается верхний предел давления паров летом - до 670 ГПа и зимой - от 670 до 930 ГПа. Бензины с более высоким давлением склонны к образованию паровых пробок, при их использовании снижается наполнение цилиндров и теряется мощность двигателя, увеличиваются потери от испарения при хранении в баках автомобилей и на складах;
• Низкотемпературные свойства - способность бензина выдерживать низкие температуры;
• Сгорание бензина. Под "сгоранием" применительно к автомобильным двигателям понимают быструю реакцию взаимодействия углеводородов топлива с кислородом воздуха с выделением значительного количества тепла. Температура паров при горении достигает 1500...2400 °С.
Присадки.
Присадки - вещества, добавляемые (обычно в количествах 0,05-0,1%) к топливам, минеральным и синтетическим маслам для улучшения их эксплуатационных свойств. К присадкам относятся, антидетонаторы, антиокислители, ингибиторы коррозии и др. Подробнее виды и назначение присадок рассмотрены в приложении №1 «Перечень допущенных присадок».
Алканы (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой Cnh3n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Простейшим представителем класса является метан (Ch5).
referat911.ru
Слайд 1
Химия Группа 121 Бескоровайный Никита и АВТОМОБИЛЬСлайд 2
Цель: показать, что достижения в области химии связаны с автомобилем Задачи: б ыть специалистом в своей профессии , значит необходимо знать химию; п омнить, что твоя безопасность и безопасность других – это твои знания и умения; показать, что химические процессы не безопасны для человека.
Слайд 3
Автомобиль-это… Транспортное средств о , основное назначение заключается в совершении транспортной работы. Автомобильный транспорт ,занимает ведущее место по сравнению с другими видами транспорта по объёму перевозок пассажиров и грузов. Современный автомобиль состоит из 15—20 тысяч деталей , из которых 150—300 являются наиболее важными и требующих наибольших затрат в эксплуатации.
Слайд 4
Автомобиль очень тесно связан с химией т.к. для поддержания его в рабочем состоянии используются различные жидкости химического происхождения например: антифриз , моторное масло, трансмиссионное масло, тормозная жидкость, жидкость гидроусилителя, вода и т.д. Но сегодня мы поговорим об АКБ (аккумуляторной батареи и электролите).
Слайд 5
Аккумуляторная батарея (АКБ) Аккумуляторная батарея — источник постоянного тока, предназначенный для пуска двигателя стартером, для питания прочих потребителей при неработающем (или работающем на малых оборотах) двигателе. Аккумуляторная батарея преобразует химическую энергию в электричество, являясь источником электроэнергии автомобиля.
Слайд 6
Устройство АКБ С точки зрения автомеханика…….
Слайд 7
Состав аккумулятора Если разбить по процентной составляющей АКБ выходит примерно такой состав: 1) Свинец и его компоненты (оксиды и диоксиды) – порядка 60 – 70% от веса 2) Пластиковый корпус, перегородки и другие элементы ПВХ – 8 – 10% 3) Электролит (зачастую раствор серной кислоты) – 20% Так что получается нормально – если брать вес обычного 55 Амперного варианта, а он составляет порядка 15 кг. То металла должно быть – 15Х0,7= 10,5 кг, ПВХ – 15Х0,1= 1,5 кг и соответственно, электролит – 15Х0,2 = 3 кг
Слайд 8
Работа АКБ Основными частями АКБ являются положительные и отрицательные пластины вылитые в виде решетки из сплава свинца , сурьмы и добавлением 1-го % мышьяка . Пластины находятся в химическом растворе 65% воды и 35 % серной кислоты (электролите ) . Г лавное в аккумуляторной батареи это мощные химические реакции , которые идут внутри пластин и повторяются, когда АКБ разряжается.
Слайд 9
Электролит Раствор воды h3O и серной кислоты h3SO4 является электролитом, веществом проводящим электрический ток.
Слайд 10
Электролит является опасной жидкостью! П ри изготовлении которой необходимо соблюдать технику безопасности!
Слайд 11
Для предохранения от ожогов кожи, глаз и отравлений необходимо надевать кислотостойкий костюм, защитные очки, резиновые перчатки и сапоги, фартук из кислотостойкого материала.
Слайд 12
П ри приготовлении электролита обязательно вливать кислоту в воду тонкой струей при непрерывном помешивании раствора эбонитовой палочкой; – кислота имеет плотность в два раза большую, чем вода , при смешивании кислоты с водой выделяется газ водород H , помещение должно хорошо вентилироваться!
Слайд 13
АКБ и окружающая среда Одной из основных проблем на сегодняшний день является утилизация автомобильных аккумуляторов. Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы. Страшно представить, что может случиться с почвой при длительном контакте с электролитом или свинцом из выброшенного на свалку аккумулятора.
Слайд 14
Вред АКБ на организм человека Свинец является токсичным металлом , который может попасть в организм при вдыхании свинцовой пыли или при прикосновении ко рту с руками, которыми до этого трогали свинец. Попадая в землю, частицы свинца загрязняют поч ву, и когда она просыхает, то попадают в воздух. Чрезмерное содержание свинца может повлиять на рост ребенка, вызвать повреждение головного мозга, повредить почки, ухудшают слух и приводить к поведенческим проблемам. Свинец также опасен для детей, которые еще только находятся в утробе матери . Взрослых, свинец может привести к потере памяти и к снижению способности концентрации вниман ия, а также нанести вред репродуктивной системе . Известно, что свинец вызывает повышенное кровяного давления , неврологические нарушения, и мышечные и суставные боли. Исследователи считают, что Людвиг ван Бетховен заболел и умер из-за отравления свинцом. Серная кислота в свинцово-кислотных батареях чрезвычайно агрессивна и потенциально более вредна, чем кислоты, используемые в других аккумуляторных системах. При попадании в глаза она может привести к постоянной слепоте; при проглатывании она повреждает внутренние органы, что может привести к смерти ..
Слайд 15
Утилизация АКБ Утилизация аккумуляторных батарей происходит на перерабатываемых предприятиях, имеющих всё необходимое оборудование. Процесс утилизации автомобильных аккумуляторов позволяет извлечь большое количество вторичного сырья: пластик, сталь, свинец и медь. Если на предприятие есть специальное оборудование, то и нейтрализованный электролит также можно использоваться повторно.
Слайд 16
Вывод: Автомобиль тесно связан с химией; АКБ являясь источником электроэнергии автомобиля, преобразует химическую энергию в электричество; Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы; Каждому автомеханику необходимы знания в области химии.
Слайд 17
Спасибо за внимание!
nsportal.ru
Программа элективного курса «Химия и профессия «Автомеханик» актуальна, она носит прикладной характер и направлена на формирование у современных выпускников школ (9 кл.) конкретных знаний, связанных с профессией «Автомеханик».
Курс программы рассчитан на 12 часов, занятия проводятся на базе СОГБОУ СПО «Верхнеднепровский технологический техникум» и способствуют развитию исследовательских навыков обучающихся, формированию у будущих рабочих профессионального мастерства.
Программа элективного курса дает возможность познакомить обучающихся школ с профессиями, связанными с работой автомобиля, помочь подросткам выявить склонности и способности к этому виду профессиональной деятельности; познакомить учащихся с видами автомобильного топлива, материалами, используемыми в устройстве автомобиля, экологическими проблемами; предоставить возможность обучающимся реализовать свой интерес к выбранной профессии.
В качестве ожидаемого эффекта нововведения после изучения курса программы прогнозируется: повышение учебной активности обучающихся, расширение мотивационно-смысловой основы обучения, рост функций самооценки и самоконтроля учебных достижений, подтверждение обоснованности выбора учащимися планируемого профиля обучения.
Изучения данного курса обеспечивает не только подготовку учащихся по предмету, но и способствует формированию у будущих рабочих профессионального мастерства. Темы элективного курса логически увязывают конкретный учебный материал с предметами профессионального цикла. Важное место в программе отводится на проведение практических, экспериментальных исследовательских работ: «Очистка бензина от нежелательных примесей», «Исследование свойств полимеров», «Исследования загрязнения воздуха городским транспортом» и др.
Программа предполагает использование активных методов обучения (игровых, проблемных, исследовательских, наглядных, практических), где отражена творческая деятельность учащихся, способствующая расширению, углублению и применению знаний.
Данная программа вносит вклад в реализацию трудового и эстетического воспитания, позволяет воспитать положительные качества характера, развивать новаторские способности, практическим умениям, расширяет знания по предмету химии.
Программа элективного курса не повторяет материал, содержащийся в базовых программах, она состоит из профессионально значимых тем, где обобщаются, конкретизируютсяи актуализируется те знания данного предмета, которые наиболее значимы в профессиональной деятельности автомехаников.
Уроки дают прекрасную возможность учащимся освоить предмет на повышенном уровне, применять знания в повседневной жизни и на практике, в разработку уроков включены различного характера химические эксперименты, повышающие интерес учащихся к обучению.
Программа элективного курса может быть предложена для проведения уроков факультативного курса для учащихся училищ, лицеев и других образовательных учреждений системы НПО, СПО.
Краткое содержание программы элективного курса
«Химия и профессия «Автомеханик»
Тема 1. Презентация курса «Химия и профессия «Автомеханик» (2). Знакомство с профессией, историей техникума. Встреча с представителями профессии (автомеханик, слесарь по ремонту автомобилей, слесарь по ремонту топливной аппаратуры и т.д.). Экскурсия в мастерские техникума.
Тема 2. Автомобильное топливо. Виды топлива, топливо для бензиновых двигателей. Дизельное топливо. Топливо для двигателей газобаллонных автомобилей (2). Лабораторная работа: «Очистка бензина от нежеланных примесей». Экскурсия на АЗС.
Тема 3. Полимерные материалы, их свойства, применение в устройстве автомобиля (2). Физико-механические свойства полимеров. Химические свойства. Использование пластмасс в автомобилестроении. Экологически грамотное обращение с полимерами.Практическая работа: «Исследование свойств полимеров».
Тема 4. Сплавы и металлы, используемые в автомобилестроении. Разрушение металлов (2). Характеристика металлических конструкционных материалов. Черные металлы, цветные металлы и сплавы, их применение в автомобилестроении. Мероприятия по увеличению долговечности металлов, применяемых в устройстве автомобиля. Влияние продуктов коррозии металлов на окружающую среду.
Тема 5. Экология и автомобиль (2). Загрязнение окружающей среды транспортными средствами, стационарными источниками на транспорте, шумовое воздействие транспорта. Альтернативные виды топлива.Практическая работа: «Исследование загрязнения воздуха городским транспортом».
Тема 6.Защита проекта (3). Завершающий этап работы над проектом. Повторение работы. Составление речи для выступления. Освоение навыков представления результатов своего интеллектуального труда, развитие творческих способностей. Обобщение представлений о профессии автомеханик.
Тематический план программы элективного курса
«Химия и профессия «Автомеханик»
| № п/п | Наименование темы | Количество учебных часов | В том числе | Уровень усвоения | |
| теоретических | практических | ||||
| 1 | Презентация курса «Химия и профессия «Автомеханик»
| 2 | 1 | 1 | 2 |
| 2 | Автомобильное топливо
| 2 | 1 | 1 | 2 |
| 3 | Полимерные материалы, их свойства, применение в устройстве автомобиля
| 2 | 1 | 1 | 2 |
| 4 | Сплавы и металлы, используемые в автомобилестроении. Разрушение металлов
| 2 | 2 | - | 2 |
| 5 | Экология и автомобиль
| 2 | 1 | 1 | 2 |
| 6 | Зачет (защита проекта, реферата, презентации работ и. т. д.)
| 2 | - | 2 | 3 |
|
|
| 12 | 6 | 6 |
|
Приложение: программа элективного курса «Химия и профессия «Автомеханик»
Список используемой литературы
www.informio.ru
МИНИСТЕРСТВО ОБРАЗОВАНИЯ МОСКОВСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ МОСКОВСКОЙ ОБЛАСТИ «ПАВЛОВО-ПОСАДСКИЙ ПРОМЫШЛЕННО-ЭКОНОМИЧЕСКИЙ ТЕХНИКУМ»
Методические указания по выполнению практических, лабораторных и самостоятельных работ по УЧЕБНОЙ ДИСЦИПЛИНе химия
Профессия: 23.01.03 АВТОМЕХАНИК
Разработала: Рождественская Ю. И.
преподаватель биологии, химии
г. Павловский Посад, 2015 г.
Пояснительная записка
Методические указания к практическим и самостоятельным работам предназначены для отработки практических умений по дисциплине «Химия» в соответствии с Государственными требованиями к минимуму содержания и уровню подготовки выпускников по профессии: 23.01.03 Автомеханик
Программой предусмотрено 57 часов самостоятельной внеаудиторной работы, 13 часов практических занятий и 16 часов лабораторных работ. Методические рекомендации к практическим и самостоятельным работам предназначены для работы на занятиях в аудитории, при подготовке заданий для практического изучения и для самостоятельной внеаудиторной работы студентов. Данные методические рекомендации включают перечень рефератов ля самостоятельной работы, правила и порядок выполнения работ, список рекомендуемой литературы, критерии оценивания и контрольные вопросы для защиты. Практическая часть содержит задания, пояснения и рекомендации по их выполнению, требования к оформлению и представлению отчета о выполнении. По окончании работы результат должен быть представлен преподавателю. В случае возникновения вопросов по выполнению обучающиеся всегда могут обратиться за помощью и консультацией к преподавателю.
Ценность практической работы состоит в том, что она вооружает студентов не только необходимыми в жизни биологическими знаниями, но и полезными умениями и навыками самостоятельной постановки эксперимента, фиксирования и обработки результатов, но и способствуют развитию интереса к биологическим исследованиям, формирует навыки, умения химического исследования, заставляет логически мыслить, делать сопоставления, выводы, позволяет развивать наблюдательность студентов в непосредственной и тесной связи с процессом мышления (работа по намеченному плану, анализ и интерпретация результатов). В курсе изучения дисциплины дается 13 практических занятий.
В результате выполнения практических и лабораторных работ обучающийся должен уметь добиваться результатов
личностных:
• чувство гордости и уважения к истории и достижениям отечественной химической науки;
• химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
• готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
• умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
метапредметных:
• использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
• использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
предметных:
• сформированность представлений о месте химии в современной научной картине мира;
• понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
• владение основополагающими химическими понятиями, теориями, законами и закономерностями;
• уверенное пользование химической терминологией и имволикой;
• владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом;
• умение обрабатывать, объяснять результаты проведенных опытов и делать выводы;
• готовность и способность применять методы познания при решении практических задач;
• сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
• владение правилами техники безопасности при использовании химических веществ;
• сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
КРИТЕРИИ ОЦЕНКИ ЛАБОРАТОРНЫХ И ПРАКТИЧЕСКИХ РАБОТ.
Оценка "5" ставится, если обучающийся:
1) правильно определил цель опыта;
2) выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений;
3) самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью;
4) научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, чертежи, графики, вычисления и сделал выводы;
5) правильно выполнил анализ погрешностей.
6) проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
7) эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Оценка "4" ставится, если обучающийся выполнил требования к оценке "5", но:
1. опыт проводил в условиях, не обеспечивающих достаточной точности измерений;
2. или было допущено два-три недочета;
3. или не более одной негрубой ошибки и одного недочета,
4. или эксперимент проведен не полностью;
5. или в описании наблюдений из опыта допустил неточности, выводы сделал неполные.
Оценка "3" ставится, если обучающийся:
1. правильно определил цель опыта; работу выполняет правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы;
2. или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов;
3. опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, анализе погрешностей и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения; или не выполнен совсем или выполнен неверно анализ погрешностей;
4. допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Оценка "2" ставится, если обучающийся:
1. не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов;
2. или опыты, измерения, вычисления, наблюдения производились неправильно;
3. или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3";
4. допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию преподавателя.
Практические работы.
Тема: Решение задач на нахождение массовой доли элемента и относительной молекулярной массы вещества.
Цели: Научиться решать задачи по заданным темам.
Относительная молекулярная масса - сумма всех относительных атомных масс входящих в молекулу атомов химических элементов.
Мr = Аr1 * i1+ Ar2* i2+ Аr3 * i3…
Например: Вычислим относительную молекулярную массу гидроксида кальция Ca(OH)2
Мr ( Ca(OH)2 )= Аr (Ca) *1+ Ar(O)* 2+ Аr(H) *2
Аr (Ca) =40
Ar(O)=16
Аr(H)=1 => Мr (Ca(OH)2)= 40*1 + 16*2 +1*2 = 74 или =>
Мr (Ca(OH)2 )= 40*1 + (16 +1)*2 = 74
Найти молекулярную массу соединений:
h3SO4; HCl; h3O; h4PO4; О2;
Найти массовую долю элемента:
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
где
w – массовая доля элемента в веществе,
n– индекс в химической формуле,
Ar– относительная атомная масса,
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w(элемента) = 20% или 0,2.
АЛГОРИТМ РЕШЕНИЯ
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу h4PO4, с точностью до сотых.
Дано:
Фосфорная кислота h4PO4
Найти:
w%(H)
w%(P)
w%(O)
Решение:
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
Ar(H)=1 Ar(P)=31 Ar(O)=16
2. Вычисляем относительную атомную массу соединения
Mr(h4PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
w(H) = n(H)·Ar(H)·100% / Mr(h4PO4) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(h4PO4) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(h4PO4) = 4·16·100% / 98 = 65,31%
Проверка
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
Подставляем значения: 3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Ответ: w(H) = 3,06%; w(P) = 31,63%; w(O) = 65,31%
Решить самостоятельно:
Определить массовую долю элемента S в h3SO4.
Определить массовую долю элемента О в Fe(OH)3.
Тема: Решение закон на применение закона Авогадро и уравнения состояния идеального газа.
Цель: Научиться решать задачи по данной теме.
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул
Следствие из закона: При одинаковых условиях 1 моль любого газа занимает одинаковый объём, который называется молярным
1 моль любого вещества занимает определённый объём, который вычисляется как частное при делении молярной массы на плотность вещества.
Молярный объём обозначается Vm =М / ρ
При нормальных условиях (t = 0°С / Т =273° К /; Р = 1 атм. = 760 мм рт. ст. =101325 Па) молярный объём всех газов равен 22,4 л/ моль.
Для перевода числа структурных частиц вещества в массу или объём пользуются следующими формулами: n = N/NА ; n = m/М ; n = V / Vm (для газов при н.у.)
Задача 1: Какой объём займут 2 моля углекислого газа?
Задача 2: Определите массу и объём 18 * 1023 молекул сероводорода.
Задача 3: Определите плотность и относительную плотность по воздуху углекислого газа при н.у.
Задача 4: Определите относительную плотность сероводорода по водороду.
Тема: Нахождение массовой доли вещества в смеси.
Цель: научится решать задачи по заданной теме, закрепить теоретический материал.
Массовая доля компонента в смеси— отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
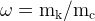
где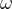 – «омега», массовая доля компонента в смеси,
– «омега», массовая доля компонента в смеси,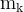 – масса компонента,
– масса компонента,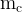 – масса смеси
– масса смеси
Задача 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
Задача. Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных ниже.
Тема: Решение задач по теме: Скорость химической реакции.
Цель: закрепить теоретические знания и научится решать задачи по заданной теме.
Задача №1.
Температурный коэффициент скорости некоторой реакции равен 2,3. Укажите, как изменится скорость этой реакции при повышении температуры на 20 градусов.
Задача №2.
Как изменится скорость реакции 2NO(г)+O2(г) = 2NO2(г), если повысить концентрацию в 3 раза.
Задача №3.
Как изменится скорость реакции 2NO(г)+O2(г) = 2NO2(г), если уменьшить объем системы в 2 раза.
скорость прямой реакции увеличилась в 8 раз;
скорость обратной реакции увеличилась в 4 раза.
Задача №4.
Как изменится скорость реакции 2NO(г)+O2(г) = 2NO2(г), если увеличить давление в системе в 3 раза.
Тема: Химическое равновесие.
Цель: научится решать задачи и закрепить теоретический материал по заданной теме.
Задача №1.
Равновесные концентрации в системе 2SO2 + O2 = 2SO3, составили [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислите константу равновесия и исходные концентрации оксида серы (IV) (SO2) и кислорода (O2).
Задача №2.
Определите константу равновесия химической реакции, если при некоторой температуре равновесные концентрации составляют: [NOCl2] = 0,05 M, [NO]= 0,55 M, [NOCl] = 0,08 M.
NOCl2(г) + NO(г) = 2NOCl(г)
Тема: Решение экспериментальных задач по теме "Металлы"
Цель:
- Закрепить знания о металлах;
- Сформировать умения выполнять химический эксперимент, соблюдать правила техники безопасности, добиваться поставленного в задании результата.
Задание.
Практически осуществите следующие превращения:
MgCO3 → MgCl2 →Mg(OH)2 →Mg(NO3)2
Цель: Провести реакции, в которых осуществляются записанные химические превращения.
Приборы и реактивы:
MgCO3, HCl , NaOH, HNO3 , h3SО4 , пробирки, штатив для пробирок, штатив.
Ход работы:
Составьте план решения. Запишите последовательность выполнения химических реакций. Вспомните, в каких случаях реакции ионного обмена протекают до конца.
Выполните реакции. Результаты оформите в таблицу.
Запишите уравнения реакций в молекулярной и ионной форме.
Тема: Значение углеводородов в жизни и будущей профессии.
Цель: закрепить знания по теме: Углеводороды и их природные источники.
Внимательно изучить теоретический материал, написать небольшое эссе по теме: «Значение углеводородов в жизни и будущей профессии».
Структура эссе определяется предъявляемыми к нему требованиями:
мысли автора эссе по проблеме излагаются в форме кратких тезисов (Т).
мысль должна быть подкреплена доказательствами - поэтому за тезисом следуют аргументы (А).
Аргументы - это факты, явления общественной жизни, события, жизненные ситуации и жизненный опыт, научные доказательства, ссылки на мнение ученых и др. Лучше приводить два аргумента в пользу каждого тезиса: один аргумент кажется неубедительным, три аргумента могут "перегрузить" изложение, выполненное в жанре, ориентированном на краткость и образность.
Таким образом, эссе приобретает кольцевую структуру (количество тезисов и аргументов зависит от темы, избранного плана, логики развития мысли):
вступление
тезис, аргументы
тезис, аргументы
тезис, аргументы
заключение.
При написании эссе важно также учитывать следующие моменты:
Вступление и заключение должны фокусировать внимание на проблеме (во вступлении она ставится, в заключении - резюмируется мнение автора).
Необходимо выделение абзацев, красных строк, установление логической связи абзацев: так достигается целостность работы.
Стиль изложения: эссе присущи эмоциональность, экспрессивность, художественность. Специалисты полагают, что должный эффект обеспечивают короткие, простые, разнообразные по интонации предложения, умелое использование "самого современного" знака препинания - тире. Впрочем, стиль отражает особенности личности, об этом тоже полезно помнить.
Тема: Промышленное использование природного газа, ректификации нефти и фракций получаемых при ректификации.
Цель: закрепить знания по теме: Углеводороды и их природные источники.
Задание. Составить опорный конспект по теме: Промышленное использование природного газа, ректификации нефти и фракций получаемых при ректификации. Составить схему «Ректификации нефти и фракции получаемые при ректификации».
Тема: Сравнение свойств крахмала и целлюлозы.
Цель: рассмотреть строение крахмала и целлюлозы, провести их сравнительный анализ;
рассмотреть их физические и химические свойства
Задание. Рассмотреть представленные образцы, определить их свойства, найти отличия.
1. Рассмотрим физические свойства данных веществ
- Опишите внимание внешние признаки этих свойств
1) белый порошок 1)твердое волокнистое вещество
- Давайте рассмотрим их отношение к воде.
Взяли пробирку с крахмалом и опустили его в стакан с холодной водой. Размешали, подняли стаканы, Что наблюдаете?
2) не растворяется в холодной воде 2) не растворяется в холод.воде
По отношению к горячей водой крахмал ведет себя иначе. У меня на столе стоит стакан с клейстером, образуется в результате набухания крахмала в горячей воде
- в горячей воде набухает
- зная физические свойства крахмала, объясните клеящее действие вареного картофеля (образуется клейстер)
2. Строение молекул
- Какой формулой выражается состав полисахаридов?
Разные свойства этих 2-х веществ связаны с их 3-я отличительными особенностями.
а) разная степень полимеризации
стр. 207 (учебника), рубрика «Строение крахмала и целлюлозы, ответьте на вопрос
- Какое количество повторяющихся звеньев характерно для крахмала и целлюлозы
от 100 до 1000 полимерных звеньев несколько миллионов
б) разная структура
- Какая структура характерна для крахмала; целлюлозы
линейная (амилоза)
разветвленная (амилопектин) линейная
Линейная растворимость в горячей воде; а разветвленная набухает.
в) разное строение структурных звеньев альфа- и бета -форм глюкозы.
В чем отличие этих 2-х циклических формул
3. Химические свойства
Качественные реакции
1.качественной реакцией на крахмал является его взаимодействие с иодом. (Л.О. Нанесение капли иода на срез картофеля)
- Почему происходит посинение продукта?
2. Качественная реакция на целлюлозу: реактив Швейцера
Гидролиз крахмала и целлюлозы
(С6Н10О5)n + (n+1)Н2О = (С6 Н12 О6 )n
Лабораторные работы.
Лабораторная работа №1
Тема: Приготовление суспензии карбоната кальция в воде.
Цель: закрепить знания о свойствах дисперсных систем и их отличии от истинных растворов, познакомиться со способами разделения смесей на примере суспензии карбоната кальция и раствора поваренной соли, приобрести навыки обращения с лабораторным оборудованием.
Оборудование: молотый карбонат кальция (СаСО3), штатив с пробирками, поваренная соль (NaCl), вода, пробиркодержатель, спиртовка, спички.
Ход работы.
А) Рассмотрите вещества в пробирках, какое из них имеет кристаллическое строение, опишите вещества в сводной таблице.
Б) Добавьте в обе пробирки немного воды, взболтайте содержимое, пронаблюдайте, что происходит, наблюдения запишите в сводную таблицу, в какой пробирке образовался раствор, а в какой дисперсная система, укажите в дисперсной системе фазу и среду.
В) Поставьте обе пробирки в штатив и наблюдайте, что произойдет к концу урока, наблюдения занесите в таблицу.
Г) Добавьте в чистую пробирку немного раствора, каким способом можно разделить эту смесь?
Д) Закрепите пробирку с небольшим количеством раствора в пробиркодержателе, зажгите спиртовку и произведите выпаривание раствора поваренной соли соблюдая технику безопасности, наблюдения занесите в таблицу.
5. Оформите работу в тетради (заполните сводную таблицу), заполните самооценочный лист.
Лабораторная работа №2.
Тема: Получение эмульсии моторного масла.
Цель: получить дисперсные системы и исследовать их свойства.
Оборудование и реактивы: дистиллированная вода; вещества и растворы: масло, раствор глицерина, фарфоровая чашка; пробирки, штатив.
Ход работы.
В стеклянную пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть несколько раз. Изучить свойства эмульсии. Добавить 2-3 капли глицерина.
Оформить наблюдения опыта у себя в тетради
Наблюдения:
*Внешний вид и видимость частиц: _________________________________
_________________________________
_________________________________
*Способность осаждаться и способность к коагуляции _________________________________
_________________________________
_________________________________
*Внешний вид после добавления глицерина _______________________
________________________________
________________________________
Дать определение понятиям:
Диспергирование –
Синерезис –
Коагуляция –
Ответить на вопрос:
Какова область применения растворов?
Вывод: (что представляют собой дисперсные системы).
Лабораторная работа №3
Тема: Гидролиз солей.
Цель занятия: Изучить реакции гидролиза солей; уметь определять pH среды.
Оборудование и реактивы: растворы солей Na2CO3, Ch4COONa, Na2SO3, AlCl3, KCl, универсальный индикатор, химическая посуда для проведения опытов.
Ход работы.
1.Реакция среды в растворах различных солей. Проводим гидролиз 5 солей, определяем pH универсальной индикаторной бумагой. Данные сводим в таблицу.
Вывод:2.Случай полного гидролиза (совместный гидролиз). Проводим совместный гидролиз солей AlCl3 и (Nh5)2S; AlCl3 и Na2CO3.
1.
2.
Наблюдения:
Вывод:
Лабораторная работа №4.
Тема: Реакции, идущие с образованием осадка, газа или воды.
Цель занятия: Изучить реакции ионного обмена, выяснить, в каких случаях они идут до конца.
Оборудование и реактивы: штатив с пробирками, колба, химический стакан, сульфат меди(2), гидроксид натрия, карбонат натрия, соляная и серная кислоты, фенолфталеин.
Ход работы.
1.Налить в пробирку 3-4 мл.сульфата меди(2), добавить немного гидроксида натрия. Что происходит? Составить уравнения реакции молекулярном, ионном и сокращенном виде.
2. Налить в пробирку 3-4 мл. карбоната натрия, добавить немного соляной кислоты. Что происходит? Составить уравнения реакции молекулярном, ионном и сокращенном виде.
3. Налить в пробирку 3-4 мл. гидроксида натрия (добавить индикатор фенолфталеин, что происходит с окраской раствора?), добавить серной кислоты, что происходит с окраской раствора? Составить уравнения реакции молекулярном, ионном и сокращенном виде.
Вывод: На основе проделанных опытов объясните, в каких случаях реакции ионного обмена идут до конца?
Лабораторная работа №5.
Тема: Зависимость скорости взаимодействия соляной кислоты с металлами от их природы, концентрации, температуры, зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации, зависимость скорости взаимодействия оксида меди (II) с серной кислотой от температуры.
Цель работы: практическим путем подтвердить зависимость скорости химической реакции от природы реагирующего вещества, от её концентрации и от температуры.
Оборудование: штатив с пробирками – 4 шт., нагревательный прибор – спиртовка или сухое горючее, спички, держатель для пробирок, Соляная кислота (10% и 70%), цинк, медная проволока, оксида меди (II), серная кислота (20%).
Опыт № 1. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
Ход работы: Поместить в две пробирки металлы: цинк и медную проволку и прилейте в обе пробирки соляную кислоту. Наблюдайте, что произойдет. Если в какой то-пробирке не будет происходить реакция объясните, почему. Как это связано с природой реагирующего вещества. Напишите уравнение реакции, которая происходит:
Zn + HCI =
Cu + HCI =
Опыт № 2. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации.
Зависимость скорости реакции от концентрации легко проследить, пользуясь реакцией взаимодействия цинка с соляной кислотой разной концентрации.
Момент сливания раствора нужно считывать началом реакции, а появление пузырьков газа (водорода) – концом реакции.
Ход работы: В две пробирки поместить гранулы цинка и прилить 1 мл соляной кислоты ( в первую разбавленную 10%, а во вторую концентрированную 70%). Отметьте время, прошедшие с момента добавления кислоты до момента выделения пузырьков газа в каждой пробирке. Концом реакции считать, одинаковую интенсивность выделения пузырьков газа. Результаты запишите в таблицу.
№ опыта
Концентрация соляной кислоты
Продолжительность реакции, t сек.
Скорость реакции
Как изменяется скорость реакции в первой и во второй пробирке при увеличении концентрации соляной кислоты?
На основании данных опыта постройте кривую зависимость скорости реакции от концентрации HCI, откладывая по оси абсцисс относительную концентрацию HCI, а по оси ординат скорость (в условных единицах).
Опыт № 3. Зависимость скорости взаимодействия оксида меди(II) с серной кислотой от температуры
Ход работы: Насыпьте в две пробирки по 2 мг порошка черного цвета оксида меди (II) и добавьте в каждую пробирку по 2 мл серной кислоты (20%), наблюдайте. Одну из двух пробирок нагреть, и наблюдайте, что произойдет в пробирке после нагревания. Результаты опыта запишите в виде таблицы.
№ опыта
Температура опыта, С
Скорость реакции V=1/t
Как изменяется скорость реакции при взаимодействии оксида меди (II) с серной кислотой (20%) при повышении температуры?
На основании данных опыта постройте кривую, иллюстрирующую, зависимость скорости реакции от температуры, откладывая по оси абсцисс температуру, по оси ординат – условную скорость реакции.
Лабораторная работа №6.
Тема: Качественные реакции на анионы кислотных остатков.
Цель: исследовать качественные реакции на анионы.
Приборы и реактивы: Штатив с пробирками, пробиркодержатель, кристаллический карбонат кальция, кристаллический нитрат калия, растворы: иодида калия, бромида калия, хлорида кальция, нитрата серебра, соляной кислоты, сульфата натрия, хлорида бария, фосфата натрия, гидроксида натрия, хлорида аммония, концентрированная серная кислота, спиртовка, спички, медная проволока, лакмусовая бумага.
Опыт № 1 Качественная реакция на анионы галогенов.В три пробирки внести по 2 мл иодида калия, бромида калия, хлорида кальция,добавить по 1 капле нитрата серебра в каждую. Записать наблюдения. Отметить цвета осадков. Написать уравнения реакций в молекулярной, полной и сокращенной ионной формах, дать названия веществам.
Опыт № 2 Качественная реакция на карбонат-ион.В пробирку насыпьте (чтобы слегка покрылось дно пробирки) карбонат кальция. В пробирку прилейте 3-4 капли раствора соляной кислоты. В пробирку внесите зажженную лучину. Какой газ выделяется при действии соляной кислоты на карбонаты? Запишите наблюдения.Напишите в молекулярной и ионной формах уравнения реакций, протекающих при действии соляной кислоты на карбонат кальция.
Опыт № 3 Качественная реакция на сульфат-ион. В пробирку внесите 1 мл раствора хлорида бария, добавьте 1 мл раствора сульфата натрия.Записать наблюдения, отметить цвет осадка. Написать уравнения реакций в молекулярной, полной и сокращенной ионной формах, дать названия веществам.
Опыт № 4 Качественная реакция на нитрат-ион.К сухому нитрату калия - 0,5 г прилить 1-2 мл концентрированной серной кислоты, затем внести в пробирку медную проволоку. Нагреть в пламени спиртовки пробирку со смесью. Отметить выделение бурого газа.Записать уравнения окислительно-восстановительных реакций. Методом электронного баланса уравнять.
Опыт № 5 Качественная реакция на фосфат-ион.В пробирку налить 1-2 мл раствора фосфата натрия и 1 мл нитрата серебра. Отметить наблюдаемые явления.Записать реакцию взаимодействия в молекулярном, полном и сокращенном ионном виде.
Опыт № 6 Качественная реакция на ион аммония.
В пробирку налейте 0,5 мл раствора гидроксида натрия, добавьте 0,5 мл раствора хлорида аммония. Нагрейте до кипения. В выделяющиеся пары внесите полоску влажной лакмусовой бумажки, отметьте изменение ее цвета и появление резкого запаха.Напишите в молекулярной и ионной форме уравнения происходящих реакций, дайте названия веществам. Как обнаруживают наличие ионов аммония в соли? Что в быту называется нашатырем, а что - нашатырным спиртом? Какое применение находят аммиак и соли аммония?
Лабораторная работа №7
Тема: Получение гидроксида алюминия и доказательство его амфотерных свойств.
Цель работы: обобщить сведения о получении и свойствах амфотерных соединений, уметь составлять уравнения реакций, проводить наблюдения, соблюдать правила по технике безопасности.
Реактивы и оборудование: AlCl 3 , ZnCl 2 , HCl, NaOH, штатив с пробирками, стеклянная палочка.
Ход работы.
1. Получите амфотерный гидроксид Аl(ОН) 3 из А1С1 3 и NaOH (к
NaOH добавить А1С1 3 ).
2. Полученный осадок разлейте в две пробирки.
3. В одну пробирку добавьте HCl. Размешайте полученный раствор.
4. В другую пробирку добавьте NaОН. Размешайте полученный
раствор.
Запишите наблюдения и составьте соответствующие опыту реакции:
AlCl 3 +NaOH=
А1(ОН) 3 +НС1=
Al(OH) 3 +NaOH=
Лабораторная работа №8.
Тема: Качественные реакции на катионы металлов.
Цели: исследование веществ на примере проведения качественных реакций (на ионы металлов и кислотных остатков).
Ход работы.
Проводим опыт 1 и определяем качественную реакцию на соли железа (2) и (3). Желтая кровяная соль не ядовита, поэтому ее используют как противоядие при отравлении солями тяжелых металлов, например меди и железа. В растворе желтая кровяная соль распадается на ион калия и комплексный ион, который с ионом железа Fe3+ образует нерастворимую соль интенсивного синего цвета, известную под названием «берлинская лазурь».
Красная кровяная соль при взаимодействии с солями железа (2) образует синий осадок, который получил название «турнбулева соль» в настоящее время берлинская лазурь и турнбулева соль представляют собой соединения одного состава и отвечают одной и той же формуле.
Исследование сульфата меди
1. Задание: написать формулу, найти относительную молекулярную массу, описать физические свойства, влияние на организм.Сульфат меди(II) (медный купорос) CuSO4 * 5Н2О Мr(CuSO4 * 5Н2О) = 250 г\моль. Синие кристаллы или синий кристаллический порошок без запаха, металлического вкуса. На воздухе и в сухом месте кристаллы выветриваются, и цвет становится светлее. CuSO4 * 5Н2О хорошо растворяется в воде (1 : 3 в холодной и 1 : 8 в горячей)1%-й раствор CuSO4 – прозрачная жидкость голубого цвета, используется для внутреннего употребления как рвотное средство.Плотность + 2,284; температура плавления + 110оС; температура кипения +150оС.
2. Задание: проделать качественные реакции на ион Сu+2. Написать уравнения реакции в ионном виде.
а) Реакция с Nh5OH
Аммиак при взаимодействии с ионом Cu(II) осаждает основные соли переменного состава сине-зеленого цвета.
CuSO4 + Nh5OH —> [Cu(Nh4)4]SO4 + 4Н2О4-5 кап. 1 кап. конц. синий осадок.
б) проделать качественные реакции на обнаружение иона SO4–2 . Написать уравнения реакции.
Лабораторная работа №9.
Тема: Определение элементного состава органического вещества.
Цель: установить, содержится ли в составе выданного образца водород и углерод.
Оборудование: пробирки, вата, газоотводная трубка, резиновая пробка, горелка, тигельные щипцы, спички, штатив.
Реактивы: сахар, оксид меди, медный купорос, известковая вода.
Ход работы.
В широкий химический стакан поместите небольшой кусочек парафиновой свечи и подожгите его с помощью горящей лучинки. Обратите внимание на стенки стакана — на них появляются капельки воды. О наличии какого химического элемента в составе парафина они свидетельствуют? Погасите свечу и выньте ее из стакана. Затем налейте в стакан немного прозрачной известковой воды и осторожно взболтайте. Что наблюдаете? О наличии какого химического элемента свидетельствуют изменения, произошедшие с известковой водой? Запишите уравнения проведенных реакций.
Лабораторная работа №10
Тема: Ознакомление с коллекцией образцов нефти и продуктов ее переработки.
Цель: изучить физические свойства нефти, продуктов ее переработки.
Оборудование: Приборы и реактивы: штативы, пробирки. Растворы веществ: бромная вода, KMnO4, HCl, фракции нефти.
Ход работы.
Опыт №1 Поместите в пробирку несколько кусочков с каучука и закройте ее пробкой с газоотводной трубкой. Пробирку с каучуком нагрейте, и продукты разложения соберите в пробирку-приемник. Половину полученных жидких продуктов влейте в пробирку с 1—2 мл бромной воды. Оставшиеся жидкие продукты влейте в другую пробирку с раствором перманганата калия, слегка подкисленным серной кислотой.
Опыт №2 В две пробирки налейте по 2—3 мл бензина. В одну из пробирок опусти кусочек резины, а в другую — такой же кусочек невулканизированного каучука. Закройте пробирки корковыми пробками и оставьте до следующего занятия. Через несколько дней можно будет убедиться, что каучук в бензине частично растворяется, а резина только набухает.
Используя ранее полученные знания и учебник О.С. Габиелян, И.Г. Остроумов Химия, тема: «Этиленовые и диеновые углеводороды» вам, предлагается выполнить следующие задания:
Задание №1. Как доказать, что в продуктах термического разложения каучук содержатся непредельные углеводороды?
Задание №2. Вам предлагаются образцы резины из следующего перечня: бензомаслостойкая, теплостойкая, морозостойкая, теплохимическистойкая. Пользуясь таблицей №1, определите, какая именно резина вам выдана.
Задание №3. Вам предлагается коллекция каучуков. Пользуясь таблицей №2, опишите в сравнении 2 образца каучука.
Задание №4. Вам предлагаются образцы фракций перегонки нефти. Пользуясь таблицей № 3, определите где, что находится.
Лабораторная работа №11
Тема: Растворение глицерина в воде и взаимодействие с гидроксидом меди (II).
Цель работы: изучить свойства глицерина уксусной кислоты, жидкого жира, глюкозы, сахарозы и крахмала.
Приборы и реактивы: штативы, пробирки, пробиркодержатель, спиртовки. Растворы веществ: глицерин, гидроксид натрия, раствор сульфата меди (II), подсолнечное масло, твердый животный жир, бромная вода, глюкоза, крахмальный клейстер.
Ход работы.
Налейте в пробирку 1 см3 глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды. Перемешайте содержимое пробирки.
В пробирку налейте 1-2 см3 раствора гидроксида натрия и добавьте несколько капель раствора сульфата меди (II).
К образовавшемуся осадку добавьте немного глицерина и перемешайте смесь стеклянной палочкой.
Сделайте вывод о растворимости глицерина в воде.
Напишите молекулярное и краткое ионно-молекулярное уравнения этой реакции.
Отметьте, какие изменения произошли.
Сделайте соответствующий вывод о свойствах глицерина.
Лабораторная работа №12
Тема: Взаимодействие глюкозы и сахарозы с гидроксидом меди (II).
Цель работы: изучить свойства глюкозы, сахарозы.
Приборы и реактивы: штативы, пробирки, пробиркодержатель, спиртовки. Растворы веществ: глицерин, гидроксид натрия, раствор сульфата меди (II), подсолнечное масло, твердый животный жир, бромная вода, глюкоза, крахмальный клейстер.
Ход работы.
Налейте в пробирку 2 см3 раствора гидроксида натрия и прибавьте не более трех капель раствора сульфата меди (II). К свежеприготовленному гидроксиду меди (II) добавьте 1 см3 раствора глюкозы. Встряхните смесь.
Нагрейте содержимое пробирки.
Что вы наблюдаете? Что доказывает данный опыт? Какие соединения вступают в аналогичную реакцию? Какие изменения вы наблюдаете? Составьте уравнение реакции глюкозы с гидроксидом меди (II) при нагревании.
Лабораторная работа №13
Тема: Качественная реакция на крахмал
Цель работы: изучить свойства крахмала.
Приборы и реактивы: штативы, пробирки, пробиркодержатель, спиртовки. Растворы веществ: глицерин, гидроксид натрия, раствор сульфата меди (II), подсолнечное масло, твердый животный жир, бромная вода, глюкоза, крахмальный клейстер.
Ход работы.
К 0,5-1 см3 крахмального клейстера в пробирке добавьте каплю спиртового раствора йода.
Нагрейте полученную смесь крахмального клейстера с йодом.
Нанесите несколько капель спиртового раствора йода на кусочек хлеба и на срез клубня картофеля.
Что вы наблюдаете?
Какие изменения происходят? Восстанавливается ли прежняя окраска при охлаждении? Объясните наблюдаемое явление.
Лабораторная работа №14
Тема: Растворение белков в воде.
Цель: изучить свойства белков.
Оборудование и реактивы: яичный белок; дистиллированная вода; раствор хлористого калия; кератин (шерсти или волос).
Ход работы.
К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
Проверяют растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах.
Результаты работы оформить в виде таблицы:
Лабораторная работа №15
Тема: Обнаружение белков в молоке и мясном бульоне
Цель: изучить свойства белков.
Оборудование и реактивы: раствор белка; раствор медного купороса; раствор ацетата свинца; пробирки
Ход работы:
Денатурация раствора белка куриного яйца солями тяжелых металлов.В 2 пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка.
Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжелыми металлами.
Сделайте выводы._____________________
_____________________________________
_____________________________________
_____________________________________
_____________________________________
_____________________________________
Лабораторная работа №16
Тема: Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании.
Цель: изучить свойства белков.
Оборудование и реактивы: раствор белка; этанол, пробирки
Выводы…Перечень рекомендуемых учебных изданий, дополнительной литературы.
Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специ-альностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образо-вания. — М., 2014.
Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. об-разования. — М., 2014.
Габриелян О. С.,Остроумов И. Г., Сладков С. А.,Дорофеева Н. М. Практикум: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О. С., Остроумов И. Г., Сладков С. А. Химия: пособие для подготовки к ЕГЭ: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Габриелян О. С.,Лысова Г. Г.Химия. Тесты, задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю. М. Сборник тестовых заданий по химии: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
Ерохин Ю. М.,Ковалева И. Б. Химия для профессий и специальностей технического про-филя. Электронный учебно-методический комплекс. — М., 2014.
Сладков С. А., Остроумов И. Г., Габриелян О. С., Лукьянова Н. Н. Химия для профессий и специальностей технического профиля. Электронное приложение (электронное учебное из-дание) для студ. учреждений сред. проф. образования. — М., 2014.
infourok.ru