|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Каталог :: Химия. Реферат цинк
Реферат - Цинк - Химия
МосковскаяГосударственная Академия Приборостроения и Информатики.
ЦИНК.
Студент: Жариков С.А.
Факультет: ТИ-6
Преподаватель: МосинаГ.Н.
Москва 2001.
ОБЩИЕ СВЕДЕНИЯ.
Z=30
атомный вес = 65,37
валентность II
заряд 2+
массовые числа основных природных изотопов: 64, 66, 68, 67,70
электронная структура атома цинка: KLM4s2
¯ ¯ ¯ ¯ ¯3d10
¯4s2
ИСТОРИЧЕСКАЯ СПРАВКА.
С древних времён известны латуни, являющиеся сплавами Cu-Zn. Металлический цинк впервыеполучен в 1746 году в Англии нагреванием каламина с древесным углём.
РАСПРОСТРАНЕНИЕ ВПРИРОДЕ.
В природе цинк находиться только в виде соединений.
СФАЛЕРИТ (цинковая обманка, ZnS)имеет вид кубических жёлтых или коричневых кристаллов; плотность 3,9-4,2 г/см3, твёрдость 3-4 по шкале Мооса. В качестве примесей содержит кадмий,индий, галлий, марганец, ртуть, германий, железо, медь, олово, свинец.
В кристаллической решётке сфалерита атомы цинка чередуются сатомами серы и наоборот. Атомы серы в решётке образуют кубическую упаковку.Атом цинка располагается в этих тетраэдрических пустотах.
ВЮРТЦИТ (ZnS) представляетсобой коричнево-чёрные гексагональные кристаллы, плотностью 3,98 г/см3 итвердостью 3,5-4 по шкале Мооса. Обычно содержит цинка больше чем сфалерит. Врешётке вюртцита каждый атом цинка тетраэдрически окружён четырьмя атомами серыи наоборот. Расположение слоёв вюртцита отличается от расположения слоёвсфалерита.
СМИТСОНИТ (цинковый шпат, ZnCO3)встречается в виде белых (зелёных, серых, коричневых в зависимости от примесей)тригональных кристаллов плотностью 4,3-4,5 г/см3 и твёрдостью 5 пошкале Мооса.
КАЛАМИН (Zn2SiO4*h3O*ZnCO3 или Zn4[Si2O7](OH)4*h3O*ZnCO3)представляет собой смесь карбоната и силиката цинка; образует белые (зелёные,синие, жёлтые, коричневые в зависимости от примесей) ромбические кристаллыплотностью 3,4-3,5 г/см3 и твёрдостью 4,5-5 по шкале Мооса.
ВИЛЛЕМИТ (Zn2SiO4) залегает в виде бесцветных илижёлто-коричневых ромбоэдрических кристаллов плотностью 3,89-4,18 г/см3 итвёрдостью 5-5,5 по шкале Мооса.
ЦИНКИТ (Zn O) — гексагональные кристаллы жёлтого, оранжевого иликрасного цвета с решёткой типа вюртцита и твёрдостью 4-4,5 по шкале Мооса.
ГАНИТ (Zn[Al2O4]) имеет вид тёмно-зелёных кристаллов плотностью4-4,6 г/см3 и твёрдостью 7,5-8 по шкале Мооса.
Помимо приведённых, известны и другие минералы цинка:
монгеймит (Zn, Fe)CO3
гидроцикит ZnCO3*2Zn(OH)2
трустит (Zn, Mn)SiO4
гетеролит Zn[Mn2O4]
франклинит (Zn, Mn)[Fe2O4]
халькофанит (Mn, Zn)Mn2O5*2h3O
госларит ZnSO4*7h3O
цинкхальканит (Zn, Cu)SO4*5h3O
адамин Zn2(AsO4)OH
тарбуттит Zn2(PO4)OH
деклуазит (Zn, Cu)Pb(VO4)OH
леграндит Zn3(AsO4)2*3h3O
гопеит Zn3(PO4)*4h3O
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО ЦИНКА.
Цинк добывают из концентратов сфалерита, смитсонита икаламина.
Сульфидные полиметаллические руды, которые содержат пирит Fe2S, галеннит PbS,
халькопирит CuFeS2 и вменьшем количестве сфалерит после измельчения и размалывания подвергаютобогащению сфалеритом методом селективной флотации. Если руда содержитмагнетит, то для его удаления используют магнитный метод.
При прокаливании (700°)концентратов сульфида цинка в специальных печах, образуется ZnO,который служит для получения металлического цинка.
2ZnS+3O2=2ZnO+2SO2+221ккал
Для превращения ZnS в ZnO измельчённые концентраты сфалерита предварительнонагревают в специальных печах горячим воздухом
Окись цинка также получают прокаливанием смитсонита при 300°.
Металлический цинк получают путём восстановления окиси цинкауглеродом
ZnO+CÞZn+CO-57 ккал
водородом
ZnO+h3ÛZn+h3O
ферросилицием
ZnO+FeSiÞ2Zn+Fe+SiO2
метаном
2ZnO+Ch5Þ2Zn+h3O+C
окисью углерода
ZnO+COÞZn+CO2
карбидом кальция
ZnO+CaC2ÞZn+CaS+C
Металлический цинк также можно получить сильным нагреванием ZnS с железом, с углеродом в присутствии CaO,с карбидом кальция
ZnS+CaC2ÞZn+CaS+C
ZnS+FeÛ2Zn+FeS
2ZnS+2CaO+7CÞZn+2CaC2+2CO+CS2
Металлургический процесс получения металлического цинка,применяемый в промышленном масштабе, заключается в восстановлении ZnO углеродом при нагревании. В результате этого процесса ZnO восстанавливается не полностью, теряется некотороеколичество цинка, идущего на образование Zn[Al2O4], иполучают загрязнённый цинк.
ФИЗИЧЕСКИЕ ИХИМИЧЕСКИЕ СВОЙСТВА.
Цинк — блестящий серебристый белый металл с плотностью 7,13г/ см3 при 20° (тяжелыйметалл), температура плавления 419,44°,температура кипения 906°, твердость 2,5- 2,9 по шкале Мооса. Имеет плотную гексагональную структуру кристаллов. Цинкстановится при 100 — 150° и хрупким — выше 200°, он геомагнитен и имеет пятьприродных изотопов.
С химической точки зрения цинк менее активен, чем щелочные ищелочноземельные металлы, и более активен, чем олово, свинец, медь, ртуть,серебро, золото.
При сильном нагревании цинк воспламеняется и горитсине-зеленым пламенем.
Zn+ 1/2 O2 = ZnO +83,5ккал
Цинк окисляется кислородом воздуха при нагревании выше 225°, а в токе сухого кислорода выше 150°.
Металлический цинк не разлагает воду при комнатнойтемпературе или кипячении, поскольку в присутствии воды поверхность цинкапокрывается Zn(OH)2,который препятствует дальнейшему разрушению металла.
Цинк, нагретый почти до температуры плавления, энергичноразлагает поры воды с образованием ZnO и h3.
Zn +h3O Û ZnO + h3
При комнатной температуре во влажном воздухе галогеныобразуют с цинком соответствующие гологениды. В сухом состоянии гологенывзаимодействуют с металлическим цинком при высокой температуре.
Zn+ F2 = Zn F2 + 172,7 ккал
Zn+ Cl2 = ZnCl2+99,55ккал
Zn+Br2 =ZnBr2 +78,4 ккал
Zn +I2 = ZnI2 + 49,8 ккал
Нагревание порошкообразного цинка порошком серы приводит кобразованию ZnS.
Zn +S = ZnS + 44 ккал
Под действием сероводорода поверхность металлического цинкапокрывается плотной защитной плёнкой ZnS.
Zn+h3SÛ ZnS + h3
Двуокись серы во влажной атмосфере и хлористый тионилвзаимодействуют с цинком при нагревании.
3Zn+ SO2 = ZnS + 2ZnO
Zn+SOCl2 = ZnCl2 + SO
Нагревание цинка в атмосфере аммиака дает нитрит Zn3N2.
Цинк непосредственно не вступает в реакцию с азотом,углеродом, водородом и другими элементами.
Обработка парами фосфора, нагретого до 440 — 780°, металлического цинка в атмосфере азота иливодорода приводят к образованию Zn3P2 и ZnP2.
Поскольку нормальный потенциал системы Zn/Zn2+ = -0,761 В, металлический цинк легкорастворяется в кислотах и щелочах. При растворении цинка в разбавленныхкислотах образуются соответствующие соли и водород.
Zn +2HCl = ZnCl2 + h3
Zn +h3SO4 = ZnSO4 + h3
Чистый металлический цинк медленно взаимодействует сразбавленными кислотами, поскольку образовавшийся атомарный водород покрываетповерхность цинка и выделение водорода уменьшается.
При образовании гальванического элемента Zn- Cu в соляной кислоте выделение водорода происходиточень интенсивно, и цинк легко растворяется, превращаясь в хлорид. Дляобразования гальванического элемента Zn — Cu в раствор соляной кислоты добавляют несколько капельсульфата меди. Медь, стоящая в электрохимическом ряду напряжений правее цинка,осаждается им, покрывает поверхность цинка и ускоряет, таким образом,растворение его в соляной кислоте.
По отношению к концентрированным серной и азотной кислотамцинк является восстановителем.
Zn +2h3SO4 = ZnSO4 + SO2 + 2h3O
4Zn+ 10HNO3 = 4Zn(NO3)2 + Nh5NO3+3h3O
При действии щелочей на металлический цинк образуютсягидроцинкаты и водород.
Zn +NaOH + 2h3O = Na2[Zn(Oh5)] + h3
Цинк вытесняет менее активныеметаллы из растворов их солей и восстанавливает хромовую, марганцевую имолибденовую кислоты, соли железа (III) и олово (IV).
С помощью цинка можно осуществлятьцинкотермическое разложение многих окислов, например: CdO,PbO, CuO, NiO.
Восстанавливая сероуглерод,цинковый порошок раскаляется.
С точки зрения физиологии цинк — необходимый элемент для живых организмов.
Цинк входит в состав фермента,имеющегося в красных кровяных тельцах (гемоглобин), с помощью которогопроисходит перенос двуокиси углерода в крови.
Для животных цинк загрязненныймышьяком, сурьмой, свинцом, кадмием становится токсичен. Вдыхание ZnCl2 в больших дозах смертельно.
ПРИМЕНЕНИЕ.
Во влажном воздухе поверхностьцинка покрывается тонкой защитной пленкой окисла и основного карбоната, которыйв дальнейшем предохраняет металл от атмосферного действия атмосферныхреагентов. Благодаря этому свойству цинк применяется для покрытия железныхлистов и проволоки. Также цинк применяется для извлечения серебра изсеребросодержащего свинца по процессу Паркеса; для получения водорода врезультате разложения соляной кислоты; для вытеснения металлов с более низкойхимической активностью из растворов их солей; для изготовления гальваническихэлементов; в качестве восстановителя во многих химических реакциях; дляполучения многочисленных сплавов с медью, алюминием, магнием, свинцом, оловом идругими металлами.
www.ronl.ru
Реферат Цинк
скачатьРеферат на тему:
План:
- Введение
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Месторождения
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 7 Применение
- 7.1 Мировое производство
- 8 Биологическая роль
- 8.1 Содержание в продуктах питания
- 8.2 Основные проявления дефицита цинка
- 9 Токсичность Примечания
Введение
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
1. История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
2. Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II[2]. Это слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллы металлического цинка похожи на иглы)[3].
3. Нахождение в природе
Наиболее распространенный минерал цинка — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
3.1. Месторождения
Месторождения цинка известны в Австралии, Боливии[4].
4. Получение
Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
5. Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Собственная концентрация носителей заряда в цинке 13,1×1028 м−3
6. Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + h3O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + h3↑,
Zn + h3SO4(разб.) = ZnSO4 + h3↑
и растворами щелочей:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(h3O)4]2+ и [Zn(h3O)6]2+.
7. Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи), ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др.
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Сульфид цинка используется для синтеза люминофоров временного действия и разного рода люминесцентов на базе смеси ZnS и CdS. Люминофоры на базе сульфидов цинка и кадмия, также применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
На разные применения цинка приходится:
- цинкование — 45-60 %
- медицина (оксид цинка как антисептик) — 10 %
- производство сплавов — 10 %
- производство резиновых шин — 10 %
- масляные краски — 10 %
7.1. Мировое производство
Производство цинка в мире за 2009 год составило 11,277 млн т, что на 3,2 % меньше чем в 2008 г.[5]
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»)[6]:
| — | Весь мир | 10,000,000 |
| 1 | Китай | 2,600,000[7] |
| 2 | Австралия | 1,380,000 |
| 3 | Перу | 1,201,794 |
| 4 | США | 727,000 |
| 5 | Канада | 710,000 |
| 6 | Мексика | 480,000[7] |
| 7 | Ирландия | 425,700 |
| 8 | Индия | 420,800 |
| 9 | Казахстан | 400,000[7] |
| 10 | Швеция | 192,400 |
| 11 | Россия | 190,000 [7] |
| 12 | Бразилия | 176,000[7] |
| 13 | Боливия | 175,000[7] |
| 14 | Польша | 135,600 |
| 15 | Иран | 130,000[7] |
| 16 | Марокко | 73,000[7] |
| 17 | Намибия | 68,000[7] |
| 18 | Северная Корея | 67,000[7] |
| 19 | Турция | 50,000[7] |
| 20 | Вьетнам | 48,000[7] |
| 21 | Таиланд | 45,000[7] |
| 22 | Гондурас | 37,646 |
| 23 | Финляндия | 35,700 |
| 24 | ЮАР | 34,444 |
| 25 | Чили | 31,725 |
| 26 | Аргентина | 30,300[7] |
| 27 | Болгария | 17,300[7] |
| 28 | Румыния | 9,600[7] |
| 29 | Япония | 7,169 |
| 30 | Алжир | 5,000[7] |
| 31 | Саудовская Аравия | 1,500[7] |
| 32 | Грузия | 400[7] |
| 33 | Босния и Герцеговина | 300[7] |
| 34 | Мьянма | 100[7] |
8. Биологическая роль
| В этом разделе не хватает информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.Эта отметка стоит на статье с 11 мая 2011. |
Цинк:
- необходим для продукции спермы и мужских гормонов[8]
- необходим для метаболизма витамина E, который является предшественником половых гормонов и включается в продукцию тестостерона.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста[8].
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы.[8]
8.1. Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 граммов устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек. Практически во всех хлебных злаках цинк содержится в достаточном количестве и в легкоусваиваемой форме. Поэтому, биологическая потребность организма человека в цинке обычно полностью обеспечивается ежедневным употреблением в пищу цельнозерновых продуктов (нерафинированного зерна).
Содержание цинка:
- ~0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зелёные овощи, минеральная вода.
- ~0,31 мг/кг — мёд.
- ~2—8 мг/кг — малина, чёрная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свёкла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.
- ~8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
- ~20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зелёный чай, сушёные дрожжи, кальмары.
- ~30—85 мг/кг — говяжья печень, некоторые виды рыб.
- ~130—202 мг/кг — отруби из пшеницы, проросшие зёрна пшеницы, тыквенные семечки, семечки подсолнечника.
8.2. Основные проявления дефицита цинка
Недостаток цинка в организме приводит к ряду расстройств. Среди них раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие [9].
Для оценки содержания цинка в организме определяют его содержание в волосах, сыворотке и цельной крови.
9. Токсичность
При длительном поступлении в организм в больших количествах все соли цинка, особенно сульфаты и хлориды, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжелое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление оксидом цинка происходит при вдыхании его паров. Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
wreferat.baza-referat.ru
Доклад Химия Цинк
works.tarefer.ru
Реферат - Цинк - Рефераты на репетирем.ру
Цинк
Элемент цинк (Zn) в таблице Менделеева имеет порядковый номер 30 . Он находится в четвертом периоде второй группы. Атомный вес - 65,37. Распределение электронов по слоям 2-8-18-2.
Цинк представляет собой синевато - белый металл, плавящийся при 419° С, а при 913° С превращающийся в пар; плотность его равна 7,14 г/см 3 . При обыкновенной температуре цинк довольно хрупок, но при 100-110° С он хорошо гнется и прокатывается в листы. На воздухе цинк покрывается тонким слоем окиси или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк, хотя он и стоит в ряду напряжений значительно левее водорода. Это объясняется тем, что образующаяся на поверхности цинка при взаимодействии его с водой гидроокись практически нерастворима и препятствует дальнейшему течению реакции. В разбавленных же кислотах цинк легко растворяется с образованием соответствующих солей. Кроме того, цинк подобно бериллию и другим металлам, образующим амфотерные гидроокиси, растворяется в щелочах. Если нагреть цинк на воздухе до температуры кипения, то пары его воспламеняются и сгорают зеленовато-белым пламенем, образуя окись цинка.
Немного истории.
Соединения цинка и его сплавы известны человечеству с глубокой древности, металлический же цинк был получен значительно позднее, чем железо, свинец и олово. Это обстоятельство объясняется тем, что обычные способы плавки руды с углем здесь не достигали цели; чтобы восстановить цинк, его надо быстро нагреть до температуры около 1000 градусов, но при этом он кипит и в виде паров теряется вместе с дымовыми газами. Только после того как научились конденсировать пары цинка в глиняных сосудах, стало возможных получение металла в свободном состоянии. Полагают, что такой дистилляционный способ получения свободного цинка впервые был изобретен в Китае.
Латунь (сплав меди с цинком) была известна грекам, индусам и другим народам Востока, употреблявшим ее для изготовления различных предметов домашнего обихода, художественного литья и украшений. Отдельные предметы из латуни, относящиеся к периоду за 1500 лет до н.э., были найдены в Палестине. Приготовление латуни восстановлением особой земли кадмия (так назывались в древности многие минералы, содержащие цинк, отличие между которые не делали) углем в присутствии меди описывают Аристотель (384- 322 гг. до н.э.), Плиний Старший (23-79 гг. н.э.) и Гомер. Плиний Старший и Диоскрид из Аназарбуса описывают лекарственные средства, содержащие соединения цинка. Лекарства эти употреблялись для заживления ран и при лечении глазных болезней.
В доисторических дакийских развалинах в Трансильвании был найден идол, отлитый из сплава, содержащего около 87% цинка. Получение металлического цинка из галмея Zn 4 (Si 2 O 7 )*H 2 O впервые описывает Страбон (60-20 гг. до н.э.). Цинк в этот период называли тутией или фальшивым серебром.
Благодаря довольно сложной выработке цинка из руд в X-XI вв. н.э. искусство получения цинка в Европе было утрачено и он ввозился сюда под названием индийского олова из Китая и Индии.
В конце XIII в. н.э. итальянский путешественник Марко Поло описал способ получения металлического цинка в Персии. В 1637 году метод выплавки цинка и его свойства описываются в китайской книге “Циен конг кан у”. Казалось бы, что раз метод получения описан в литературе, то его легко могли перенять другие народы и применить у себя на родине. Но этого не случилось. Экономическая и культурная разобщенность народов, слабые транспортные связи, а главное, стремление многих ученых описывать свои открытия на непонятном языке-все это препятствовало быстрому распространению технических достижений.
Вторично получение цинка в Европе стало известно в начале XVI века, когда о способе его выплавки упоминают в своих сочинениях Георг Агрикола (1494-1555) и Теофраст Парацельс. Однако и после этого цинк в Европе был большой редкостью, что продолжалось почти до конца XVIII в.
Название же “цинк” происходит от латинского слова, обозначающего бельмо или белый налет, и впервые встречается у Парацельса в 1530 году. Роберт Бойль назвал цинк “спелтером”. У нас цинк И.Шлаттер (1736) называл “туцией”, Ломоносов (1742) ввел название “цинк”, но оно не пользовалось успехом и цинк чаще всего называли “шпиаутер”.
В 8-м издании “Основ химии” (1906) Д.И. Менделеев употребляет современное название цинка, но наряду с этим ставит в скобках и другое его название-”шпиаутер”. Из этого можно заключить, что во времена Менделеева старое название цинка было достаточно широко распространено.
Металлический цинк.
В XVI веке были предприняты первые попытки выплавлять цинк в заводских условиях. Но производство “не пошло”, технологические трудности оказались непреодолимыми. Цинк пытались получать точно также, как и другие металлы. Руду обжигали, превращая цинк в окись, затем эту окись восстанавливали углем...
Цинк, естественно, восстанавливался, взаимодействуя с углем, но ... не выплавлялся. Не выплавлялся потому, что этот металл уже в плавильной печи испарялся - температура его кипения всего 906° С. А в печи был воздух. Встречая его, пары активного цинка реагировали с кислородом, и вновь образовывался исходный продукт-окись цинка.
Наладить цинковое производство в Европе удалось лишь после того, как руду стали восстанавливать в закрытых ретортах без доступа воздуха. Примерно так же “черновой” цинк получают и сейчас, а очищают его рафинированием. Пирометаллургическим способом сейчас получают примерно половину производимого в мире цинка, а другую половину-гидрометаллургическим.
Следует иметь в виду, что чисто цинковые руды в природе почти не встречаются. Соединения цинка (обычно 1-5% в пересчете на металл) входят в состав полиметаллических руд. Полученные при обогащении руды цинковые концентраты содержат 48-65% цинка, до 2% меди, до 2% свинца, до 12% железа. И плюс доли процента рассеянных и редких металлов...
Сложный химический и минералогический состав руд, содержащих цинк, был одной из причин, по которым цинковое производство рождалось долго и трудно. В переработке полиметаллических руд и сейчас еще есть нерешенные проблемы... Но вернемся к пирометаллургии цинка - в этом процессе проявляются сугубо индивидуальные особенности этого элемента.
При резком охлаждении пары цинка сразу же, минуя жидкое состояние, превращаются в твердую пыль. Это несколько осложняет производство, хотя элементарный цинк считается нетоксичным. Часто бывает нужно сохранить цинк именно в виде пыли, а не перерплавлять его в слитки.
В пиротехнике цинковую пыль применяют, чтобы получить голубое пламя. Цинковая пыль используется в производстве редких и благородных металлов. В частности, таким цинком вытесняют золото и серебро из цианистых растворов. Как ни парадоксально, но при получении самого цинка (и кадмия) гидрометаллургическим способом применяется цинковая пыль-для очистки раствора сульфата меди и кадмия. Но это еще не все. Вы никогда не задумывались, почему металлические мосты, пролеты заводских цехов и другие крупногабаритные изделия из металла чаще всего окрашивают в серый цвет?
Главная составная часть применяемой во всех этих случаях краски - все та же цинковая пыль. Смешанная с окисью цинка и льняным маслом, она превращается в краску, которая отлично предохраняет от коррозии. Эта краска к тому же дешева, пластична, хорошо прилипает к поверхности металла и не отслаивается при температурных перепадах. Мышиный цвет скорее достоинство, чем недостаток. Изделия, которые покрывают такой краской, должны быть не марки и в то же время опрятны.
На свойствах цинка сильно сказывается степень его чистоты. При 99,9 и 99,99% чистоты цинк хорошо растворяется в кислотах. Но стоит “прибавить” еще одну девятку (99,999%), и цинк становится нерастворимым в кислотах даже при сильном нагревании. Цинк такой чистоты отличается и большой пластичностью, его можно вытягивать в тонкие нити. А обычный цинк можно прокатить в тонкие листы, лишь нагрев его до 100-150° С. Нагретый до 250° С и выше, вплоть до точки плавления, цинк опять становится хрупким - происходит очередная перестройка его кристаллической структуры.
Листовой цинк широко применяют в производстве гальванических элементов. Первый “вольтов столб” состоял из кружочков цинка и меди. И в современных химических источниках тока отрицательный электрод чаще всего делается из цинка.
Значительна роль этого элемента в полиграфии. Из цинка делают клише, позволяющие воспроизвести в печати рисунки и фотографии. Специально приготовленный и обработанный типографский цинк воспринимает фотоизображение. Это изображение в нужных местах защищают краской, и будущее клише протравливают кислотой. Изображение приобретает рельефность, опытные граверы подчищают его, делают оттиски, а потом эти клише идут в печатные машины.
К полиграфическому цинку предъявляют особые требования: прежде всего он должен иметь мелкокристаллическую структуру, особенно на поверхности слитка. Поэтому цинк, предназначенный для полиграфии, всегда отливают в закрытые формы. Для “выравнивания” структуры применяют отжиг при 375° С с последующим медленным охлаждением и горячей прокаткой. Строго лимитируют и присутствие в таком металле примесей, особенно свинца. Если его много, то нельзя будет вытравить клише так, как это нужно. Если же свинца меньше 0,4%, то трудно получить нужную мелкокристаллическую структуру. Вот по этой кромке и “ходят” металлурги, стремясь удовлетворить запросы полиграфии.
Цинк и сталь.
Как бы громко ни называли в наше время: “век полимеров”, “век полупроводников”, “атомный век” и так далее, по сути дела мы не вышли еще из века железного. Этот металл по-прежнему остается основой промышленности. По выплавке чугуна и стали и сейчас судят о мощи государства. А чугун и сталь подвержены коррозии, и, несмотря на значительные успехи, достигнутые человечеством в борьбе с “рыжим врагом”, коррозия ежегодно губит десятки миллионов тонн металла.
Нанесение на поверхность стали и чугуна тонких пленок коррозионностойких металлов - важнейшее средство защиты от коррозии. А на первом месте среди всех металлопокрытий - и по важности, и по масштабам - стоят покрытия цинковые. На защиту стали идет 40% мирового производства цинка!
Оцинкованные ведра, оцинкованная жесть на крышах домов - вещи настолько привычные, настолько будничные, что мы, как правило, не задумываемся, а почему, собственно, они оцинкованные, а не хромированные или никелированные? Если же такой вопрос возникает, то “железная логика” мигом выдает однозначный ответ: потому что цинк дешевле хрома и никеля. Но дело не в одной дешевизне.
Цинковое покрытие часто оказывается более надежным, нежели остальные, потому что цинк не просто механически защищает железо от внешних воздействий, он его химически защищает.
Кобальт, никель, кадмий, олово и другие металлы, применяемые для защиты железа от коррозии, в ряду активности металлов стоят после железа. Это значит, что они более стойки, чем железо. Цинк же и хром, наоборот, активнее железа. Хром в ряду активности стоит почти рядом с железом (между ними только галлий), а цинк - перед хромом.
Процессы атмосферной коррозии имеют электрохимическую природу и объясняются с электрохимических позиций. Но в принципе механизм защиты железа цинком состоит в том, что цинк - металл более активный - прежде, чем железо, реагирует с агрессивными компонентами атмосферы. То есть получается, что цинк выручает железо, сам погибая.
Вот как это происходит:
В присутствии влаги между железом и цинком образуется микрогальванопара, в которой цинк - анод. Именно он и будет разрушаться при возникшем электрохимическом процессе, сохраняя в неприкосновенности основной металл. Даже если покрытие нарушено - появилась, допустим, царапина, - эти особенности цинковой защиты и ее надежность остаются неизменными. Ведь и в такой ситуации действуют микрогальванопара, в которой цинк принесен в жертву, и, кроме того, обычно в процессе нанесения покрытия железо и цинк реагируют между собой. И чаще всего царапина оголяет не само железо, а интерметаллическое соединение железа с цинком, довольно устойчивое к действию влаги.
Существенен и состав продукта, образующегося при “самопожертвовании” цинка. Активный цинк реагирует с влагой воздуха и одновременно с содержащимся в нем углекислым газом. Образуется защитная пленка состава ZnCO 3 *Zn(OH) 2 , имеющая достаточную химическую стойкость, чтобы защитить от реакций и железо, и сам цинк. Но если цинк корродирует в среде, лишенной углекислоты, скажем, в умягченной воде парового котла, то пленка нужного состава образоваться не может, и в этом случае цинковое покрытие разрушается намного быстрее.
Как же наносят цинк на железо? Способов несколько. Поскольку цинк образует сплавы с железом, быстро растворяя его даже при невысоких температурах, можно наносить распыленный цинк на подготовленную стальную поверхность из специального пистолета. Можно оцинковывать сталь (это самый старый способ), просто окуная ее в расплавленный цинк. Кстати, плавится он при сравнительно низкой температуре (419,5° С). Есть, конечно, электролитические способы цинкования. Есть, наконец, метод шерардизации (по имени изобретателя), применяемый для покрытия небольших деталей сложной конфигурации, когда особенно важно сохранить неизменными размеры.
В герметически закрытом барабане детали, пересыпанные цинковой пылью, выдерживают в течение нескольких часов при 350-375° С. В этих условиях атомы цинка достаточно быстро диффундируют в основной материал; образуется железоцинковый сплав, слой которого не “ уложен” поверх детали, а “внедрен” в нее.
Сплавы.
Уже упоминалось , что история с цинком достаточно путана. Но одно бесспорно: сплав меди и цинка - латунь - был получен намного раньше, чем металлический цинк. Самые древние латунные предметы, сделанные примерно в 1500 году до н.э., найдены при раскопках в Палестине.
Приготовление латуни восстановлением особого камня - c a d m e i a (кадмия) углем в присутствии меди описано у Гомера, Аристотеля, Плиния Старшего. В частности Аристотель писал о добываемой Индии меди, которая “отличается от золота только вкусом”.
Действительно, в довольно многочисленной группе сплавов, носящих общее название латуней, есть один (Л-96, или томпак), по цвету почти неотличимый от золота. Между прочим, томпак содержит меньше цинка, чем большинство латуней: цифра за индексом Л означает процентное содержание меди. Значит, на долю цинка в этом сплаве приходится не больше 4%.
Можно предполагать, что металл из кадмеи и в древности добавляли в медь не только затем, чтобы осветлить ее. Меняя соотношение цинка и меди, можно получить многочисленные сплавы с различными свойствами. Не случайно латуни поделены на две большие группы - альфа- и бета-латуни. В первых цинка не больше 33%. Почему именно 33?
С увеличением содержания цинка пластичность латуни растет, но только до определенного предела: латунь с 33 и более процентами цинка при деформировании в холодном состоянии растрескивается, 33% Zn - рубеж роста пластичности, рубеж, за которым латунь становится хрупкой.
Впрочем, могло случиться что за основу классификации латуней взяли бы другой “порог” - все классификации условны, ведь и прочность латуней растет по мере увеличения в них содержания цинка, но тоже до определенного предела. Здесь предел иной - 47-50% Zn. Прочность латуни, содержащей 45% цинка, в несколько раз больше, чем сплава, отлитого из равных количеств цинка и меди.
Широкий диапазон свойств латуней объясняется прежде всего хорошей совместимостью меди и цинка: они образуют серию твердых сплавов с различной кристаллической структурой. Так же разнообразно и применение сплавов этой группы. Из латуней делают конденсаторные трубки и патронные гильзы, радиаторы и различную арматуру, множество других полезных вещей - всего не перечислить.
И что здесь особенно важно. Введенный в разумных пределах цинк всегда улучшает механические свойства меди (ее прочность, пластичность, коррозийную стойкость). И всегда при этом он удешевляет сплав - ведь цинк намного дешевле меди. Легирование делает сплав более дешевым - такое встретишь не часто.
Цинк входит и в состав другого древнего сплава на медной основе. Речь идет о бронзе. Это раньше делили четко: медь плюс олово - бронза, медь плюс цинк - латунь. Теперь “грани стерлись”. Например, сплав ОЦС-3-12-5 считается бронзой, но цинка в нем в четыре раза больше, чем олова.
До сих пор мы рассказывали только о защите цинком и о легировании цинком. Но есть и сплавы на основе этого элемента. Хорошие литейные свойства и низкие температуры плавления позволяют отливать из таких сплавов сложные тонкостенные детали. Даже резьбу под болты и гайки можно получать непосредственно при отливке, если имеешь дело со сплавами на основе цинка.
Растущий дефицит свинца и олова заставил металлургов искать рецептуры новых типографских и антифрикционных сплавов. Доступный, довольно мягкий и относительно легкоплавкий цинк, естественно, привлек внимание в первую очередь. Почти тридцать лет поисковых и исследовательских работ предшествовали появлению антифрикционных сплавов на цинковой основе. При небольших нагрузках они заметно уступают и баббитам и бронзам, но в подшипниках большегрузных автомобилей и железнодорожных вагонов, угледробилок и землечерпалок они стали вытеснять традиционные сплавы. И дело здесь не только в относительной дешевизне сплавов на основе цинка. Эти материалы прекрасно выдерживают большие нагрузки при больших скоростях в условиях, когда баббиты начинают выкрашиваться...
Коротко о соединениях цинка.
Еще при первых попытках выплавить цинк из руды у средневековых химиков получался белый налет, который в книгах того времени называли двояко: либо “белым снегом” (nix alba), либо “философской шерстью” (lana philosophica). Нетрудно догадаться, что это была окись цинка ZnO - вещество, которое есть в жилище каждого городского жителя наших дней.
Этот “снег”, будучи замешанным на олифе, превращается в цинковые белила - самые распространенные из всех белил. Окись цинка нужна не только для малярных дел, ею широко пользуются многие отрасли промышленности. Стекольная - для получения молочного стекла и (в малых дозах) для увеличения термостойкости обычных стекол. В резиновой промышленности и производстве линолеума окись цинка используют как наполнитель. Известная цинковая мазь на самом деле не цинковая, а оксиноцинковая. Препараты на основе ZnO эффективны при кожных заболеваниях.
Наконец, с кристаллической окисью цинка связана одна из самых больших научных сенсаций 20-х годов нашего века. В 1924 году один из радиолюбителей города Томска установил рекорд дальности приема. Детекторным приемником он в Сибири принимал передачи радиостанций Франции и Германии, причем слышимость была более отчетливой, чем у владельцев одноламповых приемников. Как это могло произойти? Дело в том, что детекторный приемник томского любителя был смонтирован по схеме сотрудника нижегородской радиолаборатории О.В. Лосева.
Лосев установил, что если в колебательный контур определенным образом включен кристалл окиси цинка, то последний будет усиливать колебания высокой частоты и даже возбуждать незатухающие колебания. В наши “веселые транзисторные дни” такое событие прошло бы почти незамеченным, но в 1924 году изобретение Лосева представлялось революционным. Вот что говорилось в редакционной статье американского журнала “Radio-News”, целиком посвященной работе нижегородского изобретателя: ”Изобретение О.В.Лосева из Государственной радиоэлектрической лаборатории в России делает эпоху, и теперь кристалл заменит лампу!” Автор статьи оказался провидцем: кристалл действительно заменил лампу; правда, это не лосевский кристалл окиси цинка, а кристаллы других веществ. Но, между прочим, среди широко применяемых полупроводниковых материалов есть соединения цинка. Это его селениды и теллуриды, антимод и арсенид.
Еще более важно применение некоторых соединений цинка, прежде всего его сульфида, для покрытия светящихся экранов телевизоров, осциллографов, рентгеновских аппаратов. Под действием коротковолнового излучения или электронного луча сернистый цинк приобретает способность светиться, причем эта способность сохраняется и после того, как прекратилось облучение.
Резерфорд, впервые столкнувшись с явлением послесвечения сернистого цинка, воспользовался им для подсчета вылетающих из ядра альфа-частиц. В несложном приборчике, спинтарископе, ударяясь об экран, покрытый сульфидом цинка, эти частицы высекали вспышку, видимую глазом. А если частицы падают на экран достаточно часто, то вместо вспышек появляется постоянное свечение.
Биологическая роль цинка.
Фармацевты и медики жалуют многие соединения цинка. Со времен Парацельса до наших дней в фармакопее значатся глазные цинковые капли (0,25%-ный раствор ZnSO 4 ). Как присыпка издавна применяется цинковая соль стеариновой кислоты. Феносульфат цинка - хороший антисептик. Суспензия, в которую входят инсулин, протамин и хлорид цинка - новое эффективное средство против диабета, действующее лучше, чем чистый инсулин.
И вместе с тем многие соединения цинка, прежде всего его сульфат и хлорид, токсичны.
Цинк - один из важных микроэлементов. И в то же время избыток цинка для растений вреден.
Биологическая роль цинка двояка и не до конца выяснена. Установлено, что цинк - обязательная составная часть фермента крови, карбоангидразы. Этот фермент содержится в эритроцитах. Карбоангидраза ускоряет выделение углекислого газа в легких. Кроме того, она помогает превратить часть СО 2 в ион НСО 3 , играющий важную роль в обмене веществ.
Но вряд ли только карбоангидразой ограничивается роль цинка в жизни животных и человека. И если бы было так, то трудно было бы объяснить токсичность соединений этого элемента.
Известно, что довольно много цинка содержится в яде змей, особенно гадюк и кобр. Но в то же время известно, что соли цинка специфически угнетают активность этих же самых ядов, хотя, как показали опыты, под действием солей цинка яды не разрушаются. Как объяснить такое противоречие? Считают, что высокое содержание цинка в яде - это то средство, которым змея от собственного яда защищается. Но такое утверждение еще требует строгой экспериментальной проверки. Ждут выяснения и многие тонкие детали общей проблемы “цинк и жизнь”...
Это интересно!
Бурундучная руда.
Наиболее распространенный минерал цинка - сфалерит, или цинковая обманка ZnS. Разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы этого элемента: смитсонит ZnCO 3 , цинкит ZnO, каламин 2ZnO*SiO 2 *H 2 O. На Алтае нередко можно встретить полосатую “бурундучную” руду - смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Не в ночь под Ивана Купалу.
По старинным преданиям, папоротник цветет лишь в ночь под Ивана Купалу, и охраняет этот цветок нечистая сила. В действительности папоротник как споровое растение не цветет вообще, но слова “папоротниковые цветы” можно встретить на страницах вполне серьезных научных журналов. Так называют характерные узоры цинковых покрытий. Эти узоры возникают благодаря специальным добавкам сурьмы (до 0,3%) или олова (до 0,5%), которые вводят в ванны горячего цинкования. На некоторых заводах “цветы” получают иначе, - прижимая горячий оцинкованный лист к рифленому транспортеру.
ref.repetiruem.ru
Реферат - Цинк и его свойства
Химический элемент № 30
4.Электронное строение атома.
4.2. Дайте объяснение физического смысла всех индексов у данного химического элемента в системеД.И. Менделеева (порядковый номер, номер периода, номер группы, принадлежность к группе «А» или «Б»). Определите возможность «Эффекта провала электрона».
Решение.
Порядковый номер химического элемента в периодический системе – 30. молярная масса элемента равна 65.39 г/моль.
. Это значит, что в нейтральном атоме цинка содержится 30 электронов, заряд ядра атома цинка также равен 30. Цинк расположен в четвертом периоде системы. Это значит, что в атоме цинка есть четыре электронных слоя, на которых расположены электроны. Цинк расположен во второй группе периодической системы. В атоме цинка полностью заполняется 3d-подуровень на котором теперь находится 10 электронов. Цинк принадлежит к побочной подгруппе, или группе «Б».
Провал или проскок электрона для цинка невозможен, поскольку у него полностью заполнен 3d-подуровень. Провал электрона характерен для меди, серебра, у них количество d-электронов также равно 10, но s-электрон только один. Это можно объяснить повышенной энергетической стойкостью электронных структур, отвечающих полностью заполненным энергетическим подуровням. Переход электрона в атоме меди с 4s на 3d-подуровень приводит к образованию полностью заполненного 3d-подуровня и это энергетически выгодно. У цинка 3d – под уровень заполнен и электрону некуда переходить.
4.3. Выделите валентные подуровни в электронной формуле атома химического элемента, определитепринадлежность химического элемента к типу s-, p-, d-, f-элементов.
Решение.
Покажем расположение валентных электронов в атоме цинка. Как видно из электронной формулы цинк относится к d-элементам, поскольку у него заполняется 3d-подуровень.
На приведенном рисунке эллипсом выделено расположение валентных электронов.
4.4. Напишите наборы квантовых чисел для всех валентных электронов.
Решение.
У атома цинка будет два валентных электрона. Запишем наборы квантовых чисел для этих электронов. Главное квантовое число равно 4 и химический элемент находится в 4 периоде периодической системы химических элементов. Поскольку в цинка валентные электроны расположены только на s-подуровне то его орбитальное квантовое число имеет значение равное 0. Поскольку этих электронов будет 2 то они имеют противоположные спиныms = ±1/2. Поскольку ml = 0 то у элемента не будет других подуровней кроме s-подуровня.
Наборы квантовых чисел будут иметь вид:
n = 5; l = 0; ml = 0; ms = +1/2.
n = 5; l = 0; ml = 0; ms = -1/2.
4.5. Определите принадлежность химического элемента к металлам или неметаллам, спрогнозируйтевеличины степени окисления.
Решение.
Поскольку цинк расположен во второй группе периодической системы, то он относится к металлам. В химических реакциях он будет проявлять металлические свойства. для металлов более приемлема отдача электронов. Поэтому цинк может отдавать два электрона с — подуровня. Поэтому цинк будет проявлять степень окисления +2. В связи с экранированием 3d – подуровня и его заполненостью, электроны с него не будут брать участие в химических процессах и поэтому цинк будет проявлять только степень окисления равную +2.
4.6. Распределите валентные электроны атома химического элемента по энергетическим ячейкам в соответствии с принципом наименьшей энергии и правилом Гунда.
Решение.
В соответствии с принципом наименьшей энергии два валентных электрона атома цинка расположатся на 4s-подуровне, поскольку он располагает меньшей энергией чем любой другой подуровень. Правило Хунда гласит, что устойчивому состоянию атома отвечает такое расположение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Поэтому мы моглы бы считать. Что в одной ячейке будут электроны с одинаково направлеными спинами. Но это противоречит принципу Паули. И поэтому расположение электронов для цинка будет таково как на приведенном нами рисунке:
4.7. Прогнозируйте тип гибридизация валентных атомных орбиталей при образовании бинарных соединений (фторидов, хлоридов и др.).
Решение.
Рассмотрим получение :
Каждый атом фтора, входящий в состав данной молекулы, обладает одним неспаренным электроном, который и берет участие в создании ковалентной связи. Атом цинка в не возбужденном состоянии неспаренных электронов не имеет вообще:
Поэтому для участия в химическом соединении атом цинка должен перейти в возбужденное состояние: .
Образовавшийся возбужденный атом цинка владеет двумя не спаренными электронами, электронное облако одного электрона соответствует состоянию 4s, а другого состоянию 4p. При затрате некоторой энергии вместо исходных орбита лей могут образовываться две равноценные гибридные орбитали (sp – орбитали). У атома цинка в бинарных соединениях будет наблюдаться sp –гибридизация. Гибридные sp –орбитали будут вытянуты в противоположных направлениях, как это показано на рисунке.
Рис. 1. Строение молекулы ZnF2.
5. Соединение данного химического элемента с неметаллами.
5.2. С галогенами.
Решение.
Газообразные фтор, бром, хлор, иод не реагируют с цинком на холоду. Но в присутствии паров воды реакция может проходить с воспламенение металла и выделением большого количества теплоты (для фтора 172 ккал, для хлора 95,6 ккал на моль цинка)
В реакции с галогенами получаем галоген производные цинка: фториды, хлориды, броматы.
5.4. С азотом.
Решение.
С азотом, даже в парах цинк не реагирует, но довольно легко реагирует при температуре красного каления с аммиаком с выделением нитрида цинка .
5.5. С углеродом.
Решение.
Цинк непосредственно не реагирует с углеродом и карбид цинка мы можем получить только через промежуточные реакции. Карбид цинка мы можем получить при нагревании цинка в токе ацетилена при температурах около 200 – 300 С.
Карбид цинка довольно нестойкое соединение, которое легко разлагается водой и кислотами.
6.1. Запишите ряд оксидов данного химического элемента (прогноз по электронной формуле иковалентности).
Решение.
Для цинка характерна степень окисления +2. поэтому цинк имеет только один оксид: ZnO. Другие оксиды цинка неизвестны. Возможно существование пер оксида цинка ZnO2. ковалентность цинка в пер оксиде равна двум, строение его молекулы приведено на рисунке.
Ковалентность цинка в оксиде ZnOравна двум.
Запишем электронную формулу для ZnO:
6.2. Прогнозируйте характер оксидов (основной, кислотный, амфотерный) по величине Э.О. и правилухимических свойств ряда оксидов.
Решение.
Во второй побочной подгруппе периодической системе кроме цинка находится также и кадмий и ртуть. Все эти металлы имеют основные оксиды, кадмий проявляет также и амфотерные свойства. Поэтому можно прогнозировать, чтооксид цинка будет проявлять также амфотерные свойства.
Рассмотрим электроотрицательности оксида цинка:
Разница электронегативностей для ZnO равна 3,5 – 1,8 = 1,7. Для основных оксидов Na2 O, CaO, BaO эта разница составляет около 2,5, а для кислотных оксидов SO2, SO3, P2 O5 около 1÷1,3. как видно оксид цинка лежит посредине этих значений, как металл он будет обладать амфотерными свойствами.
6.3. Запишите соответствующие гидроксиды (основания и кислоты). Определите принадлежность к сильнымили слабым электролитам.
Решение.
Для цинка характерен только один гидроксид.
Поскольку цинк двухвалентен, то формула гидроксида цинка имеет вид: . Гидроксид цинка выделяется из растворов солей цинка при действии щелочей в виде белого аморфного осадка. При стоянии он постепенно приобретает кристаллическую структуру. Скорость кристаллизации зависит от раствора соли из которой она кристаллизируется. Так из растворов хлоридов гидроксид цинка кристаллизируется значительно быстрее чем из растворов нитратов.
Гидроксид цинка владеет амфотерными свойствами (с преобладанием основных свойств), константа диссоциации основания равна , а кислоты . Произведение растворимости гидроокиси цинка равно . Есть данные, что у свежеосажденного гидроксида цинка она несколько больше и составляет .
6.4. Составьте уравнения реакций, подтверждающих характер гидроксидов о молекулярном и ионном виде.
Решение.
Гидроксид цинка владеет амфотерными свойствами. Он реагирует как с кислотами так и с щелочами. С кислотами гидроксид цинка дает соли цинка, например:
В щелочном растворе гидроокись цинка ведет себя как ангидридокислота, то есть переходит в раствор в виде гидроксоцинкат-ионов за счет присоединения ионов гидроксила. Известны соли три-, тетра- и гексагидроксоцинкатов, например: .
Некоторые из цинкатов выделены в твердом состоянии: . Они образуются только при избытке щелочи.
Некоторые из полученных соединений содержат криталлизационную воду. В большинстве случаев последняя легко отцепляется при нагревании. Конституционно связанная вода удерживается в таких соединениях довольно крепко, например при нагревании до температуры 465ºС потери воды не происходит.
Цинкаты также могут быть получены при сплавлении окиси цинка и окисей других металлов, но полученные таким образом цинкаты не растворимы в воде.
6.5. Напишите уравнения реакций электролитической диссоциации гидроксидов.
Решение.
Гидроксид цинка вещество довольно мало растворимое, но он все же диссоциирует на ионы, хотя и в малой мере. Произведение растворимости равно . Рассчитаем содержание иона цинка в растворе ,
В водных растворах диссоциирует на ионы согласно уравнения:
.
Но поскольку мало растворим, то диссоциация протекает незначительно.
7. Может ли данный химический элемент образовывать комплексные соединения? Если да, то, какие(кислоты, основания, соли)? Приведите примеры.
Решение.
Цинк может образовывать комплексные соединения. Комплексы цинк образовывает с аммиаком, цианидами, гидразином, роданидами, а также с многими органическими веществами, например акридином, пирамидоном, дифенилгуанидином, некоторыми органическими красителями. Отсутствие в комплексах цинка стабилизации полем лигандов приводит к тому, что их стереохимия зависит только от размера и от электростатической и ковалентной составляющей связи. Комплексы цинка могут быть тетраэдрическими — или октаэдрическими — .
С аммиаком были выделены комплексные соединения состава: , , . Комплексы с 6 молекулами аммиака были получены только в сухом виде.
Известно значительное число комплексов цинка с органическими соединениями основного характера. В зависимости от условий могут образовываться соединения двух типов. К первому из них относятся соединения, где органический реагент непосредственно связан с ионом цинка и образует типичный комплекс внесения. Ко второму типу можно отнести соединения, в которых органическое основание играет роль катиона, дающего соли с другими ацидокомплексными анионами цинка. Эти соединения » характеру связи с органическими реагентами по существу относятся к обычным ионным ассоциатам.
Интересно отметить, что меняя условия образования комплексов, и прежде всего кислотность среды, нередко удается наблюдатьвзаимное превращения комплексов внедрения («аммиакаты») в комплексы типа «аммонийных солей» и обратно.
Гидразингидратысостава , обладают значительной прочностью из растворов комплексов сероводород не осаждает сульфид цинка. Первый из них плохо растворяется в воде, не растворим в спирте.
8. Напишите уравнения реакций гидролиза солипо 1-ой стадии в молекулярном и ионном виде с учетомвсех равновесий. Рассчитайте рН среды при гидролизе этой соли (0,01моль/л). Как усилить гидролиз?
Решение.
Соли цинка легко гидролизируются.
Рассмотрим гидролиз нитрата цинка.
В результате гидролиза нитрата цинка мы получим основную соль, основной нитрат цинка.
При гидролизе указанной соли мы получим ионы , тогда РН < 7. Раствор будет иметь кислую реакцию.
Рассчитаем РН среды.
Повлиять на процесс гидролиза можно с помощью добавки реактивов, кислот или основ. В процессе гидролиза мы получаем ионы Н+, если их связать действием ионов ОН — , то процесс гидролиза усилится. Поскольку гидролиз процесс равновесный, то уменьшение концентрации ионов Н+ из – за реакции:приведет к смещению равновесия вправо, к усилению гидролиза.
Ослабить гидролиз можно введение ионов Н+, что приведет к смещению равновесия влево.
9. Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Zn и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
Решение.
Цинк – сильный восстановитель. На реакции цинка и ионами меди основана работа химического элемента Даниеля. Нормальный электродный потенциал цинка — 0.7618 В. как восстановитель цинк используют в многих химических процессах, например, он используется при восстановлении органических веществ, и т.п.
Восстановительная активность цинка проявляется особенно активно при РН<7, в кислых растворах. Он восстанавливает водород из кислот, например разбавленной серной или соляной.
Также цинк может восстанавливать металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления гальванических элементов.
В щелочной среде цинк окисляется до иона , он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
Нормальный электродный потенциал электрода равен для реакции: -1,216 В, это значит, что цинк может восстанавливать в щелочной среде все соединения с более положительным потенциалом, это будут кислородные соединения хрома, марганца, олова, свинца и т.п.
Приведенное выше уравнение будет примеров взаимодействия цинка в щелочной среде.
9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН<7.
Предварительно рассчитайте Е0химической реакции, используя метод электронно-ионного баланса.
Решение.
Для указанных уравнений запишем окислительно-восстановительные уравнения реакций. Сначала рассмотрим эти уравнения и решим их с помощью электронного баланса.
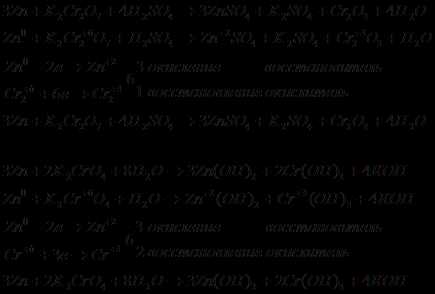
Запишем уравнения электронно-ионного баланса.
Суммируем уравнения.
Запишем полученное уравнение в молекулярном виде:
Рассчитаем Е0 химической реакции.
Суммируем уравнения.
Запишем полученное уравнение в молекулярном виде:
Рассчитаем Е0 химической реакции.
Составим уравнения ионно-электронного баланса.
Просуммируем полученные полу реакции.
Запишем уравнение в молекулярном виде.
Рассчитаем Е0 химической реакции.
10.3. Составьте и опишите схему гальванического элемента из металлического электрода данного металла и электродной системы С,
Решение.
Гальванический элемент состоит из катода и анода. Одним из электродов в нашем случае будет цинковый электрод, другим электродом будет инертный угольный электрод.
Запишем схему электрода.
Гальванический элемент состоит из цинковой пластины опущенной в раствор соли, что содержит ионы V3+ и H+ . поскольку РН <7. угольный электрод опущен в раствор, что содержит ионы . Между электродами расположена диафрагма, которая пропускает ионы, но не дает смешиваться электродным растворам. Если электрическая цепь разеденена. То в при электродных пространствах быстро наступает равновесие.
Цинковая пластинка в гальваническом элементе легко отдает свои катионы в раствор, тогда она будет окислятся.
Каждый ион цинка, переходя в раствор, оставляет на пластинке два электрона. Из-за этого пластинка получит отрицательный заряд. На угольном электроде будут проходить процессы восстановления:
Если цепь замкнуть, то в гальваническом элементе возникнет электрический ток. Электроны из места, где плотность отрицательного заряда высока, будут переходить в место с меньшей плотностью отрицательного заряда.
В целом химическую реакцию. Которая происходит в гальваническом элементе можно записать так: . В молекулярном виде уравнение будет иметь такой вид: .
Важной характеристикой любого гальванического элемента будет его ЭРС. Она равна: , если округлить полученное значение ЭРС, то мы получим: . При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием ванадия.
10.4. Опишите процесс электрохимической коррозии при контакте металла и изделия из Sn во влажной среде (Без аэрации и при аэрации).
Решение.
Если включения олова в цинк имеют значительные размеры, то мы будем иметь дело с гальваническим элементом.
Поскольку электродные потенциалы для олова и цинка равны:
Мы будем иметь гальванический элемент в котором цинк будет более активным металлом по сравнению с оловом, что приведет к его окислению.
Рассмотрим случай, когда мы имеем включения олова в цинк во влажной атмосфере без аэрации. Отсутствие аэрации означает отсутствие активного кислорода, который может вступать в электрохимические взаимодействия.
На скорость коррозии цинка будет также влиять наличие оксидной пленки на поверхности цинка.
Олово будет оказывать на цинк поляризирующее влияние, что приведет к тому, что цинк (потенциал которого меньше) будет поляризироваться анодно и скорость его коррозии возрастет.
На аноде будет проходить реакция: .
На катоде, в роли которого выступает олово, будет протекать реакция: . В результате реакции будет выделяться водород. Ионы гидроксила будут взаимодействовать с ионами цинка и в результате мы получим гидроксид цинка.
Рассмотрим процесс коррозии при аэрации. Наличие аэрации означает доступ кислорода к контакту двух металлов.
На аноде будет проходить реакция: .
На катоде, в роли которого выступает олово, будет протекать реакция: . В результате реакции мы получим ионы гидроксила. Ионы гидроксила будут взаимодействовать с ионами цинка и в результате мы получим гидроксид цинка.
Процесс коррозии при аэрации проходит более активно чем без аэрации, поэтому такой вид коррозии будет более опасен для цинковых деталей чем коррозия без доступа воздуха.
10.5. Опишите процесс электролиза с учетом перенапряжения. Электролит – раствор ZnCl2 PH= 2, 5
Электроды: катод – С,
анод – Zn.
Решение.
В растворе хлорид цинка будет диссоциировать на ионы согласно уравнения:
Рассмотрим процессы, которые будут происходить на аноде.
Анод цинковый. На цинковом аноде могут происходить несколько процесов:
Запишем потенциалы прохождения указанных процессов:
Перенапряжение выделения кислорода на цинковом электроде при плотности тока 1мА/см2 равно 1,75 В. Это значит, что кислород данной реакции выделятся не будет и на аноде возможны только две электрохимические реакции:
Как видно из значений электродных потенциалов на аноде будет происходить реакция окисления цинка: , потенциал которой будет ниже чем потенциал восстановления хлора. Мы будем иметь дело с рафинированием цинка.
Рассмотрим электродные процессы на катоде. Материал катода – уголь или графит, катод инертен и не будет брать участия в электрохимических процессах. На катоде также возможны несколько реакций, рассмотрим их. РН среды равно 2,5. На графите при температуре 20ºС перенапряжение выделения водорода при плотности тока 1 А/см2 равно 1,2 В, а при плотности тока 1 мА/см2 всего лишь 0,6 В. За уравнением Нернста мы можем вычислить значение потенциала перенапряжения водорода при РН=2,5. потенциал водородного электрода находится в линейной зависимости от РН среды.
При давлении водорода 1 атмосфера , и при РН=2,5 мы получим перенапряжение равное:
При плотности тока равной 1 А/см2 перенапряжение равно: а при плотности тока 1 мА/см2 .
Ионы же цинка восстанавливаются при потенциале равном — 0,763 В. Перенапряжением восстановления ионов цинка на графитовом электроде можно пренебречь, поскольку оно довольно мало по значению. Из полученных расчетов видно что при малых плотностях тока на графитовом электроде возможны две конкурирующие реакции:
При плотности тока на катоде будет выделятся водород по уравнению , поскольку потенциал восстановления водорода будет равен , что больше потенциала восстановления цинка. При плотности тока будут происходить конкурирующие реакции:
При этих условиях потенциал восстановления водорода равен около . При плотности тока равной 1 А/см2 перенапряжение равно: , при этих условиях мы можем вести выделение цинка из раствора по уравнению: . Тогда водород на электродах выделяться не будет.
При проведении электролиза надо учитывать повешение температуры, при повышении температуры на 1ºС перенапряжение уменьшается на 2 – 3 мВ. Оно также зависит от вида поверхности электрода и от наличия некоторых органических добавок в электролите.
Список использованной литературы.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Полеес М. Э. Аналитическая химия. – М.: Медицина, 1981. – 286 с.
3. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
4. Мороз А. С., Ковальова А. Г. Физическая и коллоидная химия. – Л.: Мир, 1994. – 278 с.
5. Физическая химия. Практическое и теоретическое руководство. Под ред. Б. П. Никольского, Л.: Химия, 1987. – 875 с.
6. Скуг Д., Уэст Д. Основы аналитической химии. В 2 т. Пер с англ. М.: Мир, 1979, — 438 с.
7. Натарова Н. Г. Аналитическая химия цинка. – М.: Химия, 1982. – 378 с.
www.ronl.ru
Реферат - Цинк - Химия
Московская Государственная Академия Приборостроения и Информатики.
ЦИНК.
Студент: Жариков С.А.
Факультет: ТИ-6
Преподаватель: Мосина Г.Н.
Москва 2001.
ОБЩИЕ СВЕДЕНИЯ.
Z=30
атомный вес = 65,37
валентность II
заряд 2+
массовые числа основных природных изотопов: 64, 66, 68, 67, 70
электронная структура атома цинка: KLM 4s2
3d10
4s2
ИСТОРИЧЕСКАЯ СПРАВКА.
С древних времён известны латуни, являющиеся сплавами Cu-Zn. Металлический цинк впервые получен в 1746 году в Англии нагреванием каламина с древесным углём.
РАСПРОСТРАНЕНИЕ В ПРИРОДЕ.
В природе цинк находиться только в виде соединений.
СФАЛЕРИТ (цинковая обманка, ZnS) имеет вид кубических жёлтых или коричневых кристаллов; плотность 3,9-4,2 г/см3 , твёрдость 3-4 по шкале Мооса. В качестве примесей содержит кадмий, индий, галлий, марганец, ртуть, германий, железо, медь, олово, свинец.
В кристаллической решётке сфалерита атомы цинка чередуются с атомами серы и наоборот. Атомы серы в решётке образуют кубическую упаковку. Атом цинка располагается в этих тетраэдрических пустотах.
ВЮРТЦИТ (ZnS) представляет собой коричнево-чёрные гексагональные кристаллы, плотностью 3,98 г/см3 и твердостью 3,5-4 по шкале Мооса. Обычно содержит цинка больше чем сфалерит. В решётке вюртцита каждый атом цинка тетраэдрически окружён четырьмя атомами серы и наоборот. Расположение слоёв вюртцита отличается от расположения слоёв сфалерита.
СМИТСОНИТ (цинковый шпат, ZnCO3 ) встречается в виде белых (зелёных, серых, коричневых в зависимости от примесей) тригональных кристаллов плотностью 4,3-4,5 г/см3 и твёрдостью 5 по шкале Мооса.
КАЛАМИН (Zn2 SiO4 *h3 O*ZnCO3 или Zn4 [Si2 O7 ](OH)4 *h3 O*ZnCO3 ) представляет собой смесь карбоната и силиката цинка; образует белые (зелёные, синие, жёлтые, коричневые в зависимости от примесей) ромбические кристаллы плотностью 3,4-3,5 г/см3 и твёрдостью 4,5-5 по шкале Мооса.
ВИЛЛЕМИТ (Zn2 SiO4 ) залегает в виде бесцветных или жёлто-коричневых ромбоэдрических кристаллов плотностью 3,89-4,18 г/см3 и твёрдостью 5-5,5 по шкале Мооса.
ЦИНКИТ (Zn O) — гексагональные кристаллы жёлтого, оранжевого или красного цвета с решёткой типа вюртцита и твёрдостью 4-4,5 по шкале Мооса.
ГАНИТ (Zn[Al2 O4 ]) имеет вид тёмно-зелёных кристаллов плотностью 4-4,6 г/см3 и твёрдостью 7,5-8 по шкале Мооса.
Помимо приведённых, известны и другие минералы цинка:
монгеймит (Zn, Fe)CO3
гидроцикит ZnCO3 *2Zn(OH)2
трустит (Zn, Mn)SiO4
гетеролит Zn[Mn2 O4 ]
франклинит (Zn, Mn)[Fe2 O4 ]
халькофанит (Mn, Zn) Mn2 O5 *2h3 O
госларит ZnSO4 *7h3 O
цинкхальканит (Zn, Cu)SO4 *5h3 O
адамин Zn2 (AsO4 )OH
тарбуттит Zn2 (PO4 )OH
деклуазит (Zn, Cu)Pb(VO4 )OH
леграндит Zn3 (AsO4 )2 *3h3 O
гопеит Zn3 (PO4 )*4h3 O
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО ЦИНКА.
Цинк добывают из концентратов сфалерита, смитсонита и каламина.
Сульфидные полиметаллические руды, которые содержат пирит Fe2 S, галеннит PbS,
халькопирит CuFeS2 и в меньшем количестве сфалерит после измельчения и размалывания подвергают обогащению сфалеритом методом селективной флотации. Если руда содержит магнетит, то для его удаления используют магнитный метод.
При прокаливании (700°) концентратов сульфида цинка в специальных печах, образуется ZnO, который служит для получения металлического цинка.
2ZnS+3O2 =2ZnO+2SO2 +221 ккал
Для превращения ZnS в ZnO измельчённые концентраты сфалерита предварительно нагревают в специальных печах горячим воздухом
Окись цинка также получают прокаливанием смитсонита при 300°.
Металлический цинк получают путём восстановления окиси цинка углеродом
ZnO+CÞZn+CO-57 ккал
водородом
ZnO+h3 ÛZn+h3 O
ферросилицием
ZnO+FeSiÞ2Zn+Fe+SiO2
метаном
2ZnO+Ch5 Þ2Zn+h3 O+C
окисью углерода
ZnO+COÞZn+CO2
карбидом кальция
ZnO+CaC2 ÞZn+CaS+C
Металлический цинк также можно получить сильным нагреванием ZnS с железом, с углеродом в присутствии CaO, с карбидом кальция
ZnS+CaC2 ÞZn+CaS+C
ZnS+FeÛ2Zn+FeS
2ZnS+2CaO+7CÞZn+2CaC2 +2CO+CS2
Металлургический процесс получения металлического цинка, применяемый в промышленном масштабе, заключается в восстановлении ZnO углеродом при нагревании. В результате этого процесса ZnO восстанавливается не полностью, теряется некоторое количество цинка, идущего на образование Zn[Al2 O4 ], и получают загрязнённый цинк.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.
Цинк — блестящий серебристый белый металл с плотностью 7,13 г/ см3 при 20° (тяжелый металл), температура плавления 419,44°, температура кипения 906°, твердость 2,5 — 2,9 по шкале Мооса. Имеет плотную гексагональную структуру кристаллов. Цинк становится при 100 — 150° и хрупким — выше 200°, он геомагнитен и имеет пять природных изотопов.
С химической точки зрения цинк менее активен, чем щелочные и щелочноземельные металлы, и более активен, чем олово, свинец, медь, ртуть, серебро, золото.
При сильном нагревании цинк воспламеняется и горит сине-зеленым пламенем.
Zn + 1/2 O2 = ZnO +83,5 ккал
Цинк окисляется кислородом воздуха при нагревании выше 225°, а в токе сухого кислорода выше 150°.
Металлический цинк не разлагает воду при комнатной температуре или кипячении, поскольку в присутствии воды поверхность цинка покрывается Zn(OH)2, который препятствует дальнейшему разрушению металла.
Цинк, нагретый почти до температуры плавления, энергично разлагает поры воды с образованием ZnO и h3 .
Zn + h3 O Û ZnO + h3
При комнатной температуре во влажном воздухе галогены образуют с цинком соответствующие гологениды. В сухом состоянии гологены взаимодействуют с металлическим цинком при высокой температуре.
Zn + F2 = Zn F2 + 172,7 ккал
Zn + Cl2 = ZnCl2 +99,55 ккал
Zn +Br2 =ZnBr2 +78,4 ккал
Zn + I2 = ZnI2 + 49,8 ккал
Нагревание порошкообразного цинка порошком серы приводит к образованию ZnS.
Zn + S = ZnS + 44 ккал
Под действием сероводорода поверхность металлического цинка покрывается плотной защитной плёнкой ZnS.
Zn+h3 S Û ZnS + h3
Двуокись серы во влажной атмосфере и хлористый тионил взаимодействуют с цинком при нагревании.
3Zn + SO2 = ZnS + 2ZnO
Zn +SOCl2 = ZnCl2 + SO
Нагревание цинка в атмосфере аммиака дает нитрит Zn3 N2 .
Цинк непосредственно не вступает в реакцию с азотом, углеродом, водородом и другими элементами.
Обработка парами фосфора, нагретого до 440 — 780°, металлического цинка в атмосфере азота или водорода приводят к образованию Zn3 P2 и ZnP2 .
Поскольку нормальный потенциал системы Zn/ Zn2+ = -0,761 В, металлический цинк легко растворяется в кислотах и щелочах. При растворении цинка в разбавленных кислотах образуются соответствующие соли и водород.
Zn + 2HCl = ZnCl2 + h3
Zn + h3 SO4 = ZnSO4 + h3
Чистый металлический цинк медленно взаимодействует с разбавленными кислотами, поскольку образовавшийся атомарный водород покрывает поверхность цинка и выделение водорода уменьшается.
При образовании гальванического элемента Zn — Cu в соляной кислоте выделение водорода происходит очень интенсивно, и цинк легко растворяется, превращаясь в хлорид. Для образования гальванического элемента Zn — Cu в раствор соляной кислоты добавляют несколько капель сульфата меди. Медь, стоящая в электрохимическом ряду напряжений правее цинка, осаждается им, покрывает поверхность цинка и ускоряет, таким образом, растворение его в соляной кислоте.
По отношению к концентрированным серной и азотной кислотам цинк является восстановителем.
Zn + 2h3 SO4 = ZnSO4 + SO2 + 2h3 O
4Zn + 10HNO3 = 4Zn(NO3 )2 + Nh5 NO3 +3h3 O
При действии щелочей на металлический цинк образуются гидроцинкаты и водород.
Zn + NaOH + 2h3 O = Na2 [Zn(Oh5 )] + h3
Цинк вытесняет менее активные металлы из растворов их солей и восстанавливает хромовую, марганцевую и молибденовую кислоты, соли железа (III) и олово (IV).
С помощью цинка можно осуществлять цинкотермическое разложение многих окислов, например: CdO, PbO, CuO, NiO.
Восстанавливая сероуглерод, цинковый порошок раскаляется.
С точки зрения физиологии цинк — необходимый элемент для живых организмов.
Цинк входит в состав фермента, имеющегося в красных кровяных тельцах (гемоглобин), с помощью которого происходит перенос двуокиси углерода в крови.
Для животных цинк загрязненный мышьяком, сурьмой, свинцом, кадмием становится токсичен. Вдыхание ZnCl2 в больших дозах смертельно.
ПРИМЕНЕНИЕ.
Во влажном воздухе поверхность цинка покрывается тонкой защитной пленкой окисла и основного карбоната, который в дальнейшем предохраняет металл от атмосферного действия атмосферных реагентов. Благодаря этому свойству цинк применяется для покрытия железных листов и проволоки. Также цинк применяется для извлечения серебра из серебросодержащего свинца по процессу Паркеса; для получения водорода в результате разложения соляной кислоты; для вытеснения металлов с более низкой химической активностью из растворов их солей; для изготовления гальванических элементов; в качестве восстановителя во многих химических реакциях; для получения многочисленных сплавов с медью, алюминием, магнием, свинцом, оловом и другими металлами.
www.ronl.ru
Реферат - Цинк - Рефераты на репетирем.ру
Элемент цинк (Zn) в таблице Менделеева имеет порядковый номер 30. Он находится в четвертом периоде второй группы. Атомный вес - 65,37. Распределение электронов по слоям 2-8-18-2.
Цинк представляет собой синевато - белый металл, плавящийся при 419° С, а при 913° С превращающийся в пар; плотность его равна 7,14 г/см3. При обыкновенной температуре цинк довольно хрупок, но при 100-110° С он хорошо гнется и прокатывается в листы. На воздухе цинк покрывается тонким слоем окиси или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк, хотя он и стоит в ряду напряжений значительно левее водорода. Это объясняется тем, что образующаяся на поверхности цинка при взаимодействии его с водой гидроокись практически нерастворима и препятствует дальнейшему течению реакции. В разбавленных же кислотах цинк легко растворяется с образованием соответствующих солей. Кроме того, цинк подобно бериллию и другим металлам, образующим амфотерные гидроокиси, растворяется в щелочах. Если нагреть цинк на воздухе до температуры кипения, то пары его воспламеняются и сгорают зеленовато-белым пламенем, образуя окись цинка.
Немного истории.
Соединения цинка и его сплавы известны человечеству с глубокой древности, металлический же цинк был получен значительно позднее, чем железо, свинец и олово. Это обстоятельство объясняется тем, что обычные способы плавки руды с углем здесь не достигали цели; чтобы восстановить цинк, его надо быстро нагреть до температуры около 1000 градусов, но при этом он кипит и в виде паров теряется вместе с дымовыми газами. Только после того как научились конденсировать пары цинка в глиняных сосудах, стало возможных получение металла в свободном состоянии. Полагают, что такой дистилляционный способ получения свободного цинка впервые был изобретен в Китае.
Латунь (сплав меди с цинком) была известна грекам, индусам и другим народам Востока, употреблявшим ее для изготовления различных предметов домашнего обихода, художественного литья и украшений. Отдельные предметы из латуни, относящиеся к периоду за 1500 лет до н.э., были найдены в Палестине. Приготовление латуни восстановлением особой земли кадмия (так назывались в древности многие минералы, содержащие цинк, отличие между которые не делали) углем в присутствии меди описывают Аристотель (384- 322 гг. до н.э.), Плиний Старший (23-79 гг. н.э.) и Гомер. Плиний Старший и Диоскрид из Аназарбуса описывают лекарственные средства, содержащие соединения цинка. Лекарства эти употреблялись для заживления ран и при лечении глазных болезней.
В доисторических дакийских развалинах в Трансильвании был найден идол, отлитый из сплава, содержащего около 87% цинка. Получение металлического цинка из галмея Zn4(Si2O7)*h3O впервые описывает Страбон (60-20 гг. до н.э.). Цинк в этот период называли тутией или фальшивым серебром.
Благодаря довольно сложной выработке цинка из руд в X-XI вв. н.э. искусство получения цинка в Европе было утрачено и он ввозился сюда под названием индийского олова из Китая и Индии.
В конце XIII в. н.э. итальянский путешественник Марко Поло описал способ получения металлического цинка в Персии. В 1637 году метод выплавки цинка и его свойства описываются в китайской книге “Циен конг кан у”. Казалось бы, что раз метод получения описан в литературе, то его легко могли перенять другие народы и применить у себя на родине. Но этого не случилось. Экономическая и культурная разобщенность народов, слабые транспортные связи, а главное, стремление многих ученых описывать свои открытия на непонятном языке-все это препятствовало быстрому распространению технических достижений.
Вторично получение цинка в Европе стало известно в начале XVI века, когда о способе его выплавки упоминают в своих сочинениях Георг Агрикола (1494-1555) и Теофраст Парацельс. Однако и после этого цинк в Европе был большой редкостью, что продолжалось почти до конца XVIII в.
Название же “цинк” происходит от латинского слова, обозначающего бельмо или белый налет, и впервые встречается у Парацельса в 1530 году. Роберт Бойль назвал цинк “спелтером”. У нас цинк И.Шлаттер (1736) называл “туцией”, Ломоносов (1742) ввел название “цинк”, но оно не пользовалось успехом и цинк чаще всего называли “шпиаутер”.
В 8-м издании “Основ химии” (1906) Д.И. Менделеев употребляет современное название цинка, но наряду с этим ставит в скобках и другое его название-”шпиаутер”. Из этого можно заключить, что во времена Менделеева старое название цинка было достаточно широко распространено.
Металлический цинк.
В XVI веке были предприняты первые попытки выплавлять цинк в заводских условиях. Но производство “не пошло”, технологические трудности оказались непреодолимыми. Цинк пытались получать точно также, как и другие металлы. Руду обжигали, превращая цинк в окись, затем эту окись восстанавливали углем...
Цинк, естественно, восстанавливался, взаимодействуя с углем, но ... не выплавлялся. Не выплавлялся потому, что этот металл уже в плавильной печи испарялся - температура его кипения всего 906° С. А в печи был воздух. Встречая его, пары активного цинка реагировали с кислородом, и вновь образовывался исходный продукт-окись цинка.
Наладить цинковое производство в Европе удалось лишь после того, как руду стали восстанавливать в закрытых ретортах без доступа воздуха. Примерно так же “черновой” цинк получают и сейчас, а очищают его рафинированием. Пирометаллургическим способом сейчас получают примерно половину производимого в мире цинка, а другую половину-гидрометаллургическим.
Следует иметь в виду, что чисто цинковые руды в природе почти не встречаются. Соединения цинка (обычно 1-5% в пересчете на металл) входят в состав полиметаллических руд. Полученные при обогащении руды цинковые концентраты содержат 48-65% цинка, до 2% меди, до 2% свинца, до 12% железа. И плюс доли процента рассеянных и редких металлов...
Сложный химический и минералогический состав руд, содержащих цинк, был одной из причин, по которым цинковое производство рождалось долго и трудно. В переработке полиметаллических руд и сейчас еще есть нерешенные проблемы... Но вернемся к пирометаллургии цинка - в этом процессе проявляются сугубо индивидуальные особенности этого элемента.
При резком охлаждении пары цинка сразу же, минуя жидкое состояние, превращаются в твердую пыль. Это несколько осложняет производство, хотя элементарный цинк считается нетоксичным. Часто бывает нужно сохранить цинк именно в виде пыли, а не перерплавлять его в слитки.
В пиротехнике цинковую пыль применяют, чтобы получить голубое пламя. Цинковая пыль используется в производстве редких и благородных металлов. В частности, таким цинком вытесняют золото и серебро из цианистых растворов. Как ни парадоксально, но при получении самого цинка (и кадмия) гидрометаллургическим способом применяется цинковая пыль-для очистки раствора сульфата меди и кадмия. Но это еще не все. Вы никогда не задумывались, почему металлические мосты, пролеты заводских цехов и другие крупногабаритные изделия из металла чаще всего окрашивают в серый цвет?
Главная составная часть применяемой во всех этих случаях краски - все та же цинковая пыль. Смешанная с окисью цинка и льняным маслом, она превращается в краску, которая отлично предохраняет от коррозии. Эта краска к тому же дешева, пластична, хорошо прилипает к поверхности металла и не отслаивается при температурных перепадах. Мышиный цвет скорее достоинство, чем недостаток. Изделия, которые покрывают такой краской, должны быть не марки и в то же время опрятны.
На свойствах цинка сильно сказывается степень его чистоты. При 99,9 и 99,99% чистоты цинк хорошо растворяется в кислотах. Но стоит “прибавить” еще одну девятку (99,999%), и цинк становится нерастворимым в кислотах даже при сильном нагревании. Цинк такой чистоты отличается и большой пластичностью, его можно вытягивать в тонкие нити. А обычный цинк можно прокатить в тонкие листы, лишь нагрев его до 100-150° С. Нагретый до 250° С и выше, вплоть до точки плавления, цинк опять становится хрупким - происходит очередная перестройка его кристаллической структуры.
Листовой цинк широко применяют в производстве гальванических элементов. Первый “вольтов столб” состоял из кружочков цинка и меди. И в современных химических источниках тока отрицательный электрод чаще всего делается из цинка.
Значительна роль этого элемента в полиграфии. Из цинка делают клише, позволяющие воспроизвести в печати рисунки и фотографии. Специально приготовленный и обработанный типографский цинк воспринимает фотоизображение. Это изображение в нужных местах защищают краской, и будущее клише протравливают кислотой. Изображение приобретает рельефность, опытные граверы подчищают его, делают оттиски, а потом эти клише идут в печатные машины.
К полиграфическому цинку предъявляют особые требования: прежде всего он должен иметь мелкокристаллическую структуру, особенно на поверхности слитка. Поэтому цинк, предназначенный для полиграфии, всегда отливают в закрытые формы. Для “выравнивания” структуры применяют отжиг при 375° С с последующим медленным охлаждением и горячей прокаткой. Строго лимитируют и присутствие в таком металле примесей, особенно свинца. Если его много, то нельзя будет вытравить клише так, как это нужно. Если же свинца меньше 0,4%, то трудно получить нужную мелкокристаллическую структуру. Вот по этой кромке и “ходят” металлурги, стремясь удовлетворить запросы полиграфии.
Цинк и сталь.
Как бы громко ни называли в наше время: “век полимеров”, “век полупроводников”, “атомный век” и так далее, по сути дела мы не вышли еще из века железного. Этот металл по-прежнему остается основой промышленности. По выплавке чугуна и стали и сейчас судят о мощи государства. А чугун и сталь подвержены коррозии, и, несмотря на значительные успехи, достигнутые человечеством в борьбе с “рыжим врагом”, коррозия ежегодно губит десятки миллионов тонн металла.
Нанесение на поверхность стали и чугуна тонких пленок коррозионностойких металлов - важнейшее средство защиты от коррозии. А на первом месте среди всех металлопокрытий - и по важности, и по масштабам - стоят покрытия цинковые. На защиту стали идет 40% мирового производства цинка!
Оцинкованные ведра, оцинкованная жесть на крышах домов - вещи настолько привычные, настолько будничные, что мы, как правило, не задумываемся, а почему, собственно, они оцинкованные, а не хромированные или никелированные? Если же такой вопрос возникает, то “железная логика” мигом выдает однозначный ответ: потому что цинк дешевле хрома и никеля. Но дело не в одной дешевизне.
Цинковое покрытие часто оказывается более надежным, нежели остальные, потому что цинк не просто механически защищает железо от внешних воздействий, он его химически защищает.
Кобальт, никель, кадмий, олово и другие металлы, применяемые для защиты железа от коррозии, в ряду активности металлов стоят после железа. Это значит, что они более стойки, чем железо. Цинк же и хром, наоборот, активнее железа. Хром в ряду активности стоит почти рядом с железом (между ними только галлий), а цинк - перед хромом.
Процессы атмосферной коррозии имеют электрохимическую природу и объясняются с электрохимических позиций. Но в принципе механизм защиты железа цинком состоит в том, что цинк - металл более активный - прежде, чем железо, реагирует с агрессивными компонентами атмосферы. То есть получается, что цинк выручает железо, сам погибая.
Вот как это происходит:
В присутствии влаги между железом и цинком образуется микрогальванопара, в которой цинк - анод. Именно он и будет разрушаться при возникшем электрохимическом процессе, сохраняя в неприкосновенности основной металл. Даже если покрытие нарушено - появилась, допустим, царапина, - эти особенности цинковой защиты и ее надежность остаются неизменными. Ведь и в такой ситуации действуют микрогальванопара, в которой цинк принесен в жертву, и, кроме того, обычно в процессе нанесения покрытия железо и цинк реагируют между собой. И чаще всего царапина оголяет не само железо, а интерметаллическое соединение железа с цинком, довольно устойчивое к действию влаги.
Существенен и состав продукта, образующегося при “самопожертвовании” цинка. Активный цинк реагирует с влагой воздуха и одновременно с содержащимся в нем углекислым газом. Образуется защитная пленка состава ZnCO3*Zn(OH)2, имеющая достаточную химическую стойкость, чтобы защитить от реакций и железо, и сам цинк. Но если цинк корродирует в среде, лишенной углекислоты, скажем, в умягченной воде парового котла, то пленка нужного состава образоваться не может, и в этом случае цинковое покрытие разрушается намного быстрее.
Как же наносят цинк на железо? Способов несколько. Поскольку цинк образует сплавы с железом, быстро растворяя его даже при невысоких температурах, можно наносить распыленный цинк на подготовленную стальную поверхность из специального пистолета. Можно оцинковывать сталь (это самый старый способ), просто окуная ее в расплавленный цинк. Кстати, плавится он при сравнительно низкой температуре (419,5° С). Есть, конечно, электролитические способы цинкования. Есть, наконец, метод шерардизации (по имени изобретателя), применяемый для покрытия небольших деталей сложной конфигурации, когда особенно важно сохранить неизменными размеры.
В герметически закрытом барабане детали, пересыпанные цинковой пылью, выдерживают в течение нескольких часов при 350-375° С. В этих условиях атомы цинка достаточно быстро диффундируют в основной материал; образуется железоцинковый сплав, слой которого не “ уложен” поверх детали, а “внедрен” в нее.
Сплавы.
Уже упоминалось, что история с цинком достаточно путана. Но одно бесспорно: сплав меди и цинка - латунь - был получен намного раньше, чем металлический цинк. Самые древние латунные предметы, сделанные примерно в 1500 году до н.э., найдены при раскопках в Палестине.
Приготовление латуни восстановлением особого камня - cadmeia (кадмия) углем в присутствии меди описано у Гомера, Аристотеля, Плиния Старшего. В частности Аристотель писал о добываемой Индии меди, которая “отличается от золота только вкусом”.
Действительно, в довольно многочисленной группе сплавов, носящих общее название латуней, есть один (Л-96, или томпак), по цвету почти неотличимый от золота. Между прочим, томпак содержит меньше цинка, чем большинство латуней: цифра за индексом Л означает процентное содержание меди. Значит, на долю цинка в этом сплаве приходится не больше 4%.
Можно предполагать, что металл из кадмеи и в древности добавляли в медь не только затем, чтобы осветлить ее. Меняя соотношение цинка и меди, можно получить многочисленные сплавы с различными свойствами. Не случайно латуни поделены на две большие группы - альфа- и бета-латуни. В первых цинка не больше 33%. Почему именно 33?
С увеличением содержания цинка пластичность латуни растет, но только до определенного предела: латунь с 33 и более процентами цинка при деформировании в холодном состоянии растрескивается, 33% Zn - рубеж роста пластичности, рубеж, за которым латунь становится хрупкой.
Впрочем, могло случиться что за основу классификации латуней взяли бы другой “порог” - все классификации условны, ведь и прочность латуней растет по мере увеличения в них содержания цинка, но тоже до определенного предела. Здесь предел иной - 47-50% Zn. Прочность латуни, содержащей 45% цинка, в несколько раз больше, чем сплава, отлитого из равных количеств цинка и меди.
Широкий диапазон свойств латуней объясняется прежде всего хорошей совместимостью меди и цинка: они образуют серию твердых сплавов с различной кристаллической структурой. Так же разнообразно и применение сплавов этой группы. Из латуней делают конденсаторные трубки и патронные гильзы, радиаторы и различную арматуру, множество других полезных вещей - всего не перечислить.
И что здесь особенно важно. Введенный в разумных пределах цинк всегда улучшает механические свойства меди (ее прочность, пластичность, коррозийную стойкость). И всегда при этом он удешевляет сплав - ведь цинк намного дешевле меди. Легирование делает сплав более дешевым - такое встретишь не часто.
Цинк входит и в состав другого древнего сплава на медной основе. Речь идет о бронзе. Это раньше делили четко: медь плюс олово - бронза, медь плюс цинк - латунь. Теперь “грани стерлись”. Например, сплав ОЦС-3-12-5 считается бронзой, но цинка в нем в четыре раза больше, чем олова.
До сих пор мы рассказывали только о защите цинком и о легировании цинком. Но есть и сплавы на основе этого элемента. Хорошие литейные свойства и низкие температуры плавления позволяют отливать из таких сплавов сложные тонкостенные детали. Даже резьбу под болты и гайки можно получать непосредственно при отливке, если имеешь дело со сплавами на основе цинка.
Растущий дефицит свинца и олова заставил металлургов искать рецептуры новых типографских и антифрикционных сплавов. Доступный, довольно мягкий и относительно легкоплавкий цинк, естественно, привлек внимание в первую очередь. Почти тридцать лет поисковых и исследовательских работ предшествовали появлению антифрикционных сплавов на цинковой основе. При небольших нагрузках они заметно уступают и баббитам и бронзам, но в подшипниках большегрузных автомобилей и железнодорожных вагонов, угледробилок и землечерпалок они стали вытеснять традиционные сплавы. И дело здесь не только в относительной дешевизне сплавов на основе цинка. Эти материалы прекрасно выдерживают большие нагрузки при больших скоростях в условиях, когда баббиты начинают выкрашиваться...
Коротко о соединениях цинка.
Еще при первых попытках выплавить цинк из руды у средневековых химиков получался белый налет, который в книгах того времени называли двояко: либо “белым снегом” (nix alba), либо “философской шерстью” (lana philosophica). Нетрудно догадаться, что это была окись цинка ZnO - вещество, которое есть в жилище каждого городского жителя наших дней.
Этот “снег”, будучи замешанным на олифе, превращается в цинковые белила - самые распространенные из всех белил. Окись цинка нужна не только для малярных дел, ею широко пользуются многие отрасли промышленности. Стекольная - для получения молочного стекла и (в малых дозах) для увеличения термостойкости обычных стекол. В резиновой промышленности и производстве линолеума окись цинка используют как наполнитель. Известная цинковая мазь на самом деле не цинковая, а оксиноцинковая. Препараты на основе ZnO эффективны при кожных заболеваниях.
Наконец, с кристаллической окисью цинка связана одна из самых больших научных сенсаций 20-х годов нашего века. В 1924 году один из радиолюбителей города Томска установил рекорд дальности приема. Детекторным приемником он в Сибири принимал передачи радиостанций Франции и Германии, причем слышимость была более отчетливой, чем у владельцев одноламповых приемников. Как это могло произойти? Дело в том, что детекторный приемник томского любителя был смонтирован по схеме сотрудника нижегородской радиолаборатории О.В. Лосева.
Лосев установил, что если в колебательный контур определенным образом включен кристалл окиси цинка, то последний будет усиливать колебания высокой частоты и даже возбуждать незатухающие колебания. В наши “веселые транзисторные дни” такое событие прошло бы почти незамеченным, но в 1924 году изобретение Лосева представлялось революционным. Вот что говорилось в редакционной статье американского журнала “Radio-News”, целиком посвященной работе нижегородского изобретателя: ”Изобретение О.В.Лосева из Государственной радиоэлектрической лаборатории в России делает эпоху, и теперь кристалл заменит лампу!” Автор статьи оказался провидцем: кристалл действительно заменил лампу; правда, это не лосевский кристалл окиси цинка, а кристаллы других веществ. Но, между прочим, среди широко применяемых полупроводниковых материалов есть соединения цинка. Это его селениды и теллуриды, антимод и арсенид.
Еще более важно применение некоторых соединений цинка, прежде всего его сульфида, для покрытия светящихся экранов телевизоров, осциллографов, рентгеновских аппаратов. Под действием коротковолнового излучения или электронного луча сернистый цинк приобретает способность светиться, причем эта способность сохраняется и после того, как прекратилось облучение.
Резерфорд, впервые столкнувшись с явлением послесвечения сернистого цинка, воспользовался им для подсчета вылетающих из ядра альфа-частиц. В несложном приборчике, спинтарископе, ударяясь об экран, покрытый сульфидом цинка, эти частицы высекали вспышку, видимую глазом. А если частицы падают на экран достаточно часто, то вместо вспышек появляется постоянное свечение.
Биологическая роль цинка.
Фармацевты и медики жалуют многие соединения цинка. Со времен Парацельса до наших дней в фармакопее значатся глазные цинковые капли (0,25%-ный раствор ZnSO4). Как присыпка издавна применяется цинковая соль стеариновой кислоты. Феносульфат цинка - хороший антисептик. Суспензия, в которую входят инсулин, протамин и хлорид цинка - новое эффективное средство против диабета, действующее лучше, чем чистый инсулин.
И вместе с тем многие соединения цинка, прежде всего его сульфат и хлорид, токсичны.
Цинк - один из важных микроэлементов. И в то же время избыток цинка для растений вреден.
Биологическая роль цинка двояка и не до конца выяснена. Установлено, что цинк - обязательная составная часть фермента крови, карбоангидразы. Этот фермент содержится в эритроцитах. Карбоангидраза ускоряет выделение углекислого газа в легких. Кроме того, она помогает превратить часть СО2 в ион НСО3, играющий важную роль в обмене веществ.
Но вряд ли только карбоангидразой ограничивается роль цинка в жизни животных и человека. И если бы было так, то трудно было бы объяснить токсичность соединений этого элемента.
Известно, что довольно много цинка содержится в яде змей, особенно гадюк и кобр. Но в то же время известно, что соли цинка специфически угнетают активность этих же самых ядов, хотя, как показали опыты, под действием солей цинка яды не разрушаются. Как объяснить такое противоречие? Считают, что высокое содержание цинка в яде - это то средство, которым змея от собственного яда защищается. Но такое утверждение еще требует строгой экспериментальной проверки. Ждут выяснения и многие тонкие детали общей проблемы “цинк и жизнь”...
Это интересно!
Бурундучная руда.
Наиболее распространенный минерал цинка - сфалерит, или цинковая обманка ZnS. Разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы этого элемента: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO*SiO2*h3O. На Алтае нередко можно встретить полосатую “бурундучную” руду - смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Не в ночь под Ивана Купалу.
По старинным преданиям, папоротник цветет лишь в ночь под Ивана Купалу, и охраняет этот цветок нечистая сила. В действительности папоротник как споровое растение не цветет вообще, но слова “папоротниковые цветы” можно встретить на страницах вполне серьезных научных журналов. Так называют характерные узоры цинковых покрытий. Эти узоры возникают благодаря специальным добавкам сурьмы (до 0,3%) или олова (до 0,5%), которые вводят в ванны горячего цинкования. На некоторых заводах “цветы” получают иначе, - прижимая горячий оцинкованный лист к рифленому транспортеру.
ref.repetiruem.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|