|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Аминокислоты в спорте. Реферат аминокислоты
Реферат - Аминокислоты - Химия
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой . Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в a-положении к карбоксильной группе.
Аминокислоты, как правило, входят в состав полимеров — белков. В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин (см. табл. 1).
Таблица 1
Незаменимые аминокислоты R-CHNh3 COOH
| Название (сокращение) | R |
| изолейцин (ile, ileu) | Ch4 Ch3 CH(CH)3 - |
| лейцин (leu) | (Ch4 )2 CHCh3 - |
| лизин (lys) | Nh3 Ch3 Ch3 Ch3 Ch3 - |
| метионин (met) | Ch4 SCh3 Ch3 - |
| фенилаланин (phe) | C6 H5 Ch3 - |
| треонин (thr) | Ch4 CH(OH)- |
| триптофан (try) | |
| валин (val) | (Ch4 )2 CH- |
| тирозин (tyr) |
Аминокислоты называют обычно как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко – с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтеза a -аминокислот заключается в аммонолизе a -галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
Этот метод можно модифицировать, получая a-бромзамещенную кислоту через малоновый эфир:
Ввести аминогруппу в эфир a-галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля ):
3. Из карбонильных соединений (синтез Штреккера ). Синтез a-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Реакции присоединения — отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота.

Химические свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные a-аминокислоты обладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина была условно приписана L -конфигурация, а a-углеродному атому (+)-серина — D -конфигурация. При этом, если проекция a-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R — внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты — справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство a-аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы, т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при b-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты — амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (- NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах — к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.

2. образование амидов по аминогруппе. При ацилировании аминогруппы a-аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из a-аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью. Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы — фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
www.ronl.ru
Доклад - Аминокислоты - Химия
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, является аминокислотой . Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в a-положении к карбоксильной группе.
Аминокислоты, как правило, входят в состав полимеров — белков. В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является также тирозин (см. табл. 1).
Таблица 1
Незаменимые аминокислоты R-CHNh3 COOH
| Название (сокращение) | R |
| изолейцин (ile, ileu) | Ch4 Ch3 CH(CH)3 - |
| лейцин (leu) | (Ch4 )2 CHCh3 - |
| лизин (lys) | Nh3 Ch3 Ch3 Ch3 Ch3 - |
| метионин (met) | Ch4 SCh3 Ch3 - |
| фенилаланин (phe) | C6 H5 Ch3 - |
| треонин (thr) | Ch4 CH(OH)- |
| триптофан (try) | |
| валин (val) | (Ch4 )2 CH- |
| тирозин (tyr) |
Аминокислоты называют обычно как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко – с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтеза a -аминокислот заключается в аммонолизе a -галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
Этот метод можно модифицировать, получая a-бромзамещенную кислоту через малоновый эфир:
Ввести аминогруппу в эфир a-галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля ):
3. Из карбонильных соединений (синтез Штреккера ). Синтез a-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Реакции присоединения — отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота.

Химические свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречаться в виде энантиомеров :
Было доказано, что почти все природные a-аминокислоты обладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина была условно приписана L -конфигурация, а a-углеродному атому (+)-серина — D -конфигурация. При этом, если проекция a-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R — внизу, у L -аминокислоты аминогруппа будет находиться слева, а у D -аминокислоты — справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.
Из рисунка видно, что L -аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство a-аминокислот, встречающихся в природе, относится к L -ряду. Их энантиоморфы, т.е. D -аминокислоты, синтезируются только микроорганизмами и называются «неприродными» аминокислотами .
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при b-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты — амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН ), так и основной (- NH 2 ) группы в одной и той же молекуле. В очень кислых растворах NH 2 -группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (биполярных ионов, внутренних солей ). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах — к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (in vitro ), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет -бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.

2. образование амидов по аминогруппе. При ацилировании аминогруппы a-аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из a-аминокислот, называются пептидами или полипептидами . Амидная связь в таких полимерах называется пептидной связью. Полипептиды с молекулярной массой не меньше 5000 называют белками . В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называется первичной структурой белка . Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называются вторичной структурой белков . Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называется третичной структурой белка . Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин ), состоящий из нескольких полноценных белковых субъединиц. Четвертичная структура определяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы — фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные (отношение меньше 10). К фибриллярным белкам относится коллаген , наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят название ферментов .
www.ronl.ru
Реферат - Аминокислоты - Химия
Аминокислоты
Любое соединение, которое содержитодновременно карбоксильную и аминогруппу, является аминокислотой.Однако, чаще этот термин применяется для обозначения карбоновых кислот,аминогруппа которых находится в a-положении к карбоксильной группе.
/>
Аминокислоты, как правило, входят всостав полимеров — белков. В природе встречается свыше 70 аминокислот,но только 20 играют важную роль в живых организмах. Незаменимыминазываются аминокислоты, которые не могут быть синтезированы организмом извеществ, поступающих с пищей, в количествах, достаточных для того, чтобыудовлетворить физиологические потребности организма. Незаменимые аминокислотыприводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотойявляется также тирозин (см. табл. 1).
Таблица 1
Незаменимыеаминокислоты R-CHNh3COOH
Название (сокращение) R изолейцин (ile, ileu)Ch4Ch3CH(CH)3-
лейцин (leu)(Ch4)2CHCh3-
лизин (lys)Nh3Ch3Ch3Ch3Ch3-
метионин (met)Ch4SCh3Ch3-
фенилаланин (phe)C6H5Ch3-
треонин (thr)Ch4CH(OH)-
триптофан (try)/>
валин (val)(Ch4)2CH-
тирозин (tyr)Аминокислоты называют обычно какзамещенные соответствующих карбоновых кислот, обозначая положение аминогруппыбуквами греческого алфавита. Для простейших аминокислот обычно применяютсятривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислотсвязана с расположением функциональных групп и со строением углеводородногоскелета. Молекула аминокислоты моет содержать одну или несколько карбоксильныхгрупп и в соответствии с этим аминокислоты различаются по основности. Также вмолекуле аминокислоты может находиться разное количество аминогрупп.
СПОСОБЫПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получитьоколо 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или двекислоты получаются в значительно больших количествах, чем остальные, и этикислоты удается выделить довольно легко – с помощью ионообменных смол.
2. Из галогензамещенных кислот. Одиниз наиболее распространенных методов синтеза a-аминокислот заключается в аммонолизе a-галогензамещенной кислоты, которуюобычно получают по реакции Геля-Фольгарда-Зелинского:
/>
Этот метод можно модифицировать,получая a-бромзамещенную кислоту черезмалоновый эфир:
/>
Ввести аминогруппу в эфир a-галогензамещенной кислоты можно спомощью фталимида калия (синтез Габриэля):
/>
3. Из карбонильных соединений (синтезШтреккера). Синтез a-аминокислотпо Штреккеру состоит в реакции карбонильного соединения со смесью хлоридааммония и цианистого натрия (это усовершенствование метода предложено Н.Д.Зелинским и Г.Л. Стадниковым).
/>
Реакции присоединения — отщепления сучастием аммиака и карбонильного соединения дают имин, который реагирует сцианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота.
/>
Химические свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречатьсяв виде энантиомеров:
/>
Было доказано, что почти всеприродные a-аминокислотыобладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина былаусловно приписана L-конфигурация,а a-углеродному атому (+)-серина — D-конфигурация. При этом, еслипроекция a-аминокислотыпо Фишеру написана так, что карбоксильная группа расположена сверху, а R — внизу, у L-аминокислоты аминогруппа будетнаходиться слева, а у D-аминокислоты- справа. Схема Фишера для определения конфигурации аминокислоты применима ковсем a-аминокислотам, обладающим хиральным a-углеродным атомом.
/>
Из рисунка видно, что L-аминокислота может бытьправовращающей (+) или левовращающей (-) в зависимости от природы радикала.Подавляющее большинство a-аминокислот,встречающихся в природе, относится к L-ряду. Их энантиоморфы, т.е. D-аминокислоты, синтезируются толькомикроорганизмами и называются «неприродными» аминокислотами.
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
/>
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле,могут быть любыми членами пары диастереомеров в зависимости от конфигурации приb-углеродном атоме. Ниже приводятсяправильные абсолютные конфигурации этих аминокислот.
/>
КИСЛОТНО-ОСНОВНЫЕСВОЙСТВА АМИНОКИСЛОТ
Аминокислоты — амфотерные вещества,которые могут существовать в виде катионов или анионов. Это свойствообъясняется наличием как кислотной (-СООН), так и основной (-Nh3) группы в одной и той же молекуле. Вочень кислых растворах Nh3-группа кислоты протонируется и кислота становится катионом. Всильнощелочных растворах карбоксильная группа аминокислоты депротонируется икислота превращается в анион.
В твердом состоянии аминокислотысуществуют в виде цвиттер-ионов (биполярных ионов, внутренних солей).В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
/>
Если поместить аминокислоту в среду,обладающую проводимостью, и опустить туда пару электродов, то в кислыхрастворах аминокислота будет мигрировать к катоду, а в щелочных растворах — каноду. При некотором значении рН, характерном для данной аминокислоты, она небудет передвигаться ни к аноду, ни к катоду, так как каждая молекула находитсяв виде цвиттер-иона (несет и положительный, и отрицательный заряд). Этозначение рН называется изоэлектрической точкой (pI) данной аминокислоты.
РЕАКЦИИАМИНОКИСЛОТ
Большинство реакций, в которыеаминокислоты вступают в лабораторных условиях (invitro), свойственны всем аминам иликарбоновым кислотам.
1. образование амидов покарбоксильной группе. При реакции карбонильной группы аминокислоты саминогруппой амина параллельно протекает реакция поликонденсации аминокислоты,приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппукислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. Сэтой целью используют карбобензоксихлорид (карбобензилоксихлорид,бензилхлорформиат), трет-бутоксикарбоксазид и др. Для реакции с аминомкарбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитнуюгруппу затем удаляют путем каталитического гидрогенолиза или действиемхолодного раствора бромистого водорода в уксусной кислоте.
/>
2. образование амидов по аминогруппе.При ацилировании аминогруппы a-аминокислоты образуется амид.
/>
Реакция лучше идет в основной среде,так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров.Карбоксильная группа аминокислоты легко этерифицируется обычными методами.Например, метиловые эфиры получают, пропуская сухой газообразный хлористыйводород через раствор аминокислоты в метаноле:
/>
Аминокислоты способны кполиконденсации, в результате которой образуется полиамид. Полиамиды, состоящиеиз a-аминокислот, называются пептидамиили полипептидами. Амидная связь в таких полимерах называется пептиднойсвязью. Полипептиды с молекулярной массой не меньше 5000 называют белками.В состав белков входит около 25 различных аминокислот. При гидролизе данногобелка могут образовываться все эти аминокислоты или некоторые из них вопределенных пропорциях, характерных для отдельного белка.
Уникальная последовательностьаминокислотных остатков в цепи, присущая данному белку, называется первичнойструктурой белка. Особенности скручивания цепей белковых молекул(взаимное расположение фрагментов в пространстве) называются вторичнойструктурой белков. Полипептидные цепи белков могут соединяться между собойс образованием амидных, дисульфидных, водородных и иных связей за счет боковыхцепей аминокислот. В результате этого происходит закручивание спирали в клубок.Эта особенность строения называется третичной структурой белка.Для проявления биологической активности некоторые белки должны сначалаобразовать макрокомплекс (олигопротеин), состоящий из несколькихполноценных белковых субъединиц. Четвертичная структураопределяет степень ассоциации таких мономеров в биологически активномматериале.
Белки делятся на две большие группы — фибриллярные (отношение длины молекулы к ширине больше 10) и глобулярные(отношение меньше 10). К фибриллярным белкам относится коллаген,наиболее распространенный белок позвоночных; на его долю приходится почти 50%сухого веса хрящей и около 30% твердого вещества кости. В большинстверегуляторных систем растений и животных катализ осуществляется глобулярнымибелками, которые носят название ферментов.
www.ronl.ru
Реферат Аминокислоты
скачатьРеферат на тему:

План:
- Введение
- 1 Физические свойства
- 2 Общие химические свойства
- 3 Оптическая изомерия
- 4 D-аминокислоты в живых организмах
- 5 Открытие аминокислот в составе белков
- 6 Протеиногенные аминокислоты
- 6.1 Таблица протеиногенных аминокислот
- 6.2 Классификация протеиногенных аминокислот
- 6.2.1 По R-группам
- 6.2.2 По функциональным группам
- 6.2.3 По классам аминоацил-тРНК-синтетаз
- 6.2.4 По путям биосинтеза
- 6.2.5 По способности организма синтезировать из предшественников
- 6.2.6 По характеру катаболизма у животных
- 6.3 «Миллеровские» аминокислоты
- 7 Родственные соединения
Введение

Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа Nh3, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре).
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
1. Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
2. Общие химические свойства
- Аминокислоты могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы -COOH, так и основные свойства, обусловленные аминогруппой -Nh3. Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -Nh4+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
- Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-66.
- Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
- Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
3. Оптическая изомерия
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
4. D-аминокислоты в живых организмах
Оптические изомеры аминокислот претерпевают медленную самопроизвольную неферментативную рацемизацию. Например, в белке дентине (входит в состав зубов) L-аспартат переходит в D-форму со скоростью 0,1 % в год, что может быть использовано для определения возраста биологических объектов.
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
5. Открытие аминокислот в составе белков
Источник: Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
| Глицин | 1820 | Желатина | А. Браконно |
| Лейцин | 1820 | Мышечные волокна | А. Браконно |
| 1839 | Фибрин шерсти | Г. Мульдер | |
| Тирозин | 1848 | Казеин | Ф. Бопп |
| Серин | 1865 | Шелк | Э. Крамер |
| Глутаминовая кислота | 1866 | Растительные белки | Г. Риттхаузен |
| Аспарагиновая кислота | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен |
| Фенилаланин | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | 1888 | Фиброин шелка | Т. Вейль |
| Лизин | 1889 | Казеин | Э. Дрексель |
| Аргинин | 1895 | Вещество рога | С. Гедин |
| Гистидин | 1896 | Стурин, гистоны | А. Кессель, С. Гедин |
| Цистин | 1899 | Вещество рога | К. Мёрнер |
| Валин | 1901 | Казеин | Э. Фишер |
| Пролин | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | 1902 | Желатина | Э. Фишер |
| Триптофан | 1902 | Казеин | Ф. Гопкинс, Д. Кол |
| Изолейцин | 1904 | Фибрин | Ф. Эрлих |
| Метионин | 1922 | Казеин | Д. Мёллер |
| Треонин | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | 1925 | Белки рыб | С. Шрайвер и др. |
6. Протеиногенные аминокислоты
См. статью: БелкиВ процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-ая и 22-ая аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
6.1. Таблица протеиногенных аминокислот
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
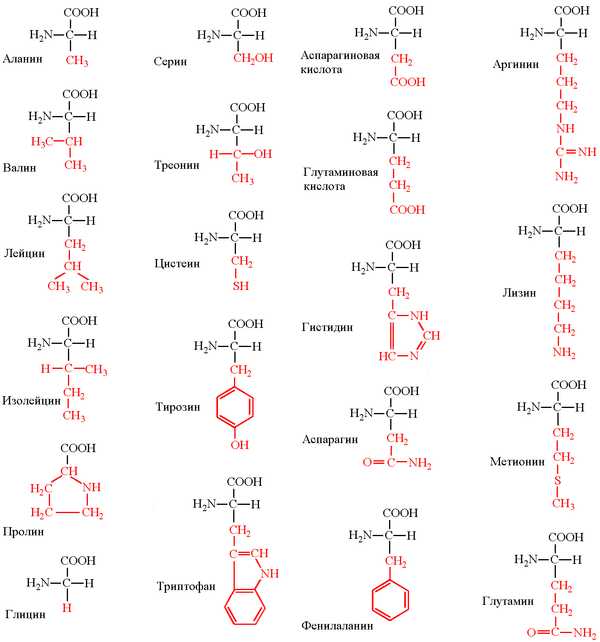
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
| Глицин | Gly | G | Glycine | Гли |
| Аланин | Ala | A | Alanine | Ала |
| Валин | Val | V | Valine | Вал |
| Изолейцин | Ile | I | Isoleucine | Иле |
| Лейцин | Leu | L | Leucine | Лей |
| Пролин | Pro | P | Proline | Про |
| Серин | Ser | S | Serine | Сер |
| Треонин | Thr | T | Treonine | Тре |
| Цистеин | Cys | C | Cysteine | Цис |
| Метионин | Met | M | Methionine | Мет |
| Аспарагиновая кислота | Asp | D | asparDic acid | Асп |
| Аспарагин | Asn | N | asparagiNe | Асн |
| Глутаминовая кислота | Glu | E | gluEtamic acid | Глу |
| Глутамин | Gln | Q | Q-tamine | Глн |
| Лизин | Lys | K | before L | Лиз |
| Аргинин | Arg | R | aRginine | Арг |
| Гистидин | His | H | Histidine | Гис |
| Фенилаланин | Phe | F | Fenylalanine | Фен |
| Тирозин | Tyr | Y | tYrosine | Тир |
| Триптофан | Trp | W | tWo rings | Три |
6.2. Классификация протеиногенных аминокислот
6.2.1. По R-группам
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин
6.2.2. По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
6.2.3. По классам аминоацил-тРНК-синтетаз
валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
6.2.4. По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
6.2.5. По способности организма синтезировать из предшественников
Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин, тирозин.
Деление аминокислот на заменимые и незаменимые не лишено своих недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
6.2.6. По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
6.3. «Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
7. Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
wreferat.baza-referat.ru
Реферат - Аминокислоты и их свойства
Реферат - Аминокислоты и их свойстваскачать (663.5 kb.)Доступные файлы (1):n1.doc
Министерство общего и профессионального образования РФ
Башкирский Государственный Университет
Реферат
«АМИНОКИСЛОТЫ
и их свойства»
| Выполнила: студентка II курса гр. А биол. ф-та БашГУ |
| Ильясова А.А. |
| Проверил: д.б.н., проф. |
| Ямалеева А.А. |
Уфа-2007
Содержание
| Введение…………………………………………………………………… | 3 |
| 1. Общие химические свойства…………………………………………… | 4 |
| 2. Изомерия………………………………………………………………… | 5 |
| 3. ?-Аминокислоты белков………………………………………………... | 6 |
| 3.1. Классификация стандартных аминокислот по R-группам………………… | 6 |
| 3.2. Классификация стандартных аминокислот по функциональным группам. | 9 |
| 4. Кислотно-основное равновесие в растворе ?-аминокислот………….. | 10 |
| 5. Некоторые химические свойства ?-аминокислот ……………………. | 13 |
| Заключение…………………………………………………………………. | 16 |
| Список использованной литературы…………………………………….. | 16 |
Введение
По современным данным, биомасса единовременно живущих на Земле организмов составляет 1,8·1012-2,4·1012 т в пересчете на сухое вещество. В организмах, составляющих биомассу Земли, обнаружено свыше 60 химических элементов. Среди них условно выделяют группу элементов, встречающихся в составе любого организма. К их числу относят C, N, H, O, S, P, Na, K, Са, Mg, Zn, Fe, Mn и др. Первым шести элементам приписывают исключительную роль в биосистемах, так как из них построены важнейшие соединения, составляющие основу живой материи – белки, нуклеиновые кислоты, углеводы, липиды и др.
Примерно 75% биомассы составляет вода. Вторым же по количественному содержанию в биологических объектах, но, несомненно, первым и главным по значению классом соединений являются белки. Белки состоят из мономерных единиц, т.е. аминокислот.
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
В данной работе мы рассмотрим общие химические свойства аминокислот, их изомерию, классификации ?-аминокислот, а также некоторые химические свойства.
Общие химические свойства
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -Nh4+, а карбоксигруппа — в виде -COO-. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
2) Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-6.
3) Изоэлектрической точкой аминокислоты называют pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
4) Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Изомерия
Рис.1. Конфигурация ?-аминокислот
Все природные аминокислоты, входящие в состав белков, относятся именно к L-ряду.
Данную особенность «живых» аминокислот трудно объяснить, так как в реакциях между оптически неактивными веществами или рацематами (из которых, видимо, состояла древняя Земля) L и D-формы образуются в одинаковых количествах. Креационисты, естественно, могут объяснить это божьим умыслом, остальным же приходится считать, что это — просто результат случайного стечения обстоятельств: самая первая молекула, с которой смог начаться матричный синтез, была оптически активной, а других пригодных молекул почему-то не образовалось.
Оптические изомеры аминокислот претерпевают медленную самопроизвольную неферментативную рацемизацию. Например, в белке дентине (входит в состав зубов) L-аспартат переходит в D-форму со скоростью 0,1% в год, что может быть использовано для определения возраста биологических объектов.
3. -Аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 важнейших ?-аминокислот, кодируемых генетическим кодом.
|
|
По физиологическому признаку аминокислоты делятся на незаменимые – те аминокислоты, которые не синтезируются в организме человека и высших млекопитающих (Val, Leu, Ile, Thr, Met, Lys, Phe, Trp), полузаменимые – те аминокислоты, которые синтезируются в организме человека, но в недостаточном количестве (Arg, Tyr, His) и обычные – те аминокислоты., которые синтезируются во всех организмах (все остальные).
3.1. Классификация стандартных аминокислот по R-группам
Таким образом, -аминокислоты различаются лишь строением радикала R, который называют боковым радикалом или боковой группой. Поскольку с точки зрения абсолютной R,S-стереохимической номенклатуры боковой радикал всегда имеет меньшее старшинство, чем карбоксильная и аминогруппа, все L-аминокислоты имеют S-конфигурацию при -атоме. В зависимости от строения бокового радикала аминокислоты подразделяют на неполярные (содержат неполярный гидрофобный радикал), полярные не заряженные и полярные заряженные (содержат полярный гидрофильный боковой остаток). Часто в отдельную группу выделяют ароматические аминокислоты (фенилаланин, тирозин, триптофан и гистидин).- Неполярные: аланин, валин, изолейцин, лейцин, метионин, пролин, триптофан, фенилаланин
- Полярные незаряженные: аспарагин, глицин, глутамин, серин, тирозин, треонин, цистеин
- Заряженные отрицательно при pH=7: аспарагиновая кислота, глутаминовая кислота
- Заряженные положительно при pH=7: аргинин, гистидин, лизин
НЕПОЛЯРНЫЕ АМИНОКИСЛОТЫ
ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ
ЗАРЯЖЕННЫЕ АМИНОКИСЛОТЫ
Рис.2. Наиболее распространенные ?-аминокислоты
Сразу следует указать, что в нейтральных растворах все аминокислоты ионизованы (то есть, заряжены). Приведенный выше термин «заряженные аминокислоты» относится исключительно к боковому радикалу аминокислоты и отражает тот факт, что в боковом радикале содержится функциональная группа, которая либо теряет протон при рH, близком к 7, (отрицательно заряженные аминокислоты), либо, наоборот, присоединяет (положительно заряженные аминокислоты).
Из 20 -аминокислот, приведенных на Рис. 2 , 17 обладают одним хиральным центром (то есть, могут существовать в виде двух энантиомеров), одна ахиральна (глицин) и две имеют два хиральных центра (изолейцин и треонин). Каждая из этих двух аминокислот может существовать в виде четырех стереоизомеров. Рассмотрим стереохимию и номенклатуру этих соединений на примере треонина (Рис. 2).
Рис. 2. Стереоизомеры треонина
Встречающийся в белках L-треонин является (2-S, 3 R)-стереоизомером. Его энантиомер называют D треонином. Для обозначения их диастереомеров используют приставку «алло» (алло по-гречески означает другой).
3.2. Классификация стандартных аминокислот по функциональным группам
- Алифатические
- Моноаминомонокарбоновые: аланин, валин, глицин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота, за счёт второй карбоксильной группы имеют несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: аргинин, гистидин, лизин, несут в растворе положительный заряд
- Серусодержащие: цистеин (цистин), метионин
- Ароматические: фенилаланин, тирозин
- Гетероциклические: триптофан, гистидин, пролин (также входит в группу иминокислот)
- Иминокислоты: пролин (также входит в группу гетероциклических)
4. Кислотно-основное равновесие в растворе -аминокислот
-Аминокислоты обладают как минимум двумя ионогеннными группами — карбоксилом и аминогруппой. Поскольку атом азота и двойная связь C=O разделены двумя ординарными связями, сопряжение карбоксильной группы со свободной электронной парой азота невозможно по пространственным соображениям. Взаимное влияние функциональных групп может осуществляться только по механизму индуктивного эффекта. Поскольку аминогруппа проявляет –I-эффект, который существенно увеличивается при протонировании, она должна повышать кислотность карбоксила.Рис. 3. Кислотно-основное равновесие в растворе ? аминокислот
В свою очередь, неионизованная карбоксильная группа (–I-эффект) должна понижать основность аминогруппы, а ионизованный карбоксил за счет сильного +I-эффекта будет усиливать основные свойства Nh3-группы.
В сильно кислой среде -аминокислоты существуют в виде двухосновной кислоты (катион на Рис. 3). В сильно щелочной среде будет преобладать анион. В нейтральных средах могут присутствовать две незаряженные формы — нейтральная и биполярная (последнюю часто называют цвиттер-ионом). Соотношение нейтральной и биполярной форм определяется относительной силой двух кислотных группировок катиона (-COOH и Nh4+). Чем больше кислотность карбоксильной группы по сравнению с аммонийной (или чем основнее аминогруппа по сравнению с карбоксилат-анионом), тем сильнее равновесие сдвинуто в сторону цвиттер-иона.
-Аминокислоты в нейтральных средах существуют практически полностью в виде цвиттер-иона.
Характеристическое значение рH, при котором концентрация цвиттер-иона максимальна называют изоэлектрической точкой (pI).. Поскольку в целом молекула цвиттер-иона электронейтральна, электропроводность раствора в такой точке будет минимальной, а молекула аминокислоты не будет смещаться в электрическом поле.
При отсутствии ионизирующихся групп в боковом радикале изоэлектрическая точка лежит при pH, численно равном среднему арифметическому двух величин pKэфф.
В Табл. 1 приведены величины pKэфф и pI некоторых аминокислот.
Табл. 1. Экспериментально измеренные pK и изоэлектрические точки -аминокислот
| Аминокислота | pKэфф | pI | ||
| COOH | -Nh3 | Боковая группа | ||
| Aланин | 2,3 | 9,9 | – | 6,0 |
| Аргинин | 1,8 | 9,0 | 12,5 | 11,2 |
| Аспарагин | 2,0 | 8,8 | – | 5,4 |
| Аспарагиновая кислота | 2,0 | 10,0 | 3,9 | 2,8 |
| Валин | 2,3 | 9,6 | – | 6,0 |
| Гистидин | 1,8 | 9,2 | 6,0 | 7,5 |
| Глицин | 2,4 | 9,8 | – | 6,0 |
| Глутамин | 2,2 | 9,1 | – | 5,7 |
| Глутаминовая кислота | 2,2 | 9,7 | 4,3 | 3,2 |
| Изолейцин | 2,4 | 9,7 | – | 6,0 |
| Лейцин | 2,4 | 9,6 | – | 6,0 |
| Лизин | 2,2 | 9,2 | 10,8 | 9,6 |
| Метионин | 2,3 | 9,2 | – | 5,7 |
| Пролин | 2,0 | 10,6 | – | 6,3 |
| Серин | 2,1 | 9,2 | – | 5,7 |
| Тирозин | 2,2 | 9,1 | 10,9 | 5,7 |
| Треонин | 2,6 | 10,4 | – | 5,6 |
| Триптофан | 2,4 | 9,4 | – | 5,9 |
| Фенилаланин | 1,8 | 9,1 | – | 5,5 |
| Цистеин | 1,8 | 10,8 | 8,3 | 5,1 |
5. Некоторые химические свойства -аминокислот
Химические свойства -аминокислот в основном определяются поведением содержащихся в них функциональных групп — карбоксильной группы, аминогруппы и функциональной группы бокового радикала (коль скоро таковая присутствует). Здесь мы остановимся на химических особенностях, интересных с биохимической точки зрения.Для обнаружения небольших количеств аминокислот наиболее широко используется нингидриновая реакция (Рис. 4).
При нагревании аминокислот с избытком нингидрина образуется продукт лилового цвета, если аминокислота содержит свободную -аминогруппу, и желтый продукт, если, как у пролина, ее аминогруппа защищена. Этот метод обладает высокой чувствительностью и используется как для качественного, так и для количественного (колориметрического) определения аминокислот.
Рис. 4. Нингидриновая реакция, используемая для обнаружения и количественного определения ? аминокислот. Атомы аминокислоты отмечены жирным шрифтом. Пигмент содержит две молекулы нингидрина и атом азота аминокислоты
Для определения аминокислотной последовательности пептидов важное значение имеет реакция аминокислот с 1 фтор-2,4-динитробензолом (Рис. 5).
Рис. 5. Образование 2,4-динитрофенильных производных аминокислот
SH-Группа цистеина чрезвычайно легко в окислительных условиях образует S–S-связь (Рис. 6).
Рис. 6. Цистеин и цистин. Образование S–S-мостиков. В белках встречается как цистин, так и цистеинЭта реакция проходит уже в присутствии газообразного кислорода. Обратная реакция легко протекает под действием даже слабых восстановителей. Образование S–S-связей играет важную роль в организации третичной структуры белка.
Отметим, что все -аминокислоты, входящие в состав белков, имеют атом водорода у углеродного атома. Это очень важная особенность, на которой основан метаболизм аминокислот в живых организмах.
Заключение
Аминокислоты – это «кирпичики», из которых построены молекулы важнейших биополимеров – белков. Многообразие функций, осуществляемых белками в живых организмах, определяется их химической структурой и физико-химическими свойствами.
Для понимания строения и свойств аминокислот, которые являются соединениями со смешанными функциями и проявляют как свойства карбоновых кислот, так и свойства аминов, необходимо изучение и азотсодержащих органических соединений, и карбоновых кислот.Список использованных материалов
1. Дюга Т., Пенни К.. Биоорганическая химия. М.: Мир, 1983.
2. Ленинджер А.. Основы биохимии. М.: Мир, 1985. – Т.1-3.
3. Марри Р., Греннер Д., Мейес П., Родуэл В.. Биохимия человека. М.: Мир, 1993. – Т.1-3.
4. Мецлер Д.. Биохимия. М.: Мир, 1980. – Т.1-3.
5. Страйер Л.. Биохимия. М.: Мир, 1985. – Т.1-3.
6. Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1985.
nashaucheba.ru
Реферат - Аминокислоты в спорте
Аминокислоты в спортеРоль аминокислот в спорте и для жизни вообще трудно переоценить. Ведь аминокислоты это и «кирпичики» всего живого, и регуляторы всех биохимических процессов, происходящих в живом организме.
Дефицит аминокислот неминуемо приводит к серьезнейшим нарушениям здоровья. Особенно чувствительны к такому дефициту спортсмены, которым эти самые «кирпичики» нужны для строительства и обновления мышечной ткани, для нормальной и четкой работы всех органов и систем организма. До 75 % чистого веса клеток, в том числе и мышц- это протеин, который состоит из различных комбинаций аминокислот. Кроме этого и гормоны (тестостерон, гормон роста, инсулин), и ферменты – тоже в большей степени построены из аминокислот.
^ Существуют заменимые и незаменимые аминокислоты
Заменимые - это те, которые могут синтезироваться нашим организмом из расщепленного путем переваривания белка. Однако для спортсменов, имеющих цель побыстрее нарастить мышцы, даже такие аминокислоты рекомендуется принимать в виде дополнительных комплексов. Особенно это нужно тем, кому нужна так называемая «сухая» мышечная масса.
Примером таких комплексов может служить АМИНО 2222 от Optimum Nutrition (США). В составе этого комплекса 22 аминокислоты. Важным моментом является то, что аминокислоты в подобных комплексам находятся в «свободном» виде. Аминокислоты в свободной форме - это те аминокислоты, которые содержат очищенные или кристаллические аминокислоты. Это аминокислоты, которые уже изначально «переварены», точнее расщеплены синтетическим путем. Они требуют меньше энергозатрат для усвоения и гораздо быстрее используются организмом. Комбинации заменимых и незаменимых аминокислот в этих комплексах оказывают на организм специфическое действие, повышая выносливость, силу, дополнительно стимулируют рост мышечной массы.
Незаменимые – это аминокислоты, которые не могут синтезироваться нашим организмом и обязательно требуется поступление их извне с пищей. Таких аминокислот всего 8: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Мало того, что из этих аминокислот наши мышцы состоят по весу примерно на 35% - их организм может использоваться в качестве источника энергии.
В спортивном питании, вернее в выпускаемых многими знаменитыми в мире производителями добавках для спортивного питания, существует множество аминокислотных комплексов с разными составами. Каждый комплекс уникален и является плодом серьезных научных исследований и клинических испытаний. Например, так называемый «азот» (т.к. способствует производству в организме оксида азота и, соответственно, стимулирует синтез белка) в виде таких продуктов, как Nitrix и NO-Xplode от BSN (США) – это не что иное, как аминокислоты аргинин, тирозин и таурин, плюс креатиновый комплекс и минералы. То есть действие удивительной формулы, составленной при участии знаменитого чемпиона мира Ронни Колемана - основано все на тех же аминокислотах. Весь секрет успеха только в правильных синергических сочетаниях ингредиентов.
Поэтому рассмотрим самые часто используемые в спортивных добавках аминокислоты, которые в разных сочетаниях можно найти в большинстве запатентованных продуктов различных фирм, выпускающих спортивное питание.
Глютамин
В американских и европейских клиниках эту аминокислоту принимают как лекарство и прописывают пациентам, пострадавшим от стресса или травмы . Исследования показывают, что прием глютамина имеет мощный антикатаболический эффект, что способствует быстрому восстановлению и исчезновению мышечных болей после нагрузки. Глютамин также - одна из немногих аминокислот, способствующих повышенной выработке гормона роста. Прием 2 граммов глютамина приводит к четырехкратному увеличению выработки гормона роста в организме человека.
Аргинин
Обладает способностью увеличивать в организме выработку оксида азота, что стимулирует синтез белка и рост мышечной ткани. Так же доказано его положительное влияние на выработку гормона роста у людей. Является мощным сосудорасширяющим действием, улучшает коронарное кровообращение (может применяться при гипертонии и стенокардии). Так же используется в сексологии для улучшения эректильной функции у мужчин.
Таурин
Содержание таурина в свободной форме в мышечной ткани очень велико - по этому показателю таурин уступает лишь глютамину. К примеру, он оказывает действие, сходное с инсулином, и способен усиливать метаболизм глюкозы и аминокислот. Таурин способствует метаболизму белка и особенно препятствует его разрушению при физических нагрузках. В медицине используется для улучшения зрения, в кардиологии для лечения гипертонии и кардиомиопатии, для улучшения мозгового кровообращения.
^ Валин, лейцин, изолейцин (ВСАА)
Эти аминокислоты объединены в группу потому, что все они обладают разветвленными цепочками и имеют схожие функции – способствуют быстрой регенерации и производству мышечных белков, особенно при критических нагрузках. Кроме этого они заметно повышают энергетику организма спортсмена.
^ Метионин, глицин
Обладают свойствами противостоять усталости, способствуют восстановлению после нагрузок и болезни, помогают заживлять раны и снимают интоксикацию организма, улучшают метаболизм мозга и являются антидепрессантами. Кроме того - эти две аминокислоты вместе с аргинином являются сырьем для производства в нашем организме креатина фосфата, а это главное мышечное «топливо». Метионин еще участвует в переработке жиров, предотвращая их отложение в печени и в стенках артерий.
Лизин
Эффективен для профилактики и лечения атеросклероза в сочетании с витамином С. Подавляет ряд вирусов (особенно гепреса). Стимулирует иммунитет. В спорте важно, что лизин противодействует развитию утомления и способствует усвоению кальция и восстановлению костных и соединительных тканей.
Орнитин
Способствует секреции гормона соматотропина и участвует в метаболизме мышечной ткани. Действует как гепатопротектор (защитник печени). Помогает в детоксикации организма от аммиака, что способствует восстановлению после тяжелой физической нагрузки.
Тирозин
Нормализует работу щитовидной железы. Повышает жизненную силу и настроение. Помогает организму противостоять стрессу.
Триптофан
Антидепрессант. Успокаивает и нормализует сон. Снимает вялость и усталость. Снижает излишний аппетит, обусловленный стрессовыми реакциями и, поэтому, используется в том числе в программах похудения.
Карнитин
Известен спортсменам как L-карнитин. Способствует энергообразованию. Улучшает сократительную способность миокарда и обладает антиаритмическим действием. Регулирует липидный состав крови. Является самым сильным липотропным жиросжигателем.
В итоге можно сделать простой вывод, что аминокислоты полезны всем людям без исключения!
Доктор А.В. Левдиков
www.ronl.ru
Реферат: Аминокислоты
Любое соединение, которое содержит одновременно карбоксильную и аминогруппу, являетсяаминокислотой. Однако, чаще этот термин применяется для обозначения карбоновых кислот, аминогруппа которых находится в a-положении к карбоксильной группе.
Аминокислоты, как правило, входят в состав полимеров -белков. В природе встречается свыше 70 аминокислот, но только 20 играют важную роль в живых организмах.Незаменимыминазываются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма. Незаменимые аминокислоты приводятся в табл. 1. Для больных фенилкетонурией незаменимой аминокислотой является такжетирозин(см. табл. 1).
Таблица 1
Незаменимые аминокислотыR-CHNh3COOH
| Название (сокращение) | R |
| изолейцин (ile, ileu) | Ch4Ch3CH(CH)3- |
| лейцин (leu) | (Ch4)2CHCh3- |
| лизин (lys) | Nh3Ch3Ch3Ch3Ch3- |
| метионин (met) | Ch4SCh3Ch3- |
| фенилаланин (phe) | C6H5Ch3- |
| треонин (thr) | Ch4CH(OH)- |
| триптофан (try) | |
| валин (val) | (Ch4)2CH- |
| тирозин (tyr) |
Аминокислоты называют обычно как замещенные соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита. Для простейших аминокислот обычно применяются тривиальные названия (глицин, аланин, изолейцин и т.д.). Изомерия аминокислот связана с расположением функциональных групп и со строением углеводородного скелета. Молекула аминокислоты моет содержать одну или несколько карбоксильных групп и в соответствии с этим аминокислоты различаются по основности. Также в молекуле аминокислоты может находиться разное количество аминогрупп.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1. Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко – с помощью ионообменных смол.
2. Из галогензамещенных кислот. Один из наиболее распространенных методов синтезаa-аминокислот заключается в аммонолизеa-галогензамещенной кислоты, которую обычно получают по реакции Геля-Фольгарда-Зелинского:
Этот метод можно модифицировать, получая a-бромзамещенную кислоту через малоновый эфир:
Ввести аминогруппу в эфир a-галогензамещенной кислоты можно с помощью фталимида калия (синтез Габриэля):
3. Из карбонильных соединений (синтез Штреккера). Синтез a-аминокислот по Штреккеру состоит в реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия (это усовершенствование метода предложено Н.Д. Зелинским и Г.Л. Стадниковым).
Реакции присоединения - отщепления с участием аммиака и карбонильного соединения дают имин, который реагирует с цианистым водородом, образуя a-аминонитрил. В результате его гидролиза образуется a-аминокислота.

Химические свойства аминокислот
Все a-аминокислоты, кроме глицина, содержат хиральный a-углеродный атом и могут встречаться в видеэнантиомеров:
Было доказано, что почти все природные a-аминокислоты обладают одной и той же относительной конфигурацией при a-углеродном атоме. a-Углеродному атому (-)-серина была условно приписанаL-конфигурация, а a-углеродному атому (+)-серина -D-конфигурация. При этом, если проекция a-аминокислоты по Фишеру написана так, что карбоксильная группа расположена сверху, а R - внизу, уL-аминокислоты аминогруппа будет находиться слева, а уD-аминокислоты - справа. Схема Фишера для определения конфигурации аминокислоты применима ко всем a-аминокислотам, обладающим хиральным a-углеродным атомом.
Из рисунка видно, чтоL-аминокислота может быть правовращающей (+) или левовращающей (-) в зависимости от природы радикала. Подавляющее большинство a-аминокислот, встречающихся в природе, относится кL-ряду. Ихэнантиоморфы, т.е.D-аминокислоты, синтезируются только микроорганизмами и называются«неприродными» аминокислотами.
Согласно номенклатуре (R,S), большинство «природных» или L-аминокислот имеет S-конфигурацию.
L-Изолейцин и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при b-углеродном атоме. Ниже приводятся правильные абсолютные конфигурации этих аминокислот.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН), так и основной (-Nh3) группы в одной и той же молекуле. В очень кислых растворахNh3-группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в видецвиттер-ионов(биполярных ионов, внутренних солей). В цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе:
Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах - к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к аноду, ни к катоду, так как каждая молекула находится в виде цвиттер-иона (несет и положительный, и отрицательный заряд). Это значение рН называетсяизоэлектрической точкой(pI) данной аминокислоты.
РЕАКЦИИ АМИНОКИСЛОТ
Большинство реакций, в которые аминокислоты вступают в лабораторных условиях (invitro), свойственны всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат),трет-бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом.Защитную группузатем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.

2. образование амидов по аминогруппе. При ацилировании аминогруппы a-аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из a-аминокислот, называютсяпептидамиилиполипептидами. Амидная связь в таких полимерах называетсяпептиднойсвязью. Полипептиды с молекулярной массой не меньше 5000 называютбелками. В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Уникальная последовательность аминокислотных остатков в цепи, присущая данному белку, называетсяпервичной структурой белка. Особенности скручивания цепей белковых молекул (взаимное расположение фрагментов в пространстве) называютсявторичной структурой белков. Полипептидные цепи белков могут соединяться между собой с образованием амидных, дисульфидных, водородных и иных связей за счет боковых цепей аминокислот. В результате этого происходит закручивание спирали в клубок. Эта особенность строения называетсятретичной структурой белка. Для проявления биологической активности некоторые белки должны сначала образовать макрокомплекс (олигопротеин), состоящий из нескольких полноценных белковых субъединиц.Четвертичная структураопределяет степень ассоциации таких мономеров в биологически активном материале.
Белки делятся на две большие группы -фибриллярные(отношение длины молекулы к ширине больше 10) иглобулярные(отношение меньше 10). К фибриллярным белкам относитсяколлаген, наиболее распространенный белок позвоночных; на его долю приходится почти 50% сухого веса хрящей и около 30% твердого вещества кости. В большинстве регуляторных систем растений и животных катализ осуществляется глобулярными белками, которые носят названиеферментов.
superbotanik.net
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|