
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3 ) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3 ·Н2 О и HNO3 · 3Н2 О, которые дают три эвтектики (рис. 1.1).

Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2 »
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.

Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2 О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:

Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3 ·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).

Рис. 1.4. Области применения азотной кислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 2.1.

Рис. 2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получение разбавленной кислоты с последующим концентрированием ее в случае необходимости и
—непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:

Первая стадия процесса (конверсия аммиака) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более совершенные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимость частой замены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600—800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты из аммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
4Nh4 + 502 = 4NO + 6Н2 0 — ΔН ΔН=907,3 кДж (1)
4Nh4 + 402 = 2N2 0 + 6Н2 0 — ΔН ΔН = 1104,9 кДж (2)
4Nh4 + 302 = 2N2 + 6Н2 0 — ΔН ΔН = 1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4Nh4 + 6NO = 5N2 + 6h3 0-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1—4. Из трех основных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому, в отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы, В современных установках используют платиновые катализаторы в виде пакета сеток из сплава платины с 7,5% родия, или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность и уменьшает потери платины за счет ее уноса током газа. Поверхность подобных катализаторов достигает 1,5 м2 /м3 объема.
Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий:
—диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора;
—активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения;
—хемосорбция молекул аммиака и образование комплекса;
—разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
—диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области.
Платиновые катализаторы весьма чувствительны к каталитическим ядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь (АмВС). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород и органические соединения серы обратимое отравление. Так как вследствие этого активность катализатора снижается, его периодически регенерируют промывкой соляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается и частицы его уносятся с потоком газа. Эррозия катализатора тем больше, чем выше температура, давление и объемная скорость газа, проходящего через катализатор. Для систем, работающих под высоким давлением, унос катализатора составляет 0,3—0,4 г на 1 тонну азотной кислоты.
В присутствии платиновых катализаторов селективность процесса окисления аммиака до оксида азота (II):
 (5)
(5)
составляет 0,95—0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:
 (6)
(6)
где: 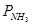 — парциальное давление аммиака, окисляемого до оксида азота (II),
— парциальное давление аммиака, окисляемого до оксида азота (II),
 — парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
— парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
Из двух реакций (2 и 3), конкурирующих с целевой реакцией окисления аммиака (1), наиболее опасной является реакция 3, приводящая к образованию элементарного азота. Скорость обеих реакций (1 и 3) может быть описана общим для гетерогенных реакций уравнением:
 (7)
(7)
и зависит от таких параметров процесса как температура (через Км), давление и состав АмВС, то есть отношение кислород: аммиак (через АС), время контактирования, то есть время пребывания АмВС в зоне катализатора. Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1 и до азота по реакции 3 и, следовательно, выход продуктов окисления, различно.
4.1. Температура. Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому, является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными табл. 15.1.
Термодинамические характеристики реакций окисления аммиака
Таблица 4.1.
Реакция | ΔН, Дж/моль | AG, кДж/моль | |
298°К | 1173о К | ||
4Nh4 + 502 = 4NO + 6Н2 0 | -226,0 | -246,2 | -414,6 |
4Nh4 + 302 = 2Н2 + 6Н2 0 | -317,2 | -326,9 | -335,2 |
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется. Зависимость выхода оксида азота (II) и элементарного азота от температуры представлена на рис. 4.1.
4.2. Состав АмВС, Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АмВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2: Nh4 = 1,8—2,0, что соответствует содержанию в АмВС 0,095—0,105 об. долей аммиака и 0,18—0,19 об. долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости АмВС. Зависимость выхода оксида азота (II) от состава АмВС представлена на рис. 4.2.

Рис. 4.1. Зависимость выхода NO и N2 Рис. 4.2. Зависимость выхода NO от температуры от состава АмВС
3. Давление. Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Так, если при атмосферном давлении (105 Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, то при давлении 0,8 МПа он достигает 0,4 г/тонну. Зависимость выхода оксида азота (II) от давления при различной температуре приведена на рис. 4.3.
4. Время контактирования, Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,9 7— 0,98 дол. ед. при атмосферном давлении и 0,98—0,96 при давлении 0,8—1,0 МПа. Время контактирования может быть рассчитано из формулы:
 (8)
(8)
где: Vk — объем катализатора, определяемый в случае платинового катализатора числом сеток в пакете, W — объемная скорость АмВС. Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10-4 — 10-5 с, для окисных катализаторов около
10-2 с. Увеличение времени контактирования, то есть снижение объемной скорости АмВС приводит к развитию реакции окисления аммиака до элементарного азота (рис. 4.4.).

Рис. 4.3. Зависимость выхода оксида Рис. 4.4. Зависимость выхода оксида
азота (II) от давления Т1 <T2 <T3. азота (II) и азота от времени
контактирования.
Оптимальный режим процесса на этой стадии должен обеспечить селективность окисления аммиака, минимальные потери катализатора вследствие его уноса и автотермичность процесса. Этим требованиям удовлетворяют следующие условия: температура 800°С, давление 0,1—1,0 МПа, молярное отношение О2: Nh4 — 1,8—2,0, время контактирования
1—2·10-4 с.
Для соблюдения этих условий исходная АмВС должна иметь состав: аммиак 0,10—0,115 об. дол., кислород 0,18—0,19 об. дол., азот 0,70—0,72 об. дол.
При использовании АмВС такого состава нитрозные газы, выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксида азота (II).
Абсорбция оксида азота ( IV )
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2 O4, NO, N2 О), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого реакциями 9-11.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ— жидкость», описываемой уравнениями:
 , где ΔН=116 кДж (9)
, где ΔН=116 кДж (9)
 , где ΔН=59 кДж (10)
, где ΔН=59 кДж (10)
и распада нестойкой азотистой кислоты по уравнению:
 , где ΔН=76 кДж (11)
, где ΔН=76 кДж (11)
Суммируя уравнения 9 и 11 и 10 и 11, получаем итоговые уравнения поглощения оксидов азота водой:
 , где ΔН=136 кДж (12)
, где ΔН=136 кДж (12)
 , где ΔН=101 кДж (13)
, где ΔН=101 кДж (13)
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через Пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 9) со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты (реакция 11).
Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением для гетерогенных процессов:
 (14)
(14)
где Δр — движущая сила абсорбции,
 — парциальное давление NO2 в газовой фазе,
— парциальное давление NO2 в газовой фазе,
 — равновесное давление NO2 у поверхности водногораствора азотной кислоты.
— равновесное давление NO2 у поверхности водногораствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.

Рис. 4.5. Зависимость абсорбционного объема от степени абсорбции.
Состояние системы «NO2 -HNO3 -h3 O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25°С абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис. 4.6).
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 масс. дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40о С, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
|
Рис. 4.6. Зависимость степени абсорбции NO2 от концентрации образующейся кислоты.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол. ед., может быть достигнута при Vaб =22 м3 / т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3 /т. (рис. 4.5.). Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
 ,
,
 .
.
5. Производство разбавленной азотной кислоты
Принципиальная технологическая схема производства разбавленной азотной кислоты под атмосферным давлением представлена на рис. 5.1.
Воздух поступает в систему через заборную трубу, устанавливаемую в местности с чистым воздухом, как правило, вдали от территории завода. Для очистки воздуха от механических и химических примесей устанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак, поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировка газов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4. Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газы с температурой около 800°С поступают в котел-утилизатор 6, где вырабатывается пар, а температура газов снижается до 250°С. Затем газы охлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (на схеме показан один). При этом происходит конденсация водяных паров и в небольшой степени окисление оксида азота до диоксида, который, частично поглощаясь конденсатом, дает разбавленную азотную кислоту.
После этого нитрозные газы газодувкой 8 подаются в абсорбционные башни 9, заполненные насадкой из кислотоупорных колец. Последняя по ходу газа башня орошается водой, а из первой башни отбирается продукционная кислота. Циркуляция кислоты в системе осуществляется насосами 10. Для охлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники 11. В поглотительных башнях перерабатывается примерно 92% оксидов азота. Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционными башнями устанавливается окислительная башня 12, где происходит частичное окисление NО до диоксида азота. Далее газы поступают в башню 13 (обычно две) для поглощения NО и NО2 раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместо раствора соды можно применять раствор едкого натра или Са(ОН)2. Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу.

Рис. 5.1. Технологическая схема производства азотной кислоты под атмосферным давлением:
1 – пенный промыватель; 2, 3 – картонные фильтры; 4 – аммиачно-воздушный вентилятор; 5 – контактный аппарат; 6 – котел-утилизатор; 7 – кожухотрубный холодильник; 8 – газодувка; 9 – абсорбционные башни; 10 – циркуляционные насосы; 11 – водяной холодильник; 12 – окислительная башня; 13 – санитарная башня.
6. Расчет материального баланса процесса абсорбции нитрозных газов
Данные для расчета
1. Производительность установки – 120 тыс.т/год (на 100 % HNO3 ).
2. Число рабочих дней в году – 350.
3. Концентрация получаемой кислоты – 50 %(масс.).
4. Общая степень абсорбции NO2 – 92 %.
5. Состав поступающих на абсорбцию газов и концентрация кислоты, подаваемой на орошение абсорбера:
Таблица 6.1
Состав нитрозных газов, %(об.) | Концентрация кислоты орошающей абсорбер, %(масс.) | ||||
NO | NO2 | O2 | h3 O | N2 | |
0,95 | 8,98 | 5,86 | 2,61 | 81,6 | 47,5 |
6. База расчета – суточная производительность установки. Окисление NO в NO2 в абсорбционной башне можно не учитывать.
Расчет суточной производительности установки

Состав газа в %(масс.):
Для пересчета объемного состава в массовый и обратно необходимо знать плотность r i каждого компонента:

Масса любого газа при нормальных условиях равна его молярной массе, поделенной на объем, занимаемый одним молем, т.е.  , где
, где  — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.

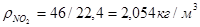

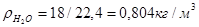

 ;
;





Расчет массы двуокиси азота
Абсорбция двуокиси азота происходит по уравнению:

Концентрация кислоты орошающей абсорбер – 47,5 %(масс.)
Содержание воды и кислоты
 — масса кислоты (в пересчете на 100 %-ю) поступающей в абсорбер;
— масса кислоты (в пересчете на 100 %-ю) поступающей в абсорбер;
 — масса воды в 47,5 %-ой кислоте.
— масса воды в 47,5 %-ой кислоте.
Рассчитаем количество реагентов для получения 1 кг кислоты (в пересчете на 100 %-ю)
На образование 2-х моль 100% кислоты требуется 3 моль NO2 .


Масса поглощенной воды на образование 1 кг кислоты (в пересчете на 100 %-ю).
На образование 2-х моль кислоты поглощается 1 моль воды


Масса водяных паров, вносимых в абсорбер с нитрозными газами на образование 1 кг кислоты (в пересчете на 100 %-ю).

 ;
;
с учетом степени абсорбции NO2 92 % —  .
.
Для получения 50 %-ой кислоты на 1 кг кислоты требуется 1 кг воды. На разбавление полученной кислоты может использоваться 0,05 кг воды из поступающей на орошение 47,5 %-ой кислоты. Отсюда, количество кислоты подаваемой на орошение составит
0,864/0,05=17,28 кг.
Образуется оксида азота 1 моль


Тогда на образование 1 кг азотной кислоты (в пересчете на 100 %-ю) из диоксида азота потребуется:
Нитрозные газы (учетом степени абсорбции):
NO2 – 1,095 кг;
Н2 О – 0,136 кг;
Кислота на орошение 17,28 кг.
Образуется оксида азота – 0,238 кг.
Всего получаем кислоты (в пересчете на 100 %-ю):
17,28·0,475+1=9,208 кг или 2·9,208=18,416 кг 50 %-ой кислоты.
17,28 кг кислоты абсорбирует 1,095 кг NO2, тогда 1 кг кислоты абсорбирует Х кг NO2 :

 .
.
Поступает с учетом степени абсорбции 92 % — 
Образуется оксида азота:

 .
.
Поглощается воды:

 .
.
Из 0,136 кг воды, содержащейся в нитрозных газах

 .
.
Образуется 100% кислоты при абсорбции 1 кг 47,5 %-ой кислоты:
0,063+0,008 — 0,014 = 0,057 кг
0,057+0,475 = 0,532 кг.
Материальный баланс абсорбера
Таблица 6.2.
№ п/п | Приход | кг | т/сут | № п/п | Расход | кг | т/сут |
1 | Азотная кислота 47,5% | 1 | 644,46 | 1 | Азотная кислота 50 % | 1,064 | 685,71 |
в том числе: | в том числе: | ||||||
HNO3 | 0,475 | 306,12 | HNO3 | 0,532 | 342,86 | ||
h3 O | 0,525 | 338,34 | h3 O | 0,532 | 342,86 | ||
2 | Нитрозные газы | 0,495 | 297,12 | ||||
в том числе: | 2 | NO | 0,019 | 12,49 | |||
NO2 | 0,069 | 45,85 | 3 | N2 | 0,382 | 224,60 | |
h3 O | 0,008 | 5,05 | 4 | O2 | 0,031 | 18,43 | |
NO | 0,005 | 3,19 | 5 | NO2 | 0,006 | 3,99 | |
N2 | 0,382 | 224,60 | |||||
O2 | 0,031 | 18,43 | |||||
ИТОГО: | 1,495 | 941,58 | ИТОГО: | 1,502 | 945,21 |
Расхождение баланса составляет:
 , что вполне допустимо.
, что вполне допустимо.
ЛИТЕРАТУРА
1. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
2. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
3. Основы химической технологии: Учебник для студентов вузов / Под ред. Мухленова И.П. – М.: «Высшая школа», 1983. – 335 с.
4. Соколов Р.С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. – М.: Гуманит. изд. центр БЛАДОС, 2000. – Т.1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ. – 368 с.
www.ronl.ru
ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
Азотная кислота является одной из важнейших минеральныхкислот и по объему производства занимает второе место после серной кислоты. Онаобразует растворимые в воде соли (нитраты), обладает нитрующим и окисляющимдействием по отношению органических соединений в концентрированном видепассивирует черные металлы. Все это обусловило широкое использование азотнойкислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температуройкристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3.Смешивается с водой во всех отношениях, образуя при этом индивидуальныесоединения — гидраты состава HNO3·Н2Ои HNO3 · 3Н2О, которые дают три эвтектики (рис.1.1).
/>
Рис.1.1 Диаграмма кристаллизации системы «HNO3– NO2»
Температура кипения водных растворов азотной кислоты зависитот их концентрации. С увеличением концентрации температура кипения возрастает,достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), послечего снижается (рис. 1.2). Это имеет существенное значение для концентрированияазотной кислоты.
/>
Теплота разбавления азотной кислоты водой существенноменяется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислотамалоустойчива термически и разлагается уже при хранении по уравнению:
/>
Рис. 1.2. Диаграмма кипения Рис. 1.3.Теплота разбавления
системы HNO3– Н2О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:
/>
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевыйцвет. Для удаления оксида из кислоты в технологическом процессе ее производствапредусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3·NO2 (нитроолеум), являющийсяпромежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кромезолота, платины, титана, тантала, родия и иридия, однако в концентрированномвиде пассивирует железо и его сплавы.
Областиприменения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%)расходуется на производство азотных и комплексных минеральных удобрений иразнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетноготоплива, остальное количество потребляется производством красителей,органическим синтезом и в цветной металлургии (травление металлов).
/>
Рис. 1.4. Области применения азотнойкислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислотапроизводится исключительно из аммиака. Поэтому структура сырья азотнокислотногопроизводства совпадает со структурой сырья для производства аммиака, как этовидно из рис. 2.1.
/>
Рис.2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производятиз синтетического аммиака, получаемого на основе конверсии природного газа.Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и парыкомпрессорного масла, являющиеся каталитическими ядами на стадии окисленияаммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием черезматерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком.Аналогично очищают от механических и химических примесей воздух, которыйпоступает в цех через заборную трубу, устанавливаемую как правило, вдали оттерритории предприятия. Для очистки воздуха используются орошаемые водойскрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получениеразбавленной кислоты с последующим концентрированием ее в случае необходимостии
—непосредственноеполучение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованиемв народном хозяйстве как концентрированной, так и разбавленной кислоты. Методыразличаются физико-химическими закономерностями протекающих процессов итехнологическими схемами. Однако независимо от схемы, синтез азотной кислоты изаммиака описывается общей химической схемой:
/>
Первая стадия процесса (конверсия аммиака) одинакова как дляполучения разбавленной, так и для получения концентрированной кислоты, втораястадия (переработка нитрозных газов) отличается рядом особенностей. Решающеезначение при выборе параметров той или иной технологической схемы имеет выбороптимального давления на каждой из стадий процесса. В производстве азотнойкислоты повышение давления существенно интенсифицирует химические реакции навсех стадиях процесса, способствует эффективности теплообмена, позволяетиспользовать более совершенные массообменные устройства, уменьшает размерыаппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативноевлияние на экономические показатели работы агрегата. К ним относятся: ускорениепобочных реакций на стадии окисления аммиака, снижение степени конверсии,потери катализатора вследствие его уноса потоком газа и необходимость частойзамены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применениеединого (повышенного) давления на всех стадиях производства целесообразно лишьв том случае, когда мощность установки не превышает 600—800 т/сутки. Установкибольшей мощности экономически выгодно создавать только с использованием разныхдавлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты изаммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторевозможно протекание следующих реакций:
4Nh4 + 502 = 4NO + 6Н20 — ΔН ΔН=907,3кДж (1)
4Nh4 + 402 = 2N20 + 6Н20 — ΔН ΔН = 1104,9 кДж (2)
4Nh4 + 302 = 2N2 + 6Н20 — ΔН ΔН =1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4Nh4 + 6NO = 5N2 + 6h30-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направлениепроцесса окисления определяется соотношением скоростей реакций 1—4. Из трехосновных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболеевероятна, так как протекает с максимальным выделением тепла. Поэтому, вотсутствии катализатора окисление аммиака идет преимущественно до элементарногоазота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующиекатализаторы, В современных установках используют платиновые катализаторы ввиде пакета сеток из сплава платины с 7,5% родия, или двухступенчатыекатализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность иуменьшает потери платины за счет ее уноса током газа. Поверхность подобныхкатализаторов достигает 1,5 м2/м3 объема.
Механизм гетерогенного каталитического окисления аммиакасостоит из следующих последовательных стадий:
—диффузия молекуламмиака и кислорода из газовой фазы к поверхности катализатора;
—активированнаяадсорбция молекул кислорода на поверхности катализатора с образованиемпромежуточного соединения;
—хемосорбциямолекул аммиака и образование комплекса;
—разложениекомплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
—диффузияпродуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления являетсяскорость диффузии кислорода к поверхности катализатора. Следовательно,каталитическое окисление аммиака на платиновом катализаторе протекаетпреимущественно в диффузионной области, в отличие от окисления на окисномкатализаторе, которое идет в кинетической области.
Платиновые катализаторы весьма чувствительны к каталитическимядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь(АмВС). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород иорганические соединения серы обратимое отравление. Так как вследствие этогоактивность катализатора снижается, его периодически регенерируют промывкойсоляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается ичастицы его уносятся с потоком газа. Эррозия катализатора тем больше, чем вышетемпература, давление и объемная скорость газа, проходящего через катализатор.Для систем, работающих под высоким давлением, унос катализатора составляет0,3—0,4 г на 1 тонну азотной кислоты.
В присутствии платиновых катализаторов селективность процессаокисления аммиака до оксида азота (II):
/> (5)
составляет0,95—0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:
/> (6)
где: /> — парциальное давление аммиака,окисляемого до оксида азота (II),
/> — парциальное давление аммиака, окисляемого дооксида азота (I) и элементарного азота (реакции2иЗ),
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
Из двух реакций (2 и 3), конкурирующих с целевой реакциейокисления аммиака (1), наиболее опасной является реакция 3, приводящая кобразованию элементарного азота. Скорость обеих реакций (1 и 3) может бытьописана общим для гетерогенных реакций уравнением:
/> (7)
и зависит от таких параметров процесса как температура (черезКм), давление и состав АмВС, то есть отношение кислород: аммиак (через АС),время контактирования, то есть время пребывания АмВС в зоне катализатора.Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1 и до азота по реакции3 и, следовательно, выход продуктов окисления, различно.
4.1. Температура. Повышение температуры способствуетувеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому,является наиболее эффективным средством, увеличения скорости процесса,протекающего преимущественно в диффузионной области. Это подтверждаетсятермодинамическими данными табл. 15.1.
Термодинамические характеристики реакций окисления аммиака
Таблица 4.1.
РеакцияΔН,
Дж/моль
AG, кДж/моль 298°К1173оК
4Nh4 + 502 = 4NO + 6Н20
-226,0 -246,2 -414,64Nh4 + 302 = 2Н2 + 6Н20
-317,2 -326,9 -335,2Из таблицы следует, что вероятность реакции окисления дооксида азота (II) с повышением температуры возрастаетпочти вдвое, а реакции окисления до азота почти не изменяется. Зависимостьвыхода оксида азота (II) иэлементарного азота от температуры представлена на рис. 4.1.
4.2. Состав АмВС, Соотношение аммиака и кислорода в газовой смесивлияет на температурный режим и общую скорость процесса в том случае, еслилимитирующей в нем является химическая реакция, то есть процесс протекает вкинетической области. При стехиометрическом соотношении компонентов в АмВСстепень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксидаазота (II) процесс ведут при отношении О2: Nh4 = 1,8—2,0, что соответствует содержанию в АмВС0,095—0,105 об. долей аммиака и 0,18—0,19 об. долей кислорода. Избытоккислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВСобеспечивает автотермичность процесса окисления и лежит за пределомвзрывчатости АмВС. Зависимость выхода оксида азота (II) от состава АмВС представлена на рис. 4.2.
/>
Рис.4.1. Зависимость выхода NO и N2 Рис. 4.2. Зависимость выхода NO от температуры от состава АмВС
3. Давление. Повышение давления ускоряет процесс окисления аммиаказа счет увеличения концентрации реагентов и производительности катализатора,что позволяет сократить размеры аппаратуры. При этом, однако, снижается выходоксида азота (II) и увеличивается эрозия и уноскатализатора, что удорожает продукцию. Так, если при атмосферном давлении (105Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, топри давлении 0,8 МПа он достигает 0,4 г/тонну. Зависимость выхода оксида азота(II) от давления при различнойтемпературе приведена на рис. 4.3.
4. Время контактирования, Скорость каталитического окисленияаммиака до оксида азота (II)весьма высока. За десятитысячные доли секунды степень превращения составляет0,9 7— 0,98 дол. ед. при атмосферном давлении и 0,98—0,96 при давлении 0,8—1,0МПа. Время контактирования может быть рассчитано из формулы:
/> (8)
где: Vk— объем катализатора, определяемый в случае платинового катализаторачислом сеток в пакете, W—объемная скорость АмВС. Время контактирования зависит от природы катализатора исоставляет; для платиновых катализаторов 10-4 — 10-5с,для окисных катализаторов около
10-2с. Увеличение времени контактирования, то естьснижение объемной скорости АмВС приводит к развитию реакции окисления аммиакадо элементарного азота (рис. 4.4.).
/>
Рис. 4.3. Зависимостьвыхода оксида Рис. 4.4. Зависимость выхода оксида
азота (II) от давления Т1<T2<T3. азота (II) и азота от времени
контактирования.
Оптимальный режим процесса на этой стадии должен обеспечитьселективность окисления аммиака, минимальные потери катализатора вследствие егоуноса и автотермичность процесса. Этим требованиям удовлетворяют следующиеусловия: температура 800°С, давление 0,1—1,0 МПа, молярное отношение О2: Nh4 — 1,8—2,0, время контактирования
1—2·10-4 с.
Для соблюдения этих условий исходная АмВС должна иметьсостав: аммиак 0,10—0,115 об. дол., кислород 0,18—0,19 об. дол., азот 0,70—0,72об. дол.
При использовании АмВС такого состава нитрозные газы,выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксидаазота (II).
Абсорбцияоксида азота (IV)
Нитрозныегазы, поступающие на абсорбцию, представляют сложную смесь различных оксидовазота (NO2, N2O4, NO, N2О), элементарного азота, кислорода и паров воды. Ихсостав зависит от условий окисления, то есть от состояния системы, описываемогореакциями 9-11.
Всеоксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, заисключением оксида азота (II),взаимодействуют с ней. Поглощение их водой сопровождается химической реакциейхемосорбции, протекающей в системе «газ— жидкость», описываемой уравнениями:
/>, где ΔН=116 кДж (9)
/>, где ΔН=59 кДж (10)
ираспада нестойкой азотистой кислоты по уравнению:
/>, где ΔН=76 кДж (11)
Суммируяуравнения 9 и 11 и 10 и 11, получаем итоговые уравнения поглощения оксидовазота водой:
/>, где ΔН=136 кДж (12)
/>, где ΔН=101 кДж (13)
Из этихуравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислотыи один моль оксида азота (II),который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизмобразования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся воднойазотной кислотой, заключается в том, что оксид азота (IV) диффундирует через Пограничный слой газа к поверхностижидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 9) со скоростью, превышающейскорость диффузии и скорость реакции разложения азотистой кислоты (реакция 11).
Образующийсяоксид азота (II) выделяется в газовую фазу, гдеокисляется кислородом до оксида азота (IV).
Скоростьпроцесса абсорбции оксида азота (IV)водой описывается уравнением для гетерогенных процессов:
/> (14)
где Δр — движущая сила абсорбции,
/> — парциальное давление NO2 в газовой фазе,
/> — равновесное давление NO2 у поверхности водногораствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастаетравновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.
/>
Рис. 4.5. Зависимость абсорбционного объема от степениабсорбции.
Состояние системы «NO2-HNO3-h3O» и, следовательно, концентрацияполучаемой азотной кислоты зависит от температуры, давления, парциальногодавления оксида азота (IV) впоглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижениитемпературы и концентрации кислоты и повышения давления степень абсорбцииоксида азота (IV) водной азотной кислотой возрастает,при том тем интенсивнее, чем выше концентрация его в нитрозных газах. Приатмосферном давлении и температуре 25°С абсорбция оксида азота практическипрекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис. 4.6).
Таким образом, возможность получения азотной кислотыконцентрацией более 0,65 масс. дол. объективно ограничена температурой идавлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальныхусловиях производства при температуре 40оС, давлении 0,1 МПа ипонижении содержания оксида азота вследствие его поглощения из газаконцентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотнойкислоты более высокой концентрации требует иной технологии.
/>
Рис. 4.6. Зависимость степени абсорбции NO2 от концентрации образующейся кислоты.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры.Повышение степени абсорбции требует, особенно, в конце процесса, значительногоувеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол.ед., может быть достигнута при Vaб=22м3/ т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на6,5% абсорбционный объем должен быть увеличен до 70 м3/т. (рис. 4.5.).Так как увеличение абсорбционного объема вызывает резкое возрастаниекапитальных затрат, то экономически более выгодно не добиваться степениабсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочнымипоглотителями с последующим окислением образовавшегося нитрита натрияконцентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
/>,
/>.
5. Производство разбавленной азотнойкислоты
Принципиальнаятехнологическая схема производства разбавленной азотной кислоты под атмосфернымдавлением представлена на рис. 5.1.
Воздух поступает в систему через заборную трубу,устанавливаемую в местности с чистым воздухом, как правило, вдали от территориизавода. Для очистки воздуха от механических и химических примесейустанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак,поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировкагазов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4.Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газыс температурой около 800°С поступают в котел-утилизатор 6, гдевырабатывается пар, а температура газов снижается до 250°С. Затем газыохлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (насхеме показан один). При этом происходит конденсация водяных паров и внебольшой степени окисление оксида азота до диоксида, который, частичнопоглощаясь конденсатом, дает разбавленную азотную кислоту.
После этого нитрозные газы газодувкой 8 подаются вабсорбционные башни 9, заполненные насадкой из кислотоупорных колец. Последняяпо ходу газа башня орошается водой, а из первой башни отбирается продукционнаякислота. Циркуляция кислоты в системе осуществляется насосами 10. Дляохлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники11. В поглотительных башнях перерабатывается примерно 92% оксидов азота.Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционнымибашнями устанавливается окислительная башня 12, где происходит частичноеокисление NО до диоксида азота. Далее газы поступают в башню 13 (обычнодве) для поглощения NО и NО2раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместораствора соды можно применять раствор едкого натра или Са(ОН)2.Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу.
www.ronl.ru
ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3·Н2О и HNO3 · 3Н2О, которые дают три эвтектики (рис. 1.1).

Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2»
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.

Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:

Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).

Рис. 1.4. Области применения азотной кислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 2.1.

Рис. 2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получение разбавленной кислоты с последующим концентрированием ее в случае необходимости и
—непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:

Первая стадия процесса (конверсия аммиака) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более совершенные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимость частой замены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600—800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты из аммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
4Nh4 + 502 = 4NO + 6Н20 - ΔН ΔН=907,3 кДж (1)
4Nh4 + 402 = 2N20 + 6Н20 - ΔН ΔН = 1104,9 кДж (2)
4Nh4 + 302 = 2N2 + 6Н20 - ΔН ΔН = 1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4Nh4 + 6NO = 5N2 + 6h30-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1—4. Из трех основных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому, в отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы, В современных установках используют платиновые катализаторы в виде пакета сеток из сплава платины с 7,5% родия, или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность и уменьшает потери платины за счет ее уноса током газа. Поверхность подобных катализаторов достигает 1,5 м2/м3 объема.
Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий:
—диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора;
—активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения;
—хемосорбция молекул аммиака и образование комплекса;
—разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
—диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области.
Платиновые катализаторы весьма чувствительны к каталитическим ядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь (АмВС). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород и органические соединения серы обратимое отравление. Так как вследствие этого активность катализатора снижается, его периодически регенерируют промывкой соляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается и частицы его уносятся с потоком газа. Эррозия катализатора тем больше, чем выше температура, давление и объемная скорость газа, проходящего через катализатор. Для систем, работающих под высоким давлением, унос катализатора составляет 0,3—0,4 г на 1 тонну азотной кислоты.
В присутствии платиновых катализаторов селективность процесса окисления аммиака до оксида азота (II):
 (5)
(5)
составляет 0,95—0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:
 (6)
(6)
где:  — парциальное давление аммиака,
окисляемого до оксида азота (II),
— парциальное давление аммиака,
окисляемого до оксида азота (II),
 — парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
— парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
Из двух реакций (2 и 3), конкурирующих с целевой реакцией окисления аммиака (1), наиболее опасной является реакция 3, приводящая к образованию элементарного азота. Скорость обеих реакций (1 и 3) может быть описана общим для гетерогенных реакций уравнением:
 (7)
(7)
и зависит от таких параметров процесса как температура (через Км), давление и состав АмВС, то есть отношение кислород: аммиак (через АС), время контактирования, то есть время пребывания АмВС в зоне катализатора. Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1 и до азота по реакции 3 и, следовательно, выход продуктов окисления, различно.
4.1. Температура. Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому, является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными табл. 15.1.
Термодинамические характеристики реакций окисления аммиака
Таблица 4.1.
|
Реакция |
ΔН, Дж/моль |
AG, кДж/моль |
|
|
298°К |
1173оК |
||
|
4Nh4+ 502 = 4NO + 6Н20 |
-226,0 |
-246,2 |
-414,6 |
|
4Nh4+ 302 = 2Н2 + 6Н20 |
-317,2 |
-326,9 |
-335,2 |
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется. Зависимость выхода оксида азота (II) и элементарного азота от температуры представлена на рис. 4.1.
4.2. Состав АмВС, Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АмВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2 : Nh4 = 1,8—2,0, что соответствует содержанию в АмВС 0,095—0,105 об. долей аммиака и 0,18—0,19 об. долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости АмВС. Зависимость выхода оксида азота (II) от состава АмВС представлена на рис. 4.2.

Рис. 4.1. Зависимость выхода NO и N2 Рис. 4.2. Зависимость выхода NO от температуры от состава АмВС
3. Давление. Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Так, если при атмосферном давлении (105 Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, то при давлении 0,8 МПа он достигает 0,4 г/тонну. Зависимость выхода оксида азота (II) от давления при различной температуре приведена на рис. 4.3.
4. Время контактирования, Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,9 7— 0,98 дол. ед. при атмосферном давлении и 0,98—0,96 при давлении 0,8—1,0 МПа. Время контактирования может быть рассчитано из формулы:
 (8)
(8)
где: Vk — объем катализатора, определяемый в случае платинового катализатора числом сеток в пакете, W — объемная скорость АмВС. Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10-4 - 10-5с, для окисных катализаторов около
10-2с. Увеличение времени контактирования, то есть снижение объемной скорости АмВС приводит к развитию реакции окисления аммиака до элементарного азота (рис. 4.4.).

Рис. 4.3. Зависимость выхода оксида Рис. 4.4. Зависимость выхода оксида
азота (II) от давления Т1<T2<T3. азота (II) и азота от времени
контактирования.
Оптимальный режим процесса на этой стадии должен обеспечить селективность окисления аммиака, минимальные потери катализатора вследствие его уноса и автотермичность процесса. Этим требованиям удовлетворяют следующие условия: температура 800°С, давление 0,1—1,0 МПа, молярное отношение О2 : Nh4 - 1,8—2,0, время контактирования
1—2·10-4 с.
Для соблюдения этих условий исходная АмВС должна иметь состав: аммиак 0,10—0,115 об. дол., кислород 0,18—0,19 об. дол., азот 0,70—0,72 об. дол.
При использовании АмВС такого состава нитрозные газы, выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксида азота (II).
Абсорбция оксида азота (IV)
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2O4, NO, N2О), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого реакциями 9-11.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ— жидкость», описываемой уравнениями:
 , где ΔН=116 кДж (9)
, где ΔН=116 кДж (9)
 , где ΔН=59 кДж (10)
, где ΔН=59 кДж (10)
и распада нестойкой азотистой кислоты по уравнению:
 , где ΔН=76 кДж (11)
, где ΔН=76 кДж (11)
Суммируя уравнения 9 и 11 и 10 и 11, получаем итоговые уравнения поглощения оксидов азота водой:
 , где ΔН=136 кДж (12)
, где ΔН=136 кДж (12)
 , где ΔН=101 кДж (13)
, где ΔН=101 кДж (13)
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через Пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 9) со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты (реакция 11).
Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением для гетерогенных процессов:
 (14)
(14)
где Δр — движущая сила абсорбции,
 — парциальное давление NO2 в газовой фазе,
— парциальное давление NO2 в газовой фазе,
 — равновесное давление NO2 у поверхности водногораствора азотной кислоты.
— равновесное давление NO2 у поверхности водногораствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.

Рис. 4.5. Зависимость абсорбционного объема от степени абсорбции.
Состояние системы «NO2-HNO3-h3O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25°С абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис. 4.6).
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 масс. дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40оС, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
|
|
Рис. 4.6. Зависимость степени абсорбции NO2 от концентрации образующейся кислоты.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол. ед., может быть достигнута при Vaб=22 м3/ т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3/т. (рис. 4.5.). Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
 ,
,
 .
.
5. Производство разбавленной азотной кислоты
Принципиальная технологическая схема производства разбавленной азотной кислоты под атмосферным давлением представлена на рис. 5.1.
Воздух поступает в систему через заборную трубу, устанавливаемую в местности с чистым воздухом, как правило, вдали от территории завода. Для очистки воздуха от механических и химических примесей устанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак, поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировка газов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4. Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газы с температурой около 800°С поступают в котел-утилизатор 6, где вырабатывается пар, а температура газов снижается до 250°С. Затем газы охлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (на схеме показан один). При этом происходит конденсация водяных паров и в небольшой степени окисление оксида азота до диоксида, который, частично поглощаясь конденсатом, дает разбавленную азотную кислоту.
После этого нитрозные газы газодувкой 8 подаются в абсорбционные башни 9, заполненные насадкой из кислотоупорных колец. Последняя по ходу газа башня орошается водой, а из первой башни отбирается продукционная кислота. Циркуляция кислоты в системе осуществляется насосами 10. Для охлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники 11. В поглотительных башнях перерабатывается примерно 92% оксидов азота. Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционными башнями устанавливается окислительная башня 12, где происходит частичное окисление NО до диоксида азота. Далее газы поступают в башню 13 (обычно две) для поглощения NО и NО2 раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместо раствора соды можно применять раствор едкого натра или Са(ОН)2. Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу.
6. Расчет материального баланса процесса абсорбции нитрозных газов
Данные для расчета
1. Производительность установки – 120 тыс.т/год (на 100 % HNO3).
2. Число рабочих дней в году – 350.
3. Концентрация получаемой кислоты – 50 %(масс.).
4. Общая степень абсорбции NO2 – 92 %.
5. Состав поступающих на абсорбцию газов и концентрация кислоты, подаваемой на орошение абсорбера:
Таблица 6.1
|
Состав нитрозных газов, %(об.) |
Концентрация кислоты орошающей абсорбер, %(масс.) |
||||
|
NO |
NO2 |
O2 |
h3O |
N2 |
|
|
0,95 |
8,98 |
5,86 |
2,61 |
81,6 |
47,5 |
6. База расчета – суточная производительность установки. Окисление NO в NO2 в абсорбционной башне можно не учитывать.
Расчет суточной производительности установки

Состав газа в %(масс.):
Для пересчета объемного состава в массовый и обратно необходимо знать плотность ri каждого компонента:

Масса любого газа при нормальных
условиях равна его молярной массе, поделенной на объем, занимаемый одним молем,
т.е.  , где
, где  - плотность газа при нормальных
условиях.
- плотность газа при нормальных
условиях.





 ;
;





Расчет массы двуокиси азота
Абсорбция двуокиси азота происходит по уравнению:

Концентрация кислоты орошающей абсорбер – 47,5 %(масс.)
Содержание воды и кислоты
 - масса кислоты (в пересчете на 100
%-ю) поступающей в абсорбер;
- масса кислоты (в пересчете на 100
%-ю) поступающей в абсорбер;
 - масса воды в 47,5 %-ой кислоте.
- масса воды в 47,5 %-ой кислоте.
Рассчитаем количество реагентов для получения 1 кг кислоты (в пересчете на 100 %-ю)
На образование 2-х моль 100% кислоты требуется 3 моль NO2.


Масса поглощенной воды на образование 1 кг кислоты (в пересчете на 100 %-ю).
На образование 2-х моль кислоты поглощается 1 моль воды


Масса водяных паров, вносимых в абсорбер с нитрозными газами на образование 1 кг кислоты (в пересчете на 100 %-ю).

 ;
;
с учетом степени
абсорбции NO2 92 % -  .
.
Для получения 50 %-ой кислоты на 1 кг кислоты требуется 1 кг воды. На разбавление полученной кислоты может использоваться 0,05 кг воды из поступающей на орошение 47,5 %-ой кислоты. Отсюда, количество кислоты подаваемой на орошение составит
0,864/0,05=17,28 кг.
Образуется оксида азота 1 моль


Тогда на образование 1 кг азотной кислоты (в пересчете на 100 %-ю) из диоксида азота потребуется:
Нитрозные газы (учетом степени абсорбции):
NO2 – 1,095 кг;
Н2О – 0,136 кг;
Кислота на орошение 17,28 кг.
Образуется оксида азота – 0,238 кг.
Всего получаем кислоты (в пересчете на 100 %-ю):
17,28·0,475+1=9,208 кг или 2·9,208=18,416 кг 50 %-ой кислоты.
17,28 кг кислоты абсорбирует 1,095 кг NO2, тогда 1 кг кислоты абсорбирует Х кг NO2:

 .
.
Поступает с учетом
степени абсорбции 92 % - 
Образуется оксида азота:

 .
.
Поглощается воды:

 .
.
Из 0,136 кг воды, содержащейся в нитрозных газах

 .
.
Образуется 100% кислоты при абсорбции 1 кг 47,5 %-ой кислоты:
0,063+0,008 - 0,014 = 0,057 кг
0,057+0,475 = 0,532 кг.
Материальный баланс абсорбера
Таблица 6.2.
|
№ п/п |
Приход |
кг |
т/сут |
№ п/п |
Расход |
кг |
т/сут |
|
1 |
Азотная кислота 47,5% |
1 |
644,46 |
1 |
Азотная кислота 50 % |
1,064 |
685,71 |
|
|
в том числе: |
|
|
|
в том числе: |
|
|
|
|
HNO3 |
0,475 |
306,12 |
|
HNO3 |
0,532 |
342,86 |
|
|
h3O |
0,525 |
338,34 |
|
h3O |
0,532 |
342,86 |
|
2 |
Нитрозные газы |
0,495 |
297,12 |
|
|
|
|
|
|
в том числе: |
|
|
2 |
NO |
0,019 |
12,49 |
|
|
NO2 |
0,069 |
45,85 |
3 |
N2 |
0,382 |
224,60 |
|
|
h3O |
0,008 |
5,05 |
4 |
O2 |
0,031 |
18,43 |
|
|
NO |
0,005 |
3,19 |
5 |
NO2 |
0,006 |
3,99 |
|
|
N2 |
0,382 |
224,60 |
|
|
|
|
|
|
O2 |
0,031 |
18,43 |
|
|
|
|
|
|
ИТОГО: |
1,495 |
941,58 |
|
ИТОГО: |
1,502 |
945,21 |
Расхождение баланса составляет:
 , что вполне допустимо.
, что вполне допустимо.
ЛИТЕРАТУРА
1. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
2. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
3. Основы химической технологии: Учебник для студентов вузов / Под ред. Мухленова И.П. – М.: «Высшая школа», 1983. – 335 с.
4. Соколов Р.С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. – М.: Гуманит. изд. центр БЛАДОС, 2000. – Т.1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ. – 368 с.
www.referatmix.ru
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3 ) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3 ·Н2 О и HNO3 · 3Н2 О, которые дают три эвтектики (рис. 1.1).

Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2 »
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.

Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2 О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:

Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3 ·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).

Рис. 1.4. Области применения азотной кислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 2.1.

Рис. 2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получение разбавленной кислоты с последующим концентрированием ее в случае необходимости и
—непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:

Первая стадия процесса (конверсия аммиака) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более совершенные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимость частой замены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600—800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты из аммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
4Nh4 + 502 = 4NO + 6Н2 0 — ΔН ΔН=907,3 кДж (1)
4Nh4 + 402 = 2N2 0 + 6Н2 0 — ΔН ΔН = 1104,9 кДж (2)
4Nh4 + 302 = 2N2 + 6Н2 0 — ΔН ΔН = 1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4Nh4 + 6NO = 5N2 + 6h3 0-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1—4. Из трех основных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому, в отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы, В современных установках используют платиновые катализаторы в виде пакета сеток из сплава платины с 7,5% родия, или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность и уменьшает потери платины за счет ее уноса током газа. Поверхность подобных катализаторов достигает 1,5 м2 /м3 объема.
Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий:
—диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора;
—активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения;
—хемосорбция молекул аммиака и образование комплекса;
—разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
—диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области.
Платиновые катализаторы весьма чувствительны к каталитическим ядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь (АмВС). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород и органические соединения серы обратимое отравление. Так как вследствие этого активность катализатора снижается, его периодически регенерируют промывкой соляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается и частицы его уносятся с потоком газа. Эррозия катализатора тем больше, чем выше температура, давление и объемная скорость газа, проходящего через катализатор. Для систем, работающих под высоким давлением, унос катализатора составляет 0,3—0,4 г на 1 тонну азотной кислоты.
В присутствии платиновых катализаторов селективность процесса окисления аммиака до оксида азота (II):
 (5)
(5)
составляет 0,95—0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:
 (6)
(6)
где: 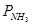 — парциальное давление аммиака, окисляемого до оксида азота (II),
— парциальное давление аммиака, окисляемого до оксида азота (II),
 — парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
— парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
Из двух реакций (2 и 3), конкурирующих с целевой реакцией окисления аммиака (1), наиболее опасной является реакция 3, приводящая к образованию элементарного азота. Скорость обеих реакций (1 и 3) может быть описана общим для гетерогенных реакций уравнением:
 (7)
(7)
и зависит от таких параметров процесса как температура (через Км), давление и состав АмВС, то есть отношение кислород: аммиак (через АС), время контактирования, то есть время пребывания АмВС в зоне катализатора. Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1 и до азота по реакции 3 и, следовательно, выход продуктов окисления, различно.
4.1. Температура. Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому, является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными табл. 15.1.
Термодинамические характеристики реакций окисления аммиака
Таблица 4.1.
Реакция | ΔН, Дж/моль | AG, кДж/моль | |
298°К | 1173о К | ||
4Nh4 + 502 = 4NO + 6Н2 0 | -226,0 | -246,2 | -414,6 |
4Nh4 + 302 = 2Н2 + 6Н2 0 | -317,2 | -326,9 | -335,2 |
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется. Зависимость выхода оксида азота (II) и элементарного азота от температуры представлена на рис. 4.1.
4.2. Состав АмВС, Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АмВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2: Nh4 = 1,8—2,0, что соответствует содержанию в АмВС 0,095—0,105 об. долей аммиака и 0,18—0,19 об. долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости АмВС. Зависимость выхода оксида азота (II) от состава АмВС представлена на рис. 4.2.

Рис. 4.1. Зависимость выхода NO и N2 Рис. 4.2. Зависимость выхода NO от температуры от состава АмВС
3. Давление. Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Так, если при атмосферном давлении (105 Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, то при давлении 0,8 МПа он достигает 0,4 г/тонну. Зависимость выхода оксида азота (II) от давления при различной температуре приведена на рис. 4.3.
4. Время контактирования, Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,9 7— 0,98 дол. ед. при атмосферном давлении и 0,98—0,96 при давлении 0,8—1,0 МПа. Время контактирования может быть рассчитано из формулы:
 (8)
(8)
где: Vk — объем катализатора, определяемый в случае платинового катализатора числом сеток в пакете, W — объемная скорость АмВС. Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10-4 — 10-5 с, для окисных катализаторов около
10-2 с. Увеличение времени контактирования, то есть снижение объемной скорости АмВС приводит к развитию реакции окисления аммиака до элементарного азота (рис. 4.4.).

Рис. 4.3. Зависимость выхода оксида Рис. 4.4. Зависимость выхода оксида
азота (II) от давления Т1 <T2 <T3. азота (II) и азота от времени
контактирования.
Оптимальный режим процесса на этой стадии должен обеспечить селективность окисления аммиака, минимальные потери катализатора вследствие его уноса и автотермичность процесса. Этим требованиям удовлетворяют следующие условия: температура 800°С, давление 0,1—1,0 МПа, молярное отношение О2: Nh4 — 1,8—2,0, время контактирования
1—2·10-4 с.
Для соблюдения этих условий исходная АмВС должна иметь состав: аммиак 0,10—0,115 об. дол., кислород 0,18—0,19 об. дол., азот 0,70—0,72 об. дол.
При использовании АмВС такого состава нитрозные газы, выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксида азота (II).
Абсорбция оксида азота ( IV )
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2 O4, NO, N2 О), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого реакциями 9-11.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ— жидкость», описываемой уравнениями:
 , где ΔН=116 кДж (9)
, где ΔН=116 кДж (9)
 , где ΔН=59 кДж (10)
, где ΔН=59 кДж (10)
и распада нестойкой азотистой кислоты по уравнению:
 , где ΔН=76 кДж (11)
, где ΔН=76 кДж (11)
Суммируя уравнения 9 и 11 и 10 и 11, получаем итоговые уравнения поглощения оксидов азота водой:
 , где ΔН=136 кДж (12)
, где ΔН=136 кДж (12)
 , где ΔН=101 кДж (13)
, где ΔН=101 кДж (13)
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через Пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 9) со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты (реакция 11).
Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением для гетерогенных процессов:
 (14)
(14)
где Δр — движущая сила абсорбции,
 — парциальное давление NO2 в газовой фазе,
— парциальное давление NO2 в газовой фазе,
 — равновесное давление NO2 у поверхности водногораствора азотной кислоты.
— равновесное давление NO2 у поверхности водногораствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.

Рис. 4.5. Зависимость абсорбционного объема от степени абсорбции.
Состояние системы «NO2 -HNO3 -h3 O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25°С абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис. 4.6).
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 масс. дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40о С, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
|
Рис. 4.6. Зависимость степени абсорбции NO2 от концентрации образующейся кислоты.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол. ед., может быть достигнута при Vaб =22 м3 / т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3 /т. (рис. 4.5.). Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
 ,
,
 .
.
5. Производство разбавленной азотной кислоты
Принципиальная технологическая схема производства разбавленной азотной кислоты под атмосферным давлением представлена на рис. 5.1.
Воздух поступает в систему через заборную трубу, устанавливаемую в местности с чистым воздухом, как правило, вдали от территории завода. Для очистки воздуха от механических и химических примесей устанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак, поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировка газов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4. Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газы с температурой около 800°С поступают в котел-утилизатор 6, где вырабатывается пар, а температура газов снижается до 250°С. Затем газы охлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (на схеме показан один). При этом происходит конденсация водяных паров и в небольшой степени окисление оксида азота до диоксида, который, частично поглощаясь конденсатом, дает разбавленную азотную кислоту.
После этого нитрозные газы газодувкой 8 подаются в абсорбционные башни 9, заполненные насадкой из кислотоупорных колец. Последняя по ходу газа башня орошается водой, а из первой башни отбирается продукционная кислота. Циркуляция кислоты в системе осуществляется насосами 10. Для охлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники 11. В поглотительных башнях перерабатывается примерно 92% оксидов азота. Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционными башнями устанавливается окислительная башня 12, где происходит частичное окисление NО до диоксида азота. Далее газы поступают в башню 13 (обычно две) для поглощения NО и NО2 раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместо раствора соды можно применять раствор едкого натра или Са(ОН)2. Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу.

Рис. 5.1. Технологическая схема производства азотной кислоты под атмосферным давлением:
1 – пенный промыватель; 2, 3 – картонные фильтры; 4 – аммиачно-воздушный вентилятор; 5 – контактный аппарат; 6 – котел-утилизатор; 7 – кожухотрубный холодильник; 8 – газодувка; 9 – абсорбционные башни; 10 – циркуляционные насосы; 11 – водяной холодильник; 12 – окислительная башня; 13 – санитарная башня.
6. Расчет материального баланса процесса абсорбции нитрозных газов
Данные для расчета
1. Производительность установки – 120 тыс.т/год (на 100 % HNO3 ).
2. Число рабочих дней в году – 350.
3. Концентрация получаемой кислоты – 50 %(масс.).
4. Общая степень абсорбции NO2 – 92 %.
5. Состав поступающих на абсорбцию газов и концентрация кислоты, подаваемой на орошение абсорбера:
Таблица 6.1
Состав нитрозных газов, %(об.) | Концентрация кислоты орошающей абсорбер, %(масс.) | ||||
NO | NO2 | O2 | h3 O | N2 | |
0,95 | 8,98 | 5,86 | 2,61 | 81,6 | 47,5 |
6. База расчета – суточная производительность установки. Окисление NO в NO2 в абсорбционной башне можно не учитывать.
Расчет суточной производительности установки

Состав газа в %(масс.):
Для пересчета объемного состава в массовый и обратно необходимо знать плотность r i каждого компонента:

Масса любого газа при нормальных условиях равна его молярной массе, поделенной на объем, занимаемый одним молем, т.е.  , где
, где  — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.

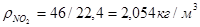

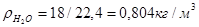

 ;
;





Расчет массы двуокиси азота
Абсорбция двуокиси азота происходит по уравнению:

Концентрация кислоты орошающей абсорбер – 47,5 %(масс.)
Содержание воды и кислоты
 — масса кислоты (в пересчете на 100 %-ю) поступающей в абсорбер;
— масса кислоты (в пересчете на 100 %-ю) поступающей в абсорбер;
 — масса воды в 47,5 %-ой кислоте.
— масса воды в 47,5 %-ой кислоте.
Рассчитаем количество реагентов для получения 1 кг кислоты (в пересчете на 100 %-ю)
На образование 2-х моль 100% кислоты требуется 3 моль NO2 .


Масса поглощенной воды на образование 1 кг кислоты (в пересчете на 100 %-ю).
На образование 2-х моль кислоты поглощается 1 моль воды


Масса водяных паров, вносимых в абсорбер с нитрозными газами на образование 1 кг кислоты (в пересчете на 100 %-ю).

 ;
;
с учетом степени абсорбции NO2 92 % —  .
.
Для получения 50 %-ой кислоты на 1 кг кислоты требуется 1 кг воды. На разбавление полученной кислоты может использоваться 0,05 кг воды из поступающей на орошение 47,5 %-ой кислоты. Отсюда, количество кислоты подаваемой на орошение составит
0,864/0,05=17,28 кг.
Образуется оксида азота 1 моль


Тогда на образование 1 кг азотной кислоты (в пересчете на 100 %-ю) из диоксида азота потребуется:
Нитрозные газы (учетом степени абсорбции):
NO2 – 1,095 кг;
Н2 О – 0,136 кг;
Кислота на орошение 17,28 кг.
Образуется оксида азота – 0,238 кг.
Всего получаем кислоты (в пересчете на 100 %-ю):
17,28·0,475+1=9,208 кг или 2·9,208=18,416 кг 50 %-ой кислоты.
17,28 кг кислоты абсорбирует 1,095 кг NO2, тогда 1 кг кислоты абсорбирует Х кг NO2 :

 .
.
Поступает с учетом степени абсорбции 92 % — 
Образуется оксида азота:

 .
.
Поглощается воды:

 .
.
Из 0,136 кг воды, содержащейся в нитрозных газах

 .
.
Образуется 100% кислоты при абсорбции 1 кг 47,5 %-ой кислоты:
0,063+0,008 — 0,014 = 0,057 кг
0,057+0,475 = 0,532 кг.
Материальный баланс абсорбера
Таблица 6.2.
№ п/п | Приход | кг | т/сут | № п/п | Расход | кг | т/сут |
1 | Азотная кислота 47,5% | 1 | 644,46 | 1 | Азотная кислота 50 % | 1,064 | 685,71 |
в том числе: | в том числе: | ||||||
HNO3 | 0,475 | 306,12 | HNO3 | 0,532 | 342,86 | ||
h3 O | 0,525 | 338,34 | h3 O | 0,532 | 342,86 | ||
2 | Нитрозные газы | 0,495 | 297,12 | ||||
в том числе: | 2 | NO | 0,019 | 12,49 | |||
NO2 | 0,069 | 45,85 | 3 | N2 | 0,382 | 224,60 | |
h3 O | 0,008 | 5,05 | 4 | O2 | 0,031 | 18,43 | |
NO | 0,005 | 3,19 | 5 | NO2 | 0,006 | 3,99 | |
N2 | 0,382 | 224,60 | |||||
O2 | 0,031 | 18,43 | |||||
ИТОГО: | 1,495 | 941,58 | ИТОГО: | 1,502 | 945,21 |
Расхождение баланса составляет:
 , что вполне допустимо.
, что вполне допустимо.
ЛИТЕРАТУРА
1. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
2. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
3. Основы химической технологии: Учебник для студентов вузов / Под ред. Мухленова И.П. – М.: «Высшая школа», 1983. – 335 с.
4. Соколов Р.С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. – М.: Гуманит. изд. центр БЛАДОС, 2000. – Т.1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ. – 368 с.
www.ronl.ru
ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
Азотная кислота является одной из важнейших минеральныхкислот и по объему производства занимает второе место после серной кислоты. Онаобразует растворимые в воде соли (нитраты), обладает нитрующим и окисляющимдействием по отношению органических соединений в концентрированном видепассивирует черные металлы. Все это обусловило широкое использование азотнойкислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температуройкристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3.Смешивается с водой во всех отношениях, образуя при этом индивидуальныесоединения — гидраты состава HNO3·Н2Ои HNO3 · 3Н2О, которые дают три эвтектики (рис.1.1).
/>
Рис.1.1 Диаграмма кристаллизации системы «HNO3– NO2»
Температура кипения водных растворов азотной кислоты зависитот их концентрации. С увеличением концентрации температура кипения возрастает,достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), послечего снижается (рис. 1.2). Это имеет существенное значение для концентрированияазотной кислоты.
/>
Теплота разбавления азотной кислоты водой существенноменяется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислотамалоустойчива термически и разлагается уже при хранении по уравнению:
/>
Рис. 1.2. Диаграмма кипения Рис. 1.3.Теплота разбавления
системы HNO3– Н2О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:
/>
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевыйцвет. Для удаления оксида из кислоты в технологическом процессе ее производствапредусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3·NO2 (нитроолеум), являющийсяпромежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кромезолота, платины, титана, тантала, родия и иридия, однако в концентрированномвиде пассивирует железо и его сплавы.
Областиприменения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%)расходуется на производство азотных и комплексных минеральных удобрений иразнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетноготоплива, остальное количество потребляется производством красителей,органическим синтезом и в цветной металлургии (травление металлов).
/>
Рис. 1.4. Области применения азотнойкислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислотапроизводится исключительно из аммиака. Поэтому структура сырья азотнокислотногопроизводства совпадает со структурой сырья для производства аммиака, как этовидно из рис. 2.1.
/>
Рис.2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производятиз синтетического аммиака, получаемого на основе конверсии природного газа.Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и парыкомпрессорного масла, являющиеся каталитическими ядами на стадии окисленияаммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием черезматерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком.Аналогично очищают от механических и химических примесей воздух, которыйпоступает в цех через заборную трубу, устанавливаемую как правило, вдали оттерритории предприятия. Для очистки воздуха используются орошаемые водойскрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получениеразбавленной кислоты с последующим концентрированием ее в случае необходимостии
—непосредственноеполучение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованиемв народном хозяйстве как концентрированной, так и разбавленной кислоты. Методыразличаются физико-химическими закономерностями протекающих процессов итехнологическими схемами. Однако независимо от схемы, синтез азотной кислоты изаммиака описывается общей химической схемой:
/>
Первая стадия процесса (конверсия аммиака) одинакова как дляполучения разбавленной, так и для получения концентрированной кислоты, втораястадия (переработка нитрозных газов) отличается рядом особенностей. Решающеезначение при выборе параметров той или иной технологической схемы имеет выбороптимального давления на каждой из стадий процесса. В производстве азотнойкислоты повышение давления существенно интенсифицирует химические реакции навсех стадиях процесса, способствует эффективности теплообмена, позволяетиспользовать более совершенные массообменные устройства, уменьшает размерыаппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативноевлияние на экономические показатели работы агрегата. К ним относятся: ускорениепобочных реакций на стадии окисления аммиака, снижение степени конверсии,потери катализатора вследствие его уноса потоком газа и необходимость частойзамены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применениеединого (повышенного) давления на всех стадиях производства целесообразно лишьв том случае, когда мощность установки не превышает 600—800 т/сутки. Установкибольшей мощности экономически выгодно создавать только с использованием разныхдавлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты изаммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторевозможно протекание следующих реакций:
4Nh4 + 502 = 4NO + 6Н20 — ΔН ΔН=907,3кДж (1)
4Nh4 + 402 = 2N20 + 6Н20 — ΔН ΔН = 1104,9 кДж (2)
4Nh4 + 302 = 2N2 + 6Н20 — ΔН ΔН =1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4Nh4 + 6NO = 5N2 + 6h30-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направлениепроцесса окисления определяется соотношением скоростей реакций 1—4. Из трехосновных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболеевероятна, так как протекает с максимальным выделением тепла. Поэтому, вотсутствии катализатора окисление аммиака идет преимущественно до элементарногоазота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующиекатализаторы, В современных установках используют платиновые катализаторы ввиде пакета сеток из сплава платины с 7,5% родия, или двухступенчатыекатализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность иуменьшает потери платины за счет ее уноса током газа. Поверхность подобныхкатализаторов достигает 1,5 м2/м3 объема.
Механизм гетерогенного каталитического окисления аммиакасостоит из следующих последовательных стадий:
—диффузия молекуламмиака и кислорода из газовой фазы к поверхности катализатора;
—активированнаяадсорбция молекул кислорода на поверхности катализатора с образованиемпромежуточного соединения;
—хемосорбциямолекул аммиака и образование комплекса;
—разложениекомплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
—диффузияпродуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления являетсяскорость диффузии кислорода к поверхности катализатора. Следовательно,каталитическое окисление аммиака на платиновом катализаторе протекаетпреимущественно в диффузионной области, в отличие от окисления на окисномкатализаторе, которое идет в кинетической области.
Платиновые катализаторы весьма чувствительны к каталитическимядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь(АмВС). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород иорганические соединения серы обратимое отравление. Так как вследствие этогоактивность катализатора снижается, его периодически регенерируют промывкойсоляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается ичастицы его уносятся с потоком газа. Эррозия катализатора тем больше, чем вышетемпература, давление и объемная скорость газа, проходящего через катализатор.Для систем, работающих под высоким давлением, унос катализатора составляет0,3—0,4 г на 1 тонну азотной кислоты.
В присутствии платиновых катализаторов селективность процессаокисления аммиака до оксида азота (II):
/> (5)
составляет0,95—0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:
/> (6)
где: /> — парциальное давление аммиака,окисляемого до оксида азота (II),
/> — парциальное давление аммиака, окисляемого дооксида азота (I) и элементарного азота (реакции2иЗ),
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
Из двух реакций (2 и 3), конкурирующих с целевой реакциейокисления аммиака (1), наиболее опасной является реакция 3, приводящая кобразованию элементарного азота. Скорость обеих реакций (1 и 3) может бытьописана общим для гетерогенных реакций уравнением:
/> (7)
и зависит от таких параметров процесса как температура (черезКм), давление и состав АмВС, то есть отношение кислород: аммиак (через АС),время контактирования, то есть время пребывания АмВС в зоне катализатора.Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1 и до азота по реакции3 и, следовательно, выход продуктов окисления, различно.
4.1. Температура. Повышение температуры способствуетувеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому,является наиболее эффективным средством, увеличения скорости процесса,протекающего преимущественно в диффузионной области. Это подтверждаетсятермодинамическими данными табл. 15.1.
Термодинамические характеристики реакций окисления аммиака
Таблица 4.1.
РеакцияΔН,
Дж/моль
AG, кДж/моль 298°К1173оК
4Nh4 + 502 = 4NO + 6Н20
-226,0 -246,2 -414,64Nh4 + 302 = 2Н2 + 6Н20
-317,2 -326,9 -335,2Из таблицы следует, что вероятность реакции окисления дооксида азота (II) с повышением температуры возрастаетпочти вдвое, а реакции окисления до азота почти не изменяется. Зависимостьвыхода оксида азота (II) иэлементарного азота от температуры представлена на рис. 4.1.
4.2. Состав АмВС, Соотношение аммиака и кислорода в газовой смесивлияет на температурный режим и общую скорость процесса в том случае, еслилимитирующей в нем является химическая реакция, то есть процесс протекает вкинетической области. При стехиометрическом соотношении компонентов в АмВСстепень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксидаазота (II) процесс ведут при отношении О2: Nh4 = 1,8—2,0, что соответствует содержанию в АмВС0,095—0,105 об. долей аммиака и 0,18—0,19 об. долей кислорода. Избытоккислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВСобеспечивает автотермичность процесса окисления и лежит за пределомвзрывчатости АмВС. Зависимость выхода оксида азота (II) от состава АмВС представлена на рис. 4.2.
/>
Рис.4.1. Зависимость выхода NO и N2 Рис. 4.2. Зависимость выхода NO от температуры от состава АмВС
3. Давление. Повышение давления ускоряет процесс окисления аммиаказа счет увеличения концентрации реагентов и производительности катализатора,что позволяет сократить размеры аппаратуры. При этом, однако, снижается выходоксида азота (II) и увеличивается эрозия и уноскатализатора, что удорожает продукцию. Так, если при атмосферном давлении (105Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, топри давлении 0,8 МПа он достигает 0,4 г/тонну. Зависимость выхода оксида азота(II) от давления при различнойтемпературе приведена на рис. 4.3.
4. Время контактирования, Скорость каталитического окисленияаммиака до оксида азота (II)весьма высока. За десятитысячные доли секунды степень превращения составляет0,9 7— 0,98 дол. ед. при атмосферном давлении и 0,98—0,96 при давлении 0,8—1,0МПа. Время контактирования может быть рассчитано из формулы:
/> (8)
где: Vk— объем катализатора, определяемый в случае платинового катализаторачислом сеток в пакете, W—объемная скорость АмВС. Время контактирования зависит от природы катализатора исоставляет; для платиновых катализаторов 10-4 — 10-5с,для окисных катализаторов около
10-2с. Увеличение времени контактирования, то естьснижение объемной скорости АмВС приводит к развитию реакции окисления аммиакадо элементарного азота (рис. 4.4.).
/>
Рис. 4.3. Зависимостьвыхода оксида Рис. 4.4. Зависимость выхода оксида
азота (II) от давления Т1<T2<T3. азота (II) и азота от времени
контактирования.
Оптимальный режим процесса на этой стадии должен обеспечитьселективность окисления аммиака, минимальные потери катализатора вследствие егоуноса и автотермичность процесса. Этим требованиям удовлетворяют следующиеусловия: температура 800°С, давление 0,1—1,0 МПа, молярное отношение О2: Nh4 — 1,8—2,0, время контактирования
1—2·10-4 с.
Для соблюдения этих условий исходная АмВС должна иметьсостав: аммиак 0,10—0,115 об. дол., кислород 0,18—0,19 об. дол., азот 0,70—0,72об. дол.
При использовании АмВС такого состава нитрозные газы,выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксидаазота (II).
Абсорбцияоксида азота (IV)
Нитрозныегазы, поступающие на абсорбцию, представляют сложную смесь различных оксидовазота (NO2, N2O4, NO, N2О), элементарного азота, кислорода и паров воды. Ихсостав зависит от условий окисления, то есть от состояния системы, описываемогореакциями 9-11.
Всеоксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, заисключением оксида азота (II),взаимодействуют с ней. Поглощение их водой сопровождается химической реакциейхемосорбции, протекающей в системе «газ— жидкость», описываемой уравнениями:
/>, где ΔН=116 кДж (9)
/>, где ΔН=59 кДж (10)
ираспада нестойкой азотистой кислоты по уравнению:
/>, где ΔН=76 кДж (11)
Суммируяуравнения 9 и 11 и 10 и 11, получаем итоговые уравнения поглощения оксидовазота водой:
/>, где ΔН=136 кДж (12)
/>, где ΔН=101 кДж (13)
Из этихуравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислотыи один моль оксида азота (II),который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизмобразования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся воднойазотной кислотой, заключается в том, что оксид азота (IV) диффундирует через Пограничный слой газа к поверхностижидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 9) со скоростью, превышающейскорость диффузии и скорость реакции разложения азотистой кислоты (реакция 11).
Образующийсяоксид азота (II) выделяется в газовую фазу, гдеокисляется кислородом до оксида азота (IV).
Скоростьпроцесса абсорбции оксида азота (IV)водой описывается уравнением для гетерогенных процессов:
/> (14)
где Δр — движущая сила абсорбции,
/> — парциальное давление NO2 в газовой фазе,
/> — равновесное давление NO2 у поверхности водногораствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастаетравновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.
/>
Рис. 4.5. Зависимость абсорбционного объема от степениабсорбции.
Состояние системы «NO2-HNO3-h3O» и, следовательно, концентрацияполучаемой азотной кислоты зависит от температуры, давления, парциальногодавления оксида азота (IV) впоглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижениитемпературы и концентрации кислоты и повышения давления степень абсорбцииоксида азота (IV) водной азотной кислотой возрастает,при том тем интенсивнее, чем выше концентрация его в нитрозных газах. Приатмосферном давлении и температуре 25°С абсорбция оксида азота практическипрекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис. 4.6).
Таким образом, возможность получения азотной кислотыконцентрацией более 0,65 масс. дол. объективно ограничена температурой идавлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальныхусловиях производства при температуре 40оС, давлении 0,1 МПа ипонижении содержания оксида азота вследствие его поглощения из газаконцентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотнойкислоты более высокой концентрации требует иной технологии.
/>
Рис. 4.6. Зависимость степени абсорбции NO2 от концентрации образующейся кислоты.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры.Повышение степени абсорбции требует, особенно, в конце процесса, значительногоувеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол.ед., может быть достигнута при Vaб=22м3/ т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на6,5% абсорбционный объем должен быть увеличен до 70 м3/т. (рис. 4.5.).Так как увеличение абсорбционного объема вызывает резкое возрастаниекапитальных затрат, то экономически более выгодно не добиваться степениабсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочнымипоглотителями с последующим окислением образовавшегося нитрита натрияконцентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
/>,
/>.
5. Производство разбавленной азотнойкислоты
Принципиальнаятехнологическая схема производства разбавленной азотной кислоты под атмосфернымдавлением представлена на рис. 5.1.
Воздух поступает в систему через заборную трубу,устанавливаемую в местности с чистым воздухом, как правило, вдали от территориизавода. Для очистки воздуха от механических и химических примесейустанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак,поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировкагазов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4.Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газыс температурой около 800°С поступают в котел-утилизатор 6, гдевырабатывается пар, а температура газов снижается до 250°С. Затем газыохлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (насхеме показан один). При этом происходит конденсация водяных паров и внебольшой степени окисление оксида азота до диоксида, который, частичнопоглощаясь конденсатом, дает разбавленную азотную кислоту.
После этого нитрозные газы газодувкой 8 подаются вабсорбционные башни 9, заполненные насадкой из кислотоупорных колец. Последняяпо ходу газа башня орошается водой, а из первой башни отбирается продукционнаякислота. Циркуляция кислоты в системе осуществляется насосами 10. Дляохлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники11. В поглотительных башнях перерабатывается примерно 92% оксидов азота.Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционнымибашнями устанавливается окислительная башня 12, где происходит частичноеокисление NО до диоксида азота. Далее газы поступают в башню 13 (обычнодве) для поглощения NО и NО2раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместораствора соды можно применять раствор едкого натра или Са(ОН)2.Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу.
www.ronl.ru
Оглавление
Введение
1. Технологические свойства азотной кислоты
2. Сырье для производства азотной кислоты
3. Общая схема азотнокислотного производства
4. Прямой синтез концентрированной азотной кислоты
4.1 Физико-химические основы и принципиальная схема процесса прямого синтеза
4.2 Технологическая схема производства концентрированной азотной кислоты прямым синтезом
4.3 Расходные коэффициенты в процессах производства концентрированной азотной кислоты
Заключение
Список используемой литературы
Введение
Азотная кислота — одна из важнейших минеральных кислот. По объему производства в химической промышленности она занимает второе место после серной кислоты. Азотная кислота широко применяется для производства многих продуктов, используемых в промышленности и сельском хозяйстве:
около 40% ее расходуется на получение сложных и азотных минеральных удобрений;
азотная кислота используется для производства
синтетических красителей,
взрывчатых веществ,
нитролаков,
пластических масс,
лекарственных синтетических веществ и др. ;
железо хорошо растворяется в разбавленной азотной кислоте. Концентрационная азотная кислота образует на поверхности железа тонкий, но плотный слой нерастворимого в концентрированной кислоте оксида, защищающего металл от дальнейшего разъедания. Эта способность железа пассивироваться используется для защиты его от коррозии.
Концентрированную азотную кислоту (особенно с добавлением 10% h3SO4) перевозят обычно в стальных цистернах. Многие органические вещества (в частности животные и растительные ткани) при действии HNO3 разрушаются, а некоторые из них от соприкосновения с очень концентрированной кислотой могут воспламеняться. В лабораторной практике обычно применяется азотная кислота, содержащая около 65% HNO3 (пл. 1,40). В промышленности применяют два сорта азотной кислоты: разбавленную с содержанием 50−60% HNO3 и концентрированную, содержащую 96−98% HNO3.
1. Технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения -- 82,6°С и плотностью -- 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения -- гидраты состава HN03-h30 и НЖ> з-ЗН20, которые дают три эвтектики (рис. 1).
Рис. 1. Диаграмма кристаллизации системы «HNO3 — h3O»
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (мае), после чего снижается (рис. 2). Это имеет существенное значение для концентрирования азотной кислоты.
Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
Рис. 2. Диаграмма кипения системы «HNO3 — h3O»
Скорость разложения возрастает с повышением концентрации; для 99% -ной кислоты температурный градиент составляет всего 5 °C.
При нагревании процесс ускоряется и протекает по уравнению:
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желтооранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение составаHN03-N02 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 4.
Рис. 4. Сырье для производства азотной кислоты
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую, как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
азотная кислота синтез концентрация
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
-- получение разбавленной кислоты с последующим концентрированием ее в случае необходимости и
-- непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:
Первая стадия процесса (конверсия аммиака) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более совершенные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимость частой замены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600--800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Прямой синтез концентрированной азотной кислоты
Внедрение в производство этого метода получения концентрированной азотной кислоты вызвано высокой энергоемкостью (расход тепла на упаривание ВОС) процессов концентрирования разбавленной кислоты.
4.1 Физико-химические основы и принципиальная схема процесса прямого синтеза
В основе прямого синтеза концентрированной азотной кислоты лежит взаимодействие жидкого тетроксида азота с водой и газообразным кислородом под давлением 5 МПа, протекающее по уравнению:
Необходимое условие этого процесса -- предварительное получение жидкого тетроксида из нитрозного газа. 100% -ный оксид азота (IV) димеризуется в тетроксид уже при атмосферном давлении и температуре 21,5С. Однако в нитрозном газе его содержание составляет не более 11%. Перевести оксид азота (IV) в тетроксид при такой концентрации его при атмосферном давлении невозможно. Даже при -- 20 °C и давлении 1 МПа степень превращения его в тетроксид в этом случае не превышает 85%.
Для выделения 100%-ного диоксида азота (IV) из нитрозного газа используют его способность растворяться в концентрированной азотной кислоте с образованием нитроолеума состава HNO3. NO2. При последующем разложении нитроолеума образуется концентрированная азотная кислота как товарный продукт и оксид азота (IV), сжижаемый при охлаждении в тетроксид азота. Процесс этот представлен в виде схемы на рис. 5.
Процесс прямого синтеза концентрированной азотной кислоты включает следующие стадии:
1. Выделение тетроксида азота из нитрозного газа:
Рис-5. Схема выделения оксида азота (IV) из нитрозного газа
2. Образование азотной кислоты:
3. Окисление оксида азота (II) концентрированной азотной кислотой:
Суммарное уравнение процесса с учетом агрегатного состояния реагентов:
Решающее значение в этом процессе имеет полнота сдвига равновесия:
которая определяется содержанием оксида азота (IV) в нитрозном газе, температурой и давлением. Поэтому, концентрация получаемой азотной кислоты зависит от давления (рис. 6).
Рис. 6. Взаимозависимость концентрации азотной кислоты и давления
4.2 Технологическая схема производства концентрированной азотной кислоты прямым синтезом
Технологическая схема производства концентрированной азотной кислоты прямым синтезом из жидких оксидов азота представлена на рис. 7. Она включает операции: охлаждение нитрозных газов в котле-утилизаторе и холодильнике-конденсаторе, окисление оксида азота (II) до оксида азота (IV), доокисление оксида азота (II) азотной кислотой, охлаждение нитрозных газов в рассольном холодильнике, поглощение оксида
Рис. 7. Технологическая схема производства азотной кислоты прямым синтезом:
азота (IV) азотной кислотой, обезвреживание отходящих газов, выделение оксида азота (IV) из раствора в азотной кислоте (нитроолеума), охлаждение оксидов азота водой и рассолом, приготовление смеси жидкого тетроксида азота и азотной кислоты, окисление тетроксида азота кислородом до азотной кислоты, десорбция избытка тетроксида азота из азотной кислоты.
Нитрозный газ поступает в скоростной холодильник 1, где охлаждается до 40 °C, причем из него выделяется 3% -ная азотная кислота, и затем в холодильник 2. Образовавшаяся в нем 30% -ная азотная кислота направляется в смеситель 7, а нитрозные газы в окислительную башню 3, орошаемую для охлаждения азотной кислотой. Из окислительной башни нитрозные газы поступают в доокислитель4, орошаемой 98% -ной азотной кислотой и затем, после охлаждения до -10°С в рассольном холодильнике 5, в абсорбционную колонну 6 для поглощения окси* да азота (IV) и получения нитроолеума. С этой целью колонна орошается 98% -ной азотной кислотой. Непоглощенные газы из верхней части колонны направляются в систему очистки выхлопных газов. Образовавшийся в абсорбционной колонне нит-роолеум подается на десорбцию оксида азота (IV) в отбелочную колонну с?, куда вводится пар. Отбеленная азотная кислота концентрацией 98% охлаждается в холодильнике 10 и поступает в хранилище. Газообразные оксиды азота из отбелочной колонны охлаждаются и конденсируются в холодильнике-конденсаторе 11у охлаждаемом рассолом до -10°С и поступают в смеситель 7, в котором из них и смеси кислот образуется смесь: 68-- 80% N204, 26--10,5% HN03 и 6--9,5% Н20. Эта смесь подается в автоклав 0, куда под давлением 5 МПа поступает кислород. Концентрированная азотная кислота отбирается из нижней части автоклава и соединившись с нитроолеумом из абсорбционной колонны 6 подается в отбелочную колонну 8.
Новыми в этой схеме являются автоклав и абсорбционная колонна.
Автоклав -- это цилиндрический вертикальный реактор непрерывного действия диаметром 1,2 м и высотой 8,6 м, изготовленный из стали, внутри которого находится стакан из алюминия. В стакане расположена насадка из ситчатых тарелок. Смесь кислоты с жидким тетроксидом азота перетекает по тарелкам сверху вниз, а снизу под давлением подается кислород.
Абсорбционная колонна диаметром 2,4 м и высотой 27 м состоит из трех зон: доокислительной, нитроолеумной и промывной, в каждой из которых расположены тарелки. Между тарелками доокислительной и нитроолеумной зон расположены охлаждающие змеевики, поддерживающие оптимальный тепловой режим работы колонны.
4.3 Расходные коэффициенты в процессах производства концентрированной азотной кислоты
В табл.1 приведены расходные коэффициенты (РК) в расчете на 1 т азотной кислоты для процессов концентрирования с помощью серной кислоты и прямого синтеза.
Таблица 1. Расходные коэффициенты производства концентрированной азотной кислоты разными способами
Из данных табл. 2. следует, что экономически более выгодным остается метод концентрирования разбавленной азотной кислоты.
Промышленность выпускает три сорта разбавленной и два сорта концентрированной азотных кислот. Согласно ГОСТ-701 они должны удовлетворять следующим условиям (табл. 2).
Таблица 2. Стандарты на азотную кислоту
Заключение
Исключительное значение азотной кислоты для многих отраслей народного хозяйства и оборонной техники и большие объемы производства обусловили интенсивную разработку эффективных и экономически выгодных направлений совершенствования азотнокислотного производства. К таким направлениям относятся:
-- создание систем высокой единичной мощности (до 400 тыс. т/год), работающих по комбинированной схеме;
-- разработка высокоактивных избирательно действующих неплатиновых катализаторов окисления аммиака;
-- возможно более полное использование энергии сжатых отходящих газов и низкопотенциальной теплоты процессов путем создания полностью автономных энерготехнологических схем;
-- создание замкнутого оборота охлаждающей воды;
-- решение проблемы очистки отходящих газов с утилизацией оксидов азота путем внедрения адсорбционно-десорбционного метода очистки на силикагеле и цеолитах;
-- возможно более полное удаление остатков оксидов азота из отходящих газов с использованием в качестве восстановителей горючих газов и аммиака.
Список используемой литературы
1. Соколов Р. С. Химическая технология: Учеб. Пособие для студ. Высш. Учеб. Заведений: В 2 т. — М.: Гумат. Изд. Центр ВЛАДОС, 2003.
2. Купетов А. М. и др. Общая химическая технология. — М.: Высшая школа, 1985.
3. Общая химическая технология. Под ред. А. Г. Амелина.- М.: Химия, 1977.
Показать Свернутьwestud.ru
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3 ) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3 ·Н2 О и HNO3 · 3Н2 О, которые дают три эвтектики (рис. 1.1).

Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2 »
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.

Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2 О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:

Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3 ·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).

Рис. 1.4. Области применения азотной кислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 2.1.

Рис. 2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получение разбавленной кислоты с последующим концентрированием ее в случае необходимости и
—непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:

Первая стадия процесса (конверсия аммиака) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более совершенные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимость частой замены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600—800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты из аммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
4Nh4 + 502 = 4NO + 6Н2 0 — ΔН ΔН=907,3 кДж (1)
4Nh4 + 402 = 2N2 0 + 6Н2 0 — ΔН ΔН = 1104,9 кДж (2)
4Nh4 + 302 = 2N2 + 6Н2 0 — ΔН ΔН = 1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4Nh4 + 6NO = 5N2 + 6h3 0-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1—4. Из трех основных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому, в отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы, В современных установках используют платиновые катализаторы в виде пакета сеток из сплава платины с 7,5% родия, или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность и уменьшает потери платины за счет ее уноса током газа. Поверхность подобных катализаторов достигает 1,5 м2 /м3 объема.
Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий:
—диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора;
—активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения;
—хемосорбция молекул аммиака и образование комплекса;
—разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
—диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области.
Платиновые катализаторы весьма чувствительны к каталитическим ядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь (АмВС). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород и органические соединения серы обратимое отравление. Так как вследствие этого активность катализатора снижается, его периодически регенерируют промывкой соляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается и частицы его уносятся с потоком газа. Эррозия катализатора тем больше, чем выше температура, давление и объемная скорость газа, проходящего через катализатор. Для систем, работающих под высоким давлением, унос катализатора составляет 0,3—0,4 г на 1 тонну азотной кислоты.
В присутствии платиновых катализаторов селективность процесса окисления аммиака до оксида азота (II):
 (5)
(5)
составляет 0,95—0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:
 (6)
(6)
где: 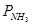 — парциальное давление аммиака, окисляемого до оксида азота (II),
— парциальное давление аммиака, окисляемого до оксида азота (II),
 — парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
— парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота (реакции2иЗ),
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
Из двух реакций (2 и 3), конкурирующих с целевой реакцией окисления аммиака (1), наиболее опасной является реакция 3, приводящая к образованию элементарного азота. Скорость обеих реакций (1 и 3) может быть описана общим для гетерогенных реакций уравнением:
 (7)
(7)
и зависит от таких параметров процесса как температура (через Км), давление и состав АмВС, то есть отношение кислород: аммиак (через АС), время контактирования, то есть время пребывания АмВС в зоне катализатора. Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1 и до азота по реакции 3 и, следовательно, выход продуктов окисления, различно.
4.1. Температура. Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому, является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными табл. 15.1.
Термодинамические характеристики реакций окисления аммиака
Таблица 4.1.
Реакция | ΔН, Дж/моль | AG, кДж/моль | |
298°К | 1173о К | ||
4Nh4 + 502 = 4NO + 6Н2 0 | -226,0 | -246,2 | -414,6 |
4Nh4 + 302 = 2Н2 + 6Н2 0 | -317,2 | -326,9 | -335,2 |
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется. Зависимость выхода оксида азота (II) и элементарного азота от температуры представлена на рис. 4.1.
4.2. Состав АмВС, Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АмВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2: Nh4 = 1,8—2,0, что соответствует содержанию в АмВС 0,095—0,105 об. долей аммиака и 0,18—0,19 об. долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости АмВС. Зависимость выхода оксида азота (II) от состава АмВС представлена на рис. 4.2.

Рис. 4.1. Зависимость выхода NO и N2 Рис. 4.2. Зависимость выхода NO от температуры от состава АмВС
3. Давление. Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Так, если при атмосферном давлении (105 Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, то при давлении 0,8 МПа он достигает 0,4 г/тонну. Зависимость выхода оксида азота (II) от давления при различной температуре приведена на рис. 4.3.
4. Время контактирования, Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,9 7— 0,98 дол. ед. при атмосферном давлении и 0,98—0,96 при давлении 0,8—1,0 МПа. Время контактирования может быть рассчитано из формулы:
 (8)
(8)
где: Vk — объем катализатора, определяемый в случае платинового катализатора числом сеток в пакете, W — объемная скорость АмВС. Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10-4 — 10-5 с, для окисных катализаторов около
10-2 с. Увеличение времени контактирования, то есть снижение объемной скорости АмВС приводит к развитию реакции окисления аммиака до элементарного азота (рис. 4.4.).

Рис. 4.3. Зависимость выхода оксида Рис. 4.4. Зависимость выхода оксида
азота (II) от давления Т1 <T2 <T3. азота (II) и азота от времени
контактирования.
Оптимальный режим процесса на этой стадии должен обеспечить селективность окисления аммиака, минимальные потери катализатора вследствие его уноса и автотермичность процесса. Этим требованиям удовлетворяют следующие условия: температура 800°С, давление 0,1—1,0 МПа, молярное отношение О2: Nh4 — 1,8—2,0, время контактирования
1—2·10-4 с.
Для соблюдения этих условий исходная АмВС должна иметь состав: аммиак 0,10—0,115 об. дол., кислород 0,18—0,19 об. дол., азот 0,70—0,72 об. дол.
При использовании АмВС такого состава нитрозные газы, выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксида азота (II).
Абсорбция оксида азота ( IV )
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2 O4, NO, N2 О), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого реакциями 9-11.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ— жидкость», описываемой уравнениями:
 , где ΔН=116 кДж (9)
, где ΔН=116 кДж (9)
 , где ΔН=59 кДж (10)
, где ΔН=59 кДж (10)
и распада нестойкой азотистой кислоты по уравнению:
 , где ΔН=76 кДж (11)
, где ΔН=76 кДж (11)
Суммируя уравнения 9 и 11 и 10 и 11, получаем итоговые уравнения поглощения оксидов азота водой:
 , где ΔН=136 кДж (12)
, где ΔН=136 кДж (12)
 , где ΔН=101 кДж (13)
, где ΔН=101 кДж (13)
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через Пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 9) со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты (реакция 11).
Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением для гетерогенных процессов:
 (14)
(14)
где Δр — движущая сила абсорбции,
 — парциальное давление NO2 в газовой фазе,
— парциальное давление NO2 в газовой фазе,
 — равновесное давление NO2 у поверхности водногораствора азотной кислоты.
— равновесное давление NO2 у поверхности водногораствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.

Рис. 4.5. Зависимость абсорбционного объема от степени абсорбции.
Состояние системы «NO2 -HNO3 -h3 O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25°С абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис. 4.6).
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 масс. дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40о С, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
|
Рис. 4.6. Зависимость степени абсорбции NO2 от концентрации образующейся кислоты.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол. ед., может быть достигнута при Vaб =22 м3 / т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3 /т. (рис. 4.5.). Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
 ,
,
 .
.
5. Производство разбавленной азотной кислоты
Принципиальная технологическая схема производства разбавленной азотной кислоты под атмосферным давлением представлена на рис. 5.1.
Воздух поступает в систему через заборную трубу, устанавливаемую в местности с чистым воздухом, как правило, вдали от территории завода. Для очистки воздуха от механических и химических примесей устанавливается ситчатый пенный промыватель 1 и картонный фильтр 2. Аммиак, поступающий со склада, также очищается от примесей в картонном фильтре 3. Транспортировка газов через систему осуществляется при помощи аммиачно-воздушного вентилятора 4. Далее газовая смесь проходит в контактный аппарат 5. Горячие нитрозные газы с температурой около 800°С поступают в котел-утилизатор 6, где вырабатывается пар, а температура газов снижается до 250°С. Затем газы охлаждаются водой примерно до 30°С в кожухотрубных холодильниках 7 (на схеме показан один). При этом происходит конденсация водяных паров и в небольшой степени окисление оксида азота до диоксида, который, частично поглощаясь конденсатом, дает разбавленную азотную кислоту.
После этого нитрозные газы газодувкой 8 подаются в абсорбционные башни 9, заполненные насадкой из кислотоупорных колец. Последняя по ходу газа башня орошается водой, а из первой башни отбирается продукционная кислота. Циркуляция кислоты в системе осуществляется насосами 10. Для охлаждения разогретой кислоты, вытекающей из башен, служат водяные холодильники 11. В поглотительных башнях перерабатывается примерно 92% оксидов азота. Кроме того, в процессе абсорбции выделяется NО. Поэтому за абсорбционными башнями устанавливается окислительная башня 12, где происходит частичное окисление NО до диоксида азота. Далее газы поступают в башню 13 (обычно две) для поглощения NО и NО2 раствором соды с образованием так называемых нитрит-нитратных щелоков. Вместо раствора соды можно применять раствор едкого натра или Са(ОН)2. Обезвреженные таким образом выхлопные газы выбрасываются в атмосферу.

Рис. 5.1. Технологическая схема производства азотной кислоты под атмосферным давлением:
1 – пенный промыватель; 2, 3 – картонные фильтры; 4 – аммиачно-воздушный вентилятор; 5 – контактный аппарат; 6 – котел-утилизатор; 7 – кожухотрубный холодильник; 8 – газодувка; 9 – абсорбционные башни; 10 – циркуляционные насосы; 11 – водяной холодильник; 12 – окислительная башня; 13 – санитарная башня.
6. Расчет материального баланса процесса абсорбции нитрозных газов
Данные для расчета
1. Производительность установки – 120 тыс.т/год (на 100 % HNO3 ).
2. Число рабочих дней в году – 350.
3. Концентрация получаемой кислоты – 50 %(масс.).
4. Общая степень абсорбции NO2 – 92 %.
5. Состав поступающих на абсорбцию газов и концентрация кислоты, подаваемой на орошение абсорбера:
Таблица 6.1
Состав нитрозных газов, %(об.) | Концентрация кислоты орошающей абсорбер, %(масс.) | ||||
NO | NO2 | O2 | h3 O | N2 | |
0,95 | 8,98 | 5,86 | 2,61 | 81,6 | 47,5 |
6. База расчета – суточная производительность установки. Окисление NO в NO2 в абсорбционной башне можно не учитывать.
Расчет суточной производительности установки

Состав газа в %(масс.):
Для пересчета объемного состава в массовый и обратно необходимо знать плотность r i каждого компонента:

Масса любого газа при нормальных условиях равна его молярной массе, поделенной на объем, занимаемый одним молем, т.е.  , где
, где  — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.


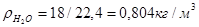

 ;
;





Расчет массы двуокиси азота
Абсорбция двуокиси азота происходит по уравнению:

Концентрация кислоты орошающей абсорбер – 47,5 %(масс.)
Содержание воды и кислоты
 — масса кислоты (в пересчете на 100 %-ю) поступающей в абсорбер;
— масса кислоты (в пересчете на 100 %-ю) поступающей в абсорбер;
 — масса воды в 47,5 %-ой кислоте.
— масса воды в 47,5 %-ой кислоте.
Рассчитаем количество реагентов для получения 1 кг кислоты (в пересчете на 100 %-ю)
На образование 2-х моль 100% кислоты требуется 3 моль NO2 .


Масса поглощенной воды на образование 1 кг кислоты (в пересчете на 100 %-ю).
На образование 2-х моль кислоты поглощается 1 моль воды


Масса водяных паров, вносимых в абсорбер с нитрозными газами на образование 1 кг кислоты (в пересчете на 100 %-ю).

 ;
;
с учетом степени абсорбции NO2 92 % —  .
.
Для получения 50 %-ой кислоты на 1 кг кислоты требуется 1 кг воды. На разбавление полученной кислоты может использоваться 0,05 кг воды из поступающей на орошение 47,5 %-ой кислоты. Отсюда, количество кислоты подаваемой на орошение составит
0,864/0,05=17,28 кг.
Образуется оксида азота 1 моль


Тогда на образование 1 кг азотной кислоты (в пересчете на 100 %-ю) из диоксида азота потребуется:
Нитрозные газы (учетом степени абсорбции):
NO2 – 1,095 кг;
Н2 О – 0,136 кг;
Кислота на орошение 17,28 кг.
Образуется оксида азота – 0,238 кг.
Всего получаем кислоты (в пересчете на 100 %-ю):
17,28·0,475+1=9,208 кг или 2·9,208=18,416 кг 50 %-ой кислоты.
17,28 кг кислоты абсорбирует 1,095 кг NO2, тогда 1 кг кислоты абсорбирует Х кг NO2 :

 .
.
Поступает с учетом степени абсорбции 92 % — 
Образуется оксида азота:

 .
.
Поглощается воды:

 .
.
Из 0,136 кг воды, содержащейся в нитрозных газах

 .
.
Образуется 100% кислоты при абсорбции 1 кг 47,5 %-ой кислоты:
0,063+0,008 — 0,014 = 0,057 кг
0,057+0,475 = 0,532 кг.
Материальный баланс абсорбера
Таблица 6.2.
№ п/п | Приход | кг | т/сут | № п/п | Расход | кг | т/сут |
1 | Азотная кислота 47,5% | 1 | 644,46 | 1 | Азотная кислота 50 % | 1,064 | 685,71 |
в том числе: | в том числе: | ||||||
HNO3 | 0,475 | 306,12 | HNO3 | 0,532 | 342,86 | ||
h3 O | 0,525 | 338,34 | h3 O | 0,532 | 342,86 | ||
2 | Нитрозные газы | 0,495 | 297,12 | ||||
в том числе: | 2 | NO | 0,019 | 12,49 | |||
NO2 | 0,069 | 45,85 | 3 | N2 | 0,382 | 224,60 | |
h3 O | 0,008 | 5,05 | 4 | O2 | 0,031 | 18,43 | |
NO | 0,005 | 3,19 | 5 | NO2 | 0,006 | 3,99 | |
N2 | 0,382 | 224,60 | |||||
O2 | 0,031 | 18,43 | |||||
ИТОГО: | 1,495 | 941,58 | ИТОГО: | 1,502 | 945,21 |
Расхождение баланса составляет:
 , что вполне допустимо.
, что вполне допустимо.
ЛИТЕРАТУРА
1. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
2. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
3. Основы химической технологии: Учебник для студентов вузов / Под ред. Мухленова И.П. – М.: «Высшая школа», 1983. – 335 с.
4. Соколов Р.С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. – М.: Гуманит. изд. центр БЛАДОС, 2000. – Т.1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ. – 368 с.
www.ronl.ru