
Оксидом является соединение, образованное двумя химическими элементами, один из которых кислород. Практически все элементы Периодической системы Менделеева Д. И. способны образовывать оксиды. Но оксиды Гелия, Неона, Аргона не получены. Наиболее известным и широко распространённым оксидом является вода. Она повсюду. Даже радуга – это результат преломления солнечных лучей в каплях воды.
Элемент с постоянной валентностью образует один оксид. Например, у двухвалентного кальция оксид: CaO. Если у элемента переменная валентность, то он способен образовывать несколько оксидов. Примером являются окиды хрома: СrO, Сr2O3, СrO3.
Формула определяется в зависимости от валентностей составляющих элементов. Приведём пример для оксида серы. 1.Кислород двухвалентен. Сера черырёхвалентна. Пишем валентности над символами IV II химических элементов: SO. 2. Определяем наименьшее число, которое делится на 2 и 4. Таким числом является 4. 3. Определяем индекс возле серы: делим полученное число на значение валентности 4/4=1. Значит, индекс возле серы не пишем. 4. Этим же методом находим индекс возле кислорода: 4/2=2. 5. Получили формулу: SO2.
Причиной эффекта собачьей пещеры в Италии является оксид углерода СО2. Он тяжелее воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек может легко пройти по ней.
В 1890 году парусное судно «Малборо» направлялось в Англию из Новой Зеландии. На борту было 23 члена экипажа и несколько пассажиров. В Англию судно не прибыло. Лишь через 23 года корабль появился вновь возле Огненной Земли. Шёл на всех парусах и оказался абсолютно не повреждённым. Оказывается, что причиной гибели людей стало извержение вулкана на острове Мартиника. Вулканические газы содержали 1,6% СО.

СО не растворяется в воде, не обладает запахом, определить его сложно. А на людей и животных воздействует, как яд. При этом для некоторых видов рыб он не опасен, хотя китоподобные могут погибнуть и при очень небольшой концентрации газа в воздухе. Холоднокровные, например жабы, могут переносить концентрацию СО в 1000 раз большую, чем теплокровные.
Кислотные дожди появляются, когда с атмосферным кислородом и водяным паром соединяются оксиды серы и азота. Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.

Оксид серы выбросов реагирует с водой, в результате образуется сернистая кислота: SO2+h3O=h3SO3. И взаимодействуя с кислородом воздуха, она частично превращается в серную кислоту: 2Н2SO3+О2=2Н2SO4.
Оксиды азота появляются в атмосфере в результате реакций азота и кислорода. Взаимодействие осуществляется при высоких температурах сгорания топлива N2+O2=2NO Но образуемое соединение быстро взаимодействует с кислородом: 2NO+O2=2NO2, А полученный оксид азота реагирует с влагой из окружающей среды 2NO2+Н2О=НNO2+НNO3.
Таким образом в воздухе появляются примеси кислот: серной, сернистой, азотной и азотистой. И эти примеси с осадками попадают на землю. Кислотные дожди негативно сказываются на росте растений, здоровье животных и людей.
В 1952 году непрозрачный туман охватил улицы Лондона, в результате чего погибло 4000 жителей. Частички смога раздражали дыхательные пути, а в лёгких появлялась слизь. Многие люди получили сердечные приступы с предшествующим тяжёлым кашлем. По оценкам учёных тот туман был более кислым, чем лимонный сок. Затем правительством было запрещено сжигать в городе топливо, образующее большое количество дыма. Это было сделано во избежание образования серной и азотной кислот.
Урожайность многих культур уменьшается на 3-8%, потому что листья повреждаются кислотами. Изменяется состав воды в озёрах и ставках. В результате погибает рыба и многие виды насекомых. Исчезают птицы и животные, которые ими питаются. У улиток истончается карбонатная раковина, которая защищает их. В результате они гибнут. Также разрушаются ракушки обитателей водоёмов. Это негативно сказывается на экосистемах.
Кислотные дожди закисляют почвы. Большинству растений это не по нраву. Существует совсем немного растений, способных расти на кислых почвах без ущерба для себя. Такое растение - хвощ полевой. Из-за жёсткости им не питаются травоядные животные.
Кроме того кислотные дожди увеличивают коррозию металлов, разрушают мрамор и известняк.
После того, как был определён вред подобных дождей, в развитых странах стали устанавливать улавливатели, не пропускающие кислотные оксиды в воздух.
Получение оксидов происходит с помощью различных способов. Из наиболее простых 2h3 + O2 = 2h3O

Существуют основные и кислотные оксиды. Они различаются тем, что при взаимодействии оксида с водой образуется либо кислота, либо основание. Эти реакции относят к реакциям соединения:
СаО+Н2О=Са(ОН)2.
1. Основные оксиды и кислотные оксиды способны взаимодействовать между собой: СаО+SO3=CaSO4 2. Основные оксиды взаимодействуют с кислотами. Образуются соответствующая соль и вода: CaO+h3SO4=CaSO4+h3O 3. Образуются соответствующая соль и вода и при взаимодействии кислотных оксидов со щелочами: СО2+2NaOH=Na2CO3+h3O.
В химии существуют вещества, проявляющие двойственность свойств. Это подобные двуликому Янусу амфотерные оксиды. Выступают как в качестве кислотных, так и в качестве основных оксидов. Поэтому со щелочами они проявляют особенности, характерные для кислотных оксидов, а с кислотами – основных.
Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо. Песок, состоящий преимущественно состоит из SiO2, используют при производстве стекла.
Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.

Эти соединения могут как дарить жизнь, так и разрушать её. То есть значение оксидов в жизни человека и природе является довольно существенным.
www.himikatus.ru
Содержание
Введение1. Определение оксидов2. Классификация оксидов3. Физические и химические свойства4. Способы полученияЗаключениеСписок использованных источников
Введение
Современная химия является одной из естественных наук и определяет собой систему отдельных дисциплин: общей и неорганической химии, аналитической химии, органической химии, физической и коллоидной химии, геохимии, космохимии и т. п.
Химия – наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи.
Неорганическая химия – это химия элементов Периодической системы и образованных ими простых и сложных веществ.
Неорганическая химия неотделима от общей химии. Исторически при изучении химического взаимодействия элементов друг с другом были сформулированы основные законы химии, общие закономерности протекания химических реакций: теория химической связи, учение о растворах и многое другое, что составляет предмет общей химии. Таким образом, общая химия изучает теоретическое представление и концепции, составляющие фундамент всей системы химических знаний.
Неорганическая химия давно перешагнула стадию описательной науки и в настоящее время переживает своё «второе рождение» в результате широкого привлечения квантово-химических методов, зонной модели энергетического спектра электронов, открытых валентно-химических соединений благородных газов, целенаправленного синтеза материалов с особыми физическими и химическими свойствами. На основе глубокого изучения зависимости между химическим строением и свойствами она решает главную задачу – создание новых неорганических веществ с заданными свойствами. Из экспериментальных методов химии важнейшим является метод химических реакций. Химические реакции – это превращение одних веществ в другие, путем изменения состава и химического строения. Во-первых, химические реакции дают возможность исследовать химические свойства вещества. Кроме того, по химическим реакциям исследуемого вещества можно косвенно судить о его химическом строении. Прямые же методы установления химического строения в большинстве своем основаны на использовании физических явлений. Во-вторых, на основе химических реакций осуществляется неорганический синтез.
Нужна помощь в написании?
Таким образом, главным объектом химии являются вещества и их превращения.
Все вещества делятся на простые и сложные. Простые, в свою очередь, подразделяются на металлы и неметаллы.
В твердом состоянии большинство веществ имеют кристаллическое строение. Связь в кристаллической решетке металлов – металлическая. Это обуславливает их особые физические свойства: электропроводность, теплопроводность, пластичность. Атомы неметаллов связаны между собой с помощью неполярной ковалентной связи. Они могут иметь атомную (алмаз, графит, кремний) или молекулярную (белый фарфор, галогены, кристаллическая сера S8) кристаллическую решетки. Поэтому физические свойства неметаллов весьма различны.
Сложные вещества делятся на 4 класса: оксиды, основания, кислоты, соли.
1. Определение оксидов
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, соединения, содержащие атомы кислорода, связанные химической связью друг с другом ( пероксиды, надпероксиды, озониды) например: пероксид натрия Na2O2 , надпероксид калия KO2 , озонид калия KO3 и соединения фтора с кислородом (OF2 , O2F2), которые следует называть не оксидами фтора, а фторидами кислорода, т. к. степень окисления кислорода в них положительная.
Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
2. Классификация оксидов
Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли. Раньше такие оксиды называли индифферентными или безразличными, но это неверно, так как по своей химической природе данные оксиды достаточно реакционноспособны. По сравнению с другими видами, количество несолеобразующих оксидов невелико, их как правило образуют одно – и двухвалентные неметаллы. Типичными представителями таких оксидов являются гемиоксид азота (закись азота) N2O, монооксид азота NO, монооксид углерода СО, монооксид кремния SiO.
Солеобразующие оксиды – это оксиды, которые образуют соли при взаимодействии с кислотами или основаниями. В зависимости от характера соответствующих гидратов оксидов все солеобразующие оксиды делятся па три типа: основные, кислотные, амфотерные.
Осно́вные оксиды – солеобразующие оксиды, проявляющие осно́вные свойства. К ним относятся:
Кислотные оксиды (ангидриды) – оксиды, растворяющиеся только в щелочах, с образованием соли и воды. Образуются типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют валентность от IV до VII. Также они могут взаимодействовать с некоторыми основными оксидами, например: оксид кальция CaO, оксид натрия Na2О и оксид цинка ZnO.
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II,III,IV.
Увеличение степени окисления элемента и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на этоме кислорода) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
1) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.
2) В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление новых свойств оксидов:
Нужна помощь в написании?
3) При повышении степени окисления элемента усиливаются кислотные свойства оксида и ослабевают основные.
3. Физические и химические свойства
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода) h3O и Cl2O7 являются бесцветными жидкостями, а некоторые – газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение.
Основные и кислотные оксиды проявляют разные свойства. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. С водой непосредственно реагируют оксиды щелочных металлов (оксиды лития, натрия, калия, рубидия и цезия) и окислы щелочноземельных металлов (оксиды кальция, стронция и бария).
Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства основных оксидов.
1. Взаимодействие основного оксида с кислотным оксидом с образованием соли:CaO+SiO2 -> CaSiO3
2. Взаимодействие основного оксида с амфотерными оксидом с образованием соли:
Na2O+Al2O3 ->2NaAlO2
3. Взаимодействие основного оксида с водой с образованием основания:
BaO+h3O=Ba(OH)2
4. Взаимодействие основного оксида с кислотой с образованием соли и воды:
MgO+2HCl=MgCl2+h3O
Кислотные оксиды могут вступать в реакции с основными и амфотерными оксидами, с растворимыми в воде основаниями (щелочами). Многие кислотных оксидов взаимодействуют с водой (исключением является кремний (IV) оксид SiO2. Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства кислотных оксидов.
1. Взаимодействие кислотного оксида с основным оксидом с образованием соли:
CO2 +Na2O=Na2CO3
2. Взаимодействие кислотного оксида с амфотерными оксидом с образованием соли:
SO3 +ZnO=ZnSO4
3. Взаимодействие кислотного оксида с водой с образованием кислоты:
P2O5 +3h3O=2h4PO4
4. Взаимодействие кислотного оксида со щелочью с образованием соли и воды:
SO2 +2KOH=K2SO3 +h3O
Амфотерными оксидам присущи свойства как основных, так и кислотных оксидов. То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей. Кроме того, амфотерные оксиды могут взаимодействовать как с кислотами, так и со щелочами с образованием солей и воды.
Например:
ZnO+h3SO4 =ZnSO4 +h3O
Al2O3 + 2KOH 2KAlO2 + h3O
4. Способы получения
1. Окисление простых веществ кислородом (сжигание простых веществ):
2Mg + O2 = 2МgО
4Р + 5O2 = 2Р2О5.
Метод не применим для получения оксидов щелочных металлов, т.к. при окислении щелочные металлы обычно дают не оксиды, а пероксиды(Na2O2, K2O2).
Не окисляются кислородом воздуха благородные металлы, напрмер, Аu, Аg, Рt.
2. Окисление сложных веществ (солей некоторых кислот и водородных соединений неметаллов):
2ZnS + 3O2 = 2ZnO + 2SO2
2Н2S + 3O2 = 2SO2 + 2Н2О
3. Разложение при нагревании гидроксидов (оснований и кислородсодержащих кислот):
Сu(ОН)2 СuО + Н2О
h3SO3 SO2 + h3O
Нельзя пользоваться этим методом для получения оксидов щелочных металлов, так как разложение щелочей происходит при слишком высоких температурах.
4. Разложение некоторых солей кислородсодержащих кислот:
СаСО3 СаО + СО2
2Рb(NO3)2 2РbО + 4NO2 + O2
Следует иметь в виду, что соли щелочных металлов не разлагаются при нагревании с образованием оксидов.
Заключение
Одной из важнейших таких систем естествознания, на мой взгляд, является химическая наука. Современная химия развивается стремительными темпами, плодотворно сотрудничая с физикой, математикой, биологией и другими науками. Истоки химических знаний лежат в глубокой древности.
В их основе – потребность человека получить необходимые вещества, объяснить взаимодействие веществ для своей жизнедеятельности. Химия очень тесно связана с производством материальных ценностей и является больше практической наукой. Современные достижения химии в ее практической деятельности вносят большой вклад в общее миропонимание, в развитие естественнонаучных знаний, существенно отражаются на состоянии взаимодействия общества с природой. Добавляемые химией и химической производственной практикой знания о природе, о вещах и превращениях веществ, являются основой для формирования мировоззрения человека, развития общих представлений о мире, о природе человека, его деятельности. Еще с древних времен и вплоть до наших дней в развитии научной, в том числе и химической мысли, почти по всем направлениям можно констатировать позитивный и безостановочный прогресс. Научные знания продолжают постоянно углубляться и совершенствоваться.
Для формирования у современного человека естественнонаучного способа мышления, целостного мировоззрения необходимы и знания основных положений химии, как одной из важнейших наук, ее исторического развития и современного понимания роли химии для жизни и деятельности человека. Роль вещества и знаний о веществе, природа химических знаний, пути и средства их формирования в историческом развитии – вот то, с чего в можно начать изучение влияния химии на формирование и развитие современного естествознания.
Список использованных источников
1. Кипер Р.А. Свойства веществ: Справочник. – Хабаровск, 2009. – 387 с.2. Коренев Ю.М., Овчаренко ., В.П., Егоров Е.Н. Общая и неорганическая химия часть 3, М.: Московский университет 2000. – 36с.3. Третьяков Ю.Д., Неорганическая химия, том 1, М.: Академия, 2004. -240с.4. Ахметов, Н. С. Общая и неорганическая химия / Н. С. Ахметов. – 5-еизд.,перераб. идоп. – М.: Высш. шк., 2003. – 744 с.5. Карапетьянц, М. Х. Общая и неорганическая химия: учебник для вузов / М. Х. Карапетьянц, С. И. Дракин. – 4-еизд., стереотип. – М.: Химия, 2000. – 592 с.
nauchniestati.ru












rpp.nashaucheba.ru
.
1. Оксиды
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, Fe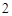 O
O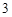
 — твердые вещества, немолекулярного строения.
— твердые вещества, немолекулярного строения.
Оксиды:
MgO – магния
NiO – никеля
SiO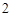 — кремния
— кремния
Fe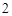 O
O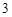
 — железа
— железа
ClO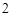 — хлора
— хлора
CO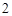 — углерода
— углерода
NO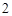 — азота
— азота
1.2. Вода
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4 градусов – 1 г/см в кубе.
градусов – 1 г/см в кубе.
При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2H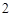 O = 2NaOH + H
O = 2NaOH + H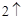
Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становится синей – это признак того, что в растворе есть щелочь.
2K + H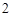 O = 2KOH + H
O = 2KOH + H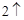
Ca + 2H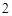 O = Ca(OH)
O = Ca(OH)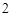 + H
+ H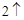
Б) с оксидами активных металлов, образуя растворимые основания – щелочи.
CaO + H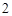 O = Ca(OH)
O = Ca(OH)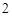
Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Б) еще примеры:
Na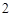 O + H
O + H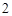 O = 2NaOH
O = 2NaOH
BaO + HO = Ba(OH)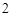
В) со многими оксидами неметаллов, образуя кислоты.
P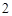 O
O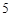 + H
+ H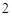 O = 2HPO
O = 2HPO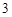
а с горячей водой:
P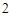 O
O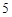 + 3H
+ 3H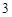 PO
PO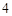 = 2H
= 2H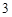 PO
PO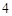
CO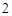 + H
+ H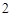 O = H
O = H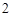 CO
CO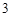
SO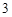 + H
+ H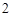 O = H
O = H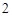 SO
SO
Г) вода разлагается под действие высокой температуры или электрического тока.
2H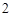 O = 2H
O = 2H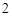
 + O
+ O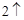
Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными.
2. Кислоты
В формулах кислот на первом месте всегда стоит водород, а дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO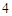 — кислотный остаток.
— кислотный остаток.
Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой:
SO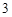 + H
+ H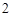 O = H
O = H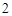 SO
SO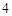
N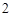 O
O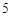 + H
+ H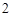 O = 2HNO
O = 2HNO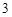
2.1. Химические свойства кислот
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl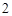 + H
+ H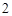

Zn + 2HCl = ZnCl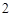 + H
+ H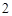

Cu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl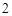 + H
+ H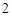 O — - — - Cu (II)
O — - — - Cu (II)
Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
2.2. Соляная кислота и хлороводород
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + H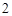 SO
SO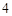 = NaHSO
= NaHSO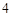 + HCl
+ HCl
2) сильное нагревание
2NaCl + H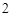 SO
SO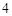 = Na
= Na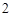 SO
SO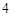 + 2HCl
+ 2HCl
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl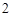 + H
+ H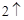
3е свойство: взаимодействует с основными оксиды:
Fe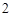 O
O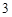 + 6HCl = 2FeCl
+ 6HCl = 2FeCl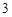 + 3H
+ 3H O
O
Примечание: HCl + AgNO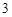 = AgCl
= AgCl +HNO
+HNO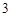
3. Основания
CaO + H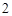 O = Ca(OH)
O = Ca(OH)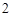
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция. Основания состоят из металла и одновалентных гидроксильных групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH)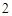 — гидроксид магния
— гидроксид магния
Ba(OH)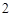 — гидроксид бария.
— гидроксид бария.
Fe(OH)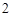 — гидроксид железа (II)
— гидроксид железа (II)
Fe(OH)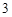 — гидроксид железа (III)
— гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)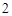 и т.п.
и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH)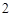 , гидроксид железа (III)
, гидроксид железа (III)
Fe(OH) и т.п.
и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2H O = 2NaOH + H
O = 2NaOH + H
BaO + H 0 = Ba(OH)
0 = Ba(OH)
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO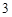 = NaNO
= NaNO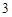 + H
+ H O
O
Cu(OH)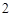 + 2HCl = CuCl
+ 2HCl = CuCl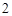 + 2H
+ 2H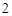 O
O
4. Амфотерные оксиды и гидроксиды
Основания реагируют с кислотами и наоборот. Всегда получается соль и вода.
Ca(OH)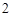 + 2HCl = CaCl
+ 2HCl = CaCl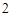 + 2H
+ 2H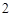 O
O
H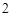 CO
CO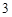 + 2NaOH = Na
+ 2NaOH = Na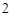 CO
CO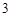 + 2H
+ 2H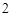 O
O
Есть такие хим. элементы, которые образуют оксиды и гидроксиды, обладающие двойственными свойствами – и основными и кислотными ( в зависимости от условий).
Это такие элементы как цинк, алюминий и др. Например:
Zn(OH)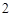 + 2HCl = ZnCl
+ 2HCl = ZnCl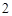 + 2H
+ 2H O
O
 сильная
сильная кислота
кислота
Zn(OH)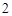 + 2NaOH = Na
+ 2NaOH = Na ZnO
ZnO + 2H
+ 2H O
O
 сильное основание
сильное основание
Пример с оксидом цинка:
ZnO + 2HNO = Zn(NO
= Zn(NO )
) + H
+ H O
O
ZnO + 2KOH = K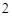 ZnO
ZnO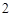 + H
+ H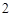 O (процесс сплавления)
O (процесс сплавления)
Способность химических соединений проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют, называется амфотерностью.
Zn(OH)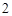 — амфотерный гидроксид
— амфотерный гидроксид
ZnO – амфотерный оксид
5. Соли
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей кислотного остатка.
Примеры солей:
NaCl — хлорид натрия
AgCl — серебра
K S — сульфид калия
S — сульфид калия
NaNo — нитрат натрия
— нитрат натрия
Mg(NO )
) — магния
— магния
Na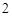 SiO
SiO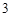 — силикат натрия
— силикат натрия
Al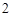 (SO
(SO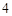 )
) — сульфат алюминия
— сульфат алюминия
Na SO
SO — натрия
— натрия
BaSO — бария
— бария
Na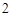 SO
SO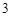 — сульфит натрия
— сульфит натрия
K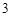 PO
PO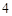 — фосфат калия
— фосфат калия
CaCO — карбонат кальция
— карбонат кальция
5.1. Химические свойства солей
Соли реагируют:
А) с металлами:
Cu + 2AgNO = Cu(NO
= Cu(NO )
) + 2Ag
+ 2Ag
Образуется новая соль и металл.
Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.
Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у.
Б) с растворимыми основаниями (щелочами):
AlCl +3NaOH = Al(OH)
+3NaOH = Al(OH)
 + 3NaCl
+ 3NaCl
K SO
SO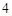 + Ba(OH)
+ Ba(OH)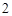 = 2KOH + BaSO
= 2KOH + BaSO
Образуется новая соль и новое основание.
Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок.
В) с кислотами:
CaCo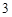 + 2HCl = CaCl
+ 2HCl = CaCl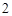 + H
+ H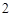 CO
CO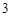
/ \
H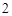 O CO
O CO
Образуется новая соль и новая кислота.
Поскольку H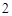 CO
CO очень непрочная, она разлагается на воду и CO
очень непрочная, она разлагается на воду и CO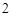 .
.
Примечание: реакция между солью и кислотой будет происходить при таких условиях:
а) когда образуется осадок, не растворимый в кислотах:
AgNO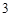 + HCl = AgCl
+ HCl = AgCl + HNO
+ HNO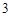
б) когда реагирующая кислота сильнее, чем та, которой образована соль:
Ca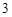 (PO
(PO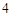 )
)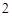 + 3H
+ 3H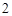 SO
SO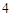 = 3CaSO
= 3CaSO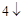 + 2H
+ 2H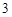 PO
PO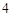
в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая:
2NaNO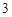 + H
+ H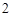 SO
SO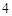 = Na
= Na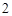 SO
SO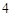 + 2HNO
+ 2HNO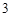
Г) с солями:
BaCl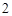 + Na
+ Na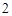 SO
SO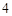 = BaSO
= BaSO + 2NaCl
+ 2NaCl
Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций:
Ответы на некоторые вопросы после параграфов:
Какие вещества называют оксидами?
Оксиды – это сложные вещества образованные двумя элементами одним из которых является кислород.
Какие вещества относятся к кислотам?
К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток.
Что называется реакцией соединения?
Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество.
Напишите уравнения химических реакций которые происходят при таких превращениях: C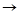 CO
CO
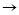 H
H CO
CO
P  P
P O
O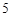
 HPO
HPO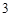
C + O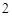 = CO
= CO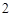
CO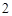 + H
+ H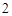 O = H
O = H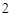 CO
CO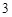
P + O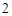 = P
= P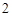 O
O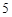
Как химическим путем отличить серебро от цинка?
Что такое хлороводород и как его получить?
Хлороводород – это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой.
Почему хлороводород на воздухе дымит?
Как доказать что выданный вам раствор кислота и это соляная кислота?
Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж – розовеет, фенолфталеин – бесцветный.
Какие вещества относятся к основаниям и как их классифицируют? Привести примеры.
К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые.
Все металлы не растворяются, а неметаллы наоборот.
Растворимые – NaOH, KOH, нерастворимые – Cu(OH) Fe(OH)
Fe(OH) .
.
10) Что вам известно о гидроксиде натрия?
Гидроксид натрия NaOH – растворимый в воде…
11) Ca CaO
CaO Ca(OH)
Ca(OH)
 Ca(NO
Ca(NO )
)
2Ca + O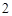 = 2CaO
= 2CaO
CaO + H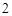 O = Ca(OH)
O = Ca(OH)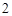
Ca(OH)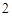 + 2HNO
+ 2HNO = Ca(NO
= Ca(NO )
) + 2H
+ 2H O
O
12) P P
P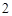 O
O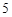
 H
H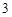 PO
PO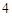
 Mg(PO
Mg(PO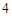 )
)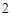
4P + 5O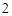 = 2P
= 2P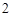 O
O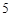

P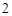 O
O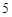 + 3H
+ 3H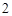 O = 2H
O = 2H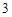 PO
PO
Что называется амфотерностью?
Амфотерность – это способность химических соединений
Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют.
Что такое соли?
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сформулируйте правило для составления формул солей.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка.
Ca CaO
CaO Ca(OH)
Ca(OH)
 CaCl
CaCl
 CaSO
CaSO
2Ca + O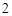 = 2CaO
= 2CaO
CaO + H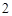 O = Ca(OH)
O = Ca(OH)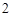
Ca(OH)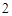 + 2HCl = CaCl
+ 2HCl = CaCl + 2H
+ 2H O
O
CaCl + H
+ H SO
SO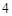 = CaSO
= CaSO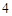 + 2HCl
+ 2HCl
Ba Ba(OH)
Ba(OH)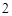
 Ba(NO
Ba(NO )
) 
 BaCO
BaCO
 BaCl
BaCl
Ba + H O = Ba(OH)
O = Ba(OH)
Ba(OH) + 2HNO
+ 2HNO = Ba(NO
= Ba(NO )
) + 2H
+ 2H O
O
Ba(NO )
) + H
+ H CO
CO = BaCO
= BaCO + 2HNO
+ 2HNO
BaCO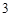 + 2HCl = BaCl
+ 2HCl = BaCl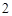 + H
+ H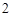 CO
CO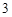
Обобщение знаний:
Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов.
Простые вещества – это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы – нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы – это растворимые в воде вещества, которые хрупкие и т.п.
Какие вещества называются сложными? На какие классы делятся неорганические вещества?
Сложные вещества – это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли.
По какому признаку оксиды делят на основные и кислотные?
Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными.
21) С чем могут взаимодействовать кислотные и основные оксиды? Что получается?
Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Короче, об этом дальше.
Что такое основания? Какие элементы их образуют?
Какие свойства для них характерны?
Основания – это сложные вещества, состоящие из металла и гидроксильных групп. Их можно получить при Взаимодействии активных металлов с водой и оксидов активных металлов с водой. Щелочи хорошо растворимы в воде.
Некоторые очень едкие. Они разъедают кожу, бумагу и другие материалы. Их называют едкими щелочами.
Какие вещества называют кислотами? Какие элементы их
Образуют? Какие свойства для них характерны?
Кислотами называют сложные вещества в состав которых входят водород и кислотный остаток. Получить кислородосодержащие кислоты можно взаимодействовать кислотных оксидов с водой. Для них характерны свойства: многие кислоты при н.у. – жидкости, но есть твердые кислоты.
Они хорошо растворяются в воде. Почти все кислоты бесцветны.
Какие вещества относятся к солям? С какими веществами могут реагировать соли?
К солям можно отнести сложные вещества, образованные атомами металлов и кислотными остатками.
Какие продукты образуются во время взаимодействия:
А) основания и кислоты
Образуются соль и вода: NaOH + HCl = NaCl + H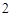 O
O
Б) основного и кислотного оксидов
Образуется тоже самое что и дано.
В) основного оксида и кислоты?
Образуется соль и вода
Na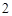 O + H
O + H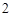 SO
SO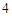 = NaSO
= NaSO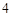 + H
+ H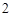 O
O
Написать уравнения реакций.
Написать уравнения реакций получения фосфата кальция четырьмя способами.
26) Написать уравнения реакций получения гидроксида калия тремя способами.
Как осуществить следующие превращения:
Натрий – Гидроксид натрия – Сульфат натрия – Хлорид натрия – Нитрат натрия
Na + H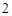 O = NaOH + H
O = NaOH + H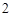
NaOH + H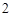 SO
SO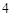 = NaSO
= NaSO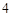 + H
+ H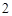 O
O
NaSO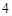 + HCl = HSO
+ HCl = HSO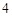
27) Что называется реакцией замещения и реакцией обмена?
Что с чем взаимодействует и что получается?
Основный оксид + кислота = соль + вода (обмен)
Оксид активных металлов + вода = щелочь (соединение)
Оксид неметаллов + вода = кислота (соединение)
Активные металлы + вода = гидроксид металлов (щелочь) + H
Кислоты + металлы = соль + H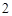
Соляная кислота + металл = соль + H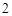
Соляная кислота + основный оксид = соль + вода (обмен)
Основания + кислота = соль + вода
Щелочи + оксид неметаллов = соль + вода
+ вода
Соль + металл (не все) = новая соль + новый металл (обмен)
Соль + щелочь = новая соль + новое основание (обмен)
Соль + кислота = новая соль + новая кислота (обмен)
Кислотные оксиды – это оксиды неметаллов – это щелочи.
www.ronl.ru
.
1. Оксиды
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, Fe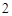 O
O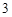
 — твердые вещества, немолекулярного строения.
— твердые вещества, немолекулярного строения.
Оксиды:
MgO – магния
NiO – никеля
SiO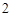 — кремния
— кремния
Fe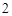 O
O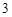
 — железа
— железа
ClO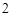 — хлора
— хлора
CO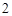 — углерода
— углерода
NO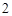 — азота
— азота
1.2. Вода
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4 градусов – 1 г/см в кубе.
градусов – 1 г/см в кубе.
При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2H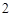 O = 2NaOH + H
O = 2NaOH + H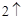
Из этой реакции видим, что водород выделился и образовался гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становится синей – это признак того, что в растворе есть щелочь.
2K + H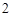 O = 2KOH + H
O = 2KOH + H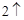
Ca + 2H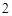 O = Ca(OH)
O = Ca(OH)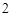 + H
+ H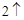
Б) с оксидами активных металлов, образуя растворимые основания – щелочи.
CaO + H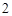 O = Ca(OH)
O = Ca(OH)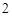
Оксиды которым соответствуют основания (независимо от того, реагируют они с водой или нет) называются основными.
Б) еще примеры:
Na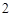 O + H
O + H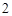 O = 2NaOH
O = 2NaOH
BaO + HO = Ba(OH)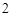
В) со многими оксидами неметаллов, образуя кислоты.
P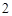 O
O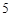 + H
+ H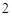 O = 2HPO
O = 2HPO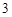
а с горячей водой:
P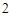 O
O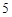 + 3H
+ 3H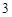 PO
PO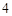 = 2H
= 2H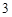 PO
PO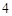
CO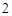 + H
+ H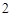 O = H
O = H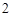 CO
CO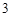
SO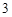 + H
+ H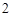 O = H
O = H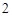 SO
SO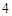
Г) вода разлагается под действие высокой температуры или электрического тока.
2H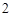 O = 2H
O = 2H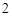
 + O
+ O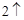
Оксиды которым соответствуют кислоты (независимо от того, реагируют они с водой или нет) называются кислотными.
2. Кислоты
В формулах кислот на первом месте всегда стоит водород, а дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO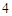 — кислотный остаток.
— кислотный остаток.
Его валентность = 2, поскольку в серной кислоте он соединен с двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой:
SO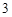 + H
+ H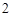 O = H
O = H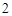 SO
SO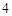
N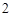 O
O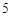 + H
+ H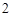 O = 2HNO
O = 2HNO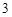
2.1. Химические свойства кислот
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl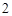 + H
+ H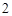

Zn + 2HCl = ZnCl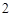 + H
+ H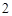

Cu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl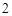 + H
+ H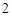 O — - — - Cu (II)
O — - — - Cu (II)
Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
2.2. Соляная кислота и хлороводород
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + H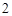 SO
SO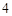 = NaHSO
= NaHSO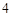 + HCl
+ HCl
2) сильное нагревание
2NaCl + H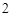 SO
SO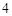 = Na
= Na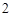 SO
SO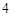 + 2HCl
+ 2HCl
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl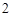 + H
+ H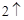
3е свойство: взаимодействует с основными оксиды:
Fe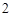 O
O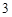 + 6HCl = 2FeCl
+ 6HCl = 2FeCl + 3H
+ 3H O
O
Примечание: HCl + AgNO = AgCl
= AgCl +HNO
+HNO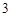
3. Основания
CaO + H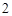 O = Ca(OH)
O = Ca(OH)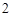
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция. Основания состоят из металла и одновалентных гидроксильных групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH)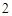 — гидроксид магния
— гидроксид магния
Ba(OH)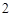 — гидроксид бария.
— гидроксид бария.
Fe(OH)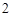 — гидроксид железа (II)
— гидроксид железа (II)
Fe(OH)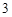 — гидроксид железа (III)
— гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)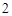 и т.п.
и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH) , гидроксид железа (III)
, гидроксид железа (III)
Fe(OH) и т.п.
и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2H O = 2NaOH + H
O = 2NaOH + H
BaO + H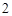 0 = Ba(OH)
0 = Ba(OH)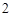
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO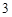 = NaNO
= NaNO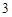 + H
+ H O
O
Cu(OH) + 2HCl = CuCl
+ 2HCl = CuCl + 2H
+ 2H O
O
4. Амфотерные оксиды и гидроксиды
Основания реагируют с кислотами и наоборот. Всегда получается соль и вода.
Ca(OH)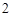 + 2HCl = CaCl
+ 2HCl = CaCl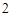 + 2H
+ 2H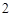 O
O
H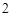 CO
CO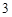 + 2NaOH = Na
+ 2NaOH = Na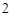 CO
CO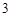 + 2H
+ 2H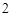 O
O
Есть такие хим. элементы, которые образуют оксиды и гидроксиды, обладающие двойственными свойствами – и основными и кислотными ( в зависимости от условий).
Это такие элементы как цинк, алюминий и др. Например:
Zn(OH)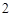 + 2HCl = ZnCl
+ 2HCl = ZnCl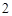 + 2H
+ 2H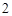 O
O
 сильная
сильная кислота
кислота
Zn(OH)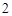 + 2NaOH = Na
+ 2NaOH = Na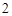 ZnO
ZnO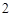 + 2H
+ 2H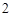 O
O
 сильное основание
сильное основание
Пример с оксидом цинка:
ZnO + 2HNO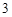 = Zn(NO
= Zn(NO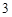 )
)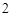 + H
+ H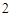 O
O
ZnO + 2KOH = K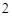 ZnO
ZnO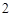 + H
+ H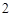 O (процесс сплавления)
O (процесс сплавления)
Способность химических соединений проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют, называется амфотерностью.
Zn(OH) — амфотерный гидроксид
— амфотерный гидроксид
ZnO – амфотерный оксид
5. Соли
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей кислотного остатка.
Примеры солей:
NaCl — хлорид натрия
AgCl — серебра
K S — сульфид калия
S — сульфид калия
NaNo — нитрат натрия
— нитрат натрия
Mg(NO )
) — магния
— магния
Na SiO
SiO — силикат натрия
— силикат натрия
Al (SO
(SO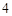 )
)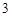 — сульфат алюминия
— сульфат алюминия
Na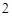 SO
SO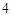 — натрия
— натрия
BaSO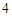 — бария
— бария
Na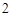 SO
SO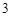 — сульфит натрия
— сульфит натрия
K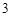 PO
PO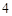 — фосфат калия
— фосфат калия
CaCO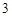 — карбонат кальция
— карбонат кальция
5.1. Химические свойства солей
Соли реагируют:
А) с металлами:
Cu + 2AgNO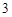 = Cu(NO
= Cu(NO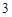 )
) + 2Ag
+ 2Ag
Образуется новая соль и металл.
Примечание: реагируют с водой только те металлы, которые в вытеснительном ряду размещаются левее от того металла, который входит в состав соли.
Но для таких реакций нельзя брать очень активные металлы, типо Li, Na, K, Ca, Ba и т.п., которые реагируют с водой в н.у.
Б) с растворимыми основаниями (щелочами):
AlCl +3NaOH = Al(OH)
+3NaOH = Al(OH)
 + 3NaCl
+ 3NaCl
K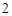 SO
SO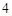 + Ba(OH)
+ Ba(OH)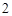 = 2KOH + BaSO
= 2KOH + BaSO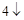
Образуется новая соль и новое основание.
Примечание: реагирующие вещества надо подбирать так, чтобы в результате реакции одно из образующихся веществ (основание или соль) выпадало в осадок.
В) с кислотами:
CaCo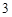 + 2HCl = CaCl
+ 2HCl = CaCl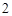 + H
+ H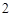 CO
CO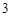
/ \
H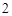 O CO
O CO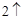
Образуется новая соль и новая кислота.
Поскольку H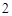 CO
CO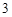 очень непрочная, она разлагается на воду и CO
очень непрочная, она разлагается на воду и CO .
.
Примечание: реакция между солью и кислотой будет происходить при таких условиях:
а) когда образуется осадок, не растворимый в кислотах:
AgNO + HCl = AgCl
+ HCl = AgCl + HNO
+ HNO
б) когда реагирующая кислота сильнее, чем та, которой образована соль:
Ca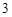 (PO
(PO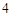 )
)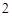 + 3H
+ 3H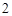 SO
SO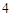 = 3CaSO
= 3CaSO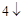 + 2H
+ 2H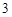 PO
PO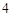
в) когда соль образована летучей кислотой, а реагирующая кислота нелетучая:
2NaNO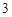 + H
+ H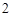 SO
SO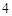 = Na
= Na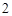 SO
SO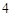 + 2HNO
+ 2HNO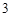
Г) с солями:
BaCl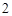 + Na
+ Na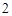 SO
SO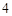 = BaSO
= BaSO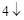 + 2NaCl
+ 2NaCl
Примечание: реакция будет происходить только тогда, когда обе исходные соли будут взяты в растворах, но одна из вновь образующихся солей будет выпадать в осадок.
Выводы по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций:
Ответы на некоторые вопросы после параграфов:
Какие вещества называют оксидами?
Оксиды – это сложные вещества образованные двумя элементами одним из которых является кислород.
Какие вещества относятся к кислотам?
К кислотам относятся сложные вещества, в состав которых входят водород и кислотный остаток.
Что называется реакцией соединения?
Это реакция в результате которой из двух или нескольких веществ (простых или сложных) образуется одно новое сложное вещество.
Напишите уравнения химических реакций которые происходят при таких превращениях: C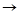 CO
CO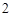
 H
H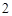 CO
CO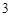
P  P
P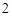 O
O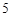
 HPO
HPO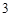
C + O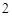 = CO
= CO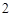
CO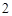 + H
+ H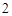 O = H
O = H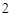 CO
CO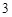
P + O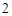 = P
= P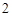 O
O
Как химическим путем отличить серебро от цинка?
Что такое хлороводород и как его получить?
Хлороводород – это бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе “дымит”. Очень хорошо растворяется в воде. Получить хлороводород можно из кристаллического хлорида натрия NaCl при нагревании его с концентрированной серной кислотой.
Почему хлороводород на воздухе дымит?
Как доказать что выданный вам раствор кислота и это соляная кислота?
Надо юзить на него индикатором. Лакмус опустить – краснеет, метилоранж – розовеет, фенолфталеин – бесцветный.
Какие вещества относятся к основаниям и как их классифицируют? Привести примеры.
К основаниям относятся вещества имеющие гидроксильную группу и металл. Основания классифицируют на щелочи и нерастворимые.
Все металлы не растворяются, а неметаллы наоборот.
Растворимые – NaOH, KOH, нерастворимые – Cu(OH)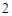 Fe(OH)
Fe(OH) .
.
10) Что вам известно о гидроксиде натрия?
Гидроксид натрия NaOH – растворимый в воде…
11) Ca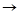 CaO
CaO Ca(OH)
Ca(OH)
 Ca(NO
Ca(NO )
)
2Ca + O = 2CaO
= 2CaO
CaO + H O = Ca(OH)
O = Ca(OH)
Ca(OH)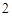 + 2HNO
+ 2HNO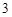 = Ca(NO
= Ca(NO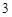 )
)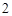 + 2H
+ 2H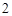 O
O
12) P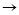 P
P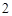 O
O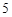
 H
H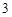 PO
PO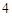
 Mg(PO
Mg(PO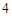 )
)
4P + 5O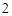 = 2P
= 2P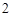 O
O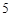

P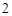 O
O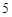 + 3H
+ 3H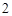 O = 2H
O = 2H PO
PO
Что называется амфотерностью?
Амфотерность – это способность химических соединений
Проявлять кислотные или основные свойства в зависимости от природы веществ, с которыми они реагируют.
Что такое соли?
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Сформулируйте правило для составления формул солей.
Сумма единиц валентностей атомов металла должна равняться сумме единиц валентностей атомом кислотного остатка.
Ca CaO
CaO Ca(OH)
Ca(OH)
 CaCl
CaCl
 CaSO
CaSO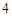
2Ca + O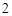 = 2CaO
= 2CaO
CaO + H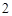 O = Ca(OH)
O = Ca(OH)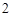
Ca(OH)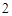 + 2HCl = CaCl
+ 2HCl = CaCl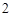 + 2H
+ 2H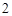 O
O
CaCl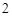 + H
+ H SO
SO = CaSO
= CaSO + 2HCl
+ 2HCl
Ba Ba(OH)
Ba(OH)
 Ba(NO
Ba(NO )
) 
 BaCO
BaCO
 BaCl
BaCl
Ba + H O = Ba(OH)
O = Ba(OH)
Ba(OH) + 2HNO
+ 2HNO = Ba(NO
= Ba(NO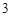 )
)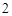 + 2H
+ 2H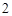 O
O
Ba(NO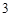 )
)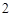 + H
+ H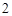 CO
CO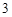 = BaCO
= BaCO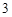 + 2HNO
+ 2HNO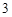
BaCO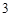 + 2HCl = BaCl
+ 2HCl = BaCl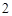 + H
+ H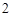 CO
CO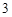
Обобщение знаний:
Какие вещества называются простыми? На какие две группы их можно разделить? Сравнить характерные свойства металлов и неметаллов.
Простые вещества – это вещества состоящие из одного элемента. Их можно разделить на металлы и неметаллы. Металлы – нерастворимые в воде вещества. Они имеют металлический блеск и пластичность. Неметаллы – это растворимые в воде вещества, которые хрупкие и т.п.
Какие вещества называются сложными? На какие классы делятся неорганические вещества?
Сложные вещества – это вещества состоящие из двух или более элементов. Неорганические вещества делятся на простые и сложные. Сложные делятся на оксиды, основания, кислоты и соли.
По какому признаку оксиды делят на основные и кислотные?
Оксиды которым соответствуют основания называют основными, а те которым соответствуют кислоты — кислотными.
21) С чем могут взаимодействовать кислотные и основные оксиды? Что получается?
Кислотные и основные оксиды могут взаимодействовать с водой и получается кислоты или основания.
Короче, об этом дальше.
Что такое основания? Какие элементы их образуют?
Какие свойства для них характерны?
Основания – это сложные вещества, состоящие из металла и гидроксильных групп. Их можно получить при Взаимодействии активных металлов с водой и оксидов активных металлов с водой. Щелочи хорошо растворимы в воде.
Некоторые очень едкие. Они разъедают кожу, бумагу и другие материалы. Их называют едкими щелочами.
Какие вещества называют кислотами? Какие элементы их
Образуют? Какие свойства для них характерны?
Кислотами называют сложные вещества в состав которых входят водород и кислотный остаток. Получить кислородосодержащие кислоты можно взаимодействовать кислотных оксидов с водой. Для них характерны свойства: многие кислоты при н.у. – жидкости, но есть твердые кислоты.
Они хорошо растворяются в воде. Почти все кислоты бесцветны.
Какие вещества относятся к солям? С какими веществами могут реагировать соли?
К солям можно отнести сложные вещества, образованные атомами металлов и кислотными остатками.
Какие продукты образуются во время взаимодействия:
А) основания и кислоты
Образуются соль и вода: NaOH + HCl = NaCl + H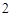 O
O
Б) основного и кислотного оксидов
Образуется тоже самое что и дано.
В) основного оксида и кислоты?
Образуется соль и вода
Na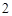 O + H
O + H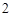 SO
SO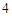 = NaSO
= NaSO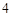 + H
+ H O
O
Написать уравнения реакций.
Написать уравнения реакций получения фосфата кальция четырьмя способами.
26) Написать уравнения реакций получения гидроксида калия тремя способами.
Как осуществить следующие превращения:
Натрий – Гидроксид натрия – Сульфат натрия – Хлорид натрия – Нитрат натрия
Na + H O = NaOH + H
O = NaOH + H
NaOH + H SO
SO = NaSO
= NaSO + H
+ H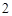 O
O
NaSO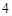 + HCl = HSO
+ HCl = HSO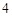
27) Что называется реакцией замещения и реакцией обмена?
Что с чем взаимодействует и что получается?
Основный оксид + кислота = соль + вода (обмен)
Оксид активных металлов + вода = щелочь (соединение)
Оксид неметаллов + вода = кислота (соединение)
Активные металлы + вода = гидроксид металлов (щелочь) + H
Кислоты + металлы = соль + H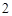
Соляная кислота + металл = соль + H
Соляная кислота + основный оксид = соль + вода (обмен)
Основания + кислота = соль + вода
Щелочи + оксид неметаллов = соль + вода
+ вода
Соль + металл (не все) = новая соль + новый металл (обмен)
Соль + щелочь = новая соль + новое основание (обмен)
Соль + кислота = новая соль + новая кислота (обмен)
Кислотные оксиды – это оксиды неметаллов – это щелочи.
www.ronl.ru












zazdoc.ru
Разделы: Химия
Цели
Образовательная:
Развивающая:
Воспитательная:
Оборудование и материалы: Вода дист. и минеральная, образцы оксидов
Тип урока. Комбинированный (урок-презентация с компьютерной поддержкой с интеграцией в другие предметы)
Ход урока
1. Организация класса
2. Мотивация учебной деятельности
Рассказ учителя
Наверное, сложно переоценить значение веществ, которые мы будем сегодня изучать, для нашей планеты и для людей. Там где нет этих веществ, нет жизни. Эти вещества образуют минералы, руды, глины, жидкий минерал, доминирующий на нашей планете.
Что же это за вещества вы ответите мне через несколько минут, когда разгадаете три загадки.
И так перед вами три шкатулки – в них разные вещества, относящиеся к теме нашего сегодняшнего урока.
? Перед вами шкатулка №1. Древний философ Фалес из Милета еще в VI веке до нашей эры назвал это вещество первым началом и сущностью всего.
Она и дождь, и град, и снег, Туман и гололед, Носитель благ, предвестник бед - И радуга и лед.
Что это за вещество?
(учащиеся дают ответ)
Ответ прост – это вода
Запишите формулу воды в тетрадь.
? А что в шкатулке №2?
Подсказка №1
Это газ, необходимый растениям для фотосинтеза.
Подсказка №2
Это газ, выделяемый нами при выдохе.
Ответ готов?
(учащиеся дают ответ)
Верно, это углекислый газ
Запишите формулу углекислого газа.
? И последняя шкатулка. Для того, чтобы разобраться, что же в ней, послушайте отрывок из стихотворение А. Ахматовой:
…На рукомойнике моем позеленела медь, Но так играет луч на нем, Что весело глядеть…
? Что произошло с медью? Она окислилась. Что означает - окислилась?
Напишите уравнение реакции окисления меди и получите ответ!
2Сu + O2 -> 2 CuO
Вы разгадали три загадки. Получили три разных вещества. Первое – вода – жидкость, без которой немыслимо существование жизни на земле.
Второе вещество – углекислый газ, газ необходимый растениям для фотосинтеза, а значит для питания и жизни.
Третье вещество твердое – оксид меди.
? Что же между ними общего?
Учащиеся выдвигают предположение о схожести состава молекул
Такие соединения называют оксидами.
3. Объяснение нового материала
Объявление темы урока.
Запишите тему нашего урока: Оксиды, их классификация, получение, применение.
? Так что же такое оксиды?
(Учащиеся формулируют правило)
Оксиды – сложные вещества, состоящие из двух элементов, один из которых оксиген.
Поскольку оксиды могут быть образованы почти всеми химическими элементами (за некоторым исключением), необходимо, чтобы не было путаницы, чтобы у каждого было свое название.
Названия оксидов
Посмотрите на формулы оксидов, которые записаны у вас в тетради.
Химическое название этих оксидов: гидроген оксид, карбон (IV) оксид, купрум (II) оксид.
? Почему в первой формуле мы не указали валентность, а во второй и третьей указали?
(учащиеся выдвигают версию о том, что для элементов с постоянной валентностью не надо указывать, для элементов с переменной валентность необходимо указать валентность.)
По международной номенклатуре названия оксидов происходят от названия химических элементов с добавлением слова “Оксид”. Если элемент имеет переменную валентность, то она указывается римскими цифрами, взятыми в скобки после названия химического элемента.
Упражнение “не прерви цепочку”.
(Для каждого ученика приготовлена карточка с формулой оксида. Ученик поднимает карточку, показывает всем, и дает название оксиду. Работа по цепочке. )
? Рассмотрим три формулы веществ, разгаданных вами. Чем они отличаются? (учащиеся говорят, что в первых двух формулах на первом месте стоит неметалл, а в третьей формуле – металл. )
Даем определение кислотным оксидам:
Оксиды неметаллов называют кислотными оксидами.
? Почему эти оксиды названы кислотными?
CO2 + h3O = h3CO3
SO3 + h3O = h3SO4
Оксиды, которым соответствуют кислоты (независимо от того, реагируют они с водой или не реагируют) называют кислотными.
? СаО MgO K2O
Что же между ними общего?
Оксиды металлов называют основными оксидами.
Что означает слово основные пока не понятно.
Если кальций оксид (негашеная известь) соединить с водой, то получиться новое вещество состава Са(ОН)2 – основание. Его используют весной в садах, парках, скверах для побелки деревьев.
Теперь, когда мы познакомились с основаниями, становится понятным название – основной оксид.
Оксиды, которым соответствуют основания (независимо от того, реагируют они с водой или не реагируют) называют основными.
Существуют амфотерные элементы.
Информация о распространении оксидов в природе и их значении.
“Путешествие в пространстве и времени”.
(На доске разворачиваем физическую карту Украины)
А сейчас мы отправимся в путешествие. А знаете ли вы, друзья, что территория Днепропетровской области и большая часть Украины, в период так называемого миоцена (около 23,5 – 25 млрд. лет назад) находилась глубоко под водой.
Когда дно поднималось, вода спадала, а от останков разных морских животных оставалась масса костей и ракушек. Все эти вещества имеют химическую формулу СаСО3 и образуются при соединении двух оксидов: кальций оксида СаО, содержащийся в костях и карбон (IV) оксида CO2 , входящего в состав воздуха, где его объем составляет 0,03%.
Богата Украина кварцевыми песками и глиной, в состав которых входят такие оксиды как силиций (IV) оксид SiO2 и алюминий оксид.
Плиний считал, что горный хрусталь “рождается из небесной влаги и чистейшего снега”. Однако состав его иной: оксид кремния (IV) SiO2.
Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния (IV). Один из распространенных оксидов – диоксид углерода CO2. Он содержится в составе вулканических газов.
Сухой лед – тоже CO2. В отличие от водяного льда плотный. Он тонет в воде, резко охлаждая ее.
Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда.
Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого.
Ценность сухого льда заключается не только в его охлаждающем действии, но и в том, что продукты в углекислом газе не плесневеют, не гниют.
Оксид хрома(III) – Cr2O3 –кристаллы зеленого цвета, нерастворимые в воде.
Cr2O3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики.
Оксид цинка – используется для приготовления белой масляной краски (цинковые белила)
Физические свойства оксидов.
? Что такое физические свойства?
Рассмотрите образца оксидов (вода, оксид хрома, оксиды железа, оксид кальция, оксид алюминия и др. )
Демонстрация: Взаимодействие концентрированной азотной кислоты с цинком – выделяется бурый газ NO2
(опыт проводится в вытяжном шкафу)
Демонстрация: Открываем бутылку газированной воды. Наблюдаем
Сделайте выводы о физических свойствах оксидов.
(учащиеся самостоятельно записывают основные физические свойства оксидов)
Получение оксидов:
Мы уже встречались с оксидами, при изучении темы “Кислород”. При взаимодействии разных веществ с кислородом получают оксиды.
? Вспомните, из каких веществ можно получить оксиды.
(учащиеся вспоминают, что оксиды получают при взаимодействии кислорода с простыми веществами. )
1. Взаимодействие простых веществ с кислородом.
? Дайте определение простым веществам. На какие группы можно разделить простые вещества?
(ответ учащихся – на металлы и неметаллы)
Работа учащихся.
Записать уравнения реакций взаимодействия металлов с кислородом и неметаллов с кислородом, назвать продукты (работа у доски)
? Какие еще вещества, кроме простых веществ вам известны?
(ответ учащихся – сложные вещества)
? Дайте определения сложным веществам
(учащиеся формулируют определение сложных веществ)
? Как горят сложные вещества?
(ответ учащихся – с образованием двух продуктов, а именно двух оксидов)
2. Взаимодействие сложных веществ с кислородом
Работа учащихся.
Записать уравнение реакции взаимодействия метана с кислородом, назвать продукты (работа у доски)
А сейчас я познакомлю вас с новыми, неизвестными еще для вас способами получения оксидов.
3. Разложение оснований
Mg(OH)2 = MgO + h3O
4. Разложение кислот
h3CO3 = h3O + CO2
4. Закрепление изученного материала
Проверим свои знания - тест
1. При нормальных условиях оксиды - это вещества:
а) только газообразные б) только жидкие в) газообразные, жидкие и твердые г) только твердые
2. Оксиды – это:
н) вещества, в состав которых входит гидроген о) вещества, в состав которых входит оксиген п) вещества, в состав которых входят металлы
3. Как называется оксид SO2?
в) сульфур оксид г) сульфур (II) оксид д) сульфур (IV) оксид е) сульфур (VI) оксид
4. Какие вещества получим при разложении CaCO3?
а) СаО и СО2 б) Са и О2 в) Са и СО2 г) С и СаО
Ответ теста: Вода
А о воде мы поговорим на следующем уроке.
Домашнее задание.
Выучить тему. Найти пословицы и поговорки о воде.
6. Подведение итогов урока.
Приложение
xn--i1abbnckbmcl9fb.xn--p1ai