|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Сущность окислительно-восстановительных реакций. Окислительно восстановительные реакции реферат
Реферат - Окислительно-восстановительный реакции - Химия
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя —акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2h3O → 2h3 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:
Cl2 + h3O → HClO + HCl
Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
Nh5NO3 → N2O + 2h3O
Примеры
Окислительно-восстановительная реакция между водородом и фтором

Разделяется на две полуреакции:
1) Окисление:

2) Восстановление:

Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:




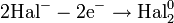
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:





Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
Отдать — Окислиться, Взять — Восстановиться (слова начинаются с одинаковых букв; при отдавании кем-либо чего-либо полезного — кислое, опущенное выражение лица, при получении — воспрявшее, восстановленное).
Окислитель — грабитель (в процессе окислительно-восстановительной реакции окислитель присоединяет электроны).
www.ronl.ru
Реферат - Окислительно-восстановительные реакции 2
Окислительно-восстановительные реакции
Вводная часть
Учитель. В III в. до н.э. на острове Родос был построен памятник в виде огромной статуи Гелиоса (у греков – бог Солнца). Грандиозный замысел и совершенство исполнения Колосса Родосского – одного из чудес света – поражали всех, кто его видел.
Мы не знаем точно, как выглядела статуя, но известно, что она была сделана из бронзы и достигала в высоту около 33 м. Статуя была создана скульптором Харетом, на ее строительство ушло 12 лет.
Бронзовая оболочка крепилась к железному каркасу. Полую статую начали строить снизу и, по мере того как она росла, заполняли камнями, чтобы сделать ее устойчивее. Примерно через 50 лет после завершения строительства Колосс рухнул. Во время землетрясения он переломился на уровне колен.
Ученые считают, что истинной причиной недолговечности этого чуда стала коррозия металла. А в основе процесса коррозии лежат окислительно-восстановительные реакции.
Сегодня на уроке вы познакомитесь с окислительно-восстановительными реакциями; узнаете о понятиях «восстановитель» и «окислитель», о процессах восстановления и окисления; научитесь расставлять коэффициенты в уравнениях окислительно-восстановительных реакций. Запишите в своих рабочих тетрадях число, тему урока.
Изучение нового материала
Учитель. Запишите молекулярные уравнения следующих реакций: взаимодействие сульфата меди (II) со щелочью и взаимодействие этой же соли с железом.
В каждом уравнении расставьте степени окисления элементов в формулах исходных веществ и продуктов реакции.

Учитель. Изменились ли степени окисления элементов в этих реакциях?
Ученик. В первом уравнении степени окисления элементов не изменились, а во втором изменились – у меди и железа.
Учитель. Вторая реакция относится к окислительно-восстановительным. Попробуйте дать определение окислительно-восстановительных реакций.
Ученик. Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями.
Учащиеся записывают в тетради под диктовку учителя определение окислительно-восстановительных реакций.
Учитель. Что же произошло в результате окислительно-восстановительной реакции? До реакции у железа была степень окисления 0, после реакции стала +2. Как видим, степень окисления повысилась, следовательно, железо отдает 2 электрона.
У меди до реакции степень окисления +2, после реакции – 0. Как видим, степень окисления понизилась. Следовательно, медь принимает 2 электрона.
Железо отдает электроны, оно является восстановителем, а процесс передачи электронов называется окислением.
Медь принимает электроны, она – окислитель, а процесс присоединения электронов называется восстановлением.
Запишем схемы этих процессов:

Итак, дайте определение понятий «восстановитель» и «окислитель».
Ученик. Атомы, молекулы или ионы, которые отдают электроны, называют восстановителями.
Атомы, молекулы или ионы, которые присоединяют электроны, называют окислителями.
Учитель. Какое определение можно дать процессам восстановления и окисления?
Ученик. Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом.
Окислением называют процесс передачи электронов атомом, молекулой или ионом.
Учащиеся записывают под диктовку определения в тетрадь и выполняют рисунок.

Запомните!
Отдать электроны – окислиться.
Взять электроны – восстановиться.
Учитель. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций используют два метода – электронного баланса и электронно-ионного баланса (метод полуреакций).
Мы рассмотрим только метод электронного баланса. Для этого используем алгоритм расстановки коэффициентов методом электронного баланса.

П р и м е р. Расставьте коэффициенты в данной схеме реакции методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
Fe2O3 + CO → Fe + CO2.
Решение
Воспользуемся алгоритмом расстановки коэффициентов методом электронного баланса.



Учитель. Окислительно-восстановительные реакции очень распространены. С ними связаны не только процессы коррозии, но и брожение, гниение, фотосинтез, процессы обмена веществ, протекающие в живом организме. Их можно наблюдать при сгорании топлива. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.
Заключительная часть
Учитель предлагает учащимся разгадать кроссворд по изученному материалу. Результат работы сдается на проверку.
Разгадав кроссворд, вы узнаете, что вещества КМnО4, К2Сr2O7, О3 – cильные … (по вертикали (2)).



www.ronl.ru
Реферат - Занятие Окислительно-восстановительные реакции в природе и промышленности Цели
Занятие 9. Окислительно-восстановительные реакции в природе ипромышленности
Цели: 1. Познакомиться с ролью окислительно-восстановительных процессов в природе и промышленности.
2. Совершенствовать умения работать с разными источниками информации (в том числе Интернет) с целью получения новых знаний.
Задание: Изучите представленную в тексте информацию. Выберите тему для реферата.
Изучите список дополнительной литературы, которой Вы можете воспользоваться. Также информацию по данным проблемам Вы можете найти в Интернете.
Познакомьтесь с требованиями по написанию рефератов. Ждем Ваши работы по адресу. Желаем успехов!
^ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В ПРОМЫШЛЕННОСТИ
Важнейшие отрасли современной промышленности основаны на использовании процессов окисления-восстановления. Приведем примеры лишь некоторых промышленных производств, связанных с использованием этих процессов.
Прежде всего, следует указать производство серной кислоты, которая является важным продуктом основной химической промышленности.
Производство серной кислоты состоит из трех стадий: получение оксида серы (IV) S02, окисление его в оксид серы (VI) S03 и поглощение оксида серы (VI) серной кислотой.
Оксид серы (IV) получается путем обжига пирита (серного колчедана):
4FeS2+1102=2Fe203+ 8S02
Окисление его большей частью производят контактным способом. В этом случае реакция протекает в присутствии твердых катализаторов.
Реакция окисления оксида серы (IV) в оксид серы (VI) является обратимой:
2S02+02 = 2S03
Увеличение количества кислорода в обжиговом газе повышает выход продукта. При температуре 450°С он обычно достигает 95% и выше.
Последняя стадия производства — поглощение оксида серы (VI) концентрированной серной кислотой. При этом образуется олеум. При разбавлении его водой получают серную кислоту необходимой концентрации.
Процесс получения азотной кислоты можно разбить на три стадии, каждая из которых является окислительно-восстановительной реакцией: окисление аммиака на платиновом катализаторе
4Nh4+502=4NO+6h30
окисление оксида азота (II) N0 кислородом воздуха: 2NO+02=2N02
поглощение оксида азота (IV) N02 водой в присутствии избытка кислорода
4N02+2h30+O2=4HN03
Окислительно-восстановительные процессы являются основой и ряда производств органической химии.
В промышленных условиях путем сжигания углеводородов (природных газов, метана, ацетилена, скипидара и др.) при ограниченном доступе воздуха или путем их термического разложения получают сажу. Она применяется как наполнитель в производстве резины, для изготовления черных красок и кремов для обуви.
При окислении метана, содержащегося в природных газах или образующегося при коксовании каменных углей и переработке нефти, получают формальдегид СН20 и метанол СНзОН. Современный способ получения метанола— каталитический синтез из оксида углерода (II) и водорода:
СО+2Н2 = СН3ОН
Процесс ведут при температуре 300—400°С, давлении 250—500 атм, с катализатором из смеси оксидов цинка и хрома (ZnO+Cr203).
^ В ОСНОВЕ МЕТАЛЛУРГИИ
Трудно переоценить значение металлов для народного хозяйства, а получение металлов из руд также основано на окислительно-восстановительных реакциях.
Обычно руды состоят из кислородных или сернистых соединений, из которых предстоит восстановить металл в свободном состоянии.
Один из самых распространенных в природе металлов - железо. Для получения его из руд применяют восстановление оксидов с помощью оксида углерода (II) СО и кокса при высоких температурах. Металлургические процессы, проводимые при высоких температурах, называются пирометаллургическими. Получается не чистое железо, а сплав его с углеродом и другими примесями (кремнием, марганцем, серой, фосфором) — чугун.
В практике часто применяют восстановление металлов из их соединений другими металлами. В качестве восстановителей применяют алюминий, магний, кальций, натрий, а также кремний. Металлотермией получают те металлы (и их сплавы), которые при восстановлении их оксидов углем образуют карбиды. Это марганец, хром, титан, молибден, вольфрам и др.
Иногда металлы из их оксидов восстанавливают водородом:
Мо03+ЗН2=Мо+ЗН20
W03+3h3=W+3h30
Гидрометаллургия охватывает способы получения металлов из растворов их солей. При этом металл, входящий в состав руды, сначала переводят в раствор с помощью подходящих реагентов, а затем извлекают его из этого раствора. Например, при обработке разбавленной серной кислотой медной руды, содержащей оксид меди, медь переходит в раствор в виде сульфата:
CuO+h3S04 = CuS04+h30
Затем медь извлекают из раствора либо электролизом, либо вытеснением с помощью железа:
CuS04 + Fe = Cu + FeS04
Современная металлургия получает более 75 металлов и многочисленные сплавы на их основе.
Металлы и сплавы подвергаются коррозии. Под коррозией понимают разрушение металла под воздействием окружающей среды. Различают два вида коррозии: химическую и электрохимическую.
Химическая коррозия обусловливается взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Большой вред приносит газовая коррозия, т. е. окисление металлов кислородом воздуха. При повышенных температурах скорость окисления многих металлов сильно возрастает. Так, на железе уже при 250—300°С появляется видимая пленка оксидов. При 600°С и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления: FeO, Fe304, Fe203. Окалина не защищает железо от дальнейшего окисления, так как содержит трещины и поры, которые не могут препятствовать проникновению кислорода к металлу. Поэтому при нагревании железа свыше 800°С скорость окисления его очень быстро растет.
У некоторых металлов соприкосновение с кислородом воздуха сильно замедляет процесс коррозии. Это происходит потому, что на поверхности металла образуется защитная оксидная пленка, которая препятствует проникновению к металлу как газов, так и жидкостей. Такой металл делается химически неактивным.
Электрохимическая коррозия — разрушение металла при контакте двух разнородных металлов в присутствии воды или другого электролита. В качестве примера можно привести коррозию железа в контакте с медью в растворе электролита соляной кислоты (при высокой концентрации ионов Н+). Более активный металл - железо окисляется и переходит в раствор в виде ионов Fe2+. Ионы же Н+ движутся к меди, где, принимая электроны, разряжаются:
Fe0 - 2e = Fe2+
2Н+ + 2ё= Н20
Fe0 + 2H+ = Fe2+ + h30
В нейтральных и щелочных растворах протекает процесс восстановления кислорода, растворенного в электролите:
02+2Н20+4ё=40Н-,
В этом случае образовавшиеся ионы ОН- соединяются с перешедшими в раствор ионами Fe2+:
Fe2++20H-=Fe(OH)2
Гидроксид железа (II) в присутствии воды и кислорода воздуха переходит в гидроксид железа (III):
4Fe(OH)2+2h30+02=4Fe(OH)3)
который частично отщепляет воду; образующееся соединение по составу отвечает бурой ржавчине.
Электрохимическую коррозию вызывают главным образом загрязнения, примеси, содержащиеся в металле, неоднородность химического состава и структуры, а также неоднородность его поверхности. Совершенно чистые металлы коррозии практически не подвергаются.
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность, а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с повышением температуры.
Коррозия металлов протекает непрерывно и причиняет огромные убытки. Подсчитано, что прямые потери железа от коррозии составляют около 10% от ежегодной выплавки. В результате коррозии металлические изделия теряют свои ценные технические свойства. Поэтому имеют очень большое значение меры борьбы с коррозией металлов. Они весьма разнообразны, но многие из них также имеют в своей основе окислительно-восстановительные процессы.
Оксидирование — создание на поверхности металла искусственной защитной пленки. При химическом способе детали погружают в концентрированный раствор щелочи, содержащий окислители: нитрат или нитрит натрия или оба вместе — и нагревают до 135—145°С. Получаемая пленка на металле состоит из оксида железа Fe304 черного цвета. Поэтому операцию оксидирования сталей называют воронением. Оксидную пленку можно получить также в растворе щелочи под током на аноде. В тех случаях, когда защищаемая конструкция (подземный трубопровод, корпус судна) находится в среде электролита (морская вода, подземные воды, почвенные воды и т. д.), применяют протекторную защиту (контакт с более активным металлом).
Принципиально на том же основана электрозащита. Конструкция, находящаяся в среде электролита, также соединяется с другим металлом, но через внешний источник тока. При этом защищаемую конструкцию присоединяют к катоду, а металл - к аноду источника тока. В этом случае не имеет значения, выше или ниже электродный потенциал защищающего металла, чем у металла конструкции, так как электроны отнимаются от анода источником тока, анод (защищающий металл) разрушается и таким образом предохраняется от разрушения конструкции.
^ ИСТОЧНИК ЭНЕРГИИ
Химические процессы часто осуществляются в целях получения и использования энергии. Смесь паров бензина с воздухом поступает в двигатель внутреннего сгорания, сжимается поршнем и зажигается от запальной свечи (искры). Образующиеся в результате окисления топлива газы двигают поршень. Так за счет освобождающейся энергии при сгорании топлива летают самолеты и мчатся автомобили.
Огромное количество энергии, выделяемое при сжигании топлива, посылает со сверхзвуковой скоростью тяжелые ракеты и поднимает в воздух летательные аппараты. И главное требование, предъявляемое к топливу,— это выделять при сгорании максимальное количество теплоты.
Современное жидкое ракетное топливо — две жидкости, два компонента, содержащиеся в отдельных баках, смешивающиеся в камере сгорания. Одна жидкость-окислитель, вторая — восстановитель, т. е. горючее, причем окислителя расходуется в несколько раз больше. Жидкости должны быть подобраны таким образом, чтобы реакция окисления горючего развивала достаточную тягу и вместе с тем отвечала условиям эксплуатации. Несмотря на то, что было предложено много различных комбинаций, широкое практическое применение получили окислители: жидкий кислород, азотная кислота и растворы оксидов азота в азотной кислоте. В качестве горючего применяют различные жидкие углеводороды — керосин и азотоводороды — гидразин, бороводороды— диметилгидразин, жидкий водород. С помощью сжигания такого топлива запускаются в космос искусственные спутники Земли, космические корабли и автоматические межпланетные станции для изучения Венеры, Марса и других планет, Луны. Ученые многих стран в десятках лабораторий мира ведут исследования различных видов топлива и предлагают новые сильные окислители.
Конечно, сильнейший окислитель — фтор. С тех пор как научились его сжижать и перевозить, увеличилась его роль как окислителя горючего. Так, за последние 10—15 лет в США его производство стало быстро развиваться. Однако фтор имеет существенные недостатки— высокую реакционную способность, низкую температуру кипения и очень большую токсичность: фтор поражает дыхательные пути и вызывает тяжелые ожоги на коже. Поэтому фтор как окислитель может эксплуатироваться только в смеси с жидким кислородом (до 30% фтора). Жидкий фтор для жидкостных ракетных двигателей впервые предложен в 1932 г. Ф. А. Цандером (СССР), а смеси жидких кислорода и фтора - В. П. Глушковым в 1933 г.
В качестве горючего исследуется применение легких металлов: лития, бериллия, алюминия и др.
Важной проблемой современной энергетики является повышение эффективности использования природного топлива. Один из путей решения этой проблемы — создание топливных элементов.
В топливном элементе химическая энергия реакции горения (окисления) топлива непосредственно превращается в электрическую энергию. В нем отсутствует термодинамически невыгодная стадия превращения тепловой энергии в механическую, которая всегда связана с большими потерями полезной энергии. Поэтому коэффициент полезного действия топливного элемента намного превышает коэффициент полезного действия тепловых машин.
^ КРУГОВОРОТ ЭЛЕМЕНТОВ В ПРИРОДЕ
До сих пор рассматривались примеры окислительно-восстановительных процессов, связанных с сознательной деятельностью человека, однако в природе они играют ведущую роль.
Весь окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции и в основном окислительно-восстановительные.
Начнем с азота. Он содержится в организмах животных и растений в виде органических соединений: белки, нуклеиновые кислоты, некоторые гормоны и витамины, краситель крови, хлорофилл и алкалоиды растений.
Каким же образом попадает азот в живые организмы? В природе азот находится как в свободном, так и в связанном состоянии. Общее содержание азота в земной коре определяется примерно в 0,04% от массы всех химических элементов. Наибольшая часть содержится в атмосфере: 75,5% по массе, или 78,10% по объему. Зная общую поверхность Земли и величину атмосферного давления, подсчитали общую массу азота воздуха. Она примерно равна 4-Ю15т. Над каждым квадратным километром земной поверхности находится около 8 млн. т азота.
Несмотря на неисчерпаемые ресурсы азота в атмосфере, растения часто испытывают недостаток в азотистой пище.
Растения получают из почвы минеральный связанный азот в виде аммонийных солей и солей азотной кислоты. При этом интенсивно протекают процессы окисления и восстановления.
В животном организме также устанавливается азотистое динамическое равновесие, при котором организм получает белок с пищей и отдает его путем пи-делений. Связанный азот возвращается в почву. Под воздействием почвенных бактерий отбросы и остатки животных и растений «гниют».
Образующийся аммиак под воздействием нитрифицирующих бактерий частично подвергается окислению:
2Nh4+302 = 2HN02+2h30,
2HN02+02=2HN03
Получающаяся азотная кислота взаимодействует с имеющимися в почве карбонатами, например:
2HN03+CaC03 = Ca (N03)2+C02+h30
Было замечено, что в местах гниения навоза появляются большие количества нитратов (селитры). Нитраты вновь усваиваются растениями, белки растений — животными, продукты распада белков тех и других вновь возвращаются в почву. Так замыкается малый круг превращений азота из неорганических соединений в органические.
Кроме малого, в природе существует большой круг превращений свободного азота в связанный — фиксация и обратно, связанного азота в свободный — дефиксация (рис. 16). Первым источником фиксации служат бактерии, а другим - грозовые разряды:
N2+02=2NO; 2NO+02=2N02; 2N02+h30 = HN03+HN02
Получающиеся при этом кислоты попадают с атмосферными осадками в почву, где и превращаются в нитраты и нитриты. Высчитали, что таким путем в почву попадает от 4 до 15 кг азота на гектар в год.
В природе протекают процессы, ведущие к большим потерям связанного азота. Частично связанный азот дефиксируется до элементарного при распаде белковых веществ. При плохой аэрации почвы (малом доступе кислорода) большую часть связанного азота переводят в свободный азот денитрифицирующие бактерии.
Углерод является главной составной частью животного и растительного мира. В атмосфере углерод содержится в виде оксида углерода С02 в незначительных концентрациях (около 0,03% по объему).
Оксид углерода (IV) образуется при сгорании органических веществ, при гниении, а также при дыхании. Но существует процесс, при- котором из оксида углерода (IV) вновь образуются органические вещества, — это фотосинтез. Солнечные лучи поглощаются в клетках листьев хлорофиллом. Суммарно процесс фотосинтеза можно выразить уравнением:
6п C02+5nh30= (С6Н10О5)п+6пО2
Ежегодно растения извлекают из атмосферы около 17 млрд. г углерода. Одновременно с поглощением оксида углерода (IV) в атмосферу выделяется кислород. В растениях синтезируются углеводы — глюкоза, крахмал, клетчатка и другие вещества, которые служат пищей человеку и животным. При дыхании людей и животных, горении и гниении органических веществ оксид углерода (IV) вновь поступает в атмосферу. Так выглядит круговорот углерода в природе.
Частично углерод выводится из круговорота: остатки растений и животных частью превращаются в торф, ископаемые угли, нефть и т. п., также некоторая часть оксида углерода (IV) реагирует с различными горными породами и при этом образуются карбонаты и гидрокарбонаты разных металлов. По данным геохимии, в результате отложения каменных углей и известняков огромные количества углерода были выведены из атмосферы земного шара на протяжении его истории.
Не менее интересен круговорот серы: с одной стороны, сера - неотъемлемая составная часть многих минералов и руд, с другой — входя в состав белков, сере является одним из необходимых элементов живых существ. Круговорот ее также имеет в своей основе окислительно-восстановительные процессы. При взаимодействии с воздухом и водой сульфиды постоянно превращаются в сероводород, который окисляется:
CaS +C02+h30 = CaC03+h3S
2h3S+02 = 2h30+S
Окисление сероводорода протекает в еще большей степени при помощи серобактерий. Образующаяся сера откладывается в телах этих бактерий, до 95% их массы. Некоторые виды серобактерий синтезируют органические вещества, используя сероводород.
При извержениях вулканов вместе с сероводородом одновременно выделяется оксид серы (IV). Между ними протекает окислительно-восстановительная реакция:
2h3S+S02=2h30+3S
Если сероводород присутствует в больших количествах, то кислород воздуха расходуется на его окисление и выделяющаяся сера образует залежи. Сера постепенно окисляется кислородом воздуха:
2S+302+2h30=2h3S04
Серная кислота, взаимодействуя с различными солями почвы и воды, переводит их в сульфаты:
CaC03+ h3S04=CaS04+C02+h30
Так образуются различные минералы, содержащие серу. Процесс восстановления сульфатов в сероводород протекает в меньшей степени. Залежи сульфатов в результате геологических смещений могут попасть в более глубокие слои Земли, где при повышенной температуре реагируют с органическими веществами (например, для простоты взят метан):
Ch5+CaS04 = CaC03+h3S+h30
При этом сероводород выходит на поверхность земли либо в виде газа, либо в растворенном виде в воде — сероводородные источники.
Другой путь восстановления сульфатов заключается в том, что растения вводят серу в состав белков. Белки, В свою очередь, частично усваиваются животными. После гибели растений и животных их белковые вещества разлагаются с выделением сероводорода.
Окислительно-восстановительные реакции играют большую роль в биохимических процессах -дыхании, обмене веществ, нервной деятельности человека и животных. Проявление различных жизненных функций организма связано с затратой энергии, которую наш организм получает из пищи в результате окислительно-восстановительных реакций.
Примерные темы рефератов:
1. Биологическое значение окислительно-восстановительных процессов (на примере белков, жиров и углеводов).
2. Круговорот элементов в природе.
3. Окислительно- восстановительные реакции в промышленном получении химических веществ (на примере серной, азотной кислот, металлов и сплавов).
Требования к оформлению реферата:
1. Требования к оформлению титульного листа
В правом верхнем углу указывается название учебного заведения, в центре - тема реферата, ниже темы справа - Ф.И.О. учащегося, класс. Ф.И.О. руководителя, внизу - город и год написания.
2. Оглавление
Следующим после титульного листа должно идти оглавление.
Реферат следует составлять из четырех основных частей: введения, основной части, заключения и списка литературы.
^ 3. Основные требования к введению
Введение должно включать в себя краткое обоснование актуальности темы реферата, которая может рассматриваться в связи с невыясненностью вопроса в науке, с его объективной сложностью для изучения, а также в связи с многочисленными теориями и спорами, которые вокруг нее возникают. В этой части необходимо также показать, почему данный вопрос может представлять научный интерес и какое может иметь практическое значение. Таким образом, тема реферата должна быть актуальна либо с научной точки зрения, либо из практических соображений.
Введение должно содержать также краткий обзор изученной литературы, в котором указывается взятый из того или иного источника материал, анализируются его сильные и слабые стороны. Объем введения обычно составляет две-три страницы текста.
^ 4. Требования к основной част реферата
Основная часть реферата содержит материал, который отобран для рассмотрения проблемы. Средний объем основной части реферата - 10 страниц. При написании необходимо обратить внимание на обоснованное распределение материала на параграфы, умение формулировать их название, соблюдение логики изложения.
Основная часть реферата, кроме содержания, выбранного из разных литературных источников, также должна включать в себя собственное мнение учащегося и сформулированные самостоятельные выводы, опирающиеся на приведенные факты.
^ 5. Требования к заключению
Заключение - часть реферата, в которой формулируются выводы. Заключение должно быть четким, кратким, вытекающим из основной части. Объем заключения 2 - 3 страницы.
^ 6. Основные требования к списку изученной литературы
Источники должны быть перечислены в алфавитной последовательности (по первым буквам фамилий авторов или но названиям сборников). Необходимо указать место издания, название издательства, год издания.
^ 7. Основные требования к написанию реферата
Основные требования к написанию реферата следующие:
1 Должна соблюдаться определенная форма (титульный лист, оглавление и т.д.)
2 Выбранная тема должна содержать определенную проблему и быть адекватной школьному уровню по объему и степени научности.
3 Реферат не должен быть очень объемным по числу страниц.
4. Введение и заключение должны быть осмыслением основной части реферата
Литература:
1. Большая энциклопедия Кирилла и Мефодия, www.KM.ru
2. Ершов Ю.А., Попков В.А., Берлянд А.С., Общая химия. Биофизическая химия. Химия биогенных элементов, М, Высшая школа,2000.
3. Т.М. Солдатова. Химия 8-11 классы. Издательство «Учитель», Волгоград,2007.
4. Г.П. Хомченко, К. И. Севастьянова. Окислительно-восстановительные реакции. М, Просвещение, 1989.
www.ronl.ru
Реферат - Сущность окислительно-восстановительных реакций
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление—один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других химических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления. Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных химических продуктов (аммиака, щёлочей, азотной, серной и других кислот) основана на окислительно-восстановительных реакциях. На окислении-восстановлении в аналитической химии основаны методы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и другие, играющие важную роль при контролировании производственных процессов и выполнении научных исследований. В органической химии для проведения ряда химических превращений самое широкое распространение нашли процессы окисления-восстановления. Инертные газы лишь в исключительных случаях способны вступать в окислительно-восстановительные реакции. ЭНЕРГИЯ ИОНИЗАЦИИ И СРОДСТВО К ЭЛЕКТРОНУ. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ Химическая природа элемента оценивается способностью его атома терять и приобретать электроны. Последняя может быть количественно оценена энергией ионизации и его сродством к электрону. Мерой энергии ионизации атома служит его ионизеционный потенциал, представляющий собой наименьшее напряжение в вольтах, Которое необходимо приложить для того, чтобы оторвать электрон от невозбужденного атома и удалить его на бесконечно далекое расстояние. В периодах, как правило, энергия ионизации увеличивается слева направо. При этом восстановительные свойства элементов уменьшаются, а окислительные—возрастают. Энергия сродства к электрону (СЭ) характеризует количество энергии, которая выделяется (или поглощается) в результате присоединения электрона к нейтральному атому с превращением его в отрицательный ион. Величины энергии сродства к электрону в периодах возрастают слева направо, в подгруппах, как правило, уменьшаются сверху вниз. Энергию ионизации ( I ) и энергию сродства к электрону ( Е ) можно отнести как к единичному атому, так и к 6,02* 1023 атомов. Для атомов свободных элементов окислительная и восстановительная активность выражается величинами энергии ионизации и сродства атома к электрону. Для того, чтобы решить вопрос, атом данного элемента легче теряет или присоединяет электрон, была введена характеристика, названная электроотрицательностью. Мерой электроотрицательности может служить арифметическая сумма значений ионизации I и сродства к электрону Е: ЭО = 1+Е. Электроотрицательность элемента имеет размерность слагаемых, из которых она образовалась, и может быть, следовательно, выражена в тех же единицах. Для более удобного пользования значениями электроотрицательности элементов принята система их относительных величин, в которой электроотрицательность лития условно принята за единицу. В табл.1 приведены значения относительной электроотрицательности (ОЭО) различных элементов по Полингу. Как и следовало ожидать, наибольшее значение электроотрицательности имеет фтор, наименьшее-цезий. Водород занимает промежуточное положение, т. е. При взаимодействии с одними элементами (например, с F ) он отдаёт электрон, а с другими (например, с Rb ) – приобретает. Чем больше различие в электроотрицательности двух элементов, тем больше химическая связь между их атомами по своему характеру отличается от ковалентной связи и приближается к ионной. Так, разница в величинах относительной электроотрицательности у элементов натрия и фтора равна: ОЭО = 4 – 0,9 = 3,1, поэтому в NaF связь ионная; в молекуле Cl2 ( ^ ОЭО = 0 ) связь ковалентная, неполярная; в молекулах HF ( ^ ОЭО = 1,9 ) и HCl ( ^ ОЭО = 0,6 ) связи полярны, причем у молекулы HF диполь больше, чем у молекулы HCl. Таблица 1 Электроотрицательность (ОЭО) атомов некоторых элементов периодической системы. Период I гр ЭО II гр ЭО III гр ЭО IVгр ЭО Vгр ЭО VIгр ЭО VIIгр ЭО I H 2,2 II Li 0,95 Be 1,5 B 2,0 C 2,6 N 3,0 O 3,5 F 3,9 III Na 0,90 Mg 1,2 Al 1,5 Si 1,9 P 2,1 S 2,6 Cl 3,1 IV K 0,80 Ca 1,0 Ga 1,6 Ge 2,0 As 2,0 Se 2,4 Br 2,9 V Rb 0,8 Sr 1,0 In 1,7 Sn 1,7 Sb 1,8 Te 2,1 I 2,6 VI Cs 0,75 Ba 0,9 Tl 1,4 Pb 1,6 Bi 1,8 Po 2,0 At 2,2 Пользуясь электроотрицательностью как величиной, характеризующей способность атома к притяжению валентных электронов, необходимо помнить, что элементу нельзя приписать постоянную электроотрицательность. Она зависит от того, в составе какого конкретного соединения рассматривается атом, в окружении атомов каких элементов он находится. Так, свободный атом хлора в молекулах Cl2, NaCl, CCl 4 обладает неодинаковыми свойствами. Следовательно, надо иметь в виду не электроотрицательность вообще, а электроотрицательность элемента, образующего конкретные химические связи в конкретном окружении, в конкретном валентном состоянии. Однако, несмотря на это, понятие электроотрицательности является полезным для объяснения многих свойств химических связей. Чем больше величина электроотрицательности элемента, тем сильнее его окислительные (неметаллические ) свойства, и наоборот, элемент, имеющий наименьшее значение электроотрицательности, наиболее активно проявляет восстановительные свойства. СТЕПЕНЬ ОКИСЛЕНИЯ Под степенью окисления атома в молекуле понимается условный электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому. При этом условии предполагается, что электроны каждой связи в моле- куле ( или ионе ) принадлежат более электроотрицательному атому. Степень окисления атома обозначается числом со знаком ( + ) или ( - ). Значение положительной степени окисления элемента соответствует числу оттянутых от атома электронов +, а величина отрицательной степени окисления – числу притянутых атомом электронов -. Для определения степени окисления атомов в свободном состоянии и в химических соединениях следует руководствоваться данными ОЭО ( табл. 1 ) и следующим : 1. Атомы кислорода в соединениях могут проявлять как целые, так и дробные степени окисления. Например, степень окисления кислорода в основном равна (-2), в h3O2 ( -1 ), в KO2 и КО3 – соответственно (-1/2 и –1/3 ), а во фторокислороде ОF2- (+2 ). Для водорода характерна степень окисления +1, но встречается и –1 ( в гидридах металлов 2. Степень окисления атомов в простых ионных соединениях по знаку м величине равна электрическому заряду иона. Например, в хлориде калия степень окисления калия равна +1, а хлора – (-1). 3.Если молекула образована за счёт ковалентной или ионно-ковалентной связи (например, SO2,Nh4, HCl,HNO3) степень окисления более электроотрицательного атома обозначается со знаком -, а менее электроотрицательного атома – со знаком +. Для понимания определения степени окисления элементов ряда соединений целесообразно писать их графические формулы. Так, в соединениях азота Nh4, N2h5, Nh3OH, HNO2, HNO3 степени окисления азота соответственно равны:-3, -2, -1, +3, +5. Это наглядно видно из их графических формул. В случае наличия химической связи между одинаковыми атомами (N3h5)электронную пару надо поделить между атомами, которые она связывает. Далее необходимо подсчитать число электронов у каждого из них. Разность между числом электронов у свободного атома на внешнем уровне и найденным числом даст степень окисления атома. 4.В отличие от рассмотренных выше молекул в молекулах, состоящих из одинаковых атомов (h3, Cl2, Br2, N2 и др. ), степень окисления атомов равна нулю, так как здесь не имеет места одностороннее оттягивание общих пар электронов к какому-либо одному атому. Например, в молекулах водорода ( Н : Н ) и хлора ( :Cl : Cl: ) степень окисления равна нулю, но ковалентность их соответствует единице по количеству электронных пар. 5.В большинстве органических соединений химические связи имеют слабо вы-раженный полярный характер: присоединение к атомам углерода, составляющим скелет органических соединений ( например, фтора, кислорода, хлора, азота ), приводит к изменению электронной плотности между атомами углерода и указанных элементов и, тем самым, к увеличению полярности связи между ними. Степень окисления атомов в них определяется так же, как и в ковалентных полярных соединениях. 6,Металлы в элементарном состоянии имеют равномерное распределение электронной плотности вокруг ядра, поэтому степень окисления их принимается равной нулю. 7.В любом ионе алгебраическая сумма степеней окисления всех атомов равняется заряду иона, а сумма степеней окисления всех атомов, входящих в электронейтральное соединение, - нулю. 8.Для комплексных соединений обычно указывают степень окисления центрального атома. Например, в К3 ( Fe ( CN6)) и (Ni (Nh4)6 ) SO4 степень окисления железа равна +3, а никеля – (+2 ). Следует подчеркнуть, что понятие степени окисления является формальным и обычно не характеризует действительного состояния рассматриваемого атома в соединении. Во многих случаях степень окисления не равна валентности данного элемента. Например, в метане (СН4), метиловом спирте (СН3ОН), формальдегиде (СН2О), муравьиной кислоте (НСООН), и углекислом газе (СО2) степень окисления углерода равна соответственно:+4, -2, 0, +2, +4, в то время как валентность углерода во всех этих соединениях равна четырем. Понятие «степень окисления» особенно широко используется при изучении окислительно-восстановительных реакций.ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Все окислительно-восстановительные реакции можно разделить на следующие типы: 1.Реакции межатомного и межмолекулярного окисления-восстановления -обмен электронами происходит между различными атомами, молекулами или ионами. Например, простейшие реакции соединения и замещения: 2Ca+O2 = 2CaO 2Hl+Br2 = 2HBr + I2 2Al + 3CuSO4 =Al2( SO4)3 +3Cu 2. Реакции диспропорционирования (самоокисления-самовосстановления ) харакктерны для соединений или простых веществ, отвечающих одному из промежуточных значений степени окисления данного элемента, например: Cl2+2NaOH ----- NaCl +NaClO P + h3 ----- Ph4 + h4PO3 3. Реакции внутримолекулярного окисления-восстановления. В этих реакциях одна составная часть молекулы выполняет функцию окислителя, а другая восстановителя. Простейшими примерами таких реакций могут служить процессы термического разложения сложного вещества на более простые составные части, например: 2NO2 ----- NO2 + O2 4KСlO3 ----- KСlO4 + KCl 2KСlO3 ------ 3O2 + 2KCl 2AgNO3 ----- 2Ag + 2No2 + O2
МЕТОДИКА СОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Для составления уравнений окислительно-восстановительных реакций следует знать окислительные и восстановительные свойства вступающих и образующихся в результате реакции соединений; они обычно усиливаются экспериментально или на основе известных свойств элементов. Необходимо учитывать, что : - в окислительно-восстановительных реакциях формально происходит только эквивалентный обмен электронов между восстановителем и окислителем, т.е. суммарно числа электронов, теряемых восстановителем и приобретаемых окислителем, равны; - для любого химического уравнения общее количество одноимённых атомов в левой части равенства должно быть равно их количеству в правой части; - если реакции окисления-восстановления проходят в растворе, то следует учитывать влияние среды на стягивание освобождающихся ионов О с ионами Н (в кислой среде) с образованием слабо диссоциирующих молекул Н2О, а в нейтральных и щелочных растворах ионы О реагируют с образованием гидроксид-ионов НОН + О = 2ОН. Применяются в основном два метода составления уравнений окислительно-восстановительных реакций: 1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю; 2) ионно-электронный – предусматривает раздельное составление уравнений для процесса окисления и восстановления с последующим суммированием их в общее ионное уравнение-метод полуреакции. В этом методе следует найти не только коэффициенты для восстановителя и окислителя, но и для молекул среды. В зависимости от характера среды число электронов, принимаемых окислителем или теряемых восстановителем, может изменяться. В некоторых случаях среда обуславливает даже изменение направления процесса, например: в щелочной среде ( рН >7 ) HIO3 +5HI = 3I2 + 3h3O в кислой среде (pH В нейтральной и слабощелочной среде(рН > 7) As2O3 + 2I2 + 2h3O = As2O5 + 4HI В кислой среде (рН При рН 5Н2О2 + I2 ---- 2HIO3 + 4h3O ; рН > 2, наоборот, HIO3 окисляет пероксид водорода : 5Н2О2 + 2НIO3 ---- I2 + 5O2 + 6h3O. Регулируя среду, можно заставить реакцию количественно протекать в желаемом направлении. Это изменение зависит также от концентрации реагирующих веществ. Уравнения реакций окисления-восстановления изображаются тремя последовательными стадиями : 1) начальные продукты; 2) промежуточные продукты и их стяжение ; 3) конечные продукты. Для оформления второй стадии реакции следует знать правила стяжения : 1. Образующиеся в реакции окисления-восстановления атомы с положительной степенью окисления +4, +5, +6, +7 стягиваются с ионами кислорода и образуют остатки типа ( RO4 ), ( RO3 ), например : SO4, MnO4, SO3, CO3, ClO4 и т.д. Исключение : С, S, Mn в нейтральной или кислой среде образуют диоксиды CO2, SO2, MnO2. Дополнение : амфотерные элементы с положительной степенью окисления +2, +3, +4 в щелочной среде образуют гидроксокомплексы типа ( Ме(ОН)4 ), ( Ме(ОН)6), ( Ме(ОН)6 ). Элементы с положительной степенью окисления –1, +2, +3 в кислой среде образуют соли. 2. Избыточные ионы кислорода ( О ) в кислой среде образуют ( стягивают ) с ионами Н малодиссоциированные молекулы воды: О + 2Н = Н2О. 3. Избыточные ионы кислорода в нейтральной или щелочной среде стягиваются с молекулами воды, образуя ОН группы: О + Н ОН = 2ОН. 4. Избыточные ионы водорода ( Н ) в щелочной среде стягиваются с ионами ОН, образуя молекулы воды : Н + ОН = Н2О 5. Недостающие ионы кислорода ( О ) в кислой и нейтральной средах берутся из молекул воды с образованием ионов Н : Н2О – О = 2Н. 6. Недостающие ионы кислорода ( О ) в щелочной среде берутся из групп ОН с образованием молекул Н2О : 2ОН - О = Н2О. 7. Недостающие ионы Н в щелочной среде берутся из молекул воды с образованием ионов гидроксила: Н2О – Н = ОН РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В КИСЛОЙ СРЕДЕ Пример 1. Окисление сульфида свинца азотной кислотой. Схема реакции: РbS +HNO3 ---- PbSO4 + NO2 +... Составляем полуреакции : PbS + 4h3O – 8 e ----- PbSO4 + 8H NO3 + 2H + 1 e ----- NO2 +h3O Суммируем полуреакции, уравнивая количество отданных и принятых электронов 1 PbS + 4h3O ----- PbSO4 + 8H 8 NO3 + 2H ----- NO2 +h3O PbS + 4h3O + 8NO3 + 16H ----- PbSO4 + 8H + 8NO2 +8h3O Записываем в молекулярном виде, сокращая молекулы воды и стягивая ионы NO3 и H : PbS + 8HNO3 + 8H ----- PbSO4 + 8H + 8NO2 + 4h3O Конечный вид уравнения : PbS + 8HNO3 == PbSO4 + 8NO2 + 4h3O РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В НЕЙТРАЛЬНОЙ СРЕДЕ Пример 1. Рассмотрим реакции окисления-восстановления, протекающие в нейтральной среде по схеме Na2SO3 + KMnO4 + h3O ----- MnO2 + Na2SO4 + SO3 + h3O – 2e ----- SO4 + 2H MnO4 + 2h3O + 3e ----- MnO2 + 4OH 3SO3 + 3h3O + 2MnO4 + 4h3O ----- 3SO4 + 6H + 2MnO2 + 3OH. Ионы H и ОН стягиваются с образованием слабо диссоциированных молекул воды: 3Na2SO3 + h3O + 2KMnO4 ----- Na2SO4 + 6h3O + 2MnO2 + 2OH 3Na2SO3 + h3O + 2KMnO4 == Na2SO4 + 2MnO2 + KOH СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ОКИСЛЕНИЯ – ВОССТАНОВЛЕНИЯ С УЧАСТИЕМ СОЕДИНЕНИЙ ПЕРЕКИСНОГО ТИПА (h3O, BaO2, h3S2, FeS2 и т. д. ) Все эти соединения содержат двухвалентные ионы ( S –S ) и (О – О), поэтому состояние окисления каждого из атомов кислорода и серы, образующих данные цепи, равно I. При разложении h3O2 переходит в более стабильное состояние: в h3O и О2, в которых соответственно равны степени окисления кислорода (-2 ) и 0. В окислительно-восстановительных реакциях пероксид водорода в зависимости от партнёров и условий реакции может выступать и как окислитель, и как восстановитель. Рассмотрим реакции этих соединений на примерах пероксида водорода: Пример 1. Н2О2 - окислитель:а) в кислой среде молекула пероксида водорода, принимая два электрона, переходит в две молекулы воды по схеме h3O2 +2e + 2H ----- 2h3O; h3O2 +h3 S ----- h3SO4 + … h3O2 + 2e + 2H ----- 2h3O2 HS + 4h3O – 8e ------ SO4 + 9H 4h3O2 + 8H + HS + 4h3O ----- 8h3O + SO4 + 9H 4h3O2 + h3S + 7H ----- 4h3O + h3SO4 + 7H 4h3O2 + h3S == 4h3O + h3SO4 б) в нейтральной среде Н2О2 + 2е ----- 2ОН ОСОБЫЕ СЛУЧАИ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Если в реакции участвуют вещества, для которых сложно подсчитать степень окисления (например, В5Н11, FeAsS, органические вещества ) можно использовать метод схематического (формального) электронного баланса, суть которого заключается в том, что алгебраическая сумма зарядов в левой части уравнения реакции окисления или восстановления должна быть равна сумме зарядов в правой части этого же уравнения. Пример 1. Дана схема реакции В2Н6 + KclO3 ----- KCl + h4BO3 Определяем восстановитель и окислитель, составляем уравнение для процессов окисления и восстановления: В2Н6 – 12е + 6Н2О ----- 2Н3ВО3 + 12Н Восстановителем в этой реакции являются молекулы В2Н6, которые окисляются до борной кислоты : В2Н6 + 6Н2О ----- 2Н3ВО3 + 12Н Недостающие ионы кислорода для образования борной кислоты можно получить из молекул воды, при этом образуются ионы Н. Как нетрудно видеть, в левой части данной схемы процесса окисления имеется 0 зарядов, а в правой части – 12 положительных зарядов. Для уравнивания зарядов в обеих частях необходимо в левой части схемы отнять 12 электронов. Окислителем являются анионы ClO3, которые превращаются в ионы Cl, принимая 6 электронов :ClO3 + 6e + 3h3O ----- Cl + 6OH. При этом освобождающиеся ионы кислорода соединяются с молекулами воды ( реакция происходит в водной среде ), образуя ионы ОН. Затем производим балансирование уравнений процессов окисления и восстановления : 1 В2Н6 – 12е + 6Н2О ----- 2Н3ВО3 + 12Н 2 ClO3 + 6e + 3h3O ----- Cl + 6OH B2H6 + 6h3O + 2ClO3 + 6h3O ----- 2h4BO3 + 12H + 12OH + 2Cl B2H6 + 2KClO3 == 2h4BO3 + 2KCl 12h3O Пользование таблицей окислительно-восстановительных потенциалов Цифры таблицы получены при температуре 25 С. С изменением температуры они мало изменяются, поэтому ими можно пользоваться для определения направления реакции в обычных условиях. Цифры таблицы действительны для случаев, когда концентрация ( или, точнее активность ) растворов в гальванической цепи равна единице ( т. е. 1 моль/л ). Необходимо иметь в виду следующее : 1. Увеличение концентрации ионов, в которые переходит окисляющийся атом или ион, понижает э. д. с. реакции, а уменьшение – повышает. 2. Увеличение концентрации окисляющихся атомов или ионов повышает э. д. с. реакции, а уменьшение понижает. 3. Правила пользования таблицами для определения направления окисления – восстановления. В таблицах реакций представлены величины нормальных потенциалов окисления ( Еокисл ) и восстановления ( Евосст ) важнейших процессов. Таблицы соответственно разделены на две группы : “ Окисление “ и “ Восстановление “. Знак “ + “ у Еокисл (или Евосст ) и у соответствующего lgKокисл (или lgKвосст) показывает, что процесс идёт преимущественно слева направо, а знак “ – “ у этих же величин – справа налево. Для определения направления той или иной реакции окисления-восстановления берут данные разделов “ Окисление “ и “ Восстановление “, распологая в одну строку уравнение рассматриваемого процесса окисления с уравнением заданного процесса восстановления. При этом получают несбалансированное общее ионное уравнение возможной окислительно-восстановительной реакции. Алгебраическая сумма Еокисл + Евосст рассматриваемых процессов может быть величиной положительной, и тогда данная реакция ( при условии аокисл = авосст = 1 и определённом значении рН ) идёт, а если эта величина окажется отрицательной, то реаакция ( при тех же условиях ) невозможна. Пример. Пойдёт ли реакция между I - ионами и Fe ионами с образованием свободного йода ? Решение. На таблице “Окисление “ ( в группе реакций “Йод“ ) находят уравнение 2I – 2e I2, по таблице “Восстановление “ ( в группе реакций “Железо” ) находят уравнение Fe + e Fe и записывают их в одну строчку, складывая величины Еокисл + Евосст;
:lgKокисл :Еокисл :Евосст :lgKвосст: 2I - 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe Алгебраическая сумма ( - 0,5345 ) + ( +0,771 ) = + 0,2365 –величина положительная : следовательно, реакция 2 I + 2 Fe ----- I2 + 2Fe будет протекать при определённых условиях. С помощью указанных в этих же монограммах логарифмов констант равновесия можно также вычислить константы равновесия разнообразных реакций окисления-восстановления. Анализируя таблицу определения направления реакции окисления-восстановления, можно сделать следующие выводы : 1. Ионы “ благородных “ металлов – сильные окислители. Например : Cr + Ag----- Cr + Ag э. д. с. = + 0,7995- - 0,4 = 1,209 в. Fe + Au---- Fe + Au э. д. с. = + 1,68- + 0,77 = 0,91 в. 2. Наиболее сильные восстановители – атомы щелочных и щелочно –земельных металлов. Наиболее слабые восстановители – “благородные” металлы и ионы галогенов ( за исключением иона йода ). 3. Наиболее сильные окислители – нейтральные атомы галогенов, высокоположительные ионы металлов, а также ионы “благородных” металлов. Наиболее слабые окислители – ионы щелочных и щелочноземельных металлов.
www.ronl.ru
Реферат - Сущность окислительно-восстановительных реакций
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление—один из важнейших процессов природы.
Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других химических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления.
Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных химических продуктов (аммиака, щёлочей, азотной, серной и других кислот) основана на окислительно-восстановительных реакциях.
На окислении-восстановлении в аналитической химии основаны методы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и другие, играющие важную роль при контролировании производственных процессов и выполнении научных исследований. В органической химии для проведения ряда химических превращений самое широкое распространение нашли процессы окисления-восстановления.
Инертные газы лишь в исключительных случаях способны вступать в окислительно-восстановительные реакции.
ЭНЕРГИЯ ИОНИЗАЦИИ И СРОДСТВО К ЭЛЕКТРОНУ. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Химическая природа элемента оценивается способностью его атома терять и приобретать электроны. Последняя может быть количественно оценена энергией ионизации и его сродством к электрону.
Мерой энергии ионизации атома служит его ионизеционный потенциал, представляющий собой наименьшее напряжение в вольтах,
Которое необходимо приложить для того, чтобы оторвать электрон от невозбужденного атома и удалить его на бесконечно далекое расстояние.

 В периодах, как правило, энергия ионизации увеличивается слева направо. При этом восстановительные свойства элементов уменьшаются, а окислительные—возрастают.
В периодах, как правило, энергия ионизации увеличивается слева направо. При этом восстановительные свойства элементов уменьшаются, а окислительные—возрастают.
Энергия сродства к электрону (СЭ) характеризует количество энергии, которая выделяется (или поглощается) в результате присоединения электрона к нейтральному атому с превращением его в отрицательный ион. Величины энергии сродства к электрону в периодах возрастают слева направо, в подгруппах, как правило, уменьшаются сверху вниз.
Энергию ионизации ( I ) и энергию сродства к электрону ( Е ) можно отнести как к единичному атому, так и к 6,02* 1023 атомов.
Для атомов свободных элементов окислительная и восстановительная активность выражается величинами энергии ионизации и сродства атома к электрону.
Для того, чтобы решить вопрос, атом данного элемента легче теряет или присоединяет электрон, была введена характеристика, названная электроотрицательностью. Мерой электроотрицательности может служить арифметическая сумма значений ионизации I и сродства к электрону Е:
ЭО = 1+Е.
Электроотрицательность элемента имеет размерность слагаемых, из которых она образовалась, и может быть, следовательно, выражена в тех же единицах.
Для более удобного пользования значениями электроотрицательности элементов принята система их относительных величин, в которой электроотрицательность лития условно принята за единицу.
В табл.1 приведены значения относительной электроотрицательности (ОЭО) различных элементов по Полингу. Как и следовало ожидать, наибольшее значение электроотрицательности имеет фтор, наименьшее-цезий. Водород занимает промежуточное положение, т. е. При взаимодействии с одними элементами (например, с F ) он отдаёт электрон, а с другими (например, с Rb ) – приобретает. Чем больше различие в электроотрицательности двух элементов, тем больше химическая связь между их атомами по своему характеру отличается от ковалентной связи и приближается к ионной. Так, разница в величинах относительной электроотрицательности у элементов натрия и фтора равна: ОЭО = 4 – 0,9 = 3,1, поэтому в NaF связь ионная; в молекуле Cl 2
( ^ ОЭО = 0 ) связь ковалентная, неполярная; в молекулах HF ( ^ ОЭО = 1,9 ) и HCl ( ^ ОЭО = 0,6 ) связи полярны, причем у молекулы HF диполь больше, чем у молекулы HCl. Таблица 1
Электроотрицательность (ОЭО) атомов некоторых элементов периодической системы.
Период | I гр | ЭО | II гр | ЭО | III гр | ЭО | IV гр | ЭО | V гр | ЭО | VI гр | ЭО | VII гр | ЭО |
I | H | 2,2 | ||||||||||||
II | Li | 0,95 | Be | 1,5 | B | 2,0 | C | 2,6 | N | 3,0 | O | 3,5 | F | 3,9 |
III | Na | 0,90 | Mg | 1,2 | Al | 1,5 | Si | 1,9 | P | 2,1 | S | 2,6 | Cl | 3,1 |
IV | K | 0,80 | Ca | 1,0 | Ga | 1,6 | Ge | 2,0 | As | 2,0 | Se | 2,4 | Br | 2,9 |
V | Rb | 0,8 | Sr | 1,0 | In | 1,7 | Sn | 1,7 | Sb | 1,8 | Te | 2,1 | I | 2,6 |
VI | Cs | 0,75 | Ba | 0,9 | Tl | 1,4 | Pb | 1,6 | Bi | 1,8 | Po | 2,0 | At | 2,2 |
Пользуясь электроотрицательностью как величиной, характеризующей способность атома к притяжению валентных электронов, необходимо помнить, что элементу нельзя приписать постоянную электроотрицательность. Она зависит от того, в составе какого конкретного соединения рассматривается атом, в окружении атомов каких элементов он находится. Так, свободный атом хлора в молекулах Cl2, NaCl, CCl 4 обладает неодинаковыми свойствами. Следовательно, надо иметь в виду не электроотрицательность вообще, а электроотрицательность элемента, образующего конкретные химические связи в конкретном окружении, в конкретном валентном состоянии. Однако, несмотря на это, понятие электроотрицательности является полезным для объяснения многих свойств химических связей.
Чем больше величина электроотрицательности элемента, тем сильнее его окислительные (неметаллические ) свойства, и наоборот, элемент, имеющий наименьшее значение электроотрицательности, наиболее активно проявляет восстановительные свойства.
СТЕПЕНЬ ОКИСЛЕНИЯ
Под степенью окисления атома в молекуле понимается условный электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому.
При этом условии предполагается, что электроны каждой связи в моле-
куле ( или ионе ) принадлежат более электроотрицательному атому.
Степень окисления атома обозначается числом со знаком ( + ) или ( — ). Значение положительной степени окисления элемента соответствует числу оттянутых от атома электронов +, а величина отрицательной степени окисления – числу притянутых атомом электронов — .
Для определения степени окисления атомов в свободном состоянии и в химических соединениях следует руководствоваться данными ОЭО ( табл. 1 ) и следующим:
1. Атомы кислорода в соединениях могут проявлять как целые, так и дробные степени окисления. Например, степень окисления кислорода в основном равна (-2), в h3O2 ( -1 ), в KO2 и КО3 – соответственно (-1/2 и –1/3 ), а во фторокислороде ОF2- (+2 ). Для водорода характерна степень окисления +1, но встречается и –1 ( в гидридах металлов 2. Степень окисления атомов в простых ионных соединениях по знаку м величине равна электрическому заряду иона. Например, в хлориде калия степень окисления калия равна +1, а хлора – (-1).
3.Если молекула образована за счёт ковалентной или ионно-ковалентной связи (например, SO2,Nh4, HCl,HNO3) степень окисления более электроотрицательного атома обозначается со знаком -, а менее электроотрицательного атома – со знаком +. Для понимания определения степени окисления элементов ряда соединений целесообразно писать их графические формулы. Так, в соединениях азота Nh4, N2h5, Nh3OH, HNO2, HNO3 степени окисления азота соответственно равны:-3, -2, -1, +3, +5. Это наглядно видно из их графических формул. В случае наличия химической связи между одинаковыми атомами (N3h5)электронную пару надо поделить между атомами, которые она связывает. Далее необходимо подсчитать число электронов у каждого из них. Разность между числом электронов у свободного атома на внешнем уровне и найденным числом даст степень окисления атома.
4.В отличие от рассмотренных выше молекул в молекулах, состоящих из одинаковых атомов (h3, Cl2, Br2, N2 и др. ), степень окисления атомов равна нулю, так как здесь не имеет места одностороннее оттягивание общих пар электронов к какому-либо одному атому. Например, в молекулах водорода ( Н: Н ) и хлора ( :Cl: Cl: ) степень окисления равна нулю, но ковалентность их соответствует единице по количеству электронных пар.
5.В большинстве органических соединений химические связи имеют слабо вы-раженный полярный характер: присоединение к атомам углерода, составляющим скелет органических соединений ( например, фтора, кислорода, хлора, азота ), приводит к изменению электронной плотности между атомами углерода и указанных элементов и, тем самым, к увеличению полярности связи между ними. Степень окисления атомов в них определяется так же, как и в ковалентных полярных соединениях.
6, Металлы в элементарном состоянии имеют равномерное распределение электронной плотности вокруг ядра, поэтому степень окисления их принимается равной нулю.
7.В любом ионе алгебраическая сумма степеней окисления всех атомов равняется заряду иона, а сумма степеней окисления всех атомов, входящих в электронейтральное соединение, — нулю.
8.Для комплексных соединений обычно указывают степень окисления центрального атома. Например, в К3 ( Fe ( CN6)) и (Ni (Nh4)6 ) SO4 степень окисления железа равна +3, а никеля – (+2 ). Следует подчеркнуть, что понятие степени окисления является формальным и обычно не характеризует действительного состояния рассматриваемого атома в соединении. Во многих случаях степень окисления не равна валентности данного элемента. Например, в метане (СН4), метиловом спирте (СН3ОН), формальдегиде (СН2О), муравьиной кислоте (НСООН), и углекислом газе (СО2) степень окисления углерода равна соответственно:+4, -2, 0, +2, +4, в то время как валентность углерода во всех этих соединениях равна четырем. Понятие «степень окисления» особенно широко используется при изучении окислительно-восстановительных реакций.
ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Все окислительно-восстановительные реакции можно разделить на следующие типы:
1.Реакции межатомного и межмолекулярного окисления-восстановления -обмен электронами происходит между различными атомами, молекулами или ионами. Например, простейшие реакции соединения и замещения:
2Ca+O2 = 2CaO
2Hl+Br2 = 2HBr + I2
2Al + 3CuSO4 =Al2( SO4)3 +3Cu
2. Реакции диспропорционирования (самоокисления-самовосстановления ) харакктерны для соединений или простых веществ, отвечающих одному из промежуточных значений степени окисления данного элемента, например:
Cl2+2NaOH — NaCl +NaClOP + h3 — Ph4 + h4PO3
3. Реакции внутримолекулярного окисления-восстановления. В этих реакциях одна составная часть молекулы выполняет функцию окислителя, а другая восстановителя. Простейшими примерами таких реакций могут служить процессы термического разложения сложного вещества на более простые составные части, например:
2NO2 — NO2 + O2 4KСlO3 — KСlO4 + KCl
2KСlO3 — 3O2 + 2KCl 2AgNO3 — 2Ag + 2No2 + O2
МЕТОДИКА СОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления уравнений окислительно-восстановительных реакций следует знать окислительные и восстановительные свойства вступающих и образующихся в результате реакции соединений; они обычно усиливаются экспериментально или на основе известных свойств элементов.
Необходимо учитывать, что:
— в окислительно-восстановительных реакциях формально происходит только эквивалентный обмен электронов между восстановителем и окислителем, т.е. суммарно числа электронов, теряемых восстановителем и приобретаемых окислителем, равны;
— для любого химического уравнения общее количество одноимённых атомов в левой части равенства должно быть равно их количеству в правой части;
— если реакции окисления-восстановления проходят в растворе, то следует учитывать влияние среды на стягивание освобождающихся ионов О с ионами Н (в кислой среде) с образованием слабо диссоциирующих молекул
Н2О, а в нейтральных и щелочных растворах ионы О реагируют с образованием гидроксид-ионов НОН + О = 2ОН.
Применяются в основном два метода составления уравнений окислительно-восстановительных реакций:
1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю;
2) ионно-электронный – предусматривает раздельное составление уравнений для процесса окисления и восстановления с последующим суммированием их в общее ионное уравнение-метод полуреакции. В этом методе следует найти не только коэффициенты для восстановителя и окислителя, но и для молекул среды. В зависимости от характера среды число электронов, принимаемых окислителем или теряемых восстановителем, может изменяться.
В некоторых случаях среда обуславливает даже изменение направления процесса, например:
в щелочной среде ( рН >7 )
HIO3 +5HI = 3I2 + 3h3O в кислой среде (pH < 7)
В нейтральной и слабощелочной среде(рН > 7)
As2O3 + 2I2 + 2h3O = As2O5 + 4HIВ кислой среде (рН <7 ).
При рН < 1 пероксид водорода является окислителем по отношению к элементарному иоду:
5Н2О2 + I2 — 2HIO3 + 4h3O ;рН > 2, наоборот, HIO3 окисляет пероксид водорода :
5Н2О2 + 2НIO3 — I2 + 5O2 + 6h3O.Регулируя среду, можно заставить реакцию количественно протекать в желаемом направлении. Это изменение зависит также от концентрации реагирующих веществ.
Уравнения реакций окисления-восстановления изображаются тремя последовательными стадиями: 1) начальные продукты; 2) промежуточные продукты и их стяжение; 3) конечные продукты.
Для оформления второй стадии реакции следует знать правила стяжения:1. Образующиеся в реакции окисления-восстановления атомы с положительной степенью окисления +4, +5, +6, +7 стягиваются с ионами кислорода и образуют остатки типа ( RO4 ), ( RO3 ), например: SO4, MnO4, SO3, CO3, ClO4 и т.д. Исключение: С, S, Mn в нейтральной или кислой среде образуют диоксиды CO2, SO2, MnO2.
Дополнение: амфотерные элементы с положительной степенью окисления +2, +3, +4 в щелочной среде образуют гидроксокомплексы типа ( Ме(ОН)4 ), ( Ме(ОН)6), ( Ме(ОН)6 ).
Элементы с положительной степенью окисления –1, +2, +3 в кислой среде образуют соли.
2. Избыточные ионы кислорода ( О ) в кислой среде образуют ( стягивают ) с ионами Н малодиссоциированные молекулы воды:
О + 2Н = Н2О.
3. Избыточные ионы кислорода в нейтральной или щелочной среде стягиваются с молекулами воды, образуя ОН группы:
О + Н ОН = 2ОН .
4. Избыточные ионы водорода ( Н ) в щелочной среде стягиваются с ионами ОН, образуя молекулы воды :
Н + ОН = Н2О
5. Недостающие ионы кислорода ( О ) в кислой и нейтральной средах берутся из молекул воды с образованием ионов Н:
Н2О – О = 2Н .
6. Недостающие ионы кислорода ( О ) в щелочной среде берутся из групп ОН с образованием молекул Н2О :
2ОН — О = Н2О.
7. Недостающие ионы Н в щелочной среде берутся из молекул воды с образованием ионов гидроксила:
Н2О – Н = ОН
РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В КИСЛОЙ СРЕДЕ
Пример 1. Окисление сульфида свинца азотной кислотой.
Схема реакции: РbS +HNO3 — PbSO4 + NO2 +...
Составляем полуреакции :
PbS + 4h3O – 8 e — PbSO4 + 8H
NO3 + 2H + 1 e — NO2 +h3O
Суммируем полуреакции, уравнивая количество отданных и принятых электронов
1  PbS + 4h3O — PbSO4 + 8H
PbS + 4h3O — PbSO4 + 8H
8 NO 3 + 2H — NO 2 +H 2 O
PbS + 4h3O + 8NO3 + 16H — PbSO4 + 8H + 8NO2 +8h3O
Записываем в молекулярном виде, сокращая молекулы воды и стягивая ионы NO3 и H :
PbS + 8HNO3 + 8H — PbSO4 + 8H + 8NO2 + 4h3O
Конечный вид уравнения :
PbS + 8HNO3 == PbSO4 + 8NO2 + 4h3O
РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В НЕЙТРАЛЬНОЙ СРЕДЕ
Пример 1. Рассмотрим реакции окисления-восстановления, протекающие в нейтральной среде по схеме
Na2SO3 + KMnO4 + h3O — MnO2 + Na2SO4 + SO3 + h3O – 2e — SO4 + 2H MnO4 + 2h3O + 3e — MnO2 + 4OH 3SO3 + 3h3O + 2MnO4 + 4h3O — 3SO4 + 6H + 2MnO2 + 3OH . Ионы H и ОН стягиваются с образованием слабо диссоциированных молекул воды: 3Na2SO3 + h3O + 2KMnO4 — Na2SO4 + 6h3O + 2MnO2 + 2OH 3Na2SO3 + h3O + 2KMnO4 == Na2SO4 + 2MnO2 + KOH СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ОКИСЛЕНИЯ – ВОССТАНОВЛЕНИЯ С УЧАСТИЕМ СОЕДИНЕНИЙ ПЕРЕКИСНОГО ТИПА (h3O, BaO2, h3S2, FeS2 и т . д . )
Все эти соединения содержат двухвалентные ионы ( S –S ) и (О – О),
поэтому состояние окисления каждого из атомов кислорода и серы, образующих данные цепи, равно I. При разложении h3O2 переходит в более стабильное состояние: в h3O и О2, в которых соответственно равны степени окисления кислорода (-2 ) и 0.
В окислительно-восстановительных реакциях пероксид водорода в зависимости от партнёров и условий реакции может выступать и как окислитель, и как восстановитель.
Рассмотрим реакции этих соединений на примерах пероксида водорода:
Пример 1. Н2О2 — окислитель: а) в кислой среде молекула пероксида водорода, принимая
два электрона, переходит в две молекулы воды по схеме
h3O2 +2e + 2H — 2h3O; h3O2 +h3 S — h3SO4 + …
h3O2 + 2e + 2H — 2h3O2
HS + 4h3O – 8e — SO4 + 9H
4h3O2 + 8H + HS + 4h3O — 8h3O + SO4 + 9H 4h3O2 + h3S + 7H — 4h3O + h3SO4 + 7H 4h3O2 + h3S == 4h3O + h3SO4 б) в нейтральной среде Н2О2 + 2е — 2ОН
ОСОБЫЕ СЛУЧАИ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Если в реакции участвуют вещества, для которых сложно подсчитать степень окисления (например, В5Н11, FeAsS, органические вещества ) можно использовать метод схематического (формального) электронного баланса, суть которого заключается в том, что алгебраическая сумма зарядов в левой части уравнения реакции окисления или восстановления должна быть равна сумме зарядов в правой части этого же уравнения. Пример 1. Дана схема реакции В2Н6 + KclO3 — KCl + h4BO3 Определяем восстановитель и окислитель, составляем уравнение для процессов окисления и восстановления: В2Н6 – 12е + 6Н2О — 2Н3ВО3 + 12Н Восстановителем в этой реакции являются молекулы В2Н6, которые окисляются до борной кислоты : В2Н6 + 6Н2О — 2Н3ВО3 + 12Н Недостающие ионы кислорода для образования борной кислоты можно получить из молекул воды, при этом образуются ионы Н. Как нетрудно видеть, в левой части данной схемы процесса окисления имеется 0 зарядов, а в правой части – 12 положительных зарядов. Для уравнивания зарядов в обеих частях необходимо в левой части схемы отнять 12 электронов. Окислителем являются анионы ClO3, которые превращаются в ионы Cl, принимая 6 электронов :ClO3 + 6e + 3h3O — Cl + 6OH . При этом освобождающиеся ионы кислорода соединяются с молекулами воды ( реакция происходит в водной среде ), образуя ионы ОН. Затем производим балансирование уравнений процессов окисления и восстановления: 1 В2Н6 – 12е + 6Н2О — 2Н3ВО3 + 12Н 2 ClO3 + 6e + 3h3O — Cl + 6OH B2H6 + 6h3O + 2ClO3 + 6h3O — 2h4BO3 + 12H + 12OH + 2Cl B2H6 + 2KClO3 == 2h4BO3 + 2KCl 12h3O
Пользование таблицей окислительно-восстановительных потенциалов
Цифры таблицы получены при температуре 25 С. С изменением температуры они мало изменяются, поэтому ими можно пользоваться для определения направления реакции в обычных условиях. Цифры таблицы действительны для случаев, когда концентрация ( или, точнее активность ) растворов в гальванической цепи равна единице ( т. е. 1 моль/л ).
Необходимо иметь в виду следующее : 1. Увеличение концентрации ионов, в которые переходит окисляющийся атом или ион, понижает э. д. с. реакции, а уменьшение – повышает. 2. Увеличение концентрации окисляющихся атомов или ионов повышает э. д. с. реакции, а уменьшение понижает. 3. Правила пользования таблицами для определения направления окисления – восстановления. В таблицах реакций представлены величины нормальных потенциалов окисления ( Еокисл ) и восстановления ( Евосст ) важнейших процессов. Таблицы соответственно разделены на две группы: “ Окисление “ и “ Восстановление “ . Знак “ + “ у Еокисл (или Евосст ) и у соответствующего lgKокисл (или lgKвосст) показывает, что процесс идёт преимущественно слева направо, а знак “ – “ у этих же величин – справа налево.
Для определения направления той или иной реакции окисления-восстановления берут данные разделов “ Окисление “ и “ Восстановление “, распологая в одну строку уравнение рассматриваемого процесса окисления с уравнением заданного процесса восстановления. При этом получают несбалансированное общее ионное уравнение возможной окислительно-восстановительной реакции.
Алгебраическая сумма Еокисл + Евосст рассматриваемых процессов может быть величиной положительной, и тогда данная реакция ( при условии аокисл = авосст = 1 и определённом значении рН ) идёт, а если эта величина окажется отрицательной, то реаакция ( при тех же условиях ) невозможна.
Пример. Пойдёт ли реакция между I — ионами и Fe ионами с образованием свободного йода ?

 Решение. На таблице “Окисление “ ( в группе реакций “Йод“ ) находят уравнение 2I – 2e I2, по таблице “Восстановление “ ( в группе реакций “Железо” ) находят уравнение Fe + e Fe и записывают их в одну строчку, складывая величины Еокисл + Евосст;
Решение. На таблице “Окисление “ ( в группе реакций “Йод“ ) находят уравнение 2I – 2e I2, по таблице “Восстановление “ ( в группе реакций “Железо” ) находят уравнение Fe + e Fe и записывают их в одну строчку, складывая величины Еокисл + Евосст;

 :lgKокисл: Еокисл: Евосст :lgKвосст:
:lgKокисл: Еокисл: Евосст :lgKвосст:
 2I — 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
2I — 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
Алгебраическая сумма ( — 0,5345 ) + ( +0,771 ) = + 0,2365 –величина положительная: следовательно, реакция 2 I + 2 Fe — I2 + 2Fe будет протекать при определённых условиях.
С помощью указанных в этих же монограммах логарифмов констант равновесия можно также вычислить константы равновесия разнообразных реакций окисления-восстановления.
Анализируя таблицу определения направления реакции окисления-восстановления, можно сделать следующие выводы :
1. Ионы “ благородных “ металлов – сильные окислители. Например: Cr + Ag----- Cr + Ag э. д. с. = + 0,7995- — 0,4 = 1,209 в. Fe + Au---- Fe + Au э. д. с. = + 1,68- + 0,77 = 0,91 в.
2. Наиболее сильные восстановители – атомы щелочных и щелочно –земельных металлов. Наиболее слабые восстановители – “благородные” металлы и ионы галогенов ( за исключением иона йода ).
3. Наиболее сильные окислители – нейтральные атомы галогенов, высокоположительные ионы металлов, а также ионы “благородных” металлов. Наиболее слабые окислители – ионы щелочных и щелочноземельных металлов.

www.ronl.ru
Реферат - Сущность окислительно-восстановительных реакций
--PAGE_BREAK--СТЕПЕНЬ ОКИСЛЕНИЯ Под степенью окисления атома в молекуле понимается условный электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому.При этом условии предполагается, что электроны каждой связи в моле-
куле ( или ионе ) принадлежат более электроотрицательному атому.
Степень окисления атома обозначается числом со знаком ( + ) или ( — ). Значение положительной степени окисления элемента соответствует числу оттянутых от атома электронов +, а величина отрицательной степени окисления – числу притянутых атомом электронов — .
Для определения степени окисления атомов в свободном состоянии и в химических соединениях следует руководствоваться данными ОЭО ( табл. 1 ) и следующим:
1. Атомы кислорода в соединениях могут проявлять как целые, так и дробные степени окисления. Например, степень окисления кислорода в основном равна (-2), в h3O2 ( -1 ), в KO2 и КО3– соответственно (-1/2 и –1/3 ), а во фторокислороде ОF2— (+2 ). Для водорода характерна степень окисления +1, но встречается и –1 ( в гидридах металлов 2. Степень окисления атомов в простых ионных соединениях по знаку м величине равна электрическому заряду иона. Например, в хлориде калия степень окисления калия равна +1, а хлора – (-1).
3.Если молекула образована за счёт ковалентной или ионно-ковалентной связи (например, SO2,Nh4, HCl,HNO3) степень окисления более электроотрицательного атома обозначается со знаком -, а менее электроотрицательного атома – со знаком +. Для понимания определения степени окисления элементов ряда соединений целесообразно писать их графические формулы. Так, в соединениях азота Nh4,N2h5, Nh3OH, HNO2, HNO3степени окисления азота соответственно равны:-3, -2, -1, +3, +5. Это наглядно видно из их графических формул. В случае наличия химической связи между одинаковыми атомами (N3h5)электронную пару надо поделить между атомами, которые она связывает. Далее необходимо подсчитать число электронов у каждого из них. Разность между числом электронов у свободного атома на внешнем уровне и найденным числом даст степень окисления атома.
4.В отличие от рассмотренных выше молекул в молекулах, состоящих из одинаковых атомов (h3, Cl2, Br2, N2и др. ), степень окисления атомов равна нулю, так как здесь не имеет места одностороннее оттягивание общих пар электронов к какому-либо одному атому. Например, в молекулах водорода ( Н: Н ) и хлора ( :Cl: Cl: ) степень окисления равна нулю, но ковалентность их соответствует единице по количеству электронных пар.
5.В большинстве органических соединений химические связи имеют слабо вы-раженный полярный характер: присоединение к атомам углерода, составляющим скелет органических соединений ( например, фтора, кислорода, хлора, азота ), приводит к изменению электронной плотности между атомами углерода и указанных элементов и, тем самым, к увеличению полярности связи между ними. Степень окисления атомов в них определяется так же, как и в ковалентных полярных соединениях.
6, Металлы в элементарном состоянии имеют равномерное распределение электронной плотности вокруг ядра, поэтому степень окисления их принимается равной нулю.
7.В любом ионе алгебраическая сумма степеней окисления всех атомов равняется заряду иона, а сумма степеней окисления всех атомов, входящих в электронейтральное соединение, — нулю.
8.Для комплексных соединений обычно указывают степень окисления центрального атома. Например, в К3( Fe ( CN6)) и (Ni (Nh4)6 ) SO4 степень окисления железа равна +3, а никеля – (+2 ). Следует подчеркнуть, что понятие степени окисления является формальным и обычно не характеризует действительного состояния рассматриваемого атома в соединении. Во многих случаях степень окисления не равна валентности данного элемента. Например, в метане (СН4), метиловом спирте (СН3ОН), формальдегиде (СН2О), муравьиной кислоте (НСООН), и углекислом газе (СО2) степень окисления углерода равна соответственно:+4, -2, 0, +2, +4, в то время как валентность углерода во всех этих соединениях равна четырем. Понятие «степень окисления» особенно широко используется при изучении окислительно-восстановительных реакций.
продолжение --PAGE_BREAK--ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Все окислительно-восстановительные реакции можно разделить на следующие типы:
1.Реакции межатомного и межмолекулярного окисления-восстановления -обмен электронами происходит между различными атомами, молекулами или ионами. Например, простейшие реакции соединения и замещения: 2Ca+O2 = 2CaO 2Hl+Br2= 2HBr + I2 2Al + 3CuSO4=Al2( SO4)3+3Cu 2. Реакции диспропорционирования (самоокисления-самовосстановления ) харакктерны для соединений или простых веществ, отвечающих одному из промежуточных значений степени окисления данного элемента, например: Cl2+2NaOH ----- NaCl +NaClO P + h3 ----- Ph4 + h4PO3
3. Реакции внутримолекулярного окисления-восстановления. В этих реакциях одна составная часть молекулы выполняет функцию окислителя, а другая восстановителя. Простейшими примерами таких реакций могут служить процессы термического разложения сложного вещества на более простые составные части, например:
2NO2— NO2 + O2 4KСlO3— KСlO4+ KCl
2KСlO3— 3O2+ 2KCl 2AgNO3— 2Ag + 2No2+ O2МЕТОДИКА СОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления уравнений окислительно-восстановительных реакций следует знать окислительные и восстановительные свойства вступающих и образующихся в результате реакции соединений; они обычно усиливаются экспериментально или на основе известных свойств элементов.
Необходимо учитывать, что:
- в окислительно-восстановительных реакциях формально происходит только эквивалентный обмен электронов между восстановителем и окислителем, т.е. суммарно числа электронов, теряемых восстановителем и приобретаемых окислителем, равны;
- для любого химического уравнения общее количество одноимённых атомов в левой части равенства должно быть равно их количеству в правой части;
- если реакции окисления-восстановления проходят в растворе, то следует учитывать влияние среды на стягивание освобождающихся ионов О с ионами Н (в кислой среде) с образованием слабо диссоциирующих молекул
Н2О, а в нейтральных и щелочных растворах ионы О реагируют с образованием гидроксид-ионов НОН + О = 2ОН.
Применяются в основном два метода составления уравнений окислительно-восстановительных реакций:
1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю;
2) ионно-электронный – предусматривает раздельное составление уравнений для процесса окисления и восстановления с последующим суммированием их в общее ионное уравнение-метод полуреакции. В этом методе следует найти не только коэффициенты для восстановителя и окислителя, но и для молекул среды. В зависимости от характера среды число электронов, принимаемых окислителем или теряемых восстановителем, может изменяться.
В некоторых случаях среда обуславливает даже изменение направления процесса, например:
в щелочной среде ( рН >7 )
HIO3 +5HI = 3I2 + 3h3O в кислой среде (pH < 7) В нейтральной и слабощелочной среде(рН > 7) As2O3 + 2I2 + 2h3O = As2O5 + 4HI В кислой среде (рН <7 ). При рН < 1 пероксид водорода является окислителем по отношению к элементарному иоду: 5Н2О2+ I2— 2HIO3+ 4h3O; рН > 2, наоборот, HIO3 окисляет пероксид водорода : 5Н2О2+ 2НIO3— I2+ 5O2+ 6h3O. Регулируя среду, можно заставить реакцию количественно протекать в желаемом направлении. Это изменение зависит также от концентрации реагирующих веществ.
Уравнения реакций окисления-восстановления изображаются тремя последовательными стадиями: 1) начальные продукты; 2) промежуточные продукты и их стяжение; 3) конечные продукты. продолжение --PAGE_BREAK--
www.ronl.ru
Реферат - Сущность окислительно-восстановительных реакций
Окислительно-восстановительные процессы принадлежат кчислу наиболее распространенных химических реакций и имеют огромное значение втеории и практике. Окисление-восстановление—один из важнейших процессов природы.
Дыхание, усвоение углекислого газа растениями с выделениемкислорода, обмен веществ и ряд других химических процессов в основе своейявляются окислительно-восстановительными реакциями. Сжигание топлива в топкахпаровых котлов и двигателях внутреннего сгорания, электролитическое осаждениеметаллов, процессы, происходящие в гальванических элементах и аккумуляторах,включают реакции окисления-восстановления.
Получение элементарных веществ (железа, хрома, марганца,золота, серебра, серы, хлора, йода и т.д.) и ценных химических продуктов(аммиака, щёлочей, азотной, серной и других кислот) основана наокислительно-восстановительных реакциях.
На окислении-восстановлении в аналитической химии основаныметоды объёмного анализа: перманганатометрия, йодометрия, броматометрия, идругие, играющие важную роль при контролировании производственных процессов ивыполнении научных исследований. В органической химии для проведения рядахимических превращений самое широкое распространение нашли процессыокисления-восстановления.
Инертные газы лишь в исключительных случаях способнывступать в окислительно-восстановительные реакции.
ЭНЕРГИЯИОНИЗАЦИИ И СРОДСТВО К ЭЛЕКТРОНУ. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Химическая природа элемента оценивается способностью егоатома терять и приобретать электроны. Последняя может быть количественнооценена энергией ионизации и его сродством к электрону.
Мерой энергии ионизации атома служит его ионизеционныйпотенциал, представляющий собой наименьшее напряжение в вольтах,
Которое необходимо приложить для того, чтобы оторватьэлектрон от невозбужденного атома и удалить его на бесконечно далекоерасстояние.
/>/>В периодах, как правило,энергия ионизации увеличивается слева направо. При этом восстановительныесвойства элементов уменьшаются, а окислительные—возрастают.
Энергия сродства к электрону (СЭ) характеризует количествоэнергии, которая выделяется (или поглощается) в результате присоединенияэлектрона к нейтральному атому с превращением его в отрицательный ион. Величиныэнергии сродства к электрону в периодах возрастают слева направо, в подгруппах,как правило, уменьшаются сверху вниз.
Энергию ионизации ( I ) и энергиюсродства к электрону ( Е ) можно отнести как к единичному атому, так и к 6,02*1023 атомов.
Для атомов свободных элементов окислительная ивосстановительная активность выражается величинами энергии ионизации и сродстваатома к электрону.
Для того, чтобы решить вопрос, атом данного элемента легчетеряет или присоединяет электрон, была введена характеристика, названная электроотрицательностью.Мерой электроотрицательности может служить арифметическая сумма значенийионизации I и сродства к электрону Е:
ЭО = 1+Е.Электроотрицательность элемента имеет размерностьслагаемых, из которых она образовалась, и может быть, следовательно, выражена втех же единицах.
Для более удобного пользования значениямиэлектроотрицательности элементов принята система их относительных величин, вкоторой электроотрицательность лития условно принята за единицу.
В табл.1 приведены значения относительнойэлектроотрицательности (ОЭО) различных элементов по Полингу. Как и следовалоожидать, наибольшее значение электроотрицательности имеет фтор,наименьшее-цезий. Водород занимает промежуточное положение, т. е. Привзаимодействии с одними элементами (например, с F ) онотдаёт электрон, а с другими (например, с Rb ) – приобретает. Чем больше различие в электроотрицательности двух элементов, тембольше химическая связь между их атомами по своему характеру отличается отковалентной связи и приближается к ионной. Так, разница в величинахотносительной электроотрицательности у элементов натрия и фтора равна: ОЭО = 4– 0,9 = 3,1, поэтому в NaF связь ионная; в молекуле Cl2
( ^ ОЭО = 0 ) связь ковалентная, неполярная; в молекулах HF ( ^ ОЭО = 1,9 ) и HCl ( ^ ОЭО = 0,6 ) связи полярны, причем у молекулы HF дипольбольше, чем у молекулы HCl. Таблица1
Электроотрицательность (ОЭО) атомов некоторых элементовпериодической системы.
Период
I гр
ЭО
II гр
ЭО
III гр
ЭО
IV
гр
ЭО
V
гр
ЭО
VI
гр
ЭО
VII
гр
ЭО
I
H
2,2
II
Li
0,95
Be
1,5
B
2,0
C
2,6
N
3,0
O
3,5
F
3,9
III
Na
0,90
Mg
1,2
Al
1,5
Si
1,9
P
2,1
S
2,6
Cl
3,1
IV
K
0,80
Ca
1,0
Ga
1,6
Ge
2,0
As
2,0
Se
2,4
Br
2,9
V
Rb
0,8
Sr
1,0
In
1,7
Sn
1,7
Sb
1,8
Te
2,1
I
2,6
VI
Cs
0,75
Ba
0,9
Tl
1,4
Pb
1,6
Bi
1,8
Po
2,0
At
2,2
Пользуясь электроотрицательностью как величиной,характеризующей способность атома к притяжению валентных электронов, необходимопомнить, что элементу нельзя приписать постоянную электроотрицательность. Оназависит от того, в составе какого конкретного соединения рассматривается атом,в окружении атомов каких элементов он находится. Так, свободный атом хлора в молекулахCl2, NaCl, CCl4 обладает неодинаковыми свойствами. Следовательно, надо иметь в виду неэлектроотрицательность вообще, а электроотрицательность элемента, образующегоконкретные химические связи в конкретном окружении, в конкретном валентномсостоянии. Однако, несмотря на это, понятие электроотрицательности являетсяполезным для объяснения многих свойств химических связей.
Чем больше величина электроотрицательности элемента, темсильнее его окислительные (неметаллические ) свойства, и наоборот, элемент,имеющий наименьшее значение электроотрицательности, наиболее активно проявляетвосстановительные свойства.
СТЕПЕНЬ ОКИСЛЕНИЯПод степенью окисления атома в молекуле понимаетсяусловный электрический заряд данного атома, вызванный смещением валентных электроновк более электроотрицательному атому.
Приэтом условии предполагается, что электроны каждой связи в моле-
куле (или ионе ) принадлежат более электроотрицательному атому.
Степень окисления атома обозначается числом со знаком ( +) или ( — ). Значение положительной степени окисления элемента соответствуетчислу оттянутых от атома электронов +, а величина отрицательной степениокисления – числу притянутых атомом электронов — .
Для определения степени окисления атомов в свободномсостоянии и в химических соединениях следует руководствоваться данными ОЭО (табл. 1 ) и следующим:
1. Атомы кислорода в соединениях могут проявлять как целые, так и дробныестепени окисления. Например, степень окисления кислорода в основном равна (-2), в h3O2 ( -1 ), в KO2 и КО3 – соответственно (-1/2 и –1/3 ), а вофторокислороде ОF2-(+2 ). Для водорода характерна степень окисления +1, но встречается и –1 ( вгидридах металлов 2. Степень окисления атомов в простых ионных соединениях познаку м величине равна электрическому заряду иона. Например, в хлориде калиястепень окисления калия равна +1, а хлора – (-1).
3.Если молекулаобразована за счёт ковалентной или ионно-ковалентной связи (например, SO2,Nh4, HCl,HNO3) степень окисления более электроотрицательногоатома обозначается со знаком -, а менее электроотрицательного атома – со знаком+. Для понимания определения степени окисления элементов ряда соединенийцелесообразно писать их графические формулы. Так, в соединениях азота Nh4, N2h5, Nh3OH, HNO2, HNO3 степени окисления азота соответственноравны:-3, -2, -1, +3, +5. Это наглядно видно из их графическихформул. В случае наличия химической связимежду одинаковыми атомами (N3h5)электроннуюпару надо поделить между атомами, которые она связывает. Далее необходимоподсчитать число электронов у каждого из них. Разность между числом электронову свободного атома на внешнем уровне и найденным числом даст степень окисленияатома.
4.В отличие отрассмотренных выше молекул в молекулах, состоящих из одинаковых атомов (h3, Cl2, Br2, N2 и др. ), степень окисления атомов равна нулю,так как здесь не имеет места одностороннее оттягивание общих пар электронов ккакому-либо одному атому. Например, в молекулах водорода ( Н: Н ) и хлора ( :Cl: Cl: ) степень окисления равнанулю, но ковалентность их соответствует единице по количеству электронных пар.
5.В большинствеорганических соединений химические связи имеют слабо вы-раженный полярныйхарактер: присоединение к атомам углерода, составляющим скелет органическихсоединений ( например, фтора, кислорода, хлора, азота ), приводит к изменениюэлектронной плотности между атомами углерода и указанных элементов и, темсамым, к увеличению полярности связи между ними. Степень окисления атомов в нихопределяется так же, как и в ковалентных полярных соединениях.
6, Металлы вэлементарном состоянии имеют равномерное распределение электронной плотностивокруг ядра, поэтому степень окисления их принимается равной нулю.
7.В любом ионеалгебраическая сумма степеней окисления всех атомов равняется заряду иона, асумма степеней окисления всех атомов, входящих в электронейтральное соединение,- нулю.
8.Для комплексныхсоединений обычно указывают степень окисления центрального атома. Например, в К3 ( Fe ( CN6)) и (Ni (Nh4)6 ) SO4 степень окисления железа равна +3, а никеля –(+2 ). Следуетподчеркнуть, что понятие степени окисления является формальным и обычно нехарактеризует действительного состояния рассматриваемого атома в соединении. Вомногих случаях степень окисления не равна валентности данного элемента.Например, в метане (СН4), метиловом спирте(СН3ОН), формальдегиде (СН2О), муравьиной кислоте (НСООН), и углекисломгазе (СО2) степень окисления углеродаравна соответственно:+4, -2, 0, +2, +4, в то время как валентность углерода вовсех этих соединениях равна четырем. Понятие «степень окисления» особенношироко используется при изучении окислительно-восстановительныхреакций.
ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙВсеокислительно-восстановительные реакции можно разделить на следующие типы:
1.Реакции межатомного имежмолекулярного окисления-восстановления -обмен электронами происходит междуразличными атомами, молекулами или ионами. Например, простейшие реакциисоединения и замещения:
2Ca+O2 = 2CaO 2Hl+Br2 = 2HBr + I2 2Al + 3CuSO4 =Al2( SO4)3 +3Cu2. Реакции диспропорционирования (самоокисления-самовосстановления )харакктерны для соединений или простых веществ, отвечающих одному изпромежуточных значений степени окисления данного элемента, например:
Cl2+2NaOH ----- NaCl +NaClOP + h3 ----- Ph4 + h4PO3
3. Реакции внутримолекулярного окисления-восстановления. В этих реакцияходна составная часть молекулы выполняет функцию окислителя, а другаявосстановителя. Простейшими примерами таких реакций могут служить процессытермического разложения сложного вещества на более простые составные части,например:
2NO2----- NO2 + O2 4KСlO3 — KСlO4 + KCl
2KСlO3 — 3O2 + 2KCl 2AgNO3 — 2Ag + 2No2 + O2
МЕТОДИКАСОСТАВЛЕНИЯ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Для составления уравненийокислительно-восстановительных реакций следует знать окислительные ивосстановительные свойства вступающих и образующихся в результате реакциисоединений; они обычно усиливаются экспериментально или на основе известныхсвойств элементов.
Необходимо учитывать, что:
- в окислительно-восстановительных реакциях формально происходит толькоэквивалентный обмен электронов между восстановителем и окислителем, т.е.суммарно числа электронов, теряемых восстановителем и приобретаемыхокислителем, равны;
- для любого химического уравнения общее количество одноимённых атомов влевой части равенства должно быть равно их количеству в правой части;
- если реакции окисления-восстановления проходят в растворе, то следуетучитывать влияние среды на стягивание освобождающихся ионов О с ионами Н (вкислой среде) с образованием слабо диссоциирующих молекул
Н2О,а в нейтральных и щелочных растворах ионы О реагируют с образованиемгидроксид-ионов НОН + О = 2ОН.
Применяются в основном дваметода составления уравнений окислительно-восстановительных реакций:
1) электронного баланса – основан на определении общего количестваэлектронов, перемещающихся от восстановителя к окислителю;
2) ионно-электронный – предусматривает раздельное составление уравненийдля процесса окисления и восстановления с последующим суммированием их в общееионное уравнение-метод полуреакции. В этом методе следует найти не толькокоэффициенты для восстановителя и окислителя, но и для молекул среды. Взависимости от характера среды число электронов, принимаемых окислителем илитеряемых восстановителем, может изменяться.
В некоторых случаях средаобуславливает даже изменение направления процесса, например:
в щелочной среде ( рН >7 )
HIO3 +5HI = 3I2 + 3h3O в кислой среде (pH < 7)
Внейтральной и слабощелочной среде(рН > 7)As2O3 + 2I2 + 2h3O = As2O5 + 4HIВкислой среде (рНПри рН < 1 пероксидводорода является окислителем по отношению к элементарному иоду:
5Н2О2 + I2 — 2HIO3 + 4h3O;рН > 2, наоборот, HIO3 окисляет пероксидводорода :
5Н2О2 + 2НIO3 — I2 + 5O2 + 6h3O.Регулируя среду, можнозаставить реакцию количественно протекать в желаемом направлении. Это изменениезависит также от концентрации реагирующих веществ.
Уравнения реакцийокисления-восстановления изображаются тремя последовательными стадиями: 1)начальные продукты; 2) промежуточные продукты и их стяжение; 3) конечныепродукты.
Для оформлениявторой стадии реакции следует знать правила стяжения:1. Образующиеся в реакцииокисления-восстановления атомы с положительной степенью окисления +4, +5, +6, +7 стягиваются с ионами кислорода и образуют остатки типа ( RO4 ) , ( RO3 ) , например: SO4, MnO4, SO3, CO3, ClO4 и т.д. Исключение: С , S , Mn в нейтральной или кислой среде образуют диоксиды CO2, SO2, MnO2.
Дополнение: амфотерныеэлементы с положительной степенью окисления +2, +3, +4 в щелочной средеобразуют гидроксокомплексы типа ( Ме(ОН)4 ), ( Ме(ОН)6), ( Ме(ОН)6 ).
Элементы с положительнойстепенью окисления –1, +2, +3 в кислой среде образуют соли.
2. Избыточные ионы кислорода (О ) в кислой среде образуют ( стягивают ) с ионами Н малодиссоциированныемолекулы воды:
О + 2Н = Н2О.
3. Избыточные ионы кислорода в нейтральной или щелочнойсреде стягиваются с молекулами воды, образуя ОН группы:
О + Н ОН = 2ОН .
4.Избыточные ионы водорода ( Н ) в щелочной среде стягиваются с ионами ОН,образуя молекулы воды :
Н + ОН = Н2О
5.Недостающие ионы кислорода ( О ) в кислой и нейтральной средах берутся измолекул воды с образованием ионов Н :
Н2О – О = 2Н .
6.Недостающие ионы кислорода ( О ) в щелочной среде берутся из групп ОН собразованием молекул Н2О :
2ОН — О = Н2О.
7. Недостающие ионыН в щелочной среде берутся из молекул воды с образованием ионов гидроксила:
Н2О – Н = ОН
РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В КИСЛОЙ СРЕДЕПример1. Окисление сульфида свинца азотной кислотой.Схема реакции: РbS +HNO3---- PbSO4 + NO2 +…
Составляем полуреакции :
PbS + 4h3O – 8 e — PbSO4 + 8H
NO3 + 2H + 1 e — NO2 +h3O
Суммируемполуреакции, уравнивая количество отданных и принятых электронов1 />PbS + 4h3O — PbSO4 + 8H
8 NO3+ 2H — NO2+h3O
PbS + 4h3O + 8NO3 + 16H — PbSO4 + 8H + 8NO2 +8h3O
Записываем в молекулярном виде,сокращая молекулы воды и стягивая ионы NO3 и H :
PbS + 8HNO3 +8H — PbSO4 + 8H + 8NO2 + 4h3O
Конечныйвид уравнения :
PbS + 8HNO3 ==PbSO4 + 8NO2 + 4h3O
РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ В НЕЙТРАЛЬНОЙСРЕДЕПример 1. Рассмотрим реакцииокисления-восстановления, протекающие в нейтральной среде по схеме
Na2SO3 + KMnO4 + h3O — MnO2 + Na2SO4 + SO3 +h3O –2e — SO4 + 2H MnO4 + 2h3O+ 3e — MnO2 + 4OH 3SO3 + 3h3O+ 2MnO4+ 4h3O----- 3SO4 + 6H + 2MnO2 + 3OH . Ионы H и ОН стягиваются с образованием слабодиссоциированных молекул воды: 3Na2SO3 + h3O + 2KMnO4 — Na2SO4 + 6h3O + 2MnO2 + 2OH 3Na2SO3 + h3O + 2KMnO4 == Na2SO4 + 2MnO2 + KOH СОСТАВЛЕНИЕУРАВНЕНИЙРЕАКЦИЙОКИСЛЕНИЯ– ВОССТАНОВЛЕНИЯСУЧАСТИЕМСОЕДИНЕНИЙПЕРЕКИСНОГОТИПА(h3O, BaO2, h3S2, FeS2 ит.д. )
Все эти соединения содержат двухвалентные ионы ( S –S ) и (О – О),
поэтому состояние окисления каждого из атомов кислорода исеры, образующих данные цепи, равно I. При разложении h3O2 переходит в более стабильное состояние: в h3Oи О2, в которых соответственно равныстепени окисления кислорода (-2 ) и 0.
В окислительно-восстановительныхреакциях пероксид водорода в зависимости от партнёров и условий реакции можетвыступать и как окислитель, и как восстановитель.
Рассмотрим реакции этихсоединений на примерах пероксида водорода:
Пример 1. Н2О2 — окислитель: а) в кислой среде молекула пероксида водорода, принимая
два электрона, переходит в двемолекулы воды по схеме
h3O2 +2e + 2H — 2h3O; h3O2 +h3 S — h3SO4 + …
h3O2 + 2e + 2H — 2h3O2HS +4h3O – 8e — SO4 + 9H4h3O2 + 8H + HS + 4h3O — 8h3O + SO4 + 9H 4h3O2 + h3S + 7H — 4h3O + h3SO4 + 7H 4h3O2 + h3S == 4h3O + h3SO4 б) в нейтральной среде Н2О2 + 2е — 2ОН
ОСОБЫЕ СЛУЧАИ СОСТАВЛЕНИЯУРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Если в реакции участвуютвещества, для которых сложно подсчитать степень окисления (например, В5Н11, FeAsS, органические вещества ) можно использовать методсхематического (формального) электронного баланса, суть которого заключается втом, что алгебраическая сумма зарядов в левой части уравнения реакции окисленияили восстановления должна быть равна сумме зарядов в правой части этого жеуравнения. Пример 1. Дана схема реакции В2Н6 + KclO3 — KCl + h4BO3 Определяем восстановитель и окислитель, составляем уравнение для процессовокисления и восстановления: В2Н6 – 12е + 6Н2О----- 2Н3ВО3+ 12Н Восстановителем в этой реакции являются молекулы В2Н6, которые окисляются до борной кислоты : В2Н6 + 6Н2О----- 2Н3ВО3+ 12Н Недостающие ионы кислорода для образования борной кислоты можно получить измолекул воды, при этом образуются ионы Н. Как нетрудно видеть, в левой частиданной схемы процесса окисления имеется 0 зарядов, а в правой части – 12положительных зарядов. Для уравнивания зарядов в обеих частях необходимо влевой части схемы отнять 12 электронов. Окислителем являются анионы ClO3, которые превращаются в ионы Cl,принимая 6 электронов :ClO3+ 6e + 3h3O — Cl + 6OH . При этом освобождающиеся ионы кислорода соединяются с молекулами воды ( реакцияпроисходит в водной среде ), образуя ионы ОН. Затем производим балансированиеуравнений процессов окисления и восстановления: 1 В2Н6– 12е + 6Н2О — 2Н3ВО3 + 12Н 2 ClO3 + 6e + 3h3O — Cl + 6OH B2H6 + 6h3O + 2ClO3 + 6h3O — 2h4BO3 + 12H + 12OH + 2Cl B2H6 + 2KClO3 == 2h4BO3 + 2KCl 12h3O
Пользованиетаблицей окислительно-восстановительных потенциаловЦифры таблицы получены притемпературе 25 С. С изменением температуры они мало изменяются, поэтому имиможно пользоваться для определения направления реакции в обычных условиях.Цифры таблицы действительны для случаев, когда концентрация ( или, точнееактивность ) растворов в гальванической цепи равна единице ( т. е. 1 моль/л ).
Необходимоиметь в виду следующее : 1. Увеличение концентрации ионов, в которые переходит окисляющийся атом илиион, понижает э. д. с. реакции, а уменьшение – повышает. 2. Увеличение концентрации окисляющихся атомов или ионов повышает э. д. с.реакции, а уменьшение понижает. 3. Правила пользования таблицами для определения направления окисления –восстановления. В таблицах реакций представлены величины нормальных потенциалов окисления (Еокисл) и восстановления ( Евосст ) важнейших процессов. Таблицы соответственноразделены на две группы : “ Окисление “ и “ Восстановление “ . Знак “ + “ у Еокисл (или Евосст ) и у соответствующего lgKокисл (или lgKвосст)показывает, что процесс идёт преимущественно слева направо, а знак “ – “ у этихже величин – справа налево.
Для определения направления той или иной реакции окисления-восстановления берутданные разделов “ Окисление “ и “ Восстановление “, распологая в одну строкууравнение рассматриваемого процесса окисления с уравнением заданного процессавосстановления. При этом получают несбалансированное общее ионное уравнениевозможной окислительно-восстановительной реакции.
Алгебраическая сумма Еокисл + Евосст рассматриваемых процессов может быть величинойположительной, и тогда данная реакция ( при условии аокисл = авосст = 1 иопределённом значении рН ) идёт, а если эта величина окажется отрицательной, тореаакция ( при тех же условиях ) невозможна.
Пример. Пойдёт ли реакция между I — ионами и Fe ионами собразованием свободного йода ?
/>/> Решение. На таблице “Окисление “ ( в группе реакций “Йод“ ) находятуравнение 2I – 2e I2, по таблице“Восстановление “ ( в группе реакций “Железо” ) находятуравнение Fe + e Fe и записывают их в одну строчку, складывая величиныЕокисл+ Евосст;
/>
/> :lgKокисл : Еокисл : Евосст :lgKвосст:
/>2I — 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
Алгебраическаясумма ( — 0,5345 ) + ( +0,771 ) = + 0,2365 –величина положительная:следовательно, реакция 2 I + 2 Fe ----- I2 + 2Feбудет протекать при определённых условиях.
С помощью указанных в этих же монограммах логарифмов констант равновесия можнотакже вычислить константы равновесия разнообразных реакцийокисления-восстановления.
Анализируя таблицу определения направления реакции окисления-восстановления,можно сделать следующие выводы :
1.Ионы “ благородных “ металлов – сильные окислители. Например : Cr + Ag----- Cr + Ag э. д. с. = + 0,7995- — 0,4 = 1,209 в. Fe +Au---- Fe + Au э. д. с. = + 1,68- + 0,77 = 0,91 в.
2.Наиболее сильные восстановители – атомы щелочных и щелочно –земельных металлов.Наиболее слабые восстановители – “благородные” металлы и ионы галогенов ( заисключением иона йода ).
3.Наиболее сильные окислители – нейтральные атомы галогенов, высокоположительныеионы металлов, а также ионы “благородных” металлов. Наиболее слабые окислители– ионы щелочных и щелочноземельных металлов.
/>
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


