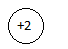 1s2
1s2Муниципальное общеобразовательное учреждение гимназия №1.
Реферат.
Инертные газы
Выполнил ученик 10А класса
Иванов Ярослав Александрович
Научный руководитель
Шашенкова Юлия Анатольевна
г. Липецк
2010г.
Оглавление.
Введение
Инертные газы, история открытия, свойства, получение, применение.
История открытия инертных газов, строение атомов и молекул
Физические и химические свойства, физиологическое воздействие на организм человека
история получения инертных газов
соединения инертных газов
применение инертных газов и их соединений
Заключение
Список литературы
Приложения
Введение
Эта тема заинтересовала меня, потому что я всегда хотел узнать, что такое инертные газы, почему они называются «благородные», почему они отличаются от других элементов крайне низкой химической активностью. В своей работе я рассматриваю их физические и химические свойства, воздействие на организм человека. В своей работе я рассматриваю именно эти вопросы.
История открытия инертных газов. Строение атомов и молекул.
Главную подгруппу восьмой группы периодической системы составляют благородные газы - гелий, неон, аргон, криптон, ксенон и радон. Элементы характеризуются очень низкой химической активность, что и дало основание назвать их благородными, или инертными газами. Они лишь с трудом образуют соединения с другими элементами или веществами; химические соединения гелия, неона и аргона не получены. Атомы благородных газов не соединены в молекулы, иначе говоря, их молекулы одноатомны.
26 октября 1868 г. на заседании Парижской академии наук были прочитаны одно за другим два письма. Одно было прислано из Индии, от французского астронома Жансена, другое - из Англии, от английского астронома Локьера, Оба сообщали, что в спектре солнечных протуберанцев они (независимо друг от друга) обнаружили новую желтую линию, которая не может принадлежать ни одному химическому элементу из существующих на земном шаре. Было решено, что новая линия в спектре принадлежит какому-то особому небесному элементу. Он был назван древнегреческим именем Солнца - гелий. Спустя 25 лет после открытия гелия на Солнце знаменитый английский физик Джон Рэлей обнаружил очень странный факт: плотность чистого азота, добытого из воздуха, больше плотности того же азота, полученного из любого азотного соединения. Разница была ничтожна - тысячные доли грамма на литр, но она была. Рэлей написал об этом письмо в лондонский журнал «Природа». Он спрашивал, не сумеет ли кто - нибудь из читателей журнала объяснить, почему «воздушный» азот тяжелее. Но ответов не последовало. Тогда Рэлей обратился к своему другу - известному английскому химику Рамзаю, и они решили, что каждый из них не покинет свою лабораторию, пока загадка не будет разгадана. Они работали разными методами и, наконец, нашли, что в обычном воздухе существует какая-то примесь, и немалая: в каждом литре воздуха содержится около 10см3 еще неизвестного газа. Они дали ему имя аргон. Странный это был газ. Подобных веществ химики еще не знали. Никакими средствами им не удавалось заставить его вступать в химические реакции. Это и было выражено в его названии: по - гречески «аргон» значит «ленивый». Аргон оказался новым химическим элементом. Тщательно изучив периодическую таблицу химических элементов Дмитрия Менделеева, Рамзай и Рэлей пришли к выводу, что аргон и гелий являются двумя представителями семейства пока еще не открытых элементов. Казалось очевидным, что эти неоткрытые элементы должны встречаться в природе в меньших количествах, чем аргон или гелий, и, следовательно, их будет значительно труднее обнаружить.
Затем Рамзай узнал, что известный химик Гильдебрант наблюдал некоторые минералы (они содержали уран или торий), которые при нагревании выделяют какой-то негорючий газ. Рамзай решил проверить, не аргон ли это. Но газ, выделившийся из минерала клевеита, оказался не аргоном. У него был совершенно другой спектр, отличный от уже изученного спектра аргона. Рамзай дал ему имя криптон («тайный») и послал запаянную пробирку с «криптоном» одному из опытных спектроскопистов английскому химику и физику Круксу для точного исследования спектра. В ответ он получил телеграмму: «Криптон - это гелий. Приходите и поглядите. Крукс». Так газ, впервые за четверть века до этого найденный на Солнце, был наконец обнаружен на Земле. Гелий оказался самым легким газом после водорода. Но периодический закон не предусматривал существования таких химических элементов, как гелий и аргон. Для них в периодической системе не было пустых клеток. Куда же поместить новые элементы? Скептики снова воспрянули духом, снова зазвучали голоса сомневающихся в периодической системе и периодическом законе. Но это продолжалось недолго. В 1897 г. Рамзай прочел доклад, который он озаглавил так: «Еще не открытый газ». Рамзай сказал: «По образцу нашего учителя Менделеева я описал, поскольку возможно было, ожидаемые и предполагаемые соотношения газообразного элемента, который должен был бы заполнить пробел между гелием и аргоном».
Места для гелия и аргона в таблице нашел' Рамзай. Они были помещены в новый, нулевой, столбец между седьмым, где были фтор и хлор, и первым, где разместились металлы, подобные литию и калию. Отсюда следовало, что должен существовать газ, столь же инертный, как аргон, но легче его - с атомным весом 20.
Исследуя различные минералы и метеориты, Рамзай не нашел никаких следов инертных газов. Однако в 1898 г., работая с Морисом Траверсом, он применил совершенно иной аналитический подход. Для того чтобы установить вещества, входящие в состав неизвестных жидкостей, как правило, медленно повышали температуру этих жидкостей, отмечая точную температуру кипения каждого вещества. Используя метод, который позволил охладить и сжижить большое количество аргона, Рамзай выделил еще два инертных газа и назвал их криптоном и неоном (от греческих слов, означающих соответственно «скрытый» и «новый»).
В результате дальнейшей работы он открыл еще один инертный газ, который назвал ксеноном (от греческого «незнакомый»). Таким образом, число инертных газов увеличилось до пяти. В течение последующих двух лет Рамзай подтвердил, что эти пять газов действительно обладают теми свойствами, которых и ожидали от этого нового класса элементов. Так в периодическую таблицу была добавлена новая группа элементов.
Инертность радона и его радиоактивность объясняет тот факт, что он был открыт не химиками, а физиками при изучении явления радиоактивности таких элементов, как торий, актиний и радий. Каждый из исследователей, работавших с этими элементами, давал обнаруженному им газу своё название. Э.Дорн, занимавшийся радием, открыл наиболее долгоживущий
изотоп газа 222Rn. Поэтому его считаю автором открытия, а газ именуют радоном (т.е. производным от радия).
Строение атомов и молекул.
Благородные газы заканчивают собой каждый период системы элементов. Кроме гелия, все они имеют в наружном электронном слое атома восемь электронов, образующих очень устойчивую систему.
Также устойчива и электронная оболочка гелия, состоящая из двух электронов. Поэтому атомы благородных газов характеризуются высокими значениями энергии ионизации и, как правило, отрицательными значениями энергии сродства к электрону.
He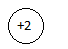 1s2
1s2
Ne 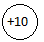 1s22s22p6
1s22s22p6
Ar  1s22s22p63s23p6
1s22s22p63s23p6
Kr  1s22s22p63s23p63d104s24p6
1s22s22p63s23p63d104s24p6
Xe 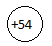 1s22s22p63s23p63d104s24p64d105s25p6
1s22s22p63s23p63d104s24p64d105s25p6
Rn  1s22s22p63s23p63d104s24p6 4d104f145s25p6 5d106s26p6
1s22s22p63s23p63d104s24p6 4d104f145s25p6 5d106s26p6
Молекулы газов одноатомны.
Физические и химические свойства, физиологическое воздействие на организм человека
Инертные газы не имеют цвета и запаха, обладают более высокой электропроводностью (по сравнению с другими) и, при прохождении через них тока, ярко светятся.
Неон – огненно- красным светом, так как его самые яркие линии находятся в красной области спектра.
Гелий - ярко-жёлтым светом, это объясняется тем, что в его сравнительно простом спектре, двойная жёлтая линия преобладает над всеми другими.
Инертные газы имеют более низкие точки сжижения и замерзания, по сравнению с другими газами с тем же молекулярным весом. Это происходит из-за насыщенного характера атомных молекул инертных газов.
Химические свойства.
Инертные газы обладают очень малой химической активностью, что объясняется жёсткой восьмиэлектронной конфигурацией внешнего электронного слоя. Как известно, с увеличением числа электронных слоёв, поляризуемость атомов растёт. Следовательно, она должна увеличиваться при переходе от гелия к радону.
Долгое время ученые вообще не находили условий, при которых благородные газы могли бы вступать в химическое взаимодействие или образовывать истинные химические соединения. Их валентность равнялась нулю. И новую группу химических элементов решили считать нулевой.
Но 1924 году высказалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. В теории, при изучении электронной структуры оболочек криптона и ксенона с позиций квантовой механики, получалось, что эти газы в состоянии образовывать устойчивые соединения с фтором.
Но шло время, а на практике все эксперименты в этой области оканчивались неудачей. Фторид ксенона не получался. Постепенно пришли к выводу, что это невозможно, и опыты прекратились.
Только в 1961 году Бартлетт, сотрудник одного из университетов Канады, изучая свойства гексафторида платины, соединения более активного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чем у кислорода (12, 13 и 12, 20 эВ соответственно), а кислород образовывал с гексафторидом платины соединение состава O2PtF6...
При комнатной температуре Бартлетт провел опыт и из газообразного гексафторида платины и газообразного ксенона получил твердое оранжево - желтое вещество, получившее название гексафторплатинат ксенона XePtF6..
При нагревании в вакууме гексафторплатинат XePtF6 возгоняется без разложения. Гидролизуется в воде, выделяя ксенон:
2XePtF6 + 6Н2О = 2Хе + О2 + 2PtО2 + 12HF
Исследуя новое вещество, Бартлетт пришел к выводу, что поведение гексафторплатината ничем не отличается от поведения обычных химических соединений.
Работы Бартлетта позволили установить, что ксенон в зависимости от условий реакции, способен образовывать два разных соединения с гексафторидом платины: XePtF6 и Xe(PtF6)2. Но при гидролизе этих соединений получаются одни и те же конечные продукты.
В 1962 году Бартлетт выступает с докладом о получении соединений ксенона, и уже через три недели после его опытов эксперимент повторила группа американских исследователей в Аргоннской национальной лаборатории во главе с Черником. Ученым впервые удалось синтезировать аналогичные соединения ксенона с гексафторидами рутения, родия и плутония.
Так были получены первые пять соединений ксенона: XePtF6, Xe(PtF6)2, XeRuF6, XeRhF6, XePuF6. Миф об абсолютной инертности газов не подтвердился. Существовавшую гипотезу о возможности прямого взаимодействия ксенона с фтором решили проверить. Для этой цели смесь газов (1 часть ксенона и 5 частей фтора) поместили в никелевый сосуд, как наиболее устойчивый к действию фтора, и нагрели под сравнительно небольшим давлением. Через час сосуд резко охладили, а газ откачали. Оставшимся газом оказалось не что иное, как фтор. Весь ксенон прореагировал! После во вскрытом сосуде обнаружили бесцветные кристаллы тетрафторида ксенона XeF4.
Это устойчивое соединение, его молекула имеет форму квадрата с ионами фтора по углам и ксеноном в центре.
Тетрафторид ксенона XeF4 фторирует ртуть, платину (но только растворенным во фтористом водороде):ХеF4 + 2Hg = Хe + 2HgF2
Замечательно то, что, меняя условия реакции, можно получить не только XeF4, но и другие фториды, например XeF2, XeF6.
В. М. Хуторецкий и В. А. Шпанский - советские ученые-химики, показали, что для синтеза дифторида ксенона совсем не обязательны жесткие условия.
Ими был предложен способ, когда смесь ксенона и фтора (в молекулярном отношении 1:1) подается в сосуд из никеля или нержавеющей стали, и при повышении давления до 35 атм начинается самопроизвольная реакция.
XeF2 — единственный фторид ксенона, получаемый под действием электрического разряда на смесь ксенона и четырехфтористого углерода, без использования элементарного фтора.
Чистый ХеF2 получается, при облучении ксенона и фтора ультрафиолетом.
Дифторид ХеF2 обладает резким специфическим запахом.
Растворимость дифторида в воде невелика. Его раствор — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтороводород. В щелочной среде разложение идет особенно быстро.
Метод синтеза дифторида ксенона, основанный на воздействии на смесь газов ультрафиолетового излучения (длина волн порядка 2500—3500 Аº) представляет большой теоретический интерес.
Излучение вызывает расщепление молекул фтора на свободные атомы. И именно в этом заключается причина образования дифторида, т.к. атомарный фтор необычайно активен.
Для получения гексафторида ксенона XeF6 требуются более жесткие условия: 700° С и 200 атм. При таких условиях в смеси ксенона и фтора, в отношение от 1:4 до 1:20, практически весь ксенон превращается в XeF6.
Гексафторид ксенона чрезвычайно активен и разлагается со взрывом.
Легко реагирует с фторидами щелочных металлов (кроме LiF):XeF6 + RbF = RbXeF7
Уже при 50° С эта соль разлагается:2RbXeF7 = XeF6 + Rb2XeF8
Высший фторид XeF8 устойчив лишь при температуре ниже минус 196° C.
Если прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности, то синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Инертные газы решили перенести в VIII группу, когда стал известен его высший фторид, в котором валентность ксенона равна восьми, что вполне согласуется со строением его электронной оболочки.
Все известные ныне соединения ксенона получены из его фторидов. Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось.
Хорошо изучено взаимодействие фторидов ксенона с водой.
При гидролизе ХеF4 в кислой среде, образуется триоксид ксенона ХеО3 — бесцветные, расплывающиеся на воздухе кристаллы.
Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине.
Это крайне неустойчивое соединение, при разложении мощность взрыва приближается к мощности взрыва тротила. Поэтому достаточно несколько сотен миллиграммов ХеО3, чтобы эксикатор разнесло в куски.
В перспективе предполагается использование триоксид ксенона в качестве взрывчатки. Такая взрывчатка была бы очень удобна, потому что все продукты взрывной реакции — газы. Пока же использовать для этой цели триоксид ксенона слишком дорого из-за небольших запасов в атмосфере и технических сложностей.
Для получения 1 м3 ксенона нужно переработать 11 млн. м3 воздуха.
Соответствующая триоксиду неустойчивая кислота шестивалентного ксенона H6XeO6 образуется в результате гидролиза XeF6 при температуре 0° С:
XeF6 + 6h3О = 6HF + H6XeO6
Если к продуктам этой реакции быстро добавить Ва (ОН)2, выпадает белый аморфный осадок Ва3ХеО6. При 125° С он разлагается на оксид бария, ксенон и кислород.
Получены аналогичные соли—ксенонаты натрия и калия.
Под действием озона из раствора ХеО3 в одномолярном едком натре образуется соль высшей кислоты ксенона Na4ХеО6. Перксенонат натрия может быть выделен в виде бесцветного кристаллогидрата Na4XeO6 · 6Н2О. Также к образованию перксенонатов приводит гидролиз XeF6 в гидроокисях натрия и калия.
Достаточно обработать твердую соль Na4XeO6 раствором нитрата свинца, серебра или уранила и получаются соответствующие перксенонаты:
Ag4XeO6 — черного, bXeO6 и (UO2) 2XeO6 - желтого цвета.
Аналогичные соли дают калий, кальций, литий, цезий,.Взаимодействием Na4XeO6 с безводной охлажденной серной кислотой, получают окисел, соответствующий высшей кислоте ксенона – четырехокись ХеO4.
Как и в октафториде, валентность ксенона равна восьми.
Твердая четырехокись при температуре выше 0° С разлагается на ксенон и кислород, а газообразная (при комнатной температуре) — на трехокись ксенона, ксенон и кислород.
Молекула ХеO4 имеет форму тетраэдра с атомом ксенона в центре. В зависимости от условий гидролиз гексафторида ксенона может идти двумя путями:
получается тетраоксифторид XeOF4,
получается диоксифторид XeO2F2.
Прямой синтез из элементов приводит к образованию оксифторида ХеОF2.
Недавно изучена реакция дифторида ксенона с безводной НС1O4.
Получено новое соединение ксенона ХеСlO4 — мощный окислитель, в результате этой реакции, самый сильный из всех перхлоратов. Синтезированы соединения ксенона, не содержащие кислорода.
Это двойные соли, продукты взаимодействия фторидов ксенона с фторидами сурьмы, мышьяка, бора, тантала: XeF2 · SbF5, ХеF6 · AsF3, ХеF6 · ВF3 и ХеF2 · 2ТаF5.
И наконец, получены вещества типа XeSbF6, устойчивые при комнатной температуре, и XeSiF6 — нестойкий комплекс. На сегодняшний день удалось установить, что радон также взаимодействует с фтором, образуя нелетучие фториды.
Выделены и изучены дифторид KrF2 и тетрафторид для криптона KrF4 по свойствам, напоминающим соединения ксенона. 4. История открытия инертных газов.К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически.
Воздух, при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка.
Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18.
Так было доказано, что воздух содержит газ, плотность которого больше плотности азота… Получили 100 см3 этого вещества с плотностью равной 19,9. Оно оказалось одноатомным газом.
Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную - почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”.
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. “гелиос”, что означает солнце.
В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита.
Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Рамзай и его сотрудники в поисках инертных газов занялись минералами, природными водами, даже метеоритами. Однако, все было безрезультатно, анализы неизменно оказывались отрицательными.
Между тем — новый газ в них был, но используемые методы,не были достаточно чувствительными и эти “микроследы” не улавливались.
Начав исследовать воздух, всего за четыре последующих года было открыто четыре новых элемента, а такие газы, как неон, криптон и ксенон были даже выделены из воздуха.
Для этого, воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. При этой процедуре более легкие газы улетучиваются и оставшиеся после испарения тяжелые инертные газы рассортировывают.
Полученные фракции подвергались различным исследованиям.
Рассмотрим спектральный анализ, как один из методов определения:
Это несложная процедура позволяет безошибочно идентифицировать инертные газа по линиям спектра.
Для этого газ помещается в разрядную трубку, к которой подключен ток.
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. Интересна история названия этого газа:
Когда Рамзай наблюдал, в очередном опыте, спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать “поклонником” отцовых работ. Увидев необычное свечение, он воскликнул: “new one!” , что по-древнегречески значит “новый”.
Так возникло название газа “неон”.
Найти инертные газы, завершающие четвёртый, пятый и шестой периоды таблицы Менделеева удалось не сразу, хотя после того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, в их существовании сомнений не было.
Но к тому времени научились получать значительные количества жидкого воздуха, во много благодаря стараниям английского ученого Траверса.
Стал доступен даже жидкий водород.
И Рамзай совместно с Траверсом смогли заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона.
Остаток одержал сырой (неочищенный) криптон. И после откачки его в сосуде неизменно оставался пузырек газа. Этот газ давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой и имел голубоватое свечение в электрическом разряде. Как известно, по спектральным линиям можно безошибочно идентифицировать элемент. И У Рамзая и Траверса были все основания считать, что открыт новый инертный газ.
Он получил название - ксенон, что в переводе с греческого значит “чужой”. Ведь действительно, в криптоновой фракции воздуха он выглядел чужаком.
В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха. Содержание ксенона в атмосфере крайне мало, но именно воздух — практически единственный и неисчерпаемый источник ксенона (почти весь ксенон возвращается в атмосферу).
Индивидуальность ксенона как нового химического элемента установили, оперируя всего 0,2 см3 этого газа.
Рамзаю так же принадлежит заслуга открытия высшего представителя инертных газов. Используя тонкие технические приёмы, он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Рамзай измерил скорость диффузии, что позволило установить молекулярный вес газа, составляющий примерно 220:
Исходя из предположения, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия (a –частицы), то выходит, что заряд его должен быть равен 88-2=86. Таким образом, новый элемент должен действительно быть инертным газом. А его атомный вес 226-4=222. Официально было решено включить в периодическую систему новую группу химических элементов 16 марта 1900 года, после встречи Рамзая с Менделеевым.
Физиологическое воздействие на организм человека.
Было бы естественно полагать, что благородные газы не должны влиять на живые организмы, потому как инертны химически. Однако это не совсем так. В смеси с кислородом вдыхание высших инертных газов приводит человека в состояние, сходное с алкогольным опьянением. Такое наркотическое действие инертных газов обуславливается растворением их в нервных тканях. И чем выше атомный вес инертного газа, тем выше его растворимость, и тем большее наркотическое действие он способен оказывать.
История получения.
Гелий.
Гелий образуется при радиоактивном распаде урана, тория и некоторых других радиоактивных элементов, подверженных распаду в недрах Земли. Высвободившийся гелий поднимается к поверхности Земли. По дороге он растворяется в подземных водах, заполняет пустоты горных пород, скапливается вместе с нефтяным газом. Содержание гелия в этом газе невелико, Для промышленной разработки интерес представляют только газы, включающие не менее 0,05% гелия. Выделение гелия из газов основано на том, что он не поглощается активированным углем. Через уголь, охлажденный жидким воздухом, пропускают природный газ, при этом гелий и водород проходят, а остальные газы, такие как метан и азот, абсорбируются углем. Гелий от водорода отделяют при помощи кислорода, в результате чего получаются вода и чистый (99,999%) гелий. Гелий - один из самых легких газов. Он в 7,3 раза легче воздуха. Поэтому гелий вместе с водородом постоянно из атмосферы Земли улетучивается в мировое пространство. Одновременно атмосфера обогащается гелием в результате радиоактивных процессов, происходящих в недрах Земли.
Изучение свойств гелия вписало яркие страницы в историю мировой и отечественной физики ХХ в. Поэтому на нем необходимо остановиться подробнее. Оказалось, что гелий - единственное вещество, остающееся жидким при охлаждении вплоть до абсолютного нуля. Но это противоречит «классическим» представлениям, и следовательно, для объяснения данного явления потребовались новые «неклассические» идеи. Эти идеи легли в основу новой физической дисциплины квантовой механики. Но она, как известно, господствует в мире атомов и молекул, тогда как здесь речь идет о веществе в жидком состоянии, т. е. о макроскопическом теле. Во всех других случаях квантовые свойства проявляются у веществ в твердом состоянии при очень низких температурах. И только у гелия квантовые свойства обнаруживаются до затвердевания. А поскольку в квантовой механике допускается движение атомов при абсолютном нуле, то жидкий гелий и не обречен на затвердевание. Иными словами, жидкий гелий - жидкость принципиально нового типа, названная квантовой жидкостью. Увы, гелий пока единственный представитель жидкостей такого рода. Это самая легкая и самая холодная жидкость. Гелий переходит в жидкое состояние при температуре 5,20 К. Понижение температуры до 2,172 К вызывает в жидком гелии скачкообразное изменение теплоемкости. Это явление было открыто в 1926 г. х. Камерлинг-Оннесом (Нидерланды).
Столь выраженное различие в физических свойствах дало повод ввести обозначения: гелий 1 - для жидкого гелия при температурах выше точки превращения и гелий 11 - для жидкого гелия при температурах ниже точки превращения (рис. 12). Гелий 11 оказался жидкостью, обладающей уникальными физическими свойствами, которые выявили В. Кееаом и мисс А. Кеезом в 1936 г. Выяснилось, что гелий 11 - наилучший из всех существующих проводников. В конце 1937 г. п.Л.Капица открыл явление, которое он назвал сверхтекучестью гелия 11. Более того, он показал, что именно сверхтекучесть определяет такое свойство, как сверхтеплопроводность, обнаруженное в 1936 г. В 1940-1941 гг. Л. д. Ландау на основе исследований Капицы создал теорию сверхтекучести. Впоследствии оба ученых за эти работы были удостоены Нобелевских премий по физике: Л. д. Ландау в 1962 г., п. Л. Капица в 1978 г. В итоге исследований 1936, 1937, 1940, 1941 и последующих годов была создана так называемая двухжидкостная модель гелия. Ее суть: гелий Д - смесь двух жидкостей, которые могут двигаться независимо друг от друга. Движение одной жидкости не обладает вязкостью, другая же перемешается с переносом тепла. Гелий II называют жидкостью бозевского типа, в отличие от открытой позднее жидкости фермиевского типа. Изучение последней стало возможным благодаря успехам ядерной физики, позволившим искусственно получить редкий изотоп 3Не в количестве, достаточном для проведения исследований. 3Не переходит в жидкое состояние при сверхнизкой температуре. Это другой тип квантовой жидкости со свойствами, отличающимися от свойств гелия II. Теорию жидкого 3Не разработал Л. Д. Ландау в 1956- 1958 гг. В 1996 г. американские ученые Д. ЛИ, Д. Ошерофф и Р. Ричардсон за открытие явления сверхтекучести 3Не при сверхнизких температурах и давлении -3.4 МПа получили Нобелевскую премию по физике.
Неон.
Получают неон из жидкого воздуха, выделяя легколетучую фракцию. В ней он находится вместе с гелием, от которого его отделают либо вымораживая неон жидким воздухом, либо адсорбируя активированным улем, охлаждаемым жидким воздухом. Обычно же в технике и используют смесь, содержащую 75% неона 25% гелия.
Аргон.
Аргон получают из сжиженного воздуха. Первоначально он загрязнен примесями кислорода и азота, составляющих главную массу воздуха. От кислорода аргон очищают химическим методом, от азота - повторным сжижением и испарением. После очистки удается получить газ высокой чистоты, содержащий 99,99% аргона.
Криптон.
Аргоновая фракция, полученная перегонкой воздуха, содержит другие инертные газы. В результате многократной перегонки этой фракции выделяется криптон. Другой способ, так называемый метод Клода, заключается в вымывании криптона жидким воздухом из газообразного воздуха, охлажденного почти до температуры сжижения.
Ксенон.
Источник получения ксенона - воздух. В настоящее время дистилляцией жидкого воздуха получают азот и кислород. Это крупные химические производства. Попутно с азотом и кислородом получают и инертные газы. Воздух поистине неистощимый источник ксенона, содержащегося в атмосфере (около 1 млрд т), достаточно, чтобы удовлетворить
потребности человечества в этом газе при любом уровне потребления, поскольку после использования он в неизменном виде возвращается в атмосферу. Процесс извлечения ксенона из воздуха сравнительно прост. Воздух очищают от воды и углекислоты и подвергают глубокому охлаждению. В результате образуется жидкость, которую постепенно испаряют. При этом происходит разделение на фракции в зависимости от температуры кипения. Вначале испаряется азот, затем кислород и, наконец, благородные газы. Их отделяют, снова охлаждают и подвергают дистилляции. Каждый благородный газ экстрагируется из так азываемого сырого концентрата. Ксенон концентрируется в сыром криптоне, где его содержание достигает 7%. Он представляет собой наименее летучий компонент жидкого воздуха. Дальнейшая очистка сочетает физические и химические методы. Разделение, основанное на разнице в температурах кипения, вполне возможно, так как она представляет ощутимую величину 44 ОС. Чтобы получить 1 м3 ксенона, нужно переработать 14 тыс. т воздуха. Газ расфасовывают в баллоны объемом не более 12 л. Они окрашены в оранжевый цвет и имеют черную надпись «ксенон».
Соединения инертных газов.
Собственно говоря, о том, что химические соединения криптона, ксенона и радона с сильными окислителями вполне могут существовать, Лайнус Полинг упоминал ещё в 1933 году. Однако прошло около тридцати лет, прежде чем в 1962 году Нил Бартлетт синтезировал в Канаде первое из таких соединений — XePtF 6, при этом в реакции участвовали благородный газ и мощный окислитель, гексафторид платины. Соображения, на которые учёный опирался в своём поиске, были весьма простыми и интуитивно понятными каждому химику: если гексафторид платины столь силён, что отбирает электрон даже у молекулярного кислорода, то почему он не может это сделать с ксеноном? Ведь внешний электрон у атома этого газа привязан к ядру ничуть не сильнее, чем у кислорода, — об этом свидетельствуют почти одинаковые значения потенциала ионизации. После того как успешный синтез подтвердил гипотезу, было получено целое семейство соединений ксенона с сильными окислителями — фторидов, оксифторидов, оксидов, солей ксеноновой кислоты и многочисленные комплексы. Химики синтезировали также хлорид ксенона и фторсодержащие соединения со связями Xe–Bи Xe–N.
В последующие двадцать лет интригующие события развернулись на стыке химии ксенона и органической химии. В семидесятые годы появилось сообщение о синтезе нестабильной молекулы FXeCF 3, а затем и Xe(CF 3 ) 2. В конце восьмидесятых получили уже стабильные ионные соли, в которых катион содержал связь Xe–C (в качестве аниона, как правило, выступал борфторид). Среди соединений такого типа особый интерес (почему — станет понятно позже) представляет соль алкинилксенония — [t–BuC¤CXe] + [BF 4] –, которую синтезировали В.В. Жданкин, П. Стэнг и Н.С. Зефиров в 1992 году. Вообще-то, подобные соединения можно считать как органическими, так и неорганическими, но в любом случае их получение стало большим шагом вперёд и для теоретической, и для синтетической химии.
Гораздо труднее сдавался криптон. Однако и его удалось сначала соединить со фтором, а затем встроить и в более сложные молекулы.
Не нужно думать, что все эти соединения — некая забавная экзотика. По крайней мере, один класс из них, фториды ксенона и, прежде всего, его дифторид, довольно часто применяют, если в лабораторных опытах нужно что-то профторировать. Работают они и для вскрытия минерального сырья, и, естественно, как промежуточные соединения при синтезе новых производных ксенона.
В целом „бартлеттовское“ направление в химии инертных газов имеет две главные особенности. Во-первых, оно принадлежит к ионной химии. Так, формулу первого соединения ксенона правильнее записывать как Xe + [PtF 6] –. Во всех случаях инертный газ служит восстановителем. Это понятно из самых общих соображений: при всём желании атом с заполненной электронной оболочкой не способен принять ещё один электрон, а вот отдать — может. Главное, чтобы партнёр был агрессивен и настойчив, то есть обладал ярко выраженными окислительными свойствами. Неудивительно, что легче других расстаётся со своим „октетным благородством“ ксенон: у него электроны внешней оболочки расположены дальше от ядра и удерживаются слабее.
Во-вторых, современная химия инертных газов тесно привязана к химии фтора. В состав подавляющего большинства соединений входят атомы фтора, и даже в тех редких случаях, когда фтора нет, путь к их получению всё равно лежит через фториды.
А может ли быть иначе? Существуют ли соединения инертных газов не только без фтора, но и без каких-либо других окислителей? Например, в виде нейтральных стабильных молекул, где атом инертного газа связан с водородом и ни с чем больше? До недавнего времени такой вопрос, повидимому, даже не приходил в голову ни теоретикам, ни экспериментаторам. Между тем именно о таких молекулах речь пойдёт дальше.
Лирическое отступление о роли благородства
Прежде чем говорить о гидридах инертных газов, давайте вернёмся к самому началу, а именно — к инертности благородных газов. Несмотря на всё сказанное выше, элементы главной подгруппы восьмой группы вполне оправдывают своё групповое название. И человек использует их естественную инертность, а не вынужденную реакционную способность.
Например, физико-химики любят применять такой метод: заморозить смесь инертного газа с молекулами какого-либо вещества. Остыв до температуры между 4 и 20К, эти молекулы оказываются в изоляции в так называемой матрице твёрдого инертного газа. Далее можно действовать светом или ионизирующим излучением и смотреть, что за промежуточные частицы получаются. В других условиях такие частицы не видны: они слишком быстро вступают в реакции. А с инертным газом, как считалось в течение многих лет, прореагировать очень непросто. Такими исследованиями на протяжении многих лет занимались в наших лабораториях — в Научно-исследовательском физико-химическом институте им. Л.Я. Карпова, а затем и в Институте синтетических полимерных материалов РАН, причём использование матриц с различными физическими свойствами (аргона, криптона,ксенона) рассказало много нового и интересного о влиянии окружения на радиационно-химические превращения изолированных молекул. Но это — тема для отдельной статьи. Для нашей же истории важно, что такая матричная изоляция неожиданно для всех привела в совершенно новую область химии инертных газов. И случилось это в результате одной встречи на международной конференции по матричной изоляции в США, которая произошла в 1995 году. Именно тогда научный мир впервые узнал о существовании новых необычных соединений ксенона и криптона.
Гидриды выходят на сцену
Финские химики из Университета Хельсинки Мика Петтерсон, Ян Лунделл и Маркку Расанен наполняли твёрдые матрицы инертных газов галогеноводородами (HCl, HBr, HI) и смотрели, как эти вещества распадаются под действием света. Как оказалось, если ксеноновую матрицу после лазерного фотолиза, который проводили при температуре ниже 20К, нагреть до 50К, то в ней появляются новые и очень интенсивные полосы поглощения в ИК-спектре в области между 2000 и 1000 см –1. В классической колебательной спектроскопии, в „среднем“ и „дальнем“ ИК-диапазонах, традиционно используют шкалу волновых чисел — эквивалентов частот колебаний, выраженных в обратных сантиметрах. Именно в таком виде характеристики колебательных спектров приведены почти во всех учебниках, справочниках и статьях. В криптоновой матрице этот же эффект проявлялся после нагрева до 30К, а в аргоновой никаких новых полос заметно не было.
Исследователи из Хельсинки сделали смелое предположение: поглощение обусловлено валентными колебаниями связей H–Xe и H–Kr. То есть при нагреве облучённых образцов возникают новые молекулы, содержащие атомы инертных газов. Эксперименты с изотопным замещениеми квантово-химические расчёты полностью подтвердили эту догадку. Таким образом, семейство соединений инертных газов пополнилось сразу несколькими новыми членами весьма необычного вида — HXeCl, HXeBr, HXeI, HKrCl и HXeH. Последняя из перечисленных формул произвела особенно сильное впечатление на химиков, воспитанных на классических традициях: только ксенон и водород, никаких сильных окислителей!
Здесь важно отметить: для того чтобы новое соединение появилось на химической карте мира, необходимо его однозначно идентифицировать. Расанен и его коллеги решились поверить своим глазам, рискнули высказать смелое предположение и смогли доказать его. Между тем подобные эксперименты с инертными матрицами проводили и другие учёные. Вполне вероятно, что они наблюдали полосы поглощения гидридов ксенона и криптона, но не смогли их опознать. Во всяком случае, дигидрид ксенона несомненно получался в наших экспериментах, только мы об этом не подозревали. Зато, рассматривая вместе с финскими коллегами наш стенд на той самой конференции, где были впервые представлены сенсационные данные хельсинкской группы, мы сразу же это соединение смогли обнаружить. В отличие от финских коллег, мы в ксеноне замораживали углеводороды, а потом облучали их быстрыми электронами. Гидрид же возникал при нагреве до 40К.
Образование нового, столь необычного соединения инертного газа именно при нагреве означает: всё дело во вторичных реакциях. Но какие частицы в них участвуют? На этот вопрос первые эксперименты ответа не давали.
Метастабильная связь в газовом льду
Следуя „ионной традиции“ в химии ксенона, финские исследователи предположили, что и здесь предшественниками служат ионные частицы — протоны и соответствующие анионы. Проверить это предположение, опираясь только на данные ИК-спектроскопии, было невозможно, ведь полосы в спектрах при нагреве появлялись внезапно, как будто из ничего. Однако в нашем распоряжении был ещё метод электронного парамагнитного резонанса(ЭПР). С его помощью удаётся определить, что за атомы и радикалы возникают при облучении и как быстро они исчезают. В частности, атомы водорода в ксеноновой матрице дают прекрасные сигналы ЭПР, которые ни с чем нельзя спутать вследствие характерного взаимодействия неспаренного электрона с магнитными ядрами изотопов ксенона (129Xe и 131Xe).
Вернувшись с памятной конференции 1995 года, мы сразу же провели эксперименты, где и выяснили, что при нагреве ксеноновой матрицы атомы водорода исчезают. Причём их гибель, зафиксированная по данным ЭПР, хорошо коррелирует с возникновением дигидрида ксенона, о котором свидетельствуютИК-спектры: оба процесса протекают в очень узком диапазоне температур (38–40К). Если же в матрицу добавить вещества, которые подавляют образование атомов водорода при облучении, то и выход дигидрида ксенона при последующем нагреве резко снижается. То есть дело вовсе не в ионах-предшественниках,о которых думали финны: молекула HXeH возникает в результате реакций подвижных атомов водорода. Когда два атома сближаются в матрице настолько, что между ними остаётся лишь один атом ксенона, вместо привычной рекомбинации с образованием Н 2 возникает молекула нового соединения. Финские учёные, в свою очередь, обнаружили, что и HXeI образуется схожим образом.
В результате этих экспериментов получилась схема образования гидридов инертных газов в ксеноновых и криптоновых матрицах. Она выглядит так. Когда твёрдую матрицу достаточно нагреют (до 30–32Кдля криптона или 38–40К для ксенона), замороженные ранее атомы водорода начинают диффундировать, то есть прыгают от одной ловушки к другой. И делают это до тех пор, пока ловушка не окажется слишком глубокой. Один из глубоких локальных минимумов энергии соответствует молекуле HXY, где Y — второй водород или какой-то галоген, а X — ксенон или криптон. Этот гидрид, несомненно, метастабилен, ведь глобальный минимум, который отвечает молекуле HY, лежит намного ниже. Однако барьер между двумя состояниями не так уж мал: при столь низкой температуре преодолеть его не удаётся и промежуточное соединение оказывается устойчивым. Во всяком случае, при той температуре, когда инертный газ ещё существует в твёрдом виде.
«Ударная пятилетка» гидридов
Такая схема оказалась неплохим руководством к действию для направленного синтеза новых молекул. Вскоре выяснилось, что в роли Y может выступать любой атом или радикал с относительно высоким сродством к электрону. В течение пяти лет группа Расанена получила целую серию новых гидридов ксенона: HXeCN, HXeNC, HXeSH, HXeOH. Последнее из этих соединений интересно тем, что с формальной точки зрения представляет собой продукт внедрения атома ксенона в молекулу воды. Список криптонсодержащих молекул пополнился двумя соединениями — HKrCN и HKrF. Но, пожалуй, главной сенсацией стало первое нейтральное химическое соединение аргона — HArF: оно возникает при фотолизе фтористого водорода в аргоновой матрице. Отметим, что в получении HArF и других соединений активное участие принимал бывший сотрудник Санкт-Петербургскогоуниверситета Леонид Хрящев, который работает в группе Расанена с 1996 года. В целом стало окончательно ясно, что в ближайшем будущем школьным учебникам химии не удастся избежать сильной корректировки.
После падения „аргонового бастиона“ для химиков, кажется, не осталось ничего незыблемого. Во всяком случае, теоретики уже всерьёз обсуждают возможность существования молекулы HHeF. Правда, надежда на то, что удастся экспериментально зафиксировать рождение такого соединения, весьма мала: скорее всего, оно будет жить очень недолго — атом водорода просочится под энергетическим барьером и соединится непосредственно со фтором без благородного посредника.
Путь к ксеноноорганике
Синтез гидридов инертных газов был одним из эффектных заключительных достижений химии XX века. И всё же к началу нового столетия эта глава химической истории закончилась. В самом деле, почти все предсказанные простые молекулы HXY были получены. Редкие теоретически устойчивые, но до сих пор не найденные исключения — это — HXeF и HXeSiF 3 или экзотическое соединение гелия. Между тем каждый химик знает, что органических соединений известно во много раз больше, чем неорганических. И возможности для комбинирования здесь почти безграничны.
Можно ли получить органические гидриды инертных газов? Никаких принципиальных препятствий для этого нет: нужно лишь представить, что в роли Y выступает органический радикал, обладающий достаточной электроотрицательностью. Каковы шансы обнаружить их практически? В современной химии расчёт часто предшествует эксперименту, и химия инертных газов здесь не исключение.
Квантово-химические расчёты органических молекул с атомом ксенона, внедрённым по связи О–Н, появились вскоре после открытия первых гидридов.
Более того, уже известный нам Ян Лунделл из Хельсинки вместе с Ариком Коэном и Робертом Гербером (Израиль–США) предсказали: могут существовать углеводороды с атомом ксенона, внедрённым по связи С–Н. При этом речь шла об очень простых и весьма популярных среди химиков углеводородах — ацетилене, бензоле, феноле. О своей идее авторы рассказали на 4-й Международной конференции по химии низких температур в Финляндии в августе 2002 года. Реакции экспериментаторов были разнообразными: от охотничьего азарта до нескрываемого пессимизма. Наибольший интерес вызвали расчёты соединения ксенона с ацетиленом, которое должно быть особенно стабильным. Не испытать возможность синтеза такого многообещающего вещества было бы просто грешно.
Ксеноновый ацетилен
Каждый, кто изучал органическую химию хотя бы в объёме средней школы, помнит типичные задания: написать схему получения сложных органических молекул из неорганических соединений. Все эти цепочки начинались одинаково: карбид кальция плюс вода — получается ацетилен. Именно поэтому ксенон, присоединённый к ацетилену, способен открыть дверь в новую своеобразную область элементоорганической химии.
Вернувшись с конференции, мы решили сразу же проверить предсказание теоретиков, и всё прошло как по нотам. Сначала с помощью ЭПР-спектров удалось выяснить, что при облучении электронами молекула ацетилена (HCCH) в ксеноновой матрице действительно диссоциирует на атом Н· и этинильный радикал ·С¤СН. При разогреве до 40–45К атомы Н исчезают почти полностью, одновременно уменьшается количество этинильных радикалов и появляется немного винильных ·HС=CH 2.
Здесь как раз и разворачивается интрига: при столь низкой температуре двигаться в ксеноне могут только атомы водорода. А тяжёлые этинильные радикалы на это не способны. Значит, гибель последних — результат реакции с участием атомов водорода. На первый взгляд причина могла бы быть тривиальной: атомы и радикалы рекомбинируют, воссоздавая исходную молекулу ацетилена. Но не тут-то было: ИК-спектры показывают, что количество ацетилена при таком разогреве не только не растёт, но даже немного снижается — он расходуется на образование винильных радикалов. Следовательно, реакция атомов водорода с радикалами·С¤СН в ксеноне даёт что-то другое, и тут уже опыт, интуиция и азарт сливаются воедино: это должна быть молекула HXeC¤CH!
Осталось совсем немного — непосредственно доказать её образование. Здесь на первый план выходит ИК-спектроскопия. Нижняя часть рисунка со спектрами показывает, что облучение приводит к заметному расходованию молекул ацетилена, а при последующем разогреве действительно появляются новые интенсивные полосы. Пара полос с максимумами при 1180и 1166 см –1 уже знакома нам по прежним исследованиям — это дигидрид ксенона. А ещё более интенсивная полоса с максимумом при 1486 см –1 возникает как раз примерно там, где, согласно предсказаниям теоретиков, должны проявляться колебания Xe–H в молекуле HХeC¤CH.(Отклонение от расчёта связано с эффектами ангармонизма и влияния матричного окружения, которыми теоретики пренебрегали.) Окончательное доказательство дали опыты с дейтерированным ацетиленом: наблюдаемый сдвиг полосы поглощения говорил о том, что водород связан с более тяжёлым атомом, чем углерод, — в исследуемой системе на роль такого атома годится только ксенон.
Применение.
Гелий.
Из всех свойств гелия в первую очередь была использована его легкость. В первую мировую войну, а именно в 1915 г., немцы применили гелий для наполнения дирижаблей, бомбивших Лондон. В настоящее время используют химическую инертность гелия. Ежегодно получают сотни тысяч литров гелия в год. Около 30% от этого количества используют в космической технике для вытеснения жидкого кислорода и водорода в ракетах. Примерно столько же расходуется на атомных станциях при хранении ядерного топлива и в качестве теплоносителя. Около 20% гелия требуется для создания инертной атмосферы при дуговой сварке. Еще столько же используется в метеорологических зондах. Остальной гелий применяется в электронике и для приготовления искусственных смесей для дыхания. Эти смеси при меняют водолазы, чтобы избежать кессонной болезни, которая возникает при подъеме с глубины. Причины кессонной болезни - повышение растворимости азота воздуха в крови при увеличении давления. При подъеме с глубины газ начинает выделяться и закупоривает сосуды. Если в газовой смеси вместо азота взять гелий, то этого не произойдет, так как он в крови не растворяется.
Как видно из сказанного, гелию уже принадлежит важная роль в жизни людей. По-видимому, с развитием науки и техники роль эта будет возрастать.
Неон.
Неон находит применение в различных областях. Его широко используют в световой рекламе. Газосветные трубки, заполненные. неоном, дают красное свечение. Человеческий г лаз наиболее чувствителен к той области спектра, в которой происходит свечение возбужденного электрическим разрядом неона. По этой же причине неоном заполняют газосветовые лампы для сигнальных устройств. Неон используют в криогенной технике - технике низких температур. Криостаты позволяют проводить такие реакции, которые при. обычной температуре взрывоопасны, например синтез пероксида водорода из озона и атомарного водорода. Неон используют при хранении ракетного топлива, применяют в радиоэлектронике (лазеры, мазеры) и вычислительной технике. За столетие, в течение которого человечество изучало неон, ему было найдено применение в различных областях науки и техники. Можно ожидать, что использование неона, как и других инертных газов, будет расширяться. Соединения неона не получены.
Аргон.
Самое большое количество аргона используют в металлургии. Им продувают расплавленную сталь для удаления из нее газов. Атмосферу аргона используют при переработке ядерного топлива, при выращивании монокристаллов для полупроводников. Смесь аргона с водородом применяют. когда при электросварке нужно получить чистые, не покрытые оксидами металлов швы или когда нужно разрезать толстые листы тугоплавкого металла. Аргон применяют в электровакуумной технике в качестве добавки при заполнении люминесцентных ламп и ламп накаливания. В последнем случае снижается скорость испарения вольфрамовой нити и улучшается распределение паров аргона по всему объему лампы, что удлиняет срок ее службы. Синее свечение аргона, возникающее при электрическом разряде, используют при изготовлении вывесок и рекламы. По-видимому, с развитием техники и научных исследований области применения аргона будут расширяться.
Криптон.
Применение криптона весьма ограниченно. Если при менять дифторид криптона как фторирующий агент, то это очень дорого и пока экономически невыгодно. Криптон сегодня используют в вакуумной технике. Его смесь с ксеноном служит для наполнения осветительных ламп и трубок. Радиоактивный изотоп 85Kr используют как источник B-излучения в медицине, для обнаружения течей в вакуумных установках, как изотопный индикатор при исследовании коррозии, для
контроля износа деталей.
Ксенон.
Ксенон находит применение в медицине при исследованиях головного мозга: он служит контрастным веществом при получении энцефалограмм, поскольку способен задерживать рентгеновское излучение. Он может применяться как анестезирующее средство, и здесь у ксенона имеется ряд достоинств - он нетоксичен и негорюч. Но пока для этой цели слишком дорог. Ксенон находит применение при изических исследованиях. Монокристалл ксенона служит рабочим телом лазера для накапливания энергии быстрых электронов и последующего излучения в ультрафиолетовом диапазоне. В этой области больших успехов достигла школа физиков под руководством академика Н. Г. Басова.
Ксенон широко используют в светотехнике прежде всего для заполнения газоразрядных источников света. Для увеличения светоотдачи трубки внутри покрывают люминофором. Возбуждаемая в нем люминесценция изменяет голубой цвет, характерный для ксенона, до желтого и оранжевого. Ксеноном также заполняют импульсные лампы. Эти лампы дают яркие вспышки непрерывного спектра длительностью до тысячной доли секунды, они применяются для съемок объектов, движущихся с большой скоростью. Ксенон применяют в газосветных лампах высокого и сверхвысокого давления. Свет ламп близок к белому, поэтому их используют в случаях, когда передача цвета имеет важную роль: в театрах для освещения сцены, при киносъемках, при получении красителей в текстильной промышленности. Кроме того, их при меняют для освещения больших площадей, железнодорожных узлов, спортивных сооружений, горных выработок. Ксеноном заполняют и обычные лампы накаливания, что повышает срок их службы и сокращает потребление энергии.
Заключение.
В заключении хотелось бы сказать, что в настоящее время в производстве инертным газам уделено мало внимания. В будущем хотелось, что бы этот пробел был исправлен.
Список литературы.
А.М. Смолеговскогий «Химия энциклопедия химических элементов»,
Н.А. Глинка «Общая химия»,
И.В. Петрянов «Вещество и энергия».
infourok.ru
Британская Международная Школа
Реферат по химии
“Инертные газы и их свойства”
Ученика 9б класса
Соколенко Алексея
Руководитель:
Чернышева И.В.
Москва
2003
Содержание:
I Вступление……………………………………………………………………………2
1.1 Инертные газы –элементы VIIIА группы……………………………………...2
1.2 Аргон на земле и вовселенной………………………………………………….5
II История открытия газов…………………………………………………..................7
2.1 Аргон………………………………………………………………………………7
2.2 Гелий…………………..…………………………………………………………..8
2.3Криптон………………………………………………………..…………………..9
2.4 Неон……………………………………………………………..…………………9
2.5Ксенон……………………………………………………………….…………….9
2.6Радон………………………………………………………………..…………….10
III Свойства инертных газов и их соединений…………………………………….....10
3.1 Физические свойства инертных газов………………………………………….10
3.2 Химическиесвойства инертных газов……………………………………….....11
3.3Получение Аргона…………………………………………………...…………..14
3.4 Физиологические свойства инертных газов……………………………………15
IV Применение инертных газов…………………………………………………..…..16
Списокиспользованной литературы………………………………………………....18
I Вступление.
Везде и по всюду нас окружает атмосферный воздух. Изчего он состоит? Ответ не составляет труда: из 78,08 процента азота, 20,9процента кислорода, 0,03 процента углекислого газа, 0,00005 процента водорода,около 0,94 процента приходится на долю так называемых инертных газов. Последниебыли открыты всего лишь в конце прошлого столетия.
Радон образуется при радиоактивном распаде радия и вничтожных количествах встречается в содержащих уран материалах, а также внекоторых природных водах. Гелий являющийся продуктом радиоактивногоα-распада элементов, иногда в заметном количества содержится в природномгазе и газе, выделяющемся из нефтяных скважин. В огромных количествах этотэлемент содержится на Солнце и на других звездах. Это второй элемент пораспространенности во вселенной (после водорода).
1.1 Инертные газы –элементы 8А группы.
Конфигурация внешнего электронного слояатомов гелия 1s2, остальных элементов подгруппы VIII – ns2np6.
/>
/>/>
1.2 Аргон на земле и вовселенной.На Земле аргона намного больше, чем всех прочих элементов его группы,вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше,чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3в литре морской и до 0,55 см3 в литре пресной воды. Любопытно,что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферномвоздухе. Это потому, что в воде аргон растворим лучше, чем азот… Главное«хранилище» земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще большедоля этого изотопа в аргоне земной коры. Между тем у подавляющего большинствалегких элементов картина обратная – преобладают легкие изотопы. Причина этойаномалии обнаружена в 1943 г. В земной коре находится мощный источникаргона-40 – радиоактивный изотоп калия 40К. Этого изотопа на первыйвзгляд в недрах немного – всего 0,0119% от общего содержания калия. Однакоабсолютное количество калия-40 велико, поскольку калий – один из самыхраспространенных на нашей планете элементов. В каждой тонне изверженных пород3,1 г калия-40. Радиоактивный распад атомных ядер калия-40 идетодновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду ипревращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 неизлучают, а, наоборот, захватывают по одному электрону с ближайшей к ядруК-орбиты («К-захват»). Захваченный электрон соединяется с протоном – образуетсяновый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшаетсяна единицу, а масса ядра остается практически неизменной. Так калийпревращается в аргон. Период полураспада 40К достаточно велик –1,3 млрд лет. Поэтому процесс образования 40Аr в недрахЗемли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайномедленно, но неуклонно будет возрастать содержание аргона в земной коре иатмосфере, куда аргон «выдыхается» литосферой в результате вулканическихпроцессов, выветривания и перекристаллизации горных пород, а также воднымиисточниками. Правда, за время существования Земли запас радиоактивного калияосновательно истощился – он стал в 10 раз меньше (если возраст Земли считатьравным 4,5 млрд лет.). Соотношение изотопов 40Аr: 40Ки 40Ar: 36Аr в горных породах легло в основу аргонногометода определения абсолютного возраста минералов. Очевидно, чем больше этиотношения, тем древнее порода. Аргонный метод считается наиболее надежным дляопределения возраста изверженных пород и большинства калийных минералов. Заразработку этого метода профессор Э.К. Герлинг в 1963 году удостоенЛенинской премии. Итак, весь или почти весь аргон-40 произошел на Земле откалия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне. Этим факторомобъясняется, кстати, одна из аномалий периодической системы. Вопрекипервоначальному принципу ее построения – принципу атомных весов – аргонпоставлен в таблице впереди калия. Если бы в аргоне, как и в соседнихэлементах, преобладали легкие изотопы (как это, по-видимому, имеет место вкосмосе), то атомный вес аргона был бы на две-три единицыменьше... Теперь о легких изотопах. Откудаберутся 36Аr и 38Аr? Не исключено, что какая-то частьэтих атомов реликтового происхождения, т.е. часть легкого аргона пришла вземную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Нобольшая часть легких изотопов аргона родилась на Земле в результате ядерныхпроцессов. Вероятно, еще не все такие процессы обнаружены. Скорее всегонекоторые из них давно прекратились, так как исчерпались короткоживущие атомы-«родители»,но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 иаргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановыхминералах) серы-33 и хлора-35:
3617Cl β–→ 3618Ar + 0–1e + ν.
3316S + 42He → 3618Ar + 10n.
3517Cl + 42He → 3818Ar + 10n + 0+1e.
В материи Вселенной аргон представлен еще обильнее, чем на нашейпланете. Особенно много его в веществе горячих звезд и планетарных туманностей.Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов,весьма распространенных на Земле. В космическом аргоне главенствуют изотопы 36Аrи 38Аr, аргона-40 во Вселенной очень мало. На это указываетмасс-спектральный анализ аргона из метеоритов. В том же убеждают подсчетыраспространенности калия. Оказывается, в космосе калия примерно в 50 тыс. разменьше, чем аргона, в то время как на Земле их соотношение явно в пользу калия– 660 : 1. А раз мало калия, то откуда же взяться аргону-40?!
II Историяоткрытия инертных газов.
К концу 18 века были обнаружены многие из известныхгазов. К ним относились: кислород – газ, поддерживающий горение; углекислый газ– его можно было легко обнаружить по весьма примечательному свойству: он мутилизвестковую воду; и, наконец, азот, горение не поддерживающий и на известковуюводу не действующий. Таков был представлении химиков того времени составатмосферы, и некто, кроме известного английского ученого лорда Кавендиша, несомневался в этом.
И у него был повод для сомнения.
В 1785 году он проделал довольно простой опыт. Преждевсего он удалил из воздуха углекислый газ. На оставшуюся смесь азота икислорода он подействовал электрической искрой. Азот, реагируя с кислородом,давал бурные пары оксидов азота, которые, растворяясь в воде, превращались вазотную кислоту. Эта операция повторялась многократно.
Однако немного менее одной сотой части объемавоздуха, взятого для опыта, оставалась неизменной. К сожалению, этот эпизод былзабыт не многие годы.
2.1 Аргон.
В1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухекакой-то новый газ, необыкновенно устойчивый химически. На долю этого газаприходилась примерно одна сто двадцатая часть объема воздуха. Но что это загаз, Кавендишу выяснить не удалось. Об этом опыте вспомнили 107 лет спустя,когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив,что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдядостоверного объяснения аномалии, Рэлей через журнал «Nature» обратился кколлегам-естествоиспытателям с предложением вместе подумать и поработать надразгадкой ее причин… Спустя два года Рэлей и У. Рамзай установили, что вазоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чемазот, и крайне инертного химически. Когда они выступили с публичным сообщениемо своем открытии, это произвело ошеломляющее впечатление. Многим казалосьневероятным, чтобы несколько поколений ученых, выполнивших тысячи анализоввоздуха, проглядели его составную часть, да еще такую заметную – почти процент!Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил своеимя, которое в переводе с греческого значит «недеятельный». Его предложилпредседательствовавший на собрании доктор Медан. Между тем нет ничегоудивительного в том, что аргон так долго ускользал от ученых. Ведь в природе онсебя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией:говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегкораспознать богача, если он не тратит своих денег… Скепсис ученых был быстроразвеян экспериментальной проверкой и установлением физических констант аргона.Но не обошлось без моральных издержек: расстроенный нападками коллег (главнымобразом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточилсвои интересы на физических проблемах. Большой ученый, он и в физике достигвыдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии.Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получалНобелевскую премию за открытие и исследование благородных газов, в том числе иаргона.
2.2 Гелий.
/>
В феврале 1895 года Размай получил письмоот лондонского метеоролога Маерса, где тот сообщал об опытах американскогогеолога Гиллебранда, который кипятил в серной кислоте редкиеминералы урана и наблюдал выделение газа, по свойствам своим напоминающий азот.Чем больше урана содержится в минералах, тем больше выделялось газа. Гиллебрандусловно предположил, что этот газ является азотом. “А может быть это аргон?” –спрашивал автор письма.
Вскоре Размай послал своих помощников влондонские химические магазины за урановым минералом клевеитом. Было куплено 30грамм клевеита, и в тот же день Размай со своим помощником Метьюзом извлекнесколько кубических сантиметров газа. Размай подверг этот газспектраскопическому исследованию. Он увидел яркую желтую линию, очень похожуюна линию натрия и в тоже время отличающуюся от нее по своему положению вспектре. Размай был на столько удивлен, что разобрал спектроскоп, почистил его,но при новом опыте снова обнаружил яркую желтую линию, не совпадавшую с линейнатрия. Размай просмотрел спектры всех элементов. Наконец он вспомнил озагадочной линии в спектре солнечной короны.
/>
В 1868 году во время солнечного затменияфранцузский исследователь Жансен и англичанин Локьер обнаружили в спектресолнечных протуберанцев яркую желтую линию, которой не оказалось в земномспектре источников света. В 1871 году Локьер высказал предположение, не принадлежитли эта линия спектру неизвестного на Земле вещества.
Он назвал этот гипотетический элемент гелием, то есть“солнечным”. Но на земле он обнаружен не был. Физики и химики им незаинтересовались: на Солнце, мол, совершенно другие условия, там и водородсойдет за гелий.
Так неужели в его руках этот самый гелий? Размай почтиуверен в этом, но он хочет услышать подтверждение от известного спектроскопистаКрукса. Размай посылает ему газ на исследование и пишет о том, что нашелкакой-то новый газ, названый им криптоном, по-гречески означает “скрытый”.Телеграмма от Крукса гласила: “Криптон есть гелий”.
2.3 Криптон.
/>
К 1895 году открыли два инертных газа.Было ясно, что между ними должен находится еще один газ, свойства которогоРазмай описал по примеру Менделеева. Лекок де Буабодран предсказал даже веснеоткрытого газа – 20,0945.
И неизвестно, обнаружил бы ученый новыеинертные газы, если бы во время его поисков Линде в Генмании и Хемпсон в Англиине взяли одновременно патент на машину, сжижжающую воздух.
Эта машина словно была специальносоздана для обнаружения инертных газов. Принцип ее действия основан наизвестном физическом явлении, если сжать воздуж, в затем дать ему быстрорасшириться, он охлаждается. Охлажденным воздухом охлаждают новую порциювоздуха, поступающую в машину, и т.д., пока воздух не превратится в жидкость.
Испарив почти весь азот и кислород, Размай оставшийсяжидкий воздух поместил в газометр. Он думал найти в нем гелий, так как считал,что этот газ испаряется медленнее, чем кислород и азот. Он очистил газ вгазометре от примеси кислорода и азота и снял спектр, в котором снял две ранеене известных линии.
Далее Размай поместил 15 литров аргона в баллоне вжидкий воздух. Для того чтобы найти инертный газ, по расчетам, более легкий,чем аргон и криптон, Размай собрал первые порции испарения аргона. Получилсяновый спектр с ярко-красными линиями. Размай назвал выделенный газ неоном, чтопо-гречески означает “новый”.
2.4 Неон.
Далее Размай поместил 15 литров аргона в баллоне вжидкий воздух. Для того чтобы найти инертный газ, по расчетам, более легкий,чем аргон и криптон, Размай собрал первые порции испарения аргона. Получилсяновый спектр с ярко-красными линиями. Размай назвал новый газ неоном, что по-гречески означает “новый”.
2.5 Ксенон.
В 1888 году помощник Размая Треверс построил машинуспособную давать температуру -2530С. С помощью ее был получентвердый аргон. Были отогнаны все газы, кроме криптона. И уже в неочищенномкриптоне был найден ксенон (“чужой”). Для того чтобы получить 300 кубическихсантиметров ксенона, ученым пришлось в течении 2 лет переработать 77,5 миллионалитров атмосферного воздуха.
2.6 Радон.
Уже было сказано, что гелий присутствует в урановыхминералах. Чем больше в клевеите урана, тем больше гелия. Размай долго пыталсянайти взаимосвязь между содержанием урана и гелия, но это ему не удалось.Разгадка пришла с другой стороны; она была связана с открытием радиоактивности.
Обнаружили, что радий выделяет газообразное вещество,названное эманацией. 1 грамм радия в сутки выделял один кубический миллиметрэманации. В 1903 году Размай и известный физик Содди занялись изучениемэманации. Они имели в своем распоряжении всего 50 миллиграммов бромистогорадия; одновременно у них было не более 0.1 кубического миллиметра эманации.
Для выполнения работ Размай построилсверхчувствительные весы, показывающие четыре миллиардные доли грамма. Вскореисследователи выяснили, что эманация является последним представителемсемейства инертных газов .
Имдолго не удавалось рассмотреть спектр эманации. Как-то, оставив трубку сэманацией на несколько дней, они поставили ее в спектроскоп и были удивлены,увидев в спектроскопе известные линии гелия.
Этотфакт подтвердил предположение Резерфорда и Содди о том, что радиоактивноепревращение связано с превращением атомов. Радий, самопроизвольно распадался,превращался в эманацию и выделял ядро атома гелия. Один элемент превращался вдругой.
Ученым стало понятно, почему гелий обнаруживается вурановых материалах; он один из продуктов распада урана. В 1923 году по решениюМеждународного комитета по химическим элементам эманация была переименована врадон.
III Свойства инертных газов и их соединений.
3.1Физические свойства инертных газов.
Благородные газы –бесцветные одноатомные газ без цвета и запаха.
Инертные газы обладают более высокойэлектропроводностью по сравнению с другими газами и при прохождении через нихтока ярко светятся: гелий ярко-жёлтым светом, потому что в его сравнительнопростом спектре двойная жёлтая линия преобладает над всеми другими; неоногненно красным светом, так как самые яркие его линии лежат в красной частиспектра.
Насыщенный характер атомных молекул инертных газовсказывается и в том, что инертные газы имеют более низкие точки сжижения изамерзания, чем другие газы с тем же молекулярным весом. Из подгруппы тяжелыхинертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостьюстановится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормальногодавления).
/>
В отличие от гелия и неона, он довольно хорошоадсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3в 100 г воды при 20°C). Еще лучше растворяется аргон во многихорганических жидкостях. Зато он практически нерастворим в металлах и недиффундирует сквозь них.
3.2 Химические свойства инертных газов.
Долгое время не находили условий, при которыхблагородные газы могли бы вступать в химическое взаимодействие. Они не образовывалиистинных химических соединений. Иными словами их валентность равнялась нулю. Наэтом основании было решено новую группу химических элементов считать нулевой.Малая химическая активность благородных газов объясняется жёсткойвосьмиэлектронной конфигурацией внешнего электронного слоя. Поляризуемостьатомов растёт с увеличением числа электронных слоёв. Следовательно, она должнаувеличиваться при переходе от гелия к радону. В этом же направлении должнаувеличиваться и реакционная способность благородных газов.
/>
/>
/>
Так, уже в 1924 году высказывалась идея, что некоторыесоединения тяжелых инертных газов (в частности, фториды и хлориды ксенона)термодинамически вполне стабильны и могут существовать при обычных условиях.Через девять лет эту идею поддержали и развили известные теоретики — Полинг иОддо. Изучение электронной структуры оболочек криптона и ксенона с позицийквантовой механики привело к заключению, что эти газы в состоянии образовыватьустойчивые соединения с фтором. Нашлись и экспериментаторы, решившие проверитьгипотезу, но шло время, ставились опыты, а фторид ксенона не получался. Врезультате почти все работы в этой области были прекращены, и мнение обабсолютной инертности благородных газов утвердилось окончательно.
Однако в 1961 году Бартлетт, сотрудник одного изуниверситетов Канады, изучая свойства гексафторида платины, соединения болееактивного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чему кислорода (12, 13 и 12, 20 эв соответственно). Между тем кислород образовывалс гексафторидом платины соединение состава O2PtF6…Бартлетт ставит опыт и при комнатной температуре из газообразного гексафторидаплатины и газообразного ксенона получает твердое оранжево — желтое вещество —гексафторплатинат ксенона XePtF6, поведение которого ничем неотличается от поведения обычных химических соединений. При нагревании в вакуумеXePtF6 возгоняется без разложения, в воде гидролизуется, выделяяксенон:
2XePtF6 + 6Н2О = 2Хе + О2+ 2PtО2 + 12HF
Последующие работы Бартлетта позволили установить, чтоксенон в зависимости от условий реакции образует два соединения с гексафторидомплатины: XePtF6 и Xe (PtF6) 2; при гидролизеих получаются одни и те же конечные продукты. Убедившись, что ксенондействительно вступил в реакцию с гексафторидом платины, Бартлетт выступил сдокладом и в 1962 году опубликовал в журнале “Proceedings of the ChemicalSociety” статью, посвященную сделанному им открытию. Статья вызвала огромныйинтерес, хотя многие химики отнеслись к ней с нескрываемым недоверием. Но ужечерез три недели эксперимент Бартлетта повторила группа американскихисследователей во главе с Черником в Аргоннской национальной лаборатории. Крометого, они впервые синтезировали аналогичные соединения ксенона с гексафторидамирутения, родия и плутония. Так были открыты первые пять соединений ксенона:XePtF6, Xe (PtF6)2, XeRuF6, XeRhF6,XePuF6 — миф об абсолютной инертности благородных газов развеян изаложено начало химии ксенона.Настало время проверить правильностьгипотезы о возможности прямого взаимодействия ксенона с фтором.
Смесь газов (1 часть ксенона и 5 частей фтора)поместили в никелевый (поскольку никель наиболее устойчив к действию фтора)сосуд и нагрели под сравнительно небольшим давлением. Через час сосуд быстроохладили, а оставшийся в нем газ откачали и проанализировали. Это был фтор.Весь ксенон прореагировал! Вскрыли сосуд и обнаружили в нем бесцветныекристаллы XeF4. Тетрафторид ксенона оказался вполне устойчивымсоединением, молекула его имеет форму квадрата с ионами фтора по углам иксеноном в центре. Тетрафторид ксенона фторирует ртуть:
ХеF4 + 2Hg = Хe + 2HgF2
/>
Кристаллы XeF4
Платина тоже фторируется этим веществом, но толькорастворенным во фтористом водороде.
Интересно в химии ксенона то, что, меняя условияреакции, можно получить не только XeF4, но и другие фториды—XeF2,XeF6.
Советские химики В. М. Хуторецкий и В. А. Шпанский показали, что длясинтеза дифторида ксенона совсем не обязательны жесткие условия. Попредложенному ими способу смесь ксенона и фтора (в молекулярном отношении 1:1)подается в сосуд из никеля или нержавеющей стали, и при повышении давления до35 атм начинается самопроизвольная реакция.
XeF2 — единственный фторид ксенона, которыйможно получить, не пользуясь элементарным фтором. Он образуется при действииэлектрического разряда на смесь ксенона и четырехфтористого углерода. Возможен,конечно, и прямой синтез. Очень чистый ХеF2 получается, если смеськсенона и фтора облучить ультрафиолетом. Растворимость дифторида в воденевелика, однако раствор его — сильнейший окислитель. Постепенно онсаморазлагается на ксенон, кислород и фтористый водород; особенно быстроразложение идет в щелочной среде. Дифторид имеет резкий специфический запах.Большой теоретический интерес представляет метод синтеза дифторида ксенона,основанный на воздействии на смесь газов ультрафиолетового излучения (длинаволн порядка 2500—3500 А). Излучение вызывает расщепление молекул фтора насвободные атомы. В этом и заключается причина образования дифторида: атомарныйфтор необычайно активен. Для получения XeF6 требуются более жесткиеусловия: 700° С и 200 атм. В таких условиях в смеси ксенона и фтора (отношениеот 1:4 до 1:20) практически весь ксенон превращается в XeF6.Гексафторид ксенона чрезвычайно активен и разлагается со взрывом. Он легкореагируете фторидами щелочных металлов (кроме LiF):
XeF6 + RbF =RbXeF7,
но при 50° С эта соль разлагается:
2RbXeF7= XeF6 + Rb2XeF8
Сообщалось также о синтезе высшего фторида XeF8,устойчивого лишь при температуре ниже минус 196° C.
Синтез первых соединений ксенона поставил передхимиками вопрос о месте инертных газов в периодической системе. Преждеблагородные газы были выделены в отдельную нулевую группу, что вполне отвечалопредставлению об их валентности. Но, когда ксенон вступил в химическую реакцию,когда стал известен его высший фторид, в котором валентность ксенона равнавосьми (а это вполне согласуется со строением его электронной оболочки),инертные газы решили перенести в VIII группу. Нулевая группа пересталасуществовать.
Заставитьксенон вступить в реакцию без участия фтора (или некоторых его соединений) покане удалось. Все известные ныне соединения ксенона получены из его фторидов. Этивещества обладают повышенной реакционной способностью. Лучше всего изученовзаимодействие фторидов ксенона с водой. Гидролиз ХеF4 в кислойсреде ведет к образованию окиси ксенона ХеО3 — бесцветных,расплывающихся на воздухе кристаллов. Молекула ХеО3 имеет структуруприплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединениекрайне неустойчиво; при его разложении мощность взрыва приближается к мощностивзрыва тротила. Достаточно несколько сотен миллиграммов ХеО3, чтобыэксикатор разнесло в куски. Не исключено, что со временем трехокись ксенонабудут использовать как взрывчатое вещество дробящего действия. Такая взрывчаткабыла бы очень удобна, потому что все продукты взрывной реакции — газы. Пока жеиспользовать для этой цели трехокись ксенона слишком дорого — ведь ксенона ватмосфере меньше, чем золота в морской воде, и процесс его выделения слишкомтрудоемок. Напомним, что для получения 1 м3 ксенона нужнопереработать 11 млн. м3 воздуха. Соответствующая трехокисинеустойчивая кислота шестивалентного ксенона H6XeO6образуется в результате гидролиза XeF6 при 0° С:
XeF6 + 6h3О = 6HF + H6XeO6
Если к продуктам этой реакции быстро добавить Ва (ОН)2,выпадает белый аморфный осадок Ва3ХеО6. При 125° С онразлагается на окись бария, ксенон и кислород. Получены аналогичныесоли—ксенонаты натрия и калия. При действии озона на раствор ХеО3 водномолярном едком натре образуется соль высшей кислоты ксенона Na4ХеО6.Перксенонат натрия может быть выделен в виде бесцветного кристаллогидратаNa4XeO6 · 6Н2О. К образованию перксенонатов приводит и гидролиз XeF6в гидроокисях натрия и калия. Если твердую соль Na4XeO6обработать раствором нитрата свинца, серебра или уранила, то получаютсясоответствующие перксенонаты: PbXeO6 и (UO2) 2XeO6желтого цвета и Ag4XeO6 — черного. Аналогичные соли даюткалий, литий, цезий, кальций.
Окисел, соответствующий высшей кислоте ксенона,получают взаимодействием Na4XeO6 с безводной охлажденнойсерной кислотой. Это четырехокись ксенона ХеO4. В ней, как и воктафториде, валентность ксенона равна восьми. Твердая четырехокись притемпературе выше 0° С разлагается на ксенон и кислород, а газообразная (прикомнатной температуре) — на трехокись ксенона, ксенон и кислород. Молекула ХеO4имеет форму тетраэдра с атомом ксенона в центре. В зависимости от условийгидролиз гексафторида ксенона может идти двумя путями; в одном случаеполучается тетраоксифторид XeOF4, другом — диоксифторид XeO2F2.Прямой синтез из элементов приводит к образованию оксифторида ХеОF2.Все это бесцветные твердые вещества, устойчивые в обычных условиях.
Очень интересна изученная недавно реакция дифторида ксенонас безводной НС1O4. В результате этой реакции получено новоесоединение ксенона ХеСlO4 — чрезвычайно мощный окислитель, вероятно,самый сильный из всех перхлоратов.
Синтезированы также соединения ксенона, не содержащиекислорода. Преимущественно это двойные соли, продукты взаимодействия фторидовксенона с фторидами сурьмы, мышьяка, бора, тантала: XeF2 · SbF5,ХеF6 · AsF3, ХеF6 · ВF3 и ХеF2· 2ТаF5. И наконец, получены вещества типа XeSbF6,устойчивые при комнатной температуре, и XeSiF6 — нестойкий комплекс.
В распоряжении химиков имеются весьма незначительныеколичества радона, тем не мене удалось установить, что он также взаимодействуетс фтором, образуя нелетучие фториды. Для криптона выделены и изучены дифторид KrF2и тетрафторид KrF4 посвойствам, напоминающим соединения ксенона.
3.3 Получение Аргона.
Земная атмосфера содержит 66 · 1013 т аргона.Этот источник аргона неисчерпаем, тем более что практически весь аргон рано илипоздно возвращается в атмосферу, поскольку при использовании он не претерпеваетникаких физических или химических изменений. Исключение составляют весьманезначительные количества изотопов аргона, расходуемые на получение в ядерныхреакциях новых элементов и изотопов. Получают аргон как побочный продукт приразделении воздуха на кислород и азот. Обычно используют воздухоразделительныеаппараты двукратной ректификации, состоящие из нижней колонны высокого давления(предварительное разделение), верхней колонны низкого давления и промежуточногоконденсатора-испарителя. В конечном счете азот отводится сверху, а кислород –из пространства над конденсатором. Летучесть аргона больше, чем кислорода, номеньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейсяпримерно на трети высоты верхней колонны, и отводят в специальную колонну.Состав аргонной фракции: 10...12% аргона, до 0,5% азота, остальное – кислород.В «аргонной» колонне, присоединенной к основному аппарату, получают аргон спримесью 3...10% кислорода и 3...5% азота. Дальше следует очистка «сырого»аргона от кислорода (химическим путем или адсорбцией) и от азота(ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-нойчистоты. Аргон извлекают также из отходов аммиачного производства – из азота,оставшегося после того, как большую его часть связали водородом. Аргон хранят итранспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленойполосой и зеленой надписью. Давление в них 150 атм. Более экономичнаперевозка сжиженного аргона, для чего используют сосуды Дюара и специальныецистерны. Искусственные радиоизотопы аргона получены при облучении некоторыхстабильных и радиоактивных изотопов (37Cl, 36Аr, 40Аr,40Са) протонами и дейтонами, а также при облучении нейтронамипродуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37Аrи 41Аr используются как радиоактивные индикаторы: первый – вмедицине и фармакологии, второй – при исследовании газовых потоков,эффективности спетом вентиляции и в разнообразных научных исследованиях. Но,конечно, не эти применения аргона самые важные.
3.4 Физиологическое действие инертных газов.
Естественно было ожидать, что столь химически инертныевещества, как инертные газы, не должны влиять и на живые организмы. Но это нетак. Вдыхание высших инертных газов (конечно в смеси с кислородом) приводитчеловека в состояние, сходное с опьянением алкоголем. Наркотическое действиеинертных газов обуславливается растворением в нервных тканях. Чем выше атомныйвес инертного газа, тем больше его растворимость и тем сильнее егонаркотическое действие.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69%Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явлениянаркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем жедавлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина –в неполярности молекул аргона, повышенное же давление усиливает растворимостьаргона в нервных тканях. Биологи нашли, что аргон благоприятствует ростурастений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и рживыкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящейиз 98% аргона и только 2% кислорода.
IV Применениеинертных газов.
Гелий является важным источником низких температур.При температуре жидкого гелия тепловое движение атомов и свободных электронов втвердых телах практически отсутствует, что позволяет изучать многие новыеявления, например сверхпроводимость в твердом состоянии.
Газообразный гелий используют как легкий газ длянаполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполненияоболочки дирижабля.
/>/>
Так как гелий хуже растворим в крови, чем азот,большие количества гелия применяют в дыхательных смесях для работ поддавлением, например при морских погружениях, при создании подводных тоннелей исооружений. При использовании гелия декомпрессия (выделение растворенного газаиз крови) у водолаза протекает менее болезненно, менее вероятна кессоннаяболезнь, исключается такое явление, как азотный наркоз, – постоянный и опасныйспутник работы водолаза. Смеси He–O2 применяют, благодаря их низкойвязкости, для снятия приступов астмы и при различных заболеваниях дыхательныхпутей.
Гелий используют как инертную среду для дуговойсварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, дляохлаждения ядерных реакторов.
Другие применения гелия – для газовой смазкиподшипников, в счетчиках нейтронов (гелий-3), газовых термометрах,рентгеновской спектроскопии, для хранения пищи, в переключателях высокогонапряжения. В смеси с другими благородными газами гелий используется в наружнойнеоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждениямагнитных сверхпроводников, ускорителей частиц и других устройств. Необычнымприменением гелия в качестве хладагента является процесс непрерывного смешения 3Heи 4He для создания и поддержания температур ниже 0,005 K
Области применения ксенона разнообразны и порой неожиданны. Человекиспользует и его инертность и его чудесную способность вступать в реакцию софтором. В светотехнике признание получили ксеноновые лампы высокого давления. Втаких лампах светит дуговой разряд в ксеноне, находящемся под давлением внесколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу послевключения, он ярок и имеет непрерывный спектр — от ультрафиолетового до ближнейобласти инфракрасного. Ксеноном пользуются и медики — при рентгеноскопическихобследованиях головного мозга. Как и баритовая каша, применяющаяся припросвечивании кишечника, ксенон сильно поглощает рентгеновское излучение ипомогает найти места поражения. При этом он совершенно безвреден. Активныйизотоп элемента № 54, ксенон — 133, используют при исследовании функциональнойдеятельности легких и сердца.
Продувкой аргона через жидкую сталь из нее удаляют газовые включения.Это улучшает свойства металла.
/>
Все шире применяется дуговая электросварка в среде аргона. В аргоннойструе можно сваривать тонкостенные изделия и металлы, которые прежде считалисьтрудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга варгонной атмосфере внесла переворот в технику резки металлов. Процесс намногоускорился, появилась возможность резать толстые листы самых тугоплавкихметаллов. Продуваемый вдоль столба дуги аргон (в смеси с водородом)предохраняет кромки разреза и вольфрамовый электрод от образования окисных,нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малойповерхности, отчего температура в зоне резки достигает 4000—6000° С. К тому жеэта газовая струя выдувает продукты резки. При сварке в аргонной струе нетнадобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва отшлака и остатков флюса.
Неон и аргон используются, как наполнители в неоновых лампах и лампахдневного свата Криптоном наполняют обычные лампы с целью уменьшения испарения иувеличения яркости свечения вольфрамовой нити. Ксеноном наполняют кварцевыелампы высокого давления, являющиеся наиболее мощными источниками света. Гелий иаргон используется в газовых лазерах.
/>
Список использованной литературы
1. Петров М.М., Михилев Л.А., Кукушкин Ю.Н.“Неорганическая химия”
2. Гузей Л.С. Лекции по общей химии”
3. Ахметов Н.С. “Общая и неорганическая химия”
4. Некрасов Б.В. “Учебник общей химии”
5. Глинка Н.Л. “Общая химия
6. Ходаков Ю.В. “Общая и неорганическая химия”
www.ronl.ru
Британская Международная Школа
Реферат по химии
“Инертные газы и их свойства”
Ученика 9б класса
Соколенко Алексея
Руководитель:
Чернышева И.В.
Москва
2003
Содержание:
IВступление……………………………………………………………………………2
1.1 Инертные газы – элементы VIIIА группы……………………………………...2
1.2 Аргон на земле и во вселенной………………………………………………….5
IIИстория открытия газов…………………………………………………..................7
2.1 Аргон………………………………………………………………………………7
2.2 Гелий…………………..…………………………………………………………..8
2.3 Криптон………………………………………………………..…………………..9
2.4 Неон……………………………………………………………..…………………9
2.5 Ксенон……………………………………………………………….…………….9
2.6 Радон………………………………………………………………..…………….10
IIIСвойства инертных газов и их соединений…………………………………….....10
3.1 Физические свойства инертных газов………………………………………….10
3.2 Химические свойства инертных газов……………………………………….....11
3.3 Получение Аргона…………………………………………………...…………..14
3.4 Физиологические свойства инертных газов……………………………………15
IVПрименение инертных газов…………………………………………………..…..16
Список использованной литературы………………………………………………....18
IВступление.
Везде и по всюду нас окружает атмосферный воздух. Из чего он состоит? Ответ не составляет труда: из 78,08 процента азота, 20,9 процента кислорода, 0,03 процента углекислого газа, 0,00005 процента водорода, около 0,94 процента приходится на долю так называемых инертных газов. Последние были открыты всего лишь в конце прошлого столетия.
Радон образуется при радиоактивном распаде радия и в ничтожных количествах встречается в содержащих уран материалах, а также в некоторых природных водах. Гелий являющийся продуктом радиоактивного α-распада элементов, иногда в заметном количества содержится в природном газе и газе, выделяющемся из нефтяных скважин. В огромных количествах этот элемент содержится на Солнце и на других звездах. Это второй элемент по распространенности во вселенной (после водорода).
1.1 Инертные газы – элементы 8А группы.
Конфигурация внешнего электронного слоя атомов гелия 1s 2, остальных элементов подгруппы VIII – ns 2np 6.



1.2 Аргон на земле и во вселенной.
На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3 в литре морской и до 0,55 см3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот… Главное «хранилище» земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы. Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40 К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40. Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты («К-захват»). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон. Период полураспада 40 К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40 Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон «выдыхается» литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками. Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.). Соотношение изотопов 40 Аr: 40 К и 40 Ar: 36 Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии. Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне. Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше… Теперь о легких изотопах. Откуда берутся 36 Аr и 38 Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов. Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-«родители», но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35:
3617 Cl β– → 3618 Ar + 0–1 e + ν.
3316 S + 42 He → 3618 Ar + 10n .
3517 Cl + 42 He → 3818 Ar + 10n + 0+1e .
В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле. В космическом аргоне главенствуют изотопы 36 Аr и 38 Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660: 1. А раз мало калия, то откуда же взяться аргону-40?!
IIИстория открытия инертных газов.
К концу 18 века были обнаружены многие из известных газов. К ним относились: кислород – газ, поддерживающий горение; углекислый газ – его можно было легко обнаружить по весьма примечательному свойству: он мутил известковую воду; и, наконец, азот, горение не поддерживающий и на известковую воду не действующий. Таков был представлении химиков того времени состав атмосферы, и некто, кроме известного английского ученого лорда Кавендиша, не сомневался в этом.
И у него был повод для сомнения.
В 1785 году он проделал довольно простой опыт. Прежде всего он удалил из воздуха углекислый газ. На оставшуюся смесь азота и кислорода он подействовал электрической искрой. Азот, реагируя с кислородом, давал бурные пары оксидов азота, которые, растворяясь в воде, превращались в азотную кислоту. Эта операция повторялась многократно.
Однако немного менее одной сотой части объема воздуха, взятого для опыта, оставалась неизменной. К сожалению, этот эпизод был забыт не многие годы.
2.1 Аргон.
В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось. Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин… Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент! Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит «недеятельный». Его предложил председательствовавший на собрании доктор Медан. Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег… Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона.
2.2 Гелий.
 |
В феврале 1895 года Размай получил письмо от лондонского метеоролога Маерса, где тот сообщал об опытах американского геолога Гиллебранда, который кипятил в серной кислоте редкие минералы урана и наблюдал выделение газа, по свойствам своим напоминающий азот. Чем больше урана содержится в минералах, тем больше выделялось газа. Гиллебранд условно предположил, что этот газ является азотом. “А может быть это аргон?” – спрашивал автор письма.
Вскоре Размай послал своих помощников в лондонские химические магазины за урановым минералом клевеитом. Было куплено 30 грамм клевеита, и в тот же день Размай со своим помощником Метьюзом извлек несколько кубических сантиметров газа. Размай подверг этот газ спектраскопическому исследованию. Он увидел яркую желтую линию, очень похожую на линию натрия и в тоже время отличающуюся от нее по своему положению в спектре. Размай был на столько удивлен, что разобрал спектроскоп, почистил его, но при новом опыте снова обнаружил яркую желтую линию, не совпадавшую с линей натрия. Размай просмотрел спектры всех элементов. Наконец он вспомнил о загадочной линии в спектре солнечной короны.
 |
В 1868 году во время солнечного затмения французский исследователь Жансен и англичанин Локьер обнаружили в спектре солнечных протуберанцев яркую желтую линию, которой не оказалось в земном спектре источников света. В 1871 году Локьер высказал предположение, не принадлежит ли эта линия спектру неизвестного на Земле вещества.
Он назвал этот гипотетический элемент гелием, то есть “солнечным”. Но на земле он обнаружен не был. Физики и химики им не заинтересовались: на Солнце, мол, совершенно другие условия, там и водород сойдет за гелий.
Так неужели в его руках этот самый гелий? Размай почти уверен в этом, но он хочет услышать подтверждение от известного спектроскописта Крукса. Размай посылает ему газ на исследование и пишет о том, что нашел какой-то новый газ, названый им криптоном, по-гречески означает “скрытый”. Телеграмма от Крукса гласила: “Криптон есть гелий”.
2.3 Криптон.
 |
К 1895 году открыли два инертных газа. Было ясно, что между ними должен находится еще один газ, свойства которого Размай описал по примеру Менделеева. Лекок де Буабодран предсказал даже вес неоткрытого газа – 20,0945.
И неизвестно, обнаружил бы ученый новые инертные газы, если бы во время его поисков Линде в Генмании и Хемпсон в Англии не взяли одновременно патент на машину, сжижжающую воздух.
Эта машина словно была специально создана для обнаружения инертных газов. Принцип ее действия основан на известном физическом явлении, если сжать воздуж, в затем дать ему быстро расшириться, он охлаждается. Охлажденным воздухом охлаждают новую порцию воздуха, поступающую в машину, и т.д., пока воздух не превратится в жидкость.
Испарив почти весь азот и кислород, Размай оставшийся жидкий воздух поместил в газометр. Он думал найти в нем гелий, так как считал, что этот газ испаряется медленнее, чем кислород и азот. Он очистил газ в газометре от примеси кислорода и азота и снял спектр, в котором снял две ранее не известных линии.
Далее Размай поместил 15 литров аргона в баллоне в жидкий воздух. Для того чтобы найти инертный газ, по расчетам, более легкий, чем аргон и криптон, Размай собрал первые порции испарения аргона. Получился новый спектр с ярко-красными линиями. Размай назвал выделенный газ неоном, что по-гречески означает “новый”.
2.4 Неон.
Далее Размай поместил 15 литров аргона в баллоне в жидкий воздух. Для того чтобы найти инертный газ, по расчетам, более легкий, чем аргон и криптон, Размай собрал первые порции испарения аргона. Получился новый спектр с ярко-красными линиями. Размай назвал новый газ неоном, что по-гречески означает “новый”.
2.5 Ксенон.
В 1888 году помощник Размая Треверс построил машину способную давать температуру -2530С. С помощью ее был получен твердый аргон. Были отогнаны все газы, кроме криптона. И уже в неочищенном криптоне был найден ксенон (“чужой”). Для того чтобы получить 300 кубических сантиметров ксенона, ученым пришлось в течении 2 лет переработать 77,5 миллиона литров атмосферного воздуха.
2.6 Радон.
Уже было сказано, что гелий присутствует в урановых минералах. Чем больше в клевеите урана, тем больше гелия. Размай долго пытался найти взаимосвязь между содержанием урана и гелия, но это ему не удалось. Разгадка пришла с другой стороны; она была связана с открытием радиоактивности.
Обнаружили, что радий выделяет газообразное вещество, названное эманацией. 1 грамм радия в сутки выделял один кубический миллиметр эманации. В 1903 году Размай и известный физик Содди занялись изучением эманации. Они имели в своем распоряжении всего 50 миллиграммов бромистого радия; одновременно у них было не более 0.1 кубического миллиметра эманации.
Для выполнения работ Размай построил сверхчувствительные весы, показывающие четыре миллиардные доли грамма. Вскоре исследователи выяснили, что эманация является последним представителем семейства инертных газов .
Им долго не удавалось рассмотреть спектр эманации. Как-то, оставив трубку с эманацией на несколько дней, они поставили ее в спектроскоп и были удивлены, увидев в спектроскопе известные линии гелия.
Этот факт подтвердил предположение Резерфорда и Содди о том, что радиоактивное превращение связано с превращением атомов. Радий, самопроизвольно распадался, превращался в эманацию и выделял ядро атома гелия. Один элемент превращался в другой.
Ученым стало понятно, почему гелий обнаруживается в урановых материалах; он один из продуктов распада урана. В 1923 году по решению Международного комитета по химическим элементам эманация была переименована в радон.
IIIСвойства инертных газов и их соединений.
3.1 Физические свойства инертных газов.
Благородные газы – бесцветные одноатомные газ без цвета и запаха.
Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся: гелий ярко-жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно красным светом, так как самые яркие его линии лежат в красной части спектра.
Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом. Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления).

В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
3.2 Химические свойства инертных газов.
Долгое время не находили условий, при которых благородные газы могли бы вступать в химическое взаимодействие. Они не образовывали истинных химических соединений. Иными словами их валентность равнялась нулю. На этом основании было решено новую группу химических элементов считать нулевой. Малая химическая активность благородных газов объясняется жёсткой восьмиэлектронной конфигурацией внешнего электронного слоя. Поляризуемость атомов растёт с увеличением числа электронных слоёв. Следовательно, она должна увеличиваться при переходе от гелия к радону. В этом же направлении должна увеличиваться и реакционная способность благородных газов.



Так, уже в 1924 году высказывалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики — Полинг и Оддо. Изучение электронной структуры оболочек криптона и ксенона с позиций квантовой механики привело к заключению, что эти газы в состоянии образовывать устойчивые соединения с фтором. Нашлись и экспериментаторы, решившие проверить гипотезу, но шло время, ставились опыты, а фторид ксенона не получался. В результате почти все работы в этой области были прекращены, и мнение об абсолютной инертности благородных газов утвердилось окончательно.
Однако в 1961 году Бартлетт, сотрудник одного из университетов Канады, изучая свойства гексафторида платины, соединения более активного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чем у кислорода (12, 13 и 12, 20 эв соответственно). Между тем кислород образовывал с гексафторидом платины соединение состава O2 PtF6… Бартлетт ставит опыт и при комнатной температуре из газообразного гексафторида платины и газообразного ксенона получает твердое оранжево — желтое вещество — гексафторплатинат ксенона XePtF6, поведение которого ничем не отличается от поведения обычных химических соединений. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XePtF6 + 6Н2 О = 2Хе + О2 + 2PtО2 + 12HF
Последующие работы Бартлетта позволили установить, что ксенон в зависимости от условий реакции образует два соединения с гексафторидом платины: XePtF6 и Xe (PtF6 ) 2; при гидролизе их получаются одни и те же конечные продукты. Убедившись, что ксенон действительно вступил в реакцию с гексафторидом платины, Бартлетт выступил с докладом и в 1962 году опубликовал в журнале “Proceedings of the Chemical Society” статью, посвященную сделанному им открытию. Статья вызвала огромный интерес, хотя многие химики отнеслись к ней с нескрываемым недоверием. Но уже через три недели эксперимент Бартлетта повторила группа американских исследователей во главе с Черником в Аргоннской национальной лаборатории. Кроме того, они впервые синтезировали аналогичные соединения ксенона с гексафторидами рутения, родия и плутония. Так были открыты первые пять соединений ксенона: XePtF6, Xe (PtF6 )2, XeRuF6, XeRhF6, XePuF6 — миф об абсолютной инертности благородных газов развеян и заложено начало химии ксенона.Настало время проверить правильность гипотезы о возможности прямого взаимодействия ксенона с фтором.
Смесь газов (1 часть ксенона и 5 частей фтора) поместили в никелевый (поскольку никель наиболее устойчив к действию фтора) сосуд и нагрели под сравнительно небольшим давлением. Через час сосуд быстро охладили, а оставшийся в нем газ откачали и проанализировали. Это был фтор. Весь ксенон прореагировал! Вскрыли сосуд и обнаружили в нем бесцветные кристаллы XeF4. Тетрафторид ксенона оказался вполне устойчивым соединением, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Тетрафторид ксенона фторирует ртуть:
ХеF4 + 2Hg = Хe + 2HgF2
Кристаллы XeF4 |
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Интересно в химии ксенона то, что, меняя условия реакции, можно получить не только XeF4, но и другие фториды—XeF2, XeF6.
Советские химики В. М. Хуторецкий и В. А. Шпанский показали, что для синтеза дифторида ксенона совсем не обязательны жесткие условия. По предложенному ими способу смесь ксенона и фтора (в молекулярном отношении 1:1) подается в сосуд из никеля или нержавеющей стали, и при повышении давления до 35 атм начинается самопроизвольная реакция.
XeF2 — единственный фторид ксенона, который можно получить, не пользуясь элементарным фтором. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Возможен, конечно, и прямой синтез. Очень чистый ХеF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтористый водород; особенно быстро разложение идет в щелочной среде. Дифторид имеет резкий специфический запах. Большой теоретический интерес представляет метод синтеза дифторида ксенона, основанный на воздействии на смесь газов ультрафиолетового излучения (длина волн порядка 2500—3500 А). Излучение вызывает расщепление молекул фтора на свободные атомы. В этом и заключается причина образования дифторида: атомарный фтор необычайно активен. Для получения XeF6 требуются более жесткие условия: 700° С и 200 атм. В таких условиях в смеси ксенона и фтора (отношение от 1:4 до 1:20) практически весь ксенон превращается в XeF6. Гексафторид ксенона чрезвычайно активен и разлагается со взрывом. Он легко реагируете фторидами щелочных металлов (кроме LiF):
XeF6 + RbF = RbXeF7 ,
но при 50° С эта соль разлагается:
2RbXeF7= XeF6 + Rb2 XeF8
Сообщалось также о синтезе высшего фторида XeF8, устойчивого лишь при температуре ниже минус 196° C.
Синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стал известен его высший фторид, в котором валентность ксенона равна восьми (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов. Эти вещества обладают повышенной реакционной способностью. Лучше всего изучено взаимодействие фторидов ксенона с водой. Гидролиз ХеF4 в кислой среде ведет к образованию окиси ксенона ХеО3 — бесцветных, расплывающихся на воздухе кристаллов. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Достаточно несколько сотен миллиграммов ХеО3, чтобы эксикатор разнесло в куски. Не исключено, что со временем трехокись ксенона будут использовать как взрывчатое вещество дробящего действия. Такая взрывчатка была бы очень удобна, потому что все продукты взрывной реакции — газы. Пока же использовать для этой цели трехокись ксенона слишком дорого — ведь ксенона в атмосфере меньше, чем золота в морской воде, и процесс его выделения слишком трудоемок. Напомним, что для получения 1 м3 ксенона нужно переработать 11 млн. м3 воздуха. Соответствующая трехокиси неустойчивая кислота шестивалентного ксенона H6 XeO6 образуется в результате гидролиза XeF6 при 0° С:
XeF6 + 6h3 О = 6HF + H6 XeO6
Если к продуктам этой реакции быстро добавить Ва (ОН)2, выпадает белый аморфный осадок Ва3 ХеО6. При 125° С он разлагается на окись бария, ксенон и кислород. Получены аналогичные соли—ксенонаты натрия и калия. При действии озона на раствор ХеО3 в одномолярном едком натре образуется соль высшей кислоты ксенона Na4 ХеО6. Перксенонат натрия может быть выделен в виде бесцветного кристаллогидрата Na4XeO6 · 6Н2 О. К образованию перксенонатов приводит и гидролиз XeF6 в гидроокисях натрия и калия. Если твердую соль Na4 XeO6 обработать раствором нитрата свинца, серебра или уранила, то получаются соответствующие перксенонаты: PbXeO6 и (UO2 ) 2XeO6 желтого цвета и Ag4 XeO6 — черного. Аналогичные соли дают калий, литий, цезий, кальций.
Окисел, соответствующий высшей кислоте ксенона, получают взаимодействием Na4 XeO6 с безводной охлажденной серной кислотой. Это четырехокись ксенона ХеO4. В ней, как и в октафториде, валентность ксенона равна восьми. Твердая четырехокись при температуре выше 0° С разлагается на ксенон и кислород, а газообразная (при комнатной температуре) — на трехокись ксенона, ксенон и кислород. Молекула ХеO4 имеет форму тетраэдра с атомом ксенона в центре. В зависимости от условий гидролиз гексафторида ксенона может идти двумя путями; в одном случае получается тетраоксифторид XeOF4, другом — диоксифторид XeO2 F2. Прямой синтез из элементов приводит к образованию оксифторида ХеОF2. Все это бесцветные твердые вещества, устойчивые в обычных условиях.
Очень интересна изученная недавно реакция дифторида ксенона с безводной НС1O4. В результате этой реакции получено новое соединение ксенона ХеСlO4 — чрезвычайно мощный окислитель, вероятно, самый сильный из всех перхлоратов.
Синтезированы также соединения ксенона, не содержащие кислорода. Преимущественно это двойные соли, продукты взаимодействия фторидов ксенона с фторидами сурьмы, мышьяка, бора, тантала: XeF2 · SbF5, ХеF6 · AsF3, ХеF6 · ВF3 и ХеF2 · 2ТаF5. И наконец, получены вещества типа XeSbF6, устойчивые при комнатной температуре, и XeSiF6 — нестойкий комплекс.
В распоряжении химиков имеются весьма незначительные количества радона, тем не мене удалось установить, что он также взаимодействует с фтором, образуя нелетучие фториды. Для криптона выделены и изучены дифторид KrF2 и тетрафторид KrF4 по свойствам, напоминающим соединения ксенона.
3.3 Получение Аргона.
Земная атмосфера содержит 66 · 1013 т аргона. Этот источник аргона неисчерпаем, тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов. Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором. Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10...12% аргона, до 0,5% азота, остальное – кислород. В «аргонной» колонне, присоединенной к основному аппарату, получают аргон с примесью 3...10% кислорода и 3...5% азота. Дальше следует очистка «сырого» аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ной чистоты. Аргон извлекают также из отходов аммиачного производства – из азота, оставшегося после того, как большую его часть связали водородом. Аргон хранят и транспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленой полосой и зеленой надписью. Давление в них 150 атм. Более экономична перевозка сжиженного аргона, для чего используют сосуды Дюара и специальные цистерны. Искусственные радиоизотопы аргона получены при облучении некоторых стабильных и радиоактивных изотопов (37 Cl, 36 Аr, 40 Аr, 40 Са) протонами и дейтонами, а также при облучении нейтронами продуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37 Аr и 41 Аr используются как радиоактивные индикаторы: первый – в медицине и фармакологии, второй – при исследовании газовых потоков, эффективности спетом вентиляции и в разнообразных научных исследованиях. Но, конечно, не эти применения аргона самые важные.
3.4Физиологическое действие инертных газов.
Естественно было ожидать, что столь химически инертные вещества, как инертные газы, не должны влиять и на живые организмы. Но это не так. Вдыхание высших инертных газов (конечно в смеси с кислородом) приводит человека в состояние, сходное с опьянением алкоголем. Наркотическое действие инертных газов обуславливается растворением в нервных тканях. Чем выше атомный вес инертного газа, тем больше его растворимость и тем сильнее его наркотическое действие.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях. Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
IV Применение инертных газов.
Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии.
Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля.


Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений. При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза. Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов.
Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения. В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств. Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3 He и 4 He для создания и поддержания температур ниже 0,005 K
Области применения ксенона разнообразны и порой неожиданны. Человек использует и его инертность и его чудесную способность вступать в реакцию со фтором. В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр — от ультрафиолетового до ближней области инфракрасного. Ксеноном пользуются и медики — при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден. Активный изотоп элемента № 54, ксенон — 133, используют при исследовании функциональной деятельности легких и сердца.
Продувкой аргона через жидкую сталь из нее удаляют газовые включения. Это улучшает свойства металла.
 |
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса.
Неон и аргон используются, как наполнители в неоновых лампах и лампах дневного свата Криптоном наполняют обычные лампы с целью уменьшения испарения и увеличения яркости свечения вольфрамовой нити. Ксеноном наполняют кварцевые лампы высокого давления, являющиеся наиболее мощными источниками света. Гелий и аргон используется в газовых лазерах.

Список использованной литературы
1. Петров М.М., Михилев Л.А., Кукушкин Ю.Н. “Неорганическая химия”
2. Гузей Л.С. Лекции по общей химии”
3. Ахметов Н.С. “Общая и неорганическая химия”
4. Некрасов Б.В. “Учебник общей химии”
5. Глинка Н.Л. “Общая химия
6. Ходаков Ю.В. “Общая и неорганическая химия”
www.ronl.ru
Британская Международная Школа
Реферат по химии
“Инертные газы и их свойства”
Ученика 9б класса
Соколенко Алексея
Руководитель:
Чернышева И.В.
Москва
2003
Содержание:
I Вступление……………………………………………………………………………2
1.1 Инертные газы – элементы VIIIА группы……………………………………...2
1.2 Аргон на земле и во вселенной………………………………………………….5
II История открытия газов…………………………………………………..................7
2.1 Аргон………………………………………………………………………………7
2.2 Гелий…………………..…………………………………………………………..8
2.3 Криптон………………………………………………………..…………………..9
2.4 Неон……………………………………………………………..…………………9
2.5 Ксенон……………………………………………………………….…………….9
2.6 Радон………………………………………………………………..…………….10
III Свойства инертных газов и их соединений…………………………………….....10
3.1 Физические свойства инертных газов………………………………………….10
3.2 Химические свойства инертных газов……………………………………….....11
3.3 Получение Аргона…………………………………………………...…………..14
3.4 Физиологические свойства инертных газов……………………………………15
IV Применение инертных газов…………………………………………………..…..16
Список использованной литературы………………………………………………....18
I Вступление.
Везде и по всюду нас окружает атмосферный воздух. Из чего он состоит? Ответ не составляет труда: из 78,08 процента азота, 20,9 процента кислорода, 0,03 процента углекислого газа, 0,00005 процента водорода, около 0,94 процента приходится на долю так называемых инертных газов. Последние были открыты всего лишь в конце прошлого столетия.
Радон образуется при радиоактивном распаде радия и в ничтожных количествах встречается в содержащих уран материалах, а также в некоторых природных водах. Гелий являющийся продуктом радиоактивного α-распада элементов, иногда в заметном количества содержится в природном газе и газе, выделяющемся из нефтяных скважин. В огромных количествах этот элемент содержится на Солнце и на других звездах. Это второй элемент по распространенности во вселенной (после водорода).
1.1 Инертные газы – элементы 8А группы.
Конфигурация внешнего электронного слоя атомов гелия 1s2, остальных элементов подгруппы VIII – ns2np6.



На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3 в литре морской и до 0,55 см3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот... Главное «хранилище» земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы. Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40. Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты («К-захват»). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон. Период полураспада 40К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон «выдыхается» литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками. Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.). Соотношение изотопов 40Аr: 40К и 40Ar: 36Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии. Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне. Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше... Теперь о легких изотопах. Откуда берутся 36Аr и 38Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов. Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-«родители», но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35:
3617Cl β–→ 3618Ar + 0–1e + ν.
3316S + 42He → 3618Ar + 10n.
3517Cl + 42He → 3818Ar + 10n + 0+1e.
В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле. В космическом аргоне главенствуют изотопы 36Аr и 38Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660 : 1. А раз мало калия, то откуда же взяться аргону-40?!
II История открытия инертных газов.
К концу 18 века были обнаружены многие из известных газов. К ним относились: кислород – газ, поддерживающий горение; углекислый газ – его можно было легко обнаружить по весьма примечательному свойству: он мутил известковую воду; и, наконец, азот, горение не поддерживающий и на известковую воду не действующий. Таков был представлении химиков того времени состав атмосферы, и некто, кроме известного английского ученого лорда Кавендиша, не сомневался в этом.
И у него был повод для сомнения.
В 1785 году он проделал довольно простой опыт. Прежде всего он удалил из воздуха углекислый газ. На оставшуюся смесь азота и кислорода он подействовал электрической искрой. Азот, реагируя с кислородом, давал бурные пары оксидов азота, которые, растворяясь в воде, превращались в азотную кислоту. Эта операция повторялась многократно.
Однако немного менее одной сотой части объема воздуха, взятого для опыта, оставалась неизменной. К сожалению, этот эпизод был забыт не многие годы.
2.1 Аргон.
В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось. Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент! Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит «недеятельный». Его предложил председательствовавший на собрании доктор Медан. Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег... Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона.
2.2 Гелий.
|
|
В феврале 1895 года Размай получил письмо от лондонского метеоролога Маерса, где тот сообщал об опытах американского геолога Гиллебранда, который кипятил в серной кислоте редкие минералы урана и наблюдал выделение газа, по свойствам своим напоминающий азот. Чем больше урана содержится в минералах, тем больше выделялось газа. Гиллебранд условно предположил, что этот газ является азотом. “А может быть это аргон?” – спрашивал автор письма.
Вскоре Размай послал своих помощников в лондонские химические магазины за урановым минералом клевеитом. Было куплено 30 грамм клевеита, и в тот же день Размай со своим помощником Метьюзом извлек несколько кубических сантиметров газа. Размай подверг этот газ спектраскопическому исследованию. Он увидел яркую желтую линию, очень похожую на линию натрия и в тоже время отличающуюся от нее по своему положению в спектре. Размай был на столько удивлен, что разобрал спектроскоп, почистил его, но при новом опыте снова обнаружил яркую желтую линию, не совпадавшую с линей натрия. Размай просмотрел спектры всех элементов. Наконец он вспомнил о загадочной линии в спектре солнечной короны.
|
|
В 1868 году во время солнечного затмения французский исследователь Жансен и англичанин Локьер обнаружили в спектре солнечных протуберанцев яркую желтую линию, которой не оказалось в земном спектре источников света. В 1871 году Локьер высказал предположение, не принадлежит ли эта линия спектру неизвестного на Земле вещества.
Он назвал этот гипотетический элемент гелием, то есть “солнечным”. Но на земле он обнаружен не был. Физики и химики им не заинтересовались: на Солнце, мол, совершенно другие условия, там и водород сойдет за гелий.
Так неужели в его руках этот самый гелий? Размай почти уверен в этом, но он хочет услышать подтверждение от известного спектроскописта Крукса. Размай посылает ему газ на исследование и пишет о том, что нашел какой-то новый газ, названый им криптоном, по-гречески означает “скрытый”. Телеграмма от Крукса гласила: “Криптон есть гелий”.
2.3 Криптон.
|
|
К 1895 году открыли два инертных газа. Было ясно, что между ними должен находится еще один газ, свойства которого Размай описал по примеру Менделеева. Лекок де Буабодран предсказал даже вес неоткрытого газа – 20,0945.
И неизвестно, обнаружил бы ученый новые инертные газы, если бы во время его поисков Линде в Генмании и Хемпсон в Англии не взяли одновременно патент на машину, сжижжающую воздух.
Эта машина словно была специально создана для обнаружения инертных газов. Принцип ее действия основан на известном физическом явлении, если сжать воздуж, в затем дать ему быстро расшириться, он охлаждается. Охлажденным воздухом охлаждают новую порцию воздуха , поступающую в машину, и т.д., пока воздух не превратится в жидкость.
Испарив почти весь азот и кислород, Размай оставшийся жидкий воздух поместил в газометр. Он думал найти в нем гелий, так как считал, что этот газ испаряется медленнее, чем кислород и азот. Он очистил газ в газометре от примеси кислорода и азота и снял спектр, в котором снял две ранее не известных линии.
Далее Размай поместил 15 литров аргона в баллоне в жидкий воздух. Для того чтобы найти инертный газ, по расчетам, более легкий, чем аргон и криптон, Размай собрал первые порции испарения аргона. Получился новый спектр с ярко-красными линиями. Размай назвал выделенный газ неоном, что по-гречески означает “новый”.
2.4 Неон.
Далее Размай поместил 15 литров аргона в баллоне в жидкий воздух. Для того чтобы найти инертный газ, по расчетам, более легкий, чем аргон и криптон, Размай собрал первые порции испарения аргона. Получился новый спектр с ярко-красными линиями. Размай назвал новый газ неоном, что по-гречески означает “новый”.
2.5 Ксенон.
В 1888 году помощник Размая Треверс построил машину способную давать температуру -2530С. С помощью ее был получен твердый аргон. Были отогнаны все газы, кроме криптона. И уже в неочищенном криптоне был найден ксенон (“чужой”). Для того чтобы получить 300 кубических сантиметров ксенона, ученым пришлось в течении 2 лет переработать 77,5 миллиона литров атмосферного воздуха.
2.6 Радон.
Уже было сказано, что гелий присутствует в урановых минералах. Чем больше в клевеите урана, тем больше гелия. Размай долго пытался найти взаимосвязь между содержанием урана и гелия, но это ему не удалось. Разгадка пришла с другой стороны; она была связана с открытием радиоактивности.
Обнаружили, что радий выделяет газообразное вещество, названное эманацией. 1 грамм радия в сутки выделял один кубический миллиметр эманации. В 1903 году Размай и известный физик Содди занялись изучением эманации. Они имели в своем распоряжении всего 50 миллиграммов бромистого радия; одновременно у них было не более 0.1 кубического миллиметра эманации.
Для выполнения работ Размай построил сверхчувствительные весы, показывающие четыре миллиардные доли грамма. Вскоре исследователи выяснили, что эманация является последним представителем семейства инертных газов .
Им долго не удавалось рассмотреть спектр эманации. Как-то, оставив трубку с эманацией на несколько дней, они поставили ее в спектроскоп и были удивлены, увидев в спектроскопе известные линии гелия.
Этот факт подтвердил предположение Резерфорда и Содди о том, что радиоактивное превращение связано с превращением атомов. Радий, самопроизвольно распадался, превращался в эманацию и выделял ядро атома гелия. Один элемент превращался в другой.
Ученым стало понятно, почему гелий обнаруживается в урановых материалах; он один из продуктов распада урана. В 1923 году по решению Международного комитета по химическим элементам эманация была переименована в радон.
III Свойства инертных газов и их соединений.
3.1 Физические свойства инертных газов.
Благородные газы – бесцветные одноатомные газ без цвета и запаха.
Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся: гелий ярко-жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно красным светом, так как самые яркие его линии лежат в красной части спектра.
Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом. Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления).

В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
3.2 Химические свойства инертных газов.
Долгое время не находили условий, при которых благородные газы могли бы вступать в химическое взаимодействие. Они не образовывали истинных химических соединений. Иными словами их валентность равнялась нулю. На этом основании было решено новую группу химических элементов считать нулевой. Малая химическая активность благородных газов объясняется жёсткой восьмиэлектронной конфигурацией внешнего электронного слоя. Поляризуемость атомов растёт с увеличением числа электронных слоёв. Следовательно, она должна увеличиваться при переходе от гелия к радону. В этом же направлении должна увеличиваться и реакционная способность благородных газов.



Так, уже в 1924 году высказывалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики — Полинг и Оддо. Изучение электронной структуры оболочек криптона и ксенона с позиций квантовой механики привело к заключению, что эти газы в состоянии образовывать устойчивые соединения с фтором. Нашлись и экспериментаторы, решившие проверить гипотезу, но шло время, ставились опыты, а фторид ксенона не получался. В результате почти все работы в этой области были прекращены, и мнение об абсолютной инертности благородных газов утвердилось окончательно.
Однако в 1961 году Бартлетт, сотрудник одного из университетов Канады, изучая свойства гексафторида платины, соединения более активного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чем у кислорода (12, 13 и 12, 20 эв соответственно). Между тем кислород образовывал с гексафторидом платины соединение состава O2PtF6... Бартлетт ставит опыт и при комнатной температуре из газообразного гексафторида платины и газообразного ксенона получает твердое оранжево - желтое вещество — гексафторплатинат ксенона XePtF6, поведение которого ничем не отличается от поведения обычных химических соединений. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XePtF6 + 6Н2О = 2Хе + О2 + 2PtО2 + 12HF
Последующие работы Бартлетта позволили установить, что ксенон в зависимости от условий реакции образует два соединения с гексафторидом платины: XePtF6 и Xe (PtF6) 2; при гидролизе их получаются одни и те же конечные продукты. Убедившись, что ксенон действительно вступил в реакцию с гексафторидом платины, Бартлетт выступил с докладом и в 1962 году опубликовал в журнале “Proceedings of the Chemical Society” статью, посвященную сделанному им открытию. Статья вызвала огромный интерес, хотя многие химики отнеслись к ней с нескрываемым недоверием. Но уже через три недели эксперимент Бартлетта повторила группа американских исследователей во главе с Черником в Аргоннской национальной лаборатории. Кроме того, они впервые синтезировали аналогичные соединения ксенона с гексафторидами рутения, родия и плутония. Так были открыты первые пять соединений ксенона: XePtF6, Xe (PtF6)2, XeRuF6, XeRhF6, XePuF6 — миф об абсолютной инертности благородных газов развеян и заложено начало химии ксенона. Настало время проверить правильность гипотезы о возможности прямого взаимодействия ксенона с фтором.
Смесь газов (1 часть ксенона и 5 частей фтора) поместили в никелевый (поскольку никель наиболее устойчив к действию фтора) сосуд и нагрели под сравнительно небольшим давлением. Через час сосуд быстро охладили, а оставшийся в нем газ откачали и проанализировали. Это был фтор. Весь ксенон прореагировал! Вскрыли сосуд и обнаружили в нем бесцветные кристаллы XeF4. Тетрафторид ксенона оказался вполне устойчивым соединением, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Тетрафторид ксенона фторирует ртуть:
ХеF4 + 2Hg = Хe + 2HgF2
|
Кристаллы XeF4 |
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Интересно в химии ксенона то, что, меняя условия реакции, можно получить не только XeF4, но и другие фториды—XeF2, XeF6.
Советские химики В. М. Хуторецкий и В. А. Шпанский показали, что для синтеза дифторида ксенона совсем не обязательны жесткие условия. По предложенному ими способу смесь ксенона и фтора (в молекулярном отношении 1:1) подается в сосуд из никеля или нержавеющей стали, и при повышении давления до 35 атм начинается самопроизвольная реакция.
XeF2 — единственный фторид ксенона, который можно получить, не пользуясь элементарным фтором. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Возможен, конечно, и прямой синтез. Очень чистый ХеF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтористый водород; особенно быстро разложение идет в щелочной среде. Дифторид имеет резкий специфический запах. Большой теоретический интерес представляет метод синтеза дифторида ксенона, основанный на воздействии на смесь газов ультрафиолетового излучения (длина волн порядка 2500—3500 А). Излучение вызывает расщепление молекул фтора на свободные атомы. В этом и заключается причина образования дифторида: атомарный фтор необычайно активен. Для получения XeF6 требуются более жесткие условия: 700° С и 200 атм. В таких условиях в смеси ксенона и фтора (отношение от 1:4 до 1:20) практически весь ксенон превращается в XeF6. Гексафторид ксенона чрезвычайно активен и разлагается со взрывом. Он легко реагируете фторидами щелочных металлов (кроме LiF):
XeF6 + RbF = RbXeF7,
но при 50° С эта соль разлагается:
2RbXeF7 = XeF6 + Rb2XeF8
Сообщалось также о синтезе высшего фторида XeF8, устойчивого лишь при температуре ниже минус 196° C.
Синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стал известен его высший фторид, в котором валентность ксенона равна восьми (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов. Эти вещества обладают повышенной реакционной способностью. Лучше всего изучено взаимодействие фторидов ксенона с водой. Гидролиз ХеF4 в кислой среде ведет к образованию окиси ксенона ХеО3 — бесцветных, расплывающихся на воздухе кристаллов. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Достаточно несколько сотен миллиграммов ХеО3, чтобы эксикатор разнесло в куски. Не исключено, что со временем трехокись ксенона будут использовать как взрывчатое вещество дробящего действия. Такая взрывчатка была бы очень удобна, потому что все продукты взрывной реакции — газы. Пока же использовать для этой цели трехокись ксенона слишком дорого — ведь ксенона в атмосфере меньше, чем золота в морской воде, и процесс его выделения слишком трудоемок. Напомним, что для получения 1 м3 ксенона нужно переработать 11 млн. м3 воздуха. Соответствующая трехокиси неустойчивая кислота шестивалентного ксенона H6XeO6 образуется в результате гидролиза XeF6 при 0° С:
XeF6 + 6h3О = 6HF + H6XeO6
Если к продуктам этой реакции быстро добавить Ва (ОН)2, выпадает белый аморфный осадок Ва3ХеО6. При 125° С он разлагается на окись бария, ксенон и кислород. Получены аналогичные соли—ксенонаты натрия и калия. При действии озона на раствор ХеО3 в одномолярном едком натре образуется соль высшей кислоты ксенона Na4ХеО6. Перксенонат натрия может быть выделен в виде бесцветного кристаллогидрата Na4XeO6 · 6Н2О. К образованию перксенонатов приводит и гидролиз XeF6 в гидроокисях натрия и калия. Если твердую соль Na4XeO6 обработать раствором нитрата свинца, серебра или уранила, то получаются соответствующие перксенонаты: PbXeO6 и (UO2) 2XeO6 желтого цвета и Ag4XeO6 — черного. Аналогичные соли дают калий, литий, цезий, кальций.
Окисел, соответствующий высшей кислоте ксенона, получают взаимодействием Na4XeO6 с безводной охлажденной серной кислотой. Это четырехокись ксенона ХеO4. В ней, как и в октафториде, валентность ксенона равна восьми. Твердая четырехокись при температуре выше 0° С разлагается на ксенон и кислород, а газообразная (при комнатной температуре) — на трехокись ксенона, ксенон и кислород. Молекула ХеO4 имеет форму тетраэдра с атомом ксенона в центре. В зависимости от условий гидролиз гексафторида ксенона может идти двумя путями; в одном случае получается тетраоксифторид XeOF4, другом — диоксифторид XeO2F2. Прямой синтез из элементов приводит к образованию оксифторида ХеОF2. Все это бесцветные твердые вещества, устойчивые в обычных условиях.
Очень интересна изученная недавно реакция дифторида ксенона с безводной НС1O4. В результате этой реакции получено новое соединение ксенона ХеСlO4 — чрезвычайно мощный окислитель, вероятно, самый сильный из всех перхлоратов.
Синтезированы также соединения ксенона, не содержащие кислорода. Преимущественно это двойные соли, продукты взаимодействия фторидов ксенона с фторидами сурьмы, мышьяка, бора, тантала: XeF2 · SbF5, ХеF6 · AsF3, ХеF6 · ВF3 и ХеF2 · 2ТаF5. И наконец, получены вещества типа XeSbF6, устойчивые при комнатной температуре, и XeSiF6 — нестойкий комплекс.
В распоряжении химиков имеются весьма незначительные количества радона, тем не мене удалось установить, что он также взаимодействует с фтором, образуя нелетучие фториды. Для криптона выделены и изучены дифторид KrF2 и тетрафторид KrF4 по свойствам, напоминающим соединения ксенона.
3.3 Получение Аргона.
Земная атмосфера содержит 66 · 1013 т аргона. Этот источник аргона неисчерпаем, тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов. Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором. Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10...12% аргона, до 0,5% азота, остальное – кислород. В «аргонной» колонне, присоединенной к основному аппарату, получают аргон с примесью 3...10% кислорода и 3...5% азота. Дальше следует очистка «сырого» аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ной чистоты. Аргон извлекают также из отходов аммиачного производства – из азота, оставшегося после того, как большую его часть связали водородом. Аргон хранят и транспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленой полосой и зеленой надписью. Давление в них 150 атм. Более экономична перевозка сжиженного аргона, для чего используют сосуды Дюара и специальные цистерны. Искусственные радиоизотопы аргона получены при облучении некоторых стабильных и радиоактивных изотопов (37Cl, 36Аr, 40Аr, 40Са) протонами и дейтонами, а также при облучении нейтронами продуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37Аr и 41Аr используются как радиоактивные индикаторы: первый – в медицине и фармакологии, второй – при исследовании газовых потоков, эффективности спетом вентиляции и в разнообразных научных исследованиях. Но, конечно, не эти применения аргона самые важные.
3.4 Физиологическое действие инертных газов.
Естественно было ожидать, что столь химически инертные вещества, как инертные газы, не должны влиять и на живые организмы. Но это не так. Вдыхание высших инертных газов (конечно в смеси с кислородом) приводит человека в состояние, сходное с опьянением алкоголем. Наркотическое действие инертных газов обуславливается растворением в нервных тканях. Чем выше атомный вес инертного газа, тем больше его растворимость и тем сильнее его наркотическое действие.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях. Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
IV Применение инертных газов.
Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии.
Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля.


Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений. При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза. Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов.
Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения. В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств. Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3He и 4He для создания и поддержания температур ниже 0,005 K
Области применения ксенона разнообразны и порой неожиданны. Человек использует и его инертность и его чудесную способность вступать в реакцию со фтором. В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр — от ультрафиолетового до ближней области инфракрасного. Ксеноном пользуются и медики — при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден. Активный изотоп элемента № 54, ксенон - 133, используют при исследовании функциональной деятельности легких и сердца.
Продувкой аргона через жидкую сталь из нее удаляют газовые включения. Это улучшает свойства металла.
|
|
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса.
Неон и аргон используются, как наполнители в неоновых лампах и лампах дневного свата Криптоном наполняют обычные лампы с целью уменьшения испарения и увеличения яркости свечения вольфрамовой нити. Ксеноном наполняют кварцевые лампы высокого давления, являющиеся наиболее мощными источниками света. Гелий и аргон используется в газовых лазерах.

Список использованной литературы
1. Петров М.М., Михилев Л.А., Кукушкин Ю.Н. “Неорганическая химия”
2. Гузей Л.С. Лекции по общей химии”
3. Ахметов Н.С. “Общая и неорганическая химия”
4. Некрасов Б.В. “Учебник общей химии”
5. Глинка Н.Л. “Общая химия
6. Ходаков Ю.В. “Общая и неорганическая химия”
www.referatmix.ru
Инертные газы
План.
1. Физические свойства инертных газов.
Инертные газы не имеют цвета и запаха. И являются одноатомными. Инертные газы считаются благородными. Обладают более высокой электропроводностью (по сравнению с другими) и, при прохождении через них тока, ярко светятся.
Неон - огненно красным светом, так как его самые яркие линии находятся в красной области спектра.
Гелий - ярко-жёлтым светом, это объясняется тем, что в его сравнительно простом спектре, двойная жёлтая линия преобладает над всеми другими.
Инертные газы имеют более низкие точки сжижения и замерзания, по сравнению с другими газами с тем же молекулярным весом. Это происходит из-за насыщенного характера атомных молекул инертных газов.
2. Химические свойства инертных газов.
Инертные газы обладают очень малой химической активностью, что объясняется жёсткой восьмиэлектронной конфигурацией внешнего электронного слоя. Как известно с увеличением числа электронных слоёв поляризуемость атомов растёт. Следовательно, она должна увеличиваться при переходе от гелия к радону.
Долгое время ученые вообще не находили условий, при которых благородные газы могли бы вступать в химическое взаимодействие или образовывать истинные химические соединения. Их валентность равнялась нулю. И новую группу химических решили считать нулевой.
Но 1924 году высказалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. В теории, при изучении электронной структуры оболочек криптона и ксенона с позиций квантовой механики, получалось, что эти газы в состоянии образовывать устойчивые соединения с фтором.
Но шло время, а на практике все эксперименты в этой области оканчивались неудачей. Фторид ксенона не получался. Постепенно пришли к выводу, что это не возможно и опыты прекратились.
Только в 1961 году Бартлетт, сотрудник одного из университетов Канады, изучая свойства гексафторида платины, соединения более активного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чем у кислорода (12, 13 и 12, 20 эв соответственно), а кислород образовывал с гексафторидом платины соединение состава O2PtF6...
При комнатной температуре Бартлетт првел опыт и из газообразного гексафторида платины и газообразного ксенона получил твердое оранжево - желтое вещество, получившее название гексафторплатинат ксенона XePtF6..
При нагревании в вакууме гексафторплатинат XePtF6 возгоняется без разложения. Гидролизуется в воде, выделяя ксенон:
2XePtF6 + 6Н2О = 2Хе + О2 + 2PtО2 + 12HF
Исследуя новое вещество Бартлетт пришел к выводу, что поведение гексафторплатината ничем не отличается от поведения обычных химических соединений.
Работы Бартлетта позволили установить, что ксенон в зависимости от условий реакции, способен образовывать два разных соединения с гексафторидом платины: XePtF6 и Xe(PtF6)2. Но при гидролизе этих соединений получаются одни и те же конечные продукты.
В 1962 году Бартлетт выступает с докладом.
И уже через три недели после его опытов, эксперимент повторила группа американских исследователей в Аргоннской национальной лаборатории во главе с Черником. Ученым впервые удалось синтезировать аналогичные соединения ксенона с гексафторидами рутения, родия и плутония.
Итак, первые пять соединений ксенона: XePtF6, Xe (PtF6)2, XeRuF6, XeRhF6, XePuF6
Миф об абсолютной инертности газов не подтвердился.
Существовавшую гипотезу о возможности прямого взаимодействия ксенона с Фтором решили проверить.
Для этой цели смесь газов (1 часть ксенона и 5 частей фтора) поместили в никелевый сосуд, как наиболее устойчивый к действию фтора, и нагрели под сравнительно небольшим давлением.
Через час сосуд резко охладили, а газ откачали. Оставшимся газом оказалось не что иное, как фтор. Весь ксенон прореагировал!
После во вскрытом сосуде обнаружили бесцветные кристаллы тетрафторида ксенона XeF4.
Это устойчивое соединение, его молекула имеет форму квадрата с ионами фтора по углам и ксеноном в центре.
Тетрафторид ксенона XeF4 фторирует ртуть, платину(но только растворенным во фтористом водороде):ХеF4 + 2Hg = Хe + 2HgF2
Замечательно то, что, меняя условия реакции, можно получить не только XeF4, но и другие фториды, например XeF2, XeF6.
В. М. Хуторецкий и В. А. Шпанский - советские ученые-химики, показали, что для синтеза дифторида ксенона совсем не обязательны жесткие условия.
Ими был предложен способ, когда смесь ксенона и фтора (в молекулярном отношении 1:1) подается в сосуд из никеля или нержавеющей стали, и при повышении давления до 35 атм начинается самопроизвольная реакция.
XeF2 — единственный фторид ксенона, получаемый под действием электрического разряда на смесь ксенона и четырехфтористого углерода, без использования элементарного фтора.
Чистый ХеF2 получается, при облучении ксенона и фтора ультрафиолетом.
Дифторид ХеF2 обладает резким специфическим запахом.
Растворимость дифторида в воде невелика. Его раствор — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтористый водород. В щелочной среде разложение идет особенно быстро.
Метод синтеза дифторида ксенона, основанный на воздействии на смесь газов ультрафиолетового излучения (длина волн порядка 2500—3500 А) представляет большой теоретический интерес.
Излучение вызывает расщепление молекул фтора на свободные атомы. И именно в этом заключается причина образования дифторида, т.к. атомарный фтор необычайно активен.
Для получения гексафторида ксенона XeF6 требуются более жесткие условия: 700° С и 200 атм. При таких условиях в смеси ксенона и фтора, в отношение от 1:4 до 1:20, практически весь ксенон превращается в XeF6.
Гексафторид ксенона чрезвычайно активен и разлагается со взрывом.
Легко реагирует с фторидами щелочных металлов (кроме LiF):XeF6 + RbF = RbXeF7
Уже при 50° С эта соль разлагается:2RbXeF7 = XeF6 + Rb2XeF8
Высший фторид XeF8 устойчив лишь при температуре ниже минус 196° C.
Если прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности, то синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Инертные газы решили перенести в VIII группу, когда стал известен его высший фторид, в котором валентность ксенона равна восьми, что вполне согласуется со строением его электронной оболочки.
Все известные ныне соединения ксенона получены из его фторидов. Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось.
Хорошо изучено взаимодействие фторидов ксенона с водой.
При гидролизе ХеF4 в кислой среде, образуется окись ксенона ХеО3 — бесцветные, расплывающиеся на воздухе кристаллы.
Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине.
Это крайне неустойчивое соединение, при разложении мощность взрыва приближается к мощности взрыва тротила. Поэтому достаточно несколько сотен миллиграммов ХеО3, чтобы эксикатор разнесло в куски.
В перспективе предполагается использование трехокиси ксенона в качестве взрывчатки. Такая взрывчатка была бы очень удобна, потому что все продукты взрывной реакции — газы. Пока же использовать для этой цели трехокись ксенона слишком дорого из-за небольших запасов в атмосфере и технических сложностей.
Для получения 1 м3 ксенона нужно переработать 11 млн. м3 воздуха.
Соответствующая трехокиси неустойчивая кислота шестивалентного ксенона H6XeO6 образуется в результате гидролиза XeF6 при температуре 0° С:
XeF6 + 6h3О = 6HF + H6XeO6
Если к продуктам этой реакции быстро добавить Ва (ОН)2, выпадает белый аморфный
осадок Ва3ХеО6. При 125° С он разлагается на окись бария, ксенон и кислород.
Получены аналогичные соли—ксенонаты натрия и калия.
Под действием озона из раствора ХеО3 в одномолярном едком натре образуется соль высшей кислоты ксенона Na4ХеО6. Перксенонат натрия может быть выделен в виде бесцветного кристаллогидрата Na4XeO6 · 6Н2О. Также к образованию перксенонатов приводит гидролиз XeF6 в гидроокисях натрия и калия.
Достаточно обработать твердую соль Na4XeO6 раствором нитрата свинца, серебра или уранила и получаются соответствующие перксенонаты:
Ag4XeO6 — черного, bXeO6 и (UO2) 2XeO6 - желтого цвета.
Аналогичные соли дают калий, кальций, литий, цезий,.Взаимодействием Na4XeO6 с безводной охлажденной серной кислотой, получают окисел, соответствующий высшей кислоте ксенона – четырехокись ХеO4.
Как и в октафториде, валентность ксенона равна восьми.
Твердая четырехокись при температуре выше 0° С разлагается на ксенон и кислород, а газообразная (при комнатной температуре) — на трехокись ксенона, ксенон и кислород.
Молекула ХеO4 имеет форму тетраэдра с атомом ксенона в центре. В зависимости от условий гидролиз гексафторида ксенона может идти двумя путями:
Прямой синтез из элементов приводит к образованию оксифторида ХеОF2.
Недавно изучена реакция дифторида ксенона с безводной НС1O4.
Получено новое соединение ксенона ХеСlO4 — мощный окислитель, в результате этой реакции, самый сильный из всех перхлоратов. Синтезированы соединения ксенона, не содержащие кислорода.
Это двойные соли, продукты взаимодействия фторидов ксенона с фторидами сурьмы, мышьяка, бора, тантала: XeF2 · SbF5, ХеF6 · AsF3, ХеF6 · ВF3 и ХеF2 · 2ТаF5.
И наконец, получены вещества типа XeSbF6, устойчивые при комнатной температуре, и XeSiF6 — нестойкий комплекс. На сегодняшний день удалось установить, что радон также взаимодействует с фтором, образуя нелетучие фториды.
Выделены и изучены дифторид KrF2 и тетрафторид для криптона KrF4 по свойствам, напоминающим соединения ксенона. 4. История открытия инертных газов.К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически.
Воздух, при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка.
Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18.
Так было доказано, что воздух содержит газ, плотность которого больше плотности азота… Получили 100 см3 этого вещества с плотностью равной 19,9. Оно оказалось одноатомным газом.
Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную - почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”.
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. “гелиос”, что означает солнце.
В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита.
Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Рамзай и его сотрудники в поисках инертных газов занялись минералами, природными водами, даже метеоритами. Однако, все было безрезультатно, анализы неизменно оказывались отрицательными.
Между тем — новый газ в них был, но используемые методы,не были достаточно чувствительными и эти “микроследы” не улавливались.
Начав исследовать воздух, всего за четыре последующих года было открыто четыре новых элемента, а такие газы, как неон, криптон и ксенон были даже выделены из воздуха.
Для этого, воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. При этой процедуре более легкие газы улетучиваются и оставшиеся после испарения тяжелые инертные газы рассортировывают.
Полученные фракции подвергались различным исследованиям.
Рассмотрим спектральный анализ, как один из методов определения:
Это несложная процедура позволяет безошибочно идентифицировать инертные газа по линиям спектра.
Для этого газ помещается в разрядную трубку, к которой подключен ток.
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. Интересна история названия этого газа:
Когда Рамзай наблюдал, в очередном опыте, спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать “поклонником” отцовых работ. Увидев необычное свечение, он воскликнул: “new one!” , что по-древнегречески значит “новый”.
Так возникло название газа “неон”.
Найти инертные газы, завершающие четвёртый, пятый и шестой периоды таблицы Менделеева удалось не сразу, хотя после того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, в их существовании сомнений не было.
Но к тому времени научились получать значительные количества жидкого воздуха, во много благодаря стараниям английского ученого Траверса.
Стал доступен даже жидкий водород.
И Рамзай совместно с Траверсом смогли заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона.
Остаток одержал сырой (неочищенный) криптон. И после откачки его в сосуде неизменно оставался пузырек газа. Этот газ давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой и имел голубоватое свечение в электрическом разряде. Как известно, по спектральным линиям можно безошибочно идентифицировать элемент. И У Рамзая и Траверса были все основания считать, что открыт новый инертный газ.
Он получил название - ксенон, что в переводе с греческого значит “чужой”. Ведь действительно, в криптоновой фракции воздуха он выглядел чужаком.
В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха. Содержание ксенона в атмосфере крайне мало, но именно воздух — практически единственный и неисчерпаемый источник ксенона (почти весь ксенон возвращается в атмосферу).
Индивидуальность ксенона как нового химического элемента установили, оперируя всего 0,2 см3 этого газа.
Рамзаю так же принадлежит заслуга открытия высшего представителя инертных газов. Используя тонкие технические приёмы, он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Рамзай измерил скорость диффузии, что позволило установить молекулярный вес газа, составляющий примерно 220:
Исходя из предположения, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия (a –частицы), то выходит, что заряд его должен быть равен 88-2=86. Таким образом, новый элемент должен действительно быть инертным газом. А его атомный вес 226-4=222. Официально было решено включить в периодическую систему новую группу химических элементов 16 марта 1900 года, после встречи Рамзая с Менделеевым.
Гелий - источник низких температур.
Жидкий гелий используется при изучении многих явлений, например, сверхпроводимость в твердом состоянии. Тепловое движение атомов и свободных электронов в твердых телах практически отсутствует при температуре жидкого гелия.
Кроме того, жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств. Довольно необычным применением гелия в качестве хладагента, является процесс непрерывного смешения 3He и 4He, для создания и поддержания температур ниже 0,005 K
Газообразный гелий используют как легкий газ для наполнения воздушных шаров.
Поскольку он не горюч, его используют для заполнения оболочки дирижабля, добавляя к водороду.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов.
Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения. В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках).
Большие количества гелия применяют в дыхательных смесях для работ под давлением, так как гелий хуже растворим в крови, чем азот. Например при морских погружениях, при создании подводных тоннелей и сооружений.
При использовании гелия, выделение растворенного газа из крови, декомпрессия, у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, Полностью исключено такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза.
Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и для лечения различных заболеваниях дыхательных путей.
Аргон широко применяется на производстве.
Очень удобна дуговая электросварка в среде аргона, т.к. в аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Считается, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов.
Продувкой аргона через жидкую сталь из нее удаляют газовые включения. Это улучшает свойства металла. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С.
Кроме того газовая струя выдувает продукты резки.
А при сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса.
Применения ксенона, зачастую основано на его способности вступать в реакцию со фтором.
В медицине ксенон получил распространение при рентгеноскопических обследованиях головного мозга. Применяющаяся при просвечивании кишечника (ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения). При этом он совершенно безвреден.
А активный изотоп ксенона, ксенон - 133, используют при исследовании функциональной деятельности легких и сердца.
В светотехнике широко используются ксеноновые лампы высокого давления. Принцип действия основан на том, что в таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер.
Свет в таких лампах ярок и имеет непрерывный спектр — от ультрафиолетового до ближней области инфракрасного, и появляется он сразу после включения.
6. Действие на организм человека.
Было бы естественно полагать, что благородные газы не должны влиять на живые организмы, потому как инертны химически. Однако это не совсем так. В с меси с кислородом вдыхание высших инертных газов приводит человека в состояние, сходное с алкогольным опьянением. Такое наркотическое действие инертных газов обуславливается растворением их в нервных тканях. И чем выше атомный вес инертного газа, тем выше его растворимость, и тем большее наркотическое действие он способен оказывать.
Список литературы.
referat.store
 скачать работу скачать работу |
referat.resurs.kz
Вятский Государственный Технический Университет
Реферат На тему: ” Инертные газы: история открытия, свойства, применение ”
Разработал студент БТ-21
хххххххххххххх
Проверила
Киров 2000 г.
1. История открытия инертных газов.К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. “Воздух при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка. Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18. Этим было доказано, что воздух содержит газ, плотность которого больше плотности азота… Я получил 100 см3 этого вещества и нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную - почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”.
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. “гелиос”, что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что -частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Вначале Рамзай и его сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в конце прошлого века, эти “микроследы” не улавливались. Затем исследователи обратились к воздуху.
Всего за четыре последующих года было открыто четыре новых элемента, при этом неон, криптон и ксенон были выделены из воздуха.
Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. Сначала “летят” более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из методов поиска был спектральный анализ: газ помещали в разрядную трубку, подключали ток и по линиям спектра определяли “кто есть кто”.
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать “болельщиком” отцовых работ. Увидев необычное свечение, он воскликнул: “new one!” Так возникло название газа “неон”, по-древнегречески значит “новый”.
После того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый, пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9, 3 л аргона и всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон (“скрытый”). Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит “чужой”: в криптоновой фракции воздуха он действительно выглядел чужаком. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента! Хотя содержание ксенона в атмосфере крайне мало, именно воздух — практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый — потому, что почти весь ксенон возвращается в атмосферу.
Заслуга открытия высшего представителя инертных газов принадлежит тому же Рамзаю. При помощи весьма тонких технических приёмов он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Его молекулярный вес – около 220 – был Рамзаем измерен по скорости диффузии. Если предположить, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия - -частицы, то заряд его должен быть равен 88-2=86, т.е. новый элемент должен действительно быть инертным газом с атомным весом 226-4=222.
Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов.2. Физические свойства инертных газов.Благородные газы – бесцветные одноатомные газ без цвета и запаха.
Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся: гелий ярко-жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно красным светом, так как самые яркие его линии лежат в красной части спектра.
Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом. Физиологическое действие инертных газов.Естественно было ожидать, что столь химически инертные вещества, как инертные газы, не должны влиять и на живые организмы. Но это не так. Вдыхание высших инертных газов (конечно в смеси с кислородом) приводит человека в состояние, сходное с опьянением алкоголем. Наркотическое действие инертных газов обуславливается растворением в нервных тканях. Чем выше атомный вес инертного газа, тем больше его растворимость и тем сильнее его наркотическое действие.4. Химические свойства инертных газов.
Долгое время не находили условий, при которых благородные газы могли бы вступать в химическое взаимодействие. Они не образовывали истинных химических соединений. Иными словами их валентность равнялась нулю. На этом основании было решено новую группу химических элементов считать нулевой. Малая химическая активность благородных газов объясняется жёсткой восьмиэлектронной конфигурацией внешнего электронного слоя. Поляризуемость атомов растёт с увеличением числа электронных слоёв. Следовательно, она должна увеличиваться при переходе от гелия к радону. В этом же направлении должна увеличиваться и реакционная способность благородных газов.
Так, уже в 1924 году высказывалась идея, что некоторые соединения тяжелых инертных газов (в частности, фториды и хлориды ксенона) термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики — Полинг и Оддо. Изучение электронной структуры оболочек криптона и ксенона с позиций квантовой механики привело к заключению, что эти газы в состоянии образовывать устойчивые соединения с фтором. Нашлись и экспериментаторы, решившие проверить гипотезу, но шло время, ставились опыты, а фторид ксенона не получался. В результате почти все работы в этой области были прекращены, и мнение об абсолютной инертности благородных газов утвердилось окончательно.
Однако в 1961 году Бартлетт, сотрудник одного из университетов Канады, изучая свойства гексафторида платины, соединения более активного, чем сам фтор, установил, что потенциал ионизации у ксенона ниже, чем у кислорода (12, 13 и 12, 20 эв соответственно). Между тем кислород образовывал с гексафторидом платины соединение состава O2PtF6... Бартлетт ставит опыт и при комнатной температуре из газообразного гексафторида платины и газообразного ксенона получает твердое оранжево - желтое вещество — гексафторплатинат ксенона XePtF6, поведение которого ничем не отличается от поведения обычных химических соединений. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XePtF6 + 6Н2О = 2Хе + О2 + 2PtО2 + 12HF
Последующие работы Бартлетта позволили установить, что ксенон в зависимости от условий реакции образует два соединения с гексафторидом платины: XePtF6 и Xe (PtF6) 2; при гидролизе их получаются одни и те же конечные продукты. Убедившись, что ксенон действительно вступил в реакцию с гексафторидом платины, Бартлетт выступил с докладом и в 1962 году опубликовал в журнале “Proceedings of the Chemical Society” статью, посвященную сделанному им открытию. Статья вызвала огромный интерес, хотя многие химики отнеслись к ней с нескрываемым недоверием. Но уже через три недели эксперимент Бартлетта повторила группа американских исследователей во главе с Черником в Аргоннской национальной лаборатории. Кроме того, они впервые синтезировали аналогичные соединения ксенона с гексафторидами рутения, родия и плутония. Так были открыты первые пять соединений ксенона: XePtF6, Xe (PtF6)2, XeRuF6, XeRhF6, XePuF6 — миф об абсолютной инертности благородных газов развеян и заложено начало химии ксенона. Настало время проверить правильность гипотезы о возможности прямого взаимодействия ксенона с фтором.
Смесь газов (1 часть ксенона и 5 частей фтора) поместили в никелевый (поскольку никель наиболее устойчив к действию фтора) сосуд и нагрели под сравнительно небольшим давлением. Через час сосуд быстро охладили, а оставшийся в нем газ откачали и проанализировали. Это был фтор. Весь ксенон прореагировал! Вскрыли сосуд и обнаружили в нем бесцветные кристаллы XeF4. Тетрафторид ксенона оказался вполне устойчивым соединением, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Тетрафторид ксенона фторирует ртуть:ХеF4 + 2Hg = Хe + 2HgF2Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Интересно в химии ксенона то, что, меняя условия реакции, можно получить не только XeF4, но и другие фториды—XeF2, XeF6.
Советские химики В. М. Хуторецкий и В. А. Шпанский показали, что для синтеза дифторида ксенона совсем не обязательны жесткие условия. По предложенному ими способу смесь ксенона и фтора (в молекулярном отношении 1:1) подается в сосуд из никеля или нержавеющей стали, и при повышении давления до 35 атм начинается самопроизвольная реакция.
XeF2 — единственный фторид ксенона, который можно получить, не пользуясь элементарным фтором. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Возможен, конечно, и прямой синтез. Очень чистый ХеF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтористый водород; особенно быстро разложение идет в щелочной среде. Дифторид имеет резкий специфический запах. Большой теоретический интерес представляет метод синтеза дифторида ксенона, основанный на воздействии на смесь газов ультрафиолетового излучения (длина волн порядка 2500—3500 А). Излучение вызывает расщепление молекул фтора на свободные атомы. В этом и заключается причина образования дифторида: атомарный фтор необычайно активен. Для получения XeF6 требуются более жесткие условия: 700° С и 200 атм. В таких условиях в смеси ксенона и фтора (отношение от 1:4 до 1:20) практически весь ксенон превращается в XeF6. Гексафторид ксенона чрезвычайно активен и разлагается со взрывом. Он легко реагируете фторидами щелочных металлов (кроме LiF):XeF6 + RbF = RbXeF7,но при 50° С эта соль разлагается:2RbXeF7 = XeF6 + Rb2XeF8Сообщалось также о синтезе высшего фторида XeF8, устойчивого лишь при температуре ниже минус 196° C.
Синтез первых соединений ксенона поставил перед химиками вопрос о месте инертных газов в периодической системе. Прежде благородные газы были выделены в отдельную нулевую группу, что вполне отвечало представлению об их валентности. Но, когда ксенон вступил в химическую реакцию, когда стал известен его высший фторид, в котором валентность ксенона равна восьми (а это вполне согласуется со строением его электронной оболочки), инертные газы решили перенести в VIII группу. Нулевая группа перестала существовать.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов. Эти вещества обладают повышенной реакционной способностью. Лучше всего изучено взаимодействие фторидов ксенона с водой. Гидролиз ХеF4 в кислой среде ведет к образованию окиси ксенона ХеО3 — бесцветных, расплывающихся на воздухе кристаллов. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Достаточно несколько сотен миллиграммов ХеО3, чтобы эксикатор разнесло в куски. Не исключено, что со временем трехокись ксенона будут использовать как взрывчатое вещество дробящего действия. Такая взрывчатка была бы очень удобна, потому что все продукты взрывной реакции — газы. Пока же использовать для этой цели трехокись ксенона слишком дорого — ведь ксенона в атмосфере меньше, чем золота в морской воде, и процесс его выделения слишком трудоемок. Напомним, что для получения 1 м3 ксенона нужно переработать 11 млн. м3 воздуха. Соответствующая трехокиси неустойчивая кислота шестивалентного ксенона H6XeO6 образуется в результате гидролиза XeF6 при 0° С: XeF6 + 6h3О = 6HF + H6XeO6Если к продуктам этой реакции быстро добавить Ва (ОН)2, выпадает белый аморфный осадок Ва3ХеО6. При 125° С он разлагается на окись бария, ксенон и кислород. Получены аналогичные соли—ксенонаты натрия и калия. При действии озона на раствор ХеО3 в одномолярном едком натре образуется соль высшей кислоты ксенона Na4ХеО6. Перксенонат натрия может быть выделен в виде бесцветного кристаллогидрата Na4XeO6 · 6Н2О. К образованию перксенонатов приводит и гидролиз XeF6 в гидроокисях натрия и калия. Если твердую соль Na4XeO6 обработать раствором нитрата свинца, серебра или уранила, то получаются соответствующие перксенонаты: PbXeO6 и (UO2) 2XeO6 желтого цвета и Ag4XeO6 — черного. Аналогичные соли дают калий, литий, цезий, кальций.
Окисел, соответствующий высшей кислоте ксенона, получают взаимодействием Na4XeO6 с безводной охлажденной серной кислотой. Это четырехокись ксенона ХеO4. В ней, как и в октафториде, валентность ксенона равна восьми. Твердая четырехокись при температуре выше 0° С разлагается на ксенон и кислород, а газообразная (при комнатной температуре) — на трехокись ксенона, ксенон и кислород. Молекула ХеO4 имеет форму тетраэдра с атомом ксенона в центре. В зависимости от условий гидролиз гексафторида ксенона может идти двумя путями; в одном случае получается тетраоксифторид XeOF4, другом — диоксифторид XeO2F2. Прямой синтез из элементов приводит к образованию оксифторида ХеОF2. Все это бесцветные твердые вещества, устойчивые в обычных условиях.
Очень интересна изученная недавно реакция дифторида ксенона с безводной НС1O4. В результате этой реакции получено новое соединение ксенона ХеСlO4 — чрезвычайно мощный окислитель, вероятно, самый сильный из всех перхлоратов.
Синтезированы также соединения ксенона, не содержащие кислорода. Преимущественно это двойные соли, продукты взаимодействия фторидов ксенона с фторидами сурьмы, мышьяка, бора, тантала: XeF2 · SbF5, ХеF6 · AsF3, ХеF6 · ВF3 и ХеF2 · 2ТаF5. И наконец, получены вещества типа XeSbF6, устойчивые при комнатной температуре, и XeSiF6 — нестойкий комплекс.
В распоряжении химиков имеются весьма незначительные количества радона, тем не мене удалось установить, что он также взаимодействует с фтором, образуя нелетучие фториды. Для криптона выделены и изучены дифторид KrF2 и тетрафторид KrF4 по свойствам, напоминающим соединения ксенона.
5. Применение инертных газов.Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии.
Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля.
Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений. При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза. Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов.
Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения. В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств. Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3He и 4He для создания и поддержания температур ниже 0,005 K
Области применения ксенона разнообразны и порой неожиданны. Человек использует и его инертность и его чудесную способность вступать в реакцию со фтором. В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр — от ультрафиолетового до ближней области инфракрасного. Ксеноном пользуются и медики — при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден. Активный изотоп элемента № 54, ксенон - 133, используют при исследовании функциональной деятельности легких и сердца.
Продувкой аргона через жидкую сталь из нее удаляют газовые включения. Это улучшает свойства металла.
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса
Список использованной литературы1. Петров М.М., Михилев Л.А., Кукушкин Ю.Н. “Неорганическая химия”
2. Гузей Л.С. Лекции по общей химии”
3. Ахметов Н.С. “Общая и неорганическая химия”
4. Некрасов Б.В. “Учебник общей химии”
5. Глинка Н.Л. “Общая химия
6. Ходаков Ю.В. “Общая и неорганическая химия”
l.120-bal.ru