контрольная работа по теме «Строение атома» | Учебно-методический материал по химии (8 класс) на тему:
8 класс
Контрольная работа. Строение атома, строение электронных оболочек.
Вариант №1.
1.Выберите характеристики атома:
А)электронейтральная частица, состоящая из протонов, электронов, нейтронов
Б)положительно заряженная элементарная частица
В)содержит одинаковое число протонов и электронов, равное порядковому номеру ХЭ
Г)отрицательно заряженная элементарная частица
Д)электронейтральная элементарная частица
2. Какие частицы можно назвать нуклонами?
А)электроны Б)атомы В)протоны г)молекулы д)нейтроны
3.Заряд ядра +9 имеет атом:
А)Беррилий Б)неон В)сера Г)фтор
4.По два электронных слоя имеют атомы:
А)гелия и лития Б)беррилия и магния В)бора и кислорода Г)алюминия и натрия
5.Какая электронная формула соответствует атому хлора?
А) 1s2,2s2,2p6,3s2,3p5 Б)1s2,2s2,2p6,3s2,3p3 Г)1s2,2s2,2p5 Д)1s2,2s2,2p6
6. Второй энергетический уровень завершен в атоме:
Второй энергетический уровень завершен в атоме:
А)B Б)Ne В)F Г)Са д)Si е)Be
7. Установите соответствие:
Атом химического элемента: Состав атома:
1)сера а)8p,8n,8e г)8p,9n,8e
2)кислород б)14p,14n,14e д)16p,20n,16e
3)кремний в) 16p,17n,16e е) 8p,10n,8e
8. Установите соответствие.
Число электронов в электронной Символ химического
оболочке атома: элемента:
1)9 а)Fe б)Ca в)K г)Zr
2)20 д)F е)Ne ж)Ba з)Au
3)56 и)Be
9. Установите соответствие.
Установите соответствие.
Сокращенная электронная формула: Полная электронная формула:
1)2e, 8e, 3e а)1s2,2s2,2p2 д)1s2,2s2,2p3
2)2e, 5e б)1s2,2s2,2p6,3s2,3p6,4s1 е) 1s2,2s2,2p6
3)2e,8e,8e,1e в)1s2,2s2,2p6,3s2,3p1
4)2e,8e г)1s2,2s2,2p5
10.Установите соответствие:
Электронные формулы атомов: Положение ХЭ в таблице Д.И.Менделеева:
1)1s2,2s2,2p6,3s2,3p6,4s2 а)2-й период, IV группа
2)1s2,2s2,2p1 б)4-й период, II группа, главная подгруппа
В)2-й период, I группа
Г)2-й период, III группа
8 класс
Контрольная работа. Строение атома, строение электронных оболочек.
Строение атома, строение электронных оболочек.
Вариант №2.
1.Выберите характеристики электрона:
А)заряд равен -1, масса почти в 2000 раз меньше массы атома водорода
Б)заряд равен +1, масса равна 1 (относительной атомной массе водорода).
В)электронейтральная элементарная частица с массой, равной 1.
Г)мельчайшая частица вещества, сохраняющая его химические свойства
Д)поток частиц отклоняется к положительно заряженной пластине
2.Какие элементарные частицы не входят в состав ядра атома?
А) протоны Б)нейтроны В)электроны
3.Заряд ядра +12 имеет атом:
А)магния Б)углерода В)серы Г)неона
4.Четыре энергетических уровня содержат электронные оболочки атомов:
А)калия В)бериллия
Б)серебра Г)меди
5. Шесть электронов находится на внешних энергетических уровнях атомов:
А)углерода В)серы Д)золота
Б)кислорода Г)хрома
6. Укажите элемент, в атоме которого завершен третий энергетический уровень:
Укажите элемент, в атоме которого завершен третий энергетический уровень:
А)аргон Б)неон В)натрий Г)сера Д)хлор
7.Установите соответствие.
Атом химического элемента: Состав атома:
1)алюминий а)10p,10n,10e г)20p,20n,18e
2)кальций б)13p,14n,10e д)19p,20n,19e
3)неон в)20p,20n,20e е)13p,14n,13e
8.Установите соответствие.
Число электронов в электронной Символ химического
оболочке атома: элемента:
1)7 а)Li б)K в)F г)Na
2)11 д)B е)N ж)Cu з)Cl
3)29 и)Si
9. Установите соответствие.
Установите соответствие.
Сокращенные Положение ХЭ Химический знак элемента:
электронные в ПСХЭ:
формулы:
А)2е, 1е 1)3-й период, II А-группа а)K б)С в)Са г)S
Б)2е,8е,6е 2)4-й период, II А-группа д)Li е)О
В)2е,4е 3)3-й период, VI А-группа
Г)2е,8е,8е,2е 4)2-й период, I А-группа
5)3-й период, III А-группа
6)2-й период, IV А-группа
10.Выберите электронные формулы атомов химических элементов V группы главной подгруппы:
А) 1s2,2s2,2p6,3s2,3p3
Б) 1s2,2s2,2p1
В) 1s2,2s2,2p5
Г) 1s2,2s2,2p3
Д) 1s2,2s2,2p6,3s2,3p5
Контрольная работа № 4 по теме «Периодический закон и периодическая система химических элементов.
 Строение атома» и «Строение вещества. Химическая связь»
Строение атома» и «Строение вещества. Химическая связь»Всероссийский конкурс педагогического мастерства для школьных учителей «Контрольная работа в формате теста по химии»
Контрольная работа № 4 по теме «Периодический закон и периодическая система химических элементов. Строение атома» и «Строение вещества. Химическая связь»
I вариант
1. Определите, какие из указанных элементов
1) Cl 2) Na 3) S 4) Ва 5) N
относятся к металлам.
2. Определите, атомы каких из указанных элементов
1) Cl 2) K 3) Ne 4) Mg 5) N
имеют три электронных слоя.
3. Определите, атомы каких из указанных элементов
1) H 2) B 3) S 4) Mg 5) Al
имеют три электрона на внешнем слое.
4. Определите, в атомах каких элементов:
1) Li 2) C 3) Ве 4) B 5) Na
в основном состоянии отсутствуют электроны на p-орбитали.
5. Порядковый номер элемента для атома 63Х, в ядре которого находится
34 нейтрона, равен …….
6. Выберите из указанных элементов, элементы второго периода
1) Li 2) C 3) S 4) B 5) Mg
и расположите в порядке уменьшения радиуса атома.
7. Выберите из указанных элементов, элементы IIА группы
1) Cа 2) N 3) Вa 4) O 5) Mg
и расположите в порядке уменьшения радиуса атома.
8. Расположите указанные элементы
1) Al 2) Si 3) S 4) Cl 5) Mg
в порядке усиления металлических свойств.
9. Определите, какие из указанных веществ
1) хлор
2) бромид натрия
3) оксид серы (IV)
4) оксид алюминия
5) бромоводород
являются веществами с ковалентной полярной связью.
10. Определите, в каких соединениях
1) S 2) Na2S 3) SO2 4) Н2SО3 5) Na2SO4
сера имеет степень окисления +4.
11. Установите соответствие между атомом элемента (1 столбец) и количеством неспаренных электронов в основном состоянии (2 столбец).
1 столбец | 2 столбец |
А) К Б) Be В) Si Г) B |
|
12. Установите соответствие между формулой высшего оксида элемента (1 столбец) и его электронной формулой (2 столбец).
1 столбец | 2 столбец |
А) Э2О3 Б) Э2О В) ЭО3 Г) ЭО |
|
13. Установите соответствие между элементом (1 столбец) и характером его высшего оксида (2 столбец).
Установите соответствие между элементом (1 столбец) и характером его высшего оксида (2 столбец).
1 столбец | 2 столбец |
А) C Б) S В) Na Г) Be |
|
14. Установите соответствие между частицей (1 столбец) и распределением электронов по энергетическим уровням (2 столбец).
1 столбец | 2 столбец |
А) N—3 Б) P+3 В) Cl+5 Г) C0 |
|
15. Выберите верные утверждения.
- Высшая степень окисления кислорода соответствует номеру группы.
- Способность атомов элемента присоединять электроны увеличивается в периоде слева направо.
- Завершенный внешний электронный слой имеет атом аргона.
- Атомы металлов всегда более электроотрицательны, чем атомы неметаллов
- Количество частиц в атоме кислорода (изотоп 16O): p+ –16 n0 – 8 ē – 8
- Высшая степень окисления фтора равна 0.
- У иодида натрия молекулярная кристаллическая решетка.
Контрольная работа № 4 по теме «Периодический закон и периодическая система химических элементов. Строение атома» и «Строение вещества. Химическая связь»
II вариант
1. Определите, какие из указанных элементов
1) Р 2) Na 3) О 4) Mg 5) Вe
относятся к неметаллам.
2. Определите, атомы каких из указанных элементов
Определите, атомы каких из указанных элементов
1) S 2) Ca 3) С 4) H 5) F
имеют два электронных слоя.
3. Определите, атомы каких из указанных элементов
1) Na 2) Be 3) O 4) Mg 5) P
имеют два электрона на внешнем слое.
4. Определите, в атомах каких элементов:
1) Al 2) N 3) F 4) B 5) Cl
в основном состоянии полностью заполнена 2p-орбиталь.
5. В ядре атома элемента 37Э находится
20 нейтронов, его порядковый номер равен ……
6. Выберите из указанных элементов, элементы третьего периода
1) N 2) Mg 3) P 4) Si 5) F
и расположите их в порядке увеличения радиуса атома.
7. Выберите из указанных элементов, элементы IIIА группы
1) Al 2) B 3) Si 4) Ga 5) S
и расположите их в порядке увеличения радиуса атома.
8. Расположите указанные элементы
1) Na 2) Li 3) Rb 4) Cs 5) K
в порядке ослабления металлических свойств.
- Определите, какие из указанных веществ
1) оксид углерода (IV)
2) оксид натрия
3) водород
4) хлороводород
5) хлорид бария
являются веществами с ионной связью.
10. Определите, в каких соединениях
1) Nа3Р 2) Р2O3 3) РF3 4) Н3PO4 5) P
фосфор имеет степень окисления +3.
11. Установите соответствие между атомом элемента (1 столбец) и количеством неспаренных электронов в основном состоянии (2 столбец).
1 столбец | 2 столбец |
А) N Б) Mg В) O Г) Cl |
|
12. Установите соответствие между формулой высшего оксида элемента (1 столбец) и его электронной формулой (2 столбец).
1 столбец | 2 столбец |
А) ЭО Б) ЭО2 В) Э2О7 Г) Э2О5 |
|
13. Установите соответствие между химическим элементом (1 столбец) и характером его высшего оксида (2 столбец).
1 столбец | 2 столбец |
А) K Б) Al В) Cl Г) Ca |
|
14. Установите соответствие между частицей (1 столбец) и распределением электронов по энергетическим уровням (2 столбец).
Установите соответствие между частицей (1 столбец) и распределением электронов по энергетическим уровням (2 столбец).
1 столбец | 2 столбец |
А) S+2 Б) Al0 В) O—2 Г) S+6 |
|
15. Выберите верные утверждения.
- Высшая степень окисления серы соответствует номеру группы.
- Способность атомов элемента отдавать электроны уменьшается в группе сверху вниз.
- Общим для элементов главной подгруппы II группы является число электронов в атоме.
- Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства серы
- Количество частиц в атоме хлора (изотоп 35Cl ): р+ – 17 n0 – 35 ē – 17
- Низшая степень окисления хлора равна −1.

- У оксида углерода (IV) молекулярная кристаллическая решетка.
ПРОВЕРКА КОНТРОЛЬНОЙ РАБОТЫ НА ПЛАГИАТ.
Уникальность теста 100 % проверено 17.03.2020 г.
https://text.ru/antiplagiat/5e703ed11cf89 1 вариант
https://text.ru/antiplagiat/5e703d84bde69 2 вариант
▶▷▶▷ контрольная работа по теме строения атома ответы
▶▷▶▷ контрольная работа по теме строения атома ответы| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 11-08-2019 |
контрольная работа по теме строения атома ответы — Контрольная работа 5 по теме строение атома и атомного textarchiveruc-2261607html Cached Контрольная работа 5 по теме Строение атома и атомного ядра Вариант 1 Явление радиоактивности, открытое Беккерелем, свидетельствует о том, что Контрольная работа по теме Строение атома и атомного ядра pandiarutext8012419525php Контрольная работа по теме Строение атома и атомного ядра Вариант 1 Явление радиоактивности, открытое Беккерелем, свидетельствует о том, что А Контрольная работа 5 по теме Строение атома и атомного ядра gigabazarudoc83564html Cached Контрольная работа 5 по теме Строение атома и атомного ядра Вариант 1 Явление радиоактивности, открытое Беккерелем, свидетельствует о том, что Контрольная работа по теме Строение атома и атомного ядра infourokrukontrolnaya-rabota-po-teme-stroenie Cached Другие методич материалы Контрольная работа по теме Строение атома и атомного ядра Использование энергии атомных ядер Ответы Проверочная работа по теме Строение атома infourokruproverochnaya-rabota-po-teme Cached Проверочная работа для текущего контроля знаний по теме Строение атома (строение электронных оболочек атомов первых 20 элементов периодической системы ДИ Менделеева) контрольная работа по теме Строение атома nsportalrushkolakhimiyalibrary20141128 Cached Контрольная работа по теме Строение атома 1 Какой химический элемент расположен в Периодической системе ДИ Менделеева в 4-м периоде va-группы? 9 класс Контрольная работа по теме: Строение атома и kopilkaurokovrufizikauroki9_klass Cached Итоговая контрольная по теме Строение атома и атомного ядра Использование энергии атомных ядер Работа представлена в 4-х вариантах Контрольная работа по химии 9 класс по теме органические docplayerru70083919-Kontrolnaya-rabota-po Cached Контрольная работа по химии 9 класс по теме органические вещества ответы Контрольная работа по теме Теория строения органических соединений АМБутлерова 1 вариант Часть А 1 Контрольная работа по химии Неметаллы, 9 класс intolimporgpublicationkontrol-naia-rabota-po Cached Контрольная работа по теме Неметаллы Вариант 1 Часть А Выполните тест А1 В каком ряду представлены простые вещества-неметаллы: 1) хлор, никель, серебро 3) железо, фосфор, ртуть Контрольная работа 5 по теме Строение атома и атомного pandiaru476339 Cached Контрольная работа 5 по теме Строение атома и атомного ядра Вариант 2 1 В состав радиоактивного излучения могут входить А Только электроны Б Только нейтроны В Только альфа-частицы Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of 1 2 3 4 5 Next 15,900
- В ядре атома химического элемента 16 протонов и 22 ней трона.

- ольная работа по теме Строение атома и атомного ядра, 9 класс. 7.Атом элемента имеет на 4 электрона меньше, чем ион хлора. Контрольная работа по химии 8 класс по темам:Атомы химических элементов и Пр
- меньше, чем ион хлора. Контрольная работа по химии 8 класс по темам:Атомы химических элементов и Простые вещества.
В основном состоянии три неспаренных электрона имеет атом 1) кремния 2) фосфора 3) серы 4) хлора 6. Тема: Электронные конфигурации атомов химических элементов.
Составьте электронную формулу атома цинка. Тема: Барионный гидродинамический удар глазами современников Конспект урока для 10 класса по теме Мыла и синтетические моющие средства
Учительский портал — сообщество учителей России и ближнего Зарубежья. Презентации, уроки и тесты для учителей, обмен авторскими методическими разработками. Контрольная работа по теме Строение атома. Материал соответствует аннотации, есть ответы.
Напиши электронную формулу элемента, заряд ядра атома которого равен 11.
обмен авторскими методическими разработками. Контрольная работа по теме Строение атома. Материал соответствует аннотации
обмен авторскими методическими разработками. Контрольная работа по теме Строение атома. Материал соответствует аннотации
- серебро 3) железо
- что Контрольная работа по теме Строение атома и атомного ядра infourokrukontrolnaya-rabota-po-teme-stroenie Cached Другие методич материалы Контрольная работа по теме Строение атома и атомного ядра Использование энергии атомных ядер Ответы Проверочная работа по теме Строение атома infourokruproverochnaya-rabota-po-teme Cached Проверочная работа для текущего контроля знаний по теме Строение атома (строение электронных оболочек атомов первых 20 элементов периодической системы ДИ Менделеева) контрольная работа по теме Строение атома nsportalrushkolakhimiyalibrary20141128 Cached Контрольная работа по теме Строение атома 1 Какой химический элемент расположен в Периодической системе ДИ Менделеева в 4-м периоде va-группы? 9 класс Контрольная работа по теме: Строение атома и kopilkaurokovrufizikauroki9_klass Cached Итоговая контрольная по теме Строение атома и атомного ядра Использование энергии атомных ядер Работа представлена в 4-х вариантах Контрольная работа по химии 9 класс по теме органические docplayerru70083919-Kontrolnaya-rabota-po Cached Контрольная работа по химии 9 класс по теме органические вещества ответы Контрольная работа по теме Теория строения органических соединений АМБутлерова 1 вариант Часть А 1 Контрольная работа по химии Неметаллы
- свидетельствует о том
контрольная работа по теме строения атома ответы Все результаты Контрольная работа по теме Строение атома и атомного ядра Видеоурок Контрольная работа по теме Строение атома и атомного ядра вокруг которого по своим орбитам обращаются электроны Ответ Контрольная работа по теме Строение атома и Инфоурок Физика мая г Cкачать Контрольная работа по теме Строение атома и атомного ядра Использование энергии атомных ядер Ответы класс Контрольная работа по теме Строение атома и атомного Физика апр г Cкачать класс Контрольная работа по теме Строение атома и атомного ядра Учитель Нуждина ЕН Ответы вариант Физика класс Контрольная работа по теме Строение атома и Контрольная работа по теме Строение атома и атомного ядра Физика Учебный план; Отзывы ; Вопросы и ответы Вариант Длительность минут Контрольная работа Тест Контрольная работа Тест Контрольная работа по теме Строение атома и атомного ядра мар г Контрольная работа по физике Строение атома и атомного ядра Состоит из заданий заданий с выбором ответа задания Контрольная работа по теме Строение атома класс Документ Составьте химические формулы веществ, молекулы которых имеют состав а два атома фосфора и три атома кислорода; бодин атом Контрольная работа по теме строение атома и атомного ядра Знакомства, Любовь, Отношения Прочие взаимоотношения Пользователь Виктория Вайнгардт задал вопрос в категории Прочие взаимоотношения и получил на него ответ Контрольная работа по теме строение атома и атомного textarchiveruchtml Контрольная работа по теме строение атома и атомного ядра вариант Чему равно массовое число ядра атома марганца Мn? Таблица перевода числа правильных ответов на обязательные вопросы в оценку Контрольная работа по теме СТРОЕНИЕ АТОМА Открытый класс wwwopenclassrunode Похожие сент г КОНТРОЛЬНАЯ РАБОТА по теме Строение атома Опишите химический элемент с порядковым номером на основании его Контрольная работа по теме Строение атома Docwebru Похожие Скачать к уроку химии Контрольная работа по теме Строение атома Часть А Определите химический элемент по составу его атома p , n , e а F б Ca в Ar г Sr Общее число Поясните ответ Изменится ли контрольная работа по теме строение атома RefinerLink wwwrefinerlinkcomkontrolnaiarabotapotemestroenieatoma_stroenieveshc апр г контрольная работа по теме строение атома строение веществ гдз рабочая тетрадь окружающий мир класс плешаков новицкая Самостоятельная работа по физике класс по теме Строение янв г контрольная работа по химии класс, по теме Строение вещества контрольная урок химии в классе по теме Строение атома контрольная работа по теме химическая связь и строение атома wwwvkprukontrolnaiarabotapotemekhimicheskaiasviazistroenieatomaxml нояб г контрольная работа по теме химическая связь и строение атома с различным уровнем сложности задания Ответы можно проверить контрольная работа по химии по теме электронное строение атома wwwvkprukontrolnaiarabotapokhimiipotemeelektronnoestroenieatomaxm контрольная работа по химии по теме электронное строение атома варианта с ответами и шкалой оценивания Контрольная работа по темам Контрольная работа по теме Строение атома химия, тесты Библиотека Химия класс Тесты февр г Контрольная работа с критериями оценки для обучающихся класса Контрольная работа по теме Строение атома Контрольная работа с критериями оценки для Выбран правильный ответ балл А контрольная работа по физике строение атома с ответами wwwzabawajudoplkontrolnaiarabotapofizikestroenieatomasotvetamixml нояб г Физика класс Контрольная работа по теме Строение атома и атомн Контрольная работа по теме Строение атома и атомного Контрольная работа по химии класс по теме Строение атома stroenieatoma Контрольная работа по химии класс по теме Строение атома Автор учитель химии I квалификационной категории Дубанова Ольга Викторовна Картинки по запросу контрольная работа по теме строения атома ответы Показать все Другие картинки по запросу контрольная работа по теме строения атома ответы Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты контрольная работа по химии класс периодический закон ответы asppermrukontrolnaiarabotapokhimiiklassperiodicheskiizakonotvetyxml контрольная работа по химии класс периодический закон ответы Закон Ответы images Контрольная работа по темам Строение атома и связь Ответы к контрольной работе по теме Строение атома Итоговый тест Контрольная работа по теме Строение атома Химическая связь мая г Работа по теме Строение атома и химическая связь Глава Общая химия АиАХ, ПТМ, ПТЭ, РС, МиТЭ контрольные работы Строение атома и химическая связьdoc Скачиваний Ответ поясните контрольная работа класс периодический закон и строение lejuristerufileskontrolnaiarabotaklassperiodicheskiizakonistroenieatomaxml апр г Проверочная работа по теме Окислительновосстановительные реакции атома Контрольная работа по химии на тему Строение атома Химия по теме строение атома класс ответы контрольная работа по Контрольная работа по теме Строение атома Периодический янв г Контрольная работа по теме Строение атома Периодический Материал соответствует аннотации, есть ответы Если Вы хотите Многовариантная контрольная работа по теме Строение атома Похожие нояб г Контрольная работа Фамилия Имя_________________________________Вариант__ Для химического элемента с порядковым Контрольная работа по теме Строение атома и атомного ядра wwwкадетрфstudentsvideotutorialsphysicsphysicsclassphysicsphp Похожие Цитата недели Живее всех живых кадетский Бессмертный полк Мая самый священный День для россиян одна радость на всех, одна Контрольная работа по химии в м классе по теме Строение открытыйурокрфстатьи Контрольная работа по химии в м классе по теме Строение атома Ответ поясните используя любую форму записи слово, схему, рисунок Химия DOC по проведению тематической диагностической работы krasnogvardnmcspbruZIPChim_DRzip?PHPSESSID Похожие Данная работа может заменить контрольную работу , проводимую в ОУ ТЕМА Периодический закон и периодическая система химических элементов теорий строения атома , химической связи для анализа строения и свойств веществ Полный правильный ответ задания части В балла, Контрольная работа по теме строение атома строение вещества aktivstroyspbru Форум апр г Реферат на тему Строение атома готовая работа бесплатно ответов Цель формирование исследовательской компетенции и контрольная работа в классе строение атома строение wwwengelsspravkarukontrolnaiarabotavklassestroenieatoma_stroenieves контрольная работа в классе строение атома строение вещества реакции Разное Контрольная работа по теме Строение вещества класс класс строение вещества ответы Контрольная работа по химии кр doc Контрольная работа по химии Тема Строение атома Тема Строение атома Файл кр doc Контрольная работа по химии При выполнении заданий части А на листе ответов напишите определения контрольная работа периодический закон строение атома класс sofarfrancecomkontrolnaiarabotaperiodicheskiizakonstroenieatomaklassx контрольная работа периодический закон строение атома класс ДИ , Контрольная работа по теме Строение атома Решебник по химии за Контрольная работа ПСХЭ и строение атома класс Вариант Контрольная работа ПСХЭ и строение атома класс Вариант Контрольная работа по теме Неорганическая химия Вариант I А Ответ , г S S S Н S ВаS Дайте характеристику реакции с точки контрольная работа по физике класс на тему строение атома mosvagruimglibkontrolnaiarabotapofizikeklassnatemustroenieatomaxml мая г контрольная работа по физике класс на тему строение атома ядра, Использование энергии атомных ядер класс с ответами Тест Тест по теме Строение атома класс Все для учителя Тест по дек г Тест по Строение атома Учебник физики класс, Пёрышкин АВ Презентация Контрольная работа по Химии Периодический закон, строение класс Контроль знаний по химии для учащихся класса триместр по теме Периодический закон, строение атома Химическая связь Классы PDF Контрольная работа по химии класс строение атома ответы работа Контрольная работа по теме Строение атома РАЗРАБОТКИ ПО ХИМИИ класс поурочные разработки разработки Ответы на вопросы DOC Административная контрольная работа за I полугодие по химии s_eduruDswMediaximiyapolugodiekldoc Похожие Административная контрольная работа за I полугодие по химии Опыты Резерфорда Планетарная модель строения атома ответов несколько Контрольная работа по теме Строение атома Контрольная работа по теме Строение атома система химических элементов Д И Менделеева СТРОЕНИЕ АТОМА Ответы на вопросы Подготовка к контрольной работе по теме Строение атома и мая г Диагностическая контрольная работа по физике для и классов Подготовка к контрольной работе по теме Строение атома и контрольная работа по физике класс атом атомное ядро ответы roskinoorgkontrolnaiarabotapofizikeklassatomatomnoeiadrootvetyxml Контрольная работа по теме Строение атома и атомного ядра infourokrukontrolnayarabotapotemestroenie Cached Контрольная работа по контрольная работа по физике класс строение атома с ответами wwwdmvilijaltkontrolnaiarabotapofizikeklassstroenieatomasotvetamixm Физика класс ЕНТ, КТА, образование, тесты, Физика класс Контрольная работа по теме Строение атома и атомного ядра Контрольные работы DOC Контрольная работа класс wwweduportalruКодификатордлякрклассФГОСdoc Спецификация КИМ для проведения контрольной работы по теме Атомы химических Строение электронных оболочек атомов первых элементов Представлен правильный ответ на вопрос и приведено достаточное Контрольная работа по темам Строение атома и Продлёнка авг г Контрольная работа составлена по программе Габриеляна ОС по темам Строение атома и периодический закон, Строение вещества урока по химии класса в стихотворной форме на тему Основания вопрос Публикации учащихся Онлайн тесты Вопрос ответ FAQ Для Контрольная работа Строение атома класс скачать Скачать Контрольная работа Строение атома класс Контрольная работа по теме Строение атома I ПСХЭ Объясните свой ответ PDF профильный уровень Школа Narodru mooschnarodrurphimiyaprpdf ответ полный и правильный на основании изученных теорий; материал Контрольная работа по теме Строение атома КР Раздел II Контрольная работа по теме Строение атома и ABru abru_kontrolnaya_rabota_po_teme_stroenie_atoma_i_atomnogo_yadra_ Похожие Контрольная работа по теме Строение атома и атомного ядра физика класс Опубликовано Автор Канайкин Иван Никитович Химия класс Контрольная работа Строение атома с Похожие окт г класс Контрольная работа Строение атома балла Установите соответствие ответ приведите в виде сочетания букв и цифр Контрольная работа по теме Периодический закон и УчМет Химия класс окт г Контрольная работа по теме Периодический закон и периодическая система химических элементов ДИМенделеева Строение атома контрольная работа на тему строение атома Conceptronic wwwconceptronicnetkontrolnaiarabotanatemustroenieatoma_periodicheskii апр г контрольная работа на тему строение атома периодический закон работы по этой теме Вопросы и ответы к теме Устное народное DOC Пояснительная записка Планирование составлено на основе wwwschoolklgdrufilesarticlesinformationeducationbasicpdocx?v В программе определён перечень практических занятий и контрольных работ современные представления о строении атома атом, изотопы, атомные орбитали, особенности строения не даны ответы на вспомогательные вопросы учителя; Содержание работы полностью соответствует теме DOC Итоговая контрольная работа Средняя общеобразовательная mboshedusiterusvedenfilesffffebbecfededocx , Алюминий Строение атома , физические и химические свойства простого вещества , Контрольная работа по теме Органические вещества При выполнении заданий этой части выберите один правильный ответ Вместе с контрольная работа по теме строения атома ответы часто ищут контрольная работа по теме атомная физика класс ответы глава строение атома и атомного ядра контрольная работа контрольная работа строение атома и атомного ядра класс вариант контрольная работа строение атома и атомного ядра использование энергии ответы контрольная работа по теме строение атома и атомного ядра контрольная работа по теме строение атома химическая связь контрольная работа по физике класс атомное ядро ядерная энергия контрольная работа по теме строение атома и атомного ядра Документы Blogger Duo Hangouts Keep Jamboard Подборки Другие сервисы
В ядре атома химического элемента 16 протонов и 22 ней трона. Дидактические материалы 9 класс Контрольная работа по теме Строение атома и атомного ядра, 9 класс.
7.Атом элемента имеет на 4 электрона меньше, чем ион хлора. Контрольная работа по химии 8 класс по темам:Атомы химических элементов и Простые вещества.
В основном состоянии три неспаренных электрона имеет атом 1) кремния 2) фосфора 3) серы 4) хлора 6. Тема: Электронные конфигурации атомов химических элементов.
Составьте электронную формулу атома цинка. Тема: Барионный гидродинамический удар глазами современников Конспект урока для 10 класса по теме Мыла и синтетические моющие средства
Учительский портал — сообщество учителей России и ближнего Зарубежья. Презентации, уроки и тесты для учителей, обмен авторскими методическими разработками. Контрольная работа по теме Строение атома. Материал соответствует аннотации, есть ответы.
Напиши электронную формулу элемента, заряд ядра атома которого равен 11. Различные темы. Строение атома. Контрольно измерительные материалы_55188.
Дидактические материалы 9 класс Контрольная работа по теме Строение атома и атомного ядра, 9 класс.
7.Атом элемента имеет на 4 электрона меньше, чем ион хлора. Контрольная работа по химии 8 класс по темам:Атомы химических элементов и Простые вещества.
В основном состоянии три неспаренных электрона имеет атом 1) кремния 2) фосфора 3) серы 4) хлора 6. Тема: Электронные конфигурации атомов химических элементов.
Составьте электронную формулу атома цинка. Тема: Барионный гидродинамический удар глазами современников Конспект урока для 10 класса по теме Мыла и синтетические моющие средства
Учительский портал — сообщество учителей России и ближнего Зарубежья. Презентации, уроки и тесты для учителей, обмен авторскими методическими разработками. Контрольная работа по теме Строение атома. Материал соответствует аннотации, есть ответы.
Напиши электронную формулу элемента, заряд ядра атома которого равен 11. Различные темы. Строение атома. Контрольно измерительные материалы_55188. Тест по теме социальная сфера.
5. Вы являетесь преподавателем и беседуете с учеником о плотной упаковке атомов в кристалле металла. К.З.т : Контрольная работа 1 по темам Строение атома.
7. От атома лития отделился один электрон. Тема электризация электрическое поле. 4. Какое строение имеет атом? Физика 8 (Гутник) Самостоятельная работа по теме Электризация.
А) количеству протонов Б) массе атома В) количеству нейтронов Г) заряду ядра. Контрольная работа по теме строение атома. Часть А. с выбором одного ответа.
Контрольная работа по теме: Строение атома и вещества. Тест состоит из 3-х частей: в части А предполагается выбор 1 правильного ответа,…
Тест по теме социальная сфера.
5. Вы являетесь преподавателем и беседуете с учеником о плотной упаковке атомов в кристалле металла. К.З.т : Контрольная работа 1 по темам Строение атома.
7. От атома лития отделился один электрон. Тема электризация электрическое поле. 4. Какое строение имеет атом? Физика 8 (Гутник) Самостоятельная работа по теме Электризация.
А) количеству протонов Б) массе атома В) количеству нейтронов Г) заряду ядра. Контрольная работа по теме строение атома. Часть А. с выбором одного ответа.
Контрольная работа по теме: Строение атома и вещества. Тест состоит из 3-х частей: в части А предполагается выбор 1 правильного ответа,…
Урок №58. Контрольная работа №4 по темам « Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома» и «Химическая связь. Строение вещества»
Итоговая контрольная работа
1 вариант
ФИ ________________________________________Класс: _____
1. Укажите число электронов на последнем энергетическом уровне в атоме берилия:
Укажите число электронов на последнем энергетическом уровне в атоме берилия:
А) 1 Б) 2 В) 5 Г) 4
2. Укажите число энергетических уровней в атоме калия:
А) 2 Б) 3 В) 4 Г) 6
3. Укажите число нейтронов в атоме кремния:
А) 27 Б) 12 В) 13 Г) 14
4. Укажите электронную формулу (паспорт) атома фтора:
А) 1s22s22p1 Б) 1s22s22p3 В) 1s22s22p4 Г) 1s22s22p5
5. Установите соответствие
А) H2SO4 a) Соли
Б) К2СО3 б) Кислотный оксид
В) Сu(OH)2 в) Основный оксид
Г) Na2O г) Основание
Д) P2O5 д) кислота
6. Закончите уравнения реакций, укажите тип, подпишите названия полученных веществ.
Закончите уравнения реакций, укажите тип, подпишите названия полученных веществ.
А) Ba (OH)2+ HCl =
Б) HNO3+ Al2O3=
В) СО2+ NaOH=
Г) SO2+CaO=
7. Вычислите количество вещества (моль) калия, необходимого для реакции с 2,24 л хлора (н.у)
8. Разберите сущность окислительно-восстановительной реакции (определите степени окисления каждого элемента, сделайте электронный баланс)
К + Сl2= KCl
Выпишите: а) вещество с ионной связью _________________________________________
б) вещество с ковалентно неполярной связью _____________________________________
в) изобразите электронные схемы образования их связей____________________________
____________________________________________________________________________
Итоговая контрольная работа
2 вариант
ФИ ________________________________________Класс: _____
1. Укажите число электронов на последнем энергетическом уровне в атоме фосфора:
Укажите число электронов на последнем энергетическом уровне в атоме фосфора:
А) 2 Б) 3 В) 4 Г) 5
2. Укажите число энергетических уровней в атоме углерода:
А) 2 Б) 3 В) 5 Г) 7
3. Укажите число нейтронов в атоме натрия:
А) 11 Б) 12 В) 13 Г) 23
4. Укажите электронную формулу (паспорт) атома азота:
А) 1s22s22p1 Б) 1s22s22p3 В) 1s22s22p2 Г) 1s22s22p4
5. Установите соответствие:
А) SO3 a) Основный оксид
Б) Mg(NO3)2 б) Кислота
В) HCl в) Основание
Г) NaОН г) Кислотный оксид
Д) ВаO д) соль
6. Закончите уравнения реакций, укажите тип, подпишите названия полученных веществ.
А) Ba(OH)2+ CO2=
Б) HNO3+ Cu(OH)2=
В) H2S + K2O =
Г) SO3+ Li2O =
7. Вычислите объем водорода (н.у), необходимого для реакции с 0,5 моль углерода.
8. Разберите сущность окислительно-восстановительной реакции (определите степени окисления каждого элемента, сделайте электронный баланс)
С + Н2= СН4
Выписать: а) вещество с ковалентно полярной связью ____________________________
б) вещество с ковалентно неполярной связью _____________________________________
в) изобразить электронные схемы образования их связей____________________________
____________________________________________________________________________
Какой вид химической связи в молекуле pcl5. Контрольная работа по химии (8 класс) «Строение атома
61. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные схемы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования?
62. Какая связь называется s- и какая — p-связью? Какая из них менее прочная? Изобразите структурные формулы этана C 2 H 6 , этилена C 2 H 4 и ацетилена C 2 H 2 . Отметьте s- и p-связи на структурных схемах углеводородов.
63. В молекулах F 2 , O 2 , H 2 SO 4 , HCl, CO 2 укажите тип связей, число s- и p-связей.
64. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H 2 O, HBr, Ar, N 2 , NH 3 ?
65. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями:
а) электронная пара – свободная орбиталь (2+0) и
б) электронная пара – электрон (2+1).
Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония + ?
66. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl 2 , (BeCl 2) n , CO и CO 2 . Изобразите структурные формулы молекул.
67. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в:
а) n-полупроводник; б) р-полупроводник?
68. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO + ?
69. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
70. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li 2 Cl 2 , LiF, — , BF 3 .
71. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса 2+ . Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона?
72. Почему существует молекула PCl 5 , но не существует молекула NCl 5 , хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl 5 .
73 Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO 2 , CH 3 COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование?
74. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы.
75. Какой тип гибридизации в молекулах CCl 4 , H 2 O, NH 3 ? Изобразите в виде схем взаимное расположение гибридных облаков и укажите углы между ними.
76. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями:
а) электрон + электрон (1+1) и
б) электрон + вакантная орбиталь (1+0).
Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H 2 и молекулярном ионе ?
77. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации.
78. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? s — или p-связи в этих молекулах?
79. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа AB n , если связь в них образуется за счет sp-, sp 2 -, sp 3 — гибридизации орбиталей атома A? Приведите примеры молекул с указанными типами гибридизации. Укажите углы между связями.
80. Даны пары веществ: а) H 2 O и CО; б) Вr 2 и CH 4 ; в) CаО и N 2 ; г) H 2 и NH 3 . Для какой пары веществ характерна ковалентная неполярная связь? Изобразите структурные схемы выбранных молекул, укажите формы этих молекул и углы между связями.
Вариант 1
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
Укажите положение серы в Периодической таблице. Приведите её электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ковалентная неполярная связь: PCl 5 , CH 4 , H 2 , CO 2 , O 2 , S 8 , SCl 2 , SiH 4 .
2 O, S 2 , NH 3 .
Контрольная работа «Атомы химических элементов»
Вариант 2
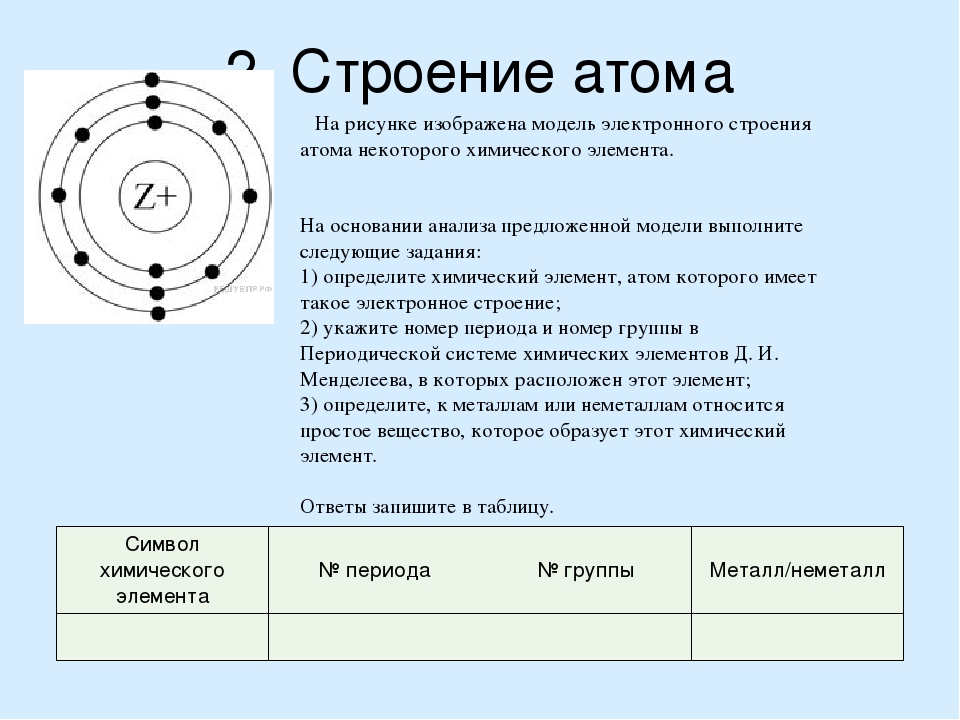
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение азота в Периодической системе. Приведите его электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ионная связь: NaF , N 2 O 5 , H 2 S , KI , Cu , SO 3 , BaS .
Определите тип химической связи и запишите схемы её образования для веществ: Cl 2 , MgCl 2 , NCl 3 .
Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 3
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение алюминия в Периодической системе. Приведите его электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ковалентная полярная связь: O 3 , P 2 O 5 , P 4 , H 2 SO 4 , CsF , HF , HNO 3 , H 2 .
Определите тип химической связи и запишите схемы её образования для веществ: H 2 O, N 2 , Na 3 S.
Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 4
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение кислорода в Периодической системе. Приведите его электронную формулу.
3. Вещества только с ионной связью приведены в ряду:
1) F 2 , СС l 4 , КС 1;
2) NaBr, Na 2 O, KI;
3) SO 2 , P 4 , CaF 2 ;
4) H 2 S, Br 2 , K 2 S.
4. Определите тип химической связи и запишите схемы её образования для веществ: CaCl 2 , O 2 , HF.
5. Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 5
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
2. Укажите положение углерода в Периодической системе. Приведите его электронную формулу.
3. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl 2 ;
2) O 2 , H 2 O, CO 2 ;
3) H 2 O, NH 3 , CH 4 ;
4) NaBr, HBr, CO.
4. Определите тип химической связи и запишите схемы её образования для веществ: Li 2 O, S 2 , NH 3 .
5. Определите для каждого изотопа:
«Основные типы химической связи» — Металлическая связь. Механизмы разрыва ковалентной связи. Электроны. Na+Cl. Ионная химическая связь. Химическая связь. Полярность связи. Параметры ковалентной связи. Насыщаемость. Водородная связь. Механизмы образования ковалентной связи. Свойства ковалентной связи. Виды ковалентной связи. Взаимодействие атомов в химических соединениях.
«Водородная связь» — Водородная связь. 2)между молекулами аммиака. Тема. Высокие температуры. Возникает между молекулами. Факторы, разрушающие водородную связь в белковой молекуле (денатурирующие факторы). 2)некоторые спирты и кислоты неограниченно растворимы в воде. 1)между молекулами воды. Электромагнитное излучение. Внутримолекулярная водородная связь.
«Металлическая химическая связь» — Металлическая связь имеет черты сходства с ковалентной связью. Металлическая химическая связь. Наиболее пластичны золото, медь, серебро. Лучшие проводники медь и серебро. Различия металлической связи с ионной и ковалентной. Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов.
«Химия «Химическая связь»» — Вещества с ковалентной связью. Параметры ковалентной связи. Ковалентная связь. Ионная связь – это электростатическое притяжение между ионами. Металлы образуют металлические кристаллические решетки. Число общих электронных пар равно числу связей между двумя атомами. Водородная химическая связь. Виды химической связи и типы кристаллических решеток.
«Ковалентная связь» — Способы образования связи. А 3. Химическая связь. В молекуле оксида серы (IV) имеются связи 1) 1б и 1 П 2) 3б и 1 П 3) 4б 4) 2б и 2 П. Степень окисления и валентность химических элементов. Степень окисления равна нулю в соединениях: 1) Ca3P2 2) O3 3) P4O6 4) CaO 12. Высшую степень окисления проявляет в соединении 1) SO3 2) Al2S3 3) h3S 4) NaHSO3 11.
«Химическая связь и её виды» — Полярная связь. Взаимодействие между атомами. Определение понятия. Проверочная работа. Виды химической связи в неорганических веществах. Ковалентная неполярная связь. Характеристика типов связи. Выигрышный путь. Выполните задание. Ионная связь. Параметры характеристики связи. Самостоятельная работа.
Всего в теме 23 презентации
«Строение атома. Химическая связь» Вариант 4
Напишите электронные конфигурации атомов следующих химических элементов: натрий, германий, технеций, ртуть.
Пользуясь графическим изображением, определите валентные возможности элементов с порядковыми номерами 17 и 30.
Предскажите место в Периодической системе и свойства элементов с данными схемами строения атомов. Объясните Ваши предположения.
а) 1s22s22p63s23p63d34s2
b) [2He] 2s22p3
c) 1s22s22p63s23p64s1
4. Температуры кипения NF3, PF3, AsF3 соответственно равны 144, 178, 336 К. объясните наблюдаемую закономерность.
5. Укажите, как изменяется энергия ионизации атома от азота к мышьяку.
6. Определите тип гибридизации орбиталей центрального атома в частицах SO3 и AlF4—. Назовите и изобразите геометрическую форму частицы.
7. Укажите квантовые числа электрона, который является последним по порядку заполнения, и определите число неспаренных электронов в атоме алюминия.
Контрольная работа по теме: «Строение атома. Химическая связь» Вариант 5
Напишите электронные конфигурации атомов следующих химических элементов: фтор, скандий, рубидий, гафний.
Пользуясь графическим изображением, определите валентные возможности элементов с порядковыми номерами 35 и 42.
Предскажите место в Периодической системе и свойства элементов с данными схемами строения атомов. Объясните Ваши предположения.
a) 1s22s22p63s23p63d34s2
b) [18Ar3d10]4s24p5
c) 1s22s22p2
4. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 4р? Почему?
5. Укажите, как изменяется сродство к электрону атома от азота к фтору.
6. Определите тип гибридизации орбиталей центрального атома в частицах SCl2O2 и PH4+ . Назовите и изобразите геометрическую форму частицы.
7. Укажите квантовые числа электрона, который является последним по порядку заполнения, и определите число неспаренных электронов в атоме кремния.
Контрольная работа по теме: «Строение атома. Химическая связь» Вариант 6
Напишите электронные конфигурации атомов следующих химических элементов: углерод, марганец, криптон, актиний
Пользуясь графическим изображением, определите валентные возможности элементов с порядковыми номерами 22 и 41.
Предскажите место в Периодической системе и свойства элементов с данными схемами строения атомов. Объясните Ваши предположения.
а)1s22s22p63s1
b)[10Ne]3s23p2
c) [18Ar]3d54s2
4. Сколько σ- и π- связей в молекулах бутина (С4Н6) и уксусной кислоты (СН3СООН)?
5. Определите, у какого соединения (KF или KI) температура плавления ниже.
6. Определите тип гибридизации орбиталей центрального атома в частицах PCl3O и ICl2— . Назовите и изобразите геометрическую форму частицы.
7. Укажите квантовые числа электрона, который является последним по порядку заполнения, и определите число неспаренных электронов в атоме фосфора.
Контрольная работа по теме: «Строение атома. Химическая связь» Вариант 7
Напишите электронные конфигурации атомов следующих химических элементов: азот, цинк, ксенон, осмий.
Пользуясь графическим изображением, определите валентные возможности элементов с порядковыми номерами 20 и 40.
Предскажите место в Периодической системе и свойства элементов с данными схемами строения атомов. Объясните Ваши предположения.
а)1s22s22p63s23p63d84s2
b) [18Ar] 3d24s2
c) 1s22s22p5
Температура кипения BF3, BCl3, BBr3, BI3 соответственно равны 172, 286, 364, 483 К. Объясните наблюдаемую закономерность.
Укажите, как изменяется (растет или убывает) сродство к электрону от кислорода к теллуру. Ответ поясните.
Определите тип гибридизации орбиталей центрального атома в частицах NOF3 и SeO2 . Назовите и изобразите геометрическую форму частицы.
Укажите квантовые числа электрона, который является последним по порядку заполнения, и определите число неспаренных электронов в атоме калия.
Типы химической связи». Контрольная работа по химии (8 класс) «Строение атома. Типы химической связи» Какой вид химической связи в молекуле pcl5
61. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные схемы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования?
62. Какая связь называется s- и какая — p-связью? Какая из них менее прочная? Изобразите структурные формулы этана C 2 H 6 , этилена C 2 H 4 и ацетилена C 2 H 2 . Отметьте s- и p-связи на структурных схемах углеводородов.
63. В молекулах F 2 , O 2 , H 2 SO 4 , HCl, CO 2 укажите тип связей, число s- и p-связей.
64. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H 2 O, HBr, Ar, N 2 , NH 3 ?
65. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями:
а) электронная пара – свободная орбиталь (2+0) и
б) электронная пара – электрон (2+1).
Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония + ?
66. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl 2 , (BeCl 2) n , CO и CO 2 . Изобразите структурные формулы молекул.
67. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в:
а) n-полупроводник; б) р-полупроводник?
68. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO + ?
69. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
70. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li 2 Cl 2 , LiF, — , BF 3 .
71. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса 2+ . Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона?
72. Почему существует молекула PCl 5 , но не существует молекула NCl 5 , хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl 5 .
73 Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO 2 , CH 3 COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование?
74. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы.
75. Какой тип гибридизации в молекулах CCl 4 , H 2 O, NH 3 ? Изобразите в виде схем взаимное расположение гибридных облаков и укажите углы между ними.
76. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями:
а) электрон + электрон (1+1) и
б) электрон + вакантная орбиталь (1+0).
Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H 2 и молекулярном ионе ?
77. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации.
78. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? s — или p-связи в этих молекулах?
79. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа AB n , если связь в них образуется за счет sp-, sp 2 -, sp 3 — гибридизации орбиталей атома A? Приведите примеры молекул с указанными типами гибридизации. Укажите углы между связями.
80. Даны пары веществ: а) H 2 O и CО; б) Вr 2 и CH 4 ; в) CаО и N 2 ; г) H 2 и NH 3 . Для какой пары веществ характерна ковалентная неполярная связь? Изобразите структурные схемы выбранных молекул, укажите формы этих молекул и углы между связями.
«Основные типы химической связи» — Металлическая связь. Механизмы разрыва ковалентной связи. Электроны. Na+Cl. Ионная химическая связь. Химическая связь. Полярность связи. Параметры ковалентной связи. Насыщаемость. Водородная связь. Механизмы образования ковалентной связи. Свойства ковалентной связи. Виды ковалентной связи. Взаимодействие атомов в химических соединениях.
«Водородная связь» — Водородная связь. 2)между молекулами аммиака. Тема. Высокие температуры. Возникает между молекулами. Факторы, разрушающие водородную связь в белковой молекуле (денатурирующие факторы). 2)некоторые спирты и кислоты неограниченно растворимы в воде. 1)между молекулами воды. Электромагнитное излучение. Внутримолекулярная водородная связь.
«Металлическая химическая связь» — Металлическая связь имеет черты сходства с ковалентной связью. Металлическая химическая связь. Наиболее пластичны золото, медь, серебро. Лучшие проводники медь и серебро. Различия металлической связи с ионной и ковалентной. Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов.
«Химия «Химическая связь»» — Вещества с ковалентной связью. Параметры ковалентной связи. Ковалентная связь. Ионная связь – это электростатическое притяжение между ионами. Металлы образуют металлические кристаллические решетки. Число общих электронных пар равно числу связей между двумя атомами. Водородная химическая связь. Виды химической связи и типы кристаллических решеток.
«Ковалентная связь» — Способы образования связи. А 3. Химическая связь. В молекуле оксида серы (IV) имеются связи 1) 1б и 1 П 2) 3б и 1 П 3) 4б 4) 2б и 2 П. Степень окисления и валентность химических элементов. Степень окисления равна нулю в соединениях: 1) Ca3P2 2) O3 3) P4O6 4) CaO 12. Высшую степень окисления проявляет в соединении 1) SO3 2) Al2S3 3) h3S 4) NaHSO3 11.
«Химическая связь и её виды» — Полярная связь. Взаимодействие между атомами. Определение понятия. Проверочная работа. Виды химической связи в неорганических веществах. Ковалентная неполярная связь. Характеристика типов связи. Выигрышный путь. Выполните задание. Ионная связь. Параметры характеристики связи. Самостоятельная работа.
Всего в теме 23 презентации
Вариант 1
2) укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
Укажите положение серы в Периодической таблице. Приведите её электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ковалентная неполярная связь: PCl 5 , CH 4 , H 2 , CO 2 , O 2 , S 8 , SCl 2 , SiH 4 .
2 O, S 2 , NH 3 .
Контрольная работа «Атомы химических элементов»
Вариант 2
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение азота в Периодической системе. Приведите его электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ионная связь: NaF , N 2 O 5 , H 2 S , KI , Cu , SO 3 , BaS .
Определите тип химической связи и запишите схемы её образования для веществ: Cl 2 , MgCl 2 , NCl 3 .
Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 3
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение алюминия в Периодической системе. Приведите его электронную формулу.
Выберите из списка вещества, в молекулах которых содержится ковалентная полярная связь: O 3 , P 2 O 5 , P 4 , H 2 SO 4 , CsF , HF , HNO 3 , H 2 .
Определите тип химической связи и запишите схемы её образования для веществ: H 2 O, N 2 , Na 3 S.
Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 4
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Укажите положение кислорода в Периодической системе. Приведите его электронную формулу.
3. Вещества только с ионной связью приведены в ряду:
1) F 2 , СС l 4 , КС 1;
2) NaBr, Na 2 O, KI;
3) SO 2 , P 4 , CaF 2 ;
4) H 2 S, Br 2 , K 2 S.
4. Определите тип химической связи и запишите схемы её образования для веществ: CaCl 2 , O 2 , HF.
5. Определите для каждого изотопа:
Контрольная работа «Атомы химических элементов»
Вариант 5
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
2. Укажите положение углерода в Периодической системе. Приведите его электронную формулу.
3. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl 2 ;
2) O 2 , H 2 O, CO 2 ;
3) H 2 O, NH 3 , CH 4 ;
4) NaBr, HBr, CO.
4. Определите тип химической связи и запишите схемы её образования для веществ: Li 2 O, S 2 , NH 3 .
5. Определите для каждого изотопа:
AP Chemistry: Atomic Structure — Practice Test Questions & Chapter Exam
Стр. 1
Вопрос 1 1. Как данные из PES поддерживают модель оболочек и подоболочки?
Ответы:вопрос 2 2. Что измеряет энергия связи?
Ответы:Вопрос 3 3.Что из следующего является примером поглощения энергии электроном?
Ответы:Вопрос 4 4. Чем должна заканчиваться электронная конфигурация неона (Ne)? Будет ли это стабильный атом или реактивный атом?
Ответы:Вопрос 5 5.Какое главное квантовое число последнего электрона, добавленного к калию?
Ответы:Стр. 2
Вопрос 6 6. Какая буква орбитали соответствует l = 2?
Ответы:Вопрос 7 7.Модель атома Бора:
Ответы:Вопрос 8 8. Каковы возможные координаты оси X на графиках, построенных на основе данных PES?
Ответы:Вопрос 9 9. Что представляет собой атомный номер?
Ответы:Вопрос 10 10.Какой принцип гласит, что электроны заполняют орбитали с более низкой энергией, прежде чем перейти на орбитали с более высокой энергией?
Ответы:Стр. 3
Вопрос 11 11. Какое правило гласит, что электроны переходят на пустые орбитали с той же энергией, прежде чем войти на орбиталь с присутствующим электроном?
Ответы:Вопрос 12 12.Как называется константа в уравнении принципа неопределенности Гейзенберга?
Ответы:Вопрос 13 13. Сколько нейтронов имеет самый распространенный изотоп водорода?
Ответы:Вопрос 14 14.Что из следующего верно о парамагнитных атомах?
Ответы:Вопрос 15 15. Какое квантовое число указывает положение орбитали?
Ответы:стр. 4
Вопрос 16 16.Почему Демокрит не соглашался с Аристотелем?
Ответы:Вопрос 17 17. Если в атоме № 1 19 протонов и 22 нейтрона, а в атоме № 2 20 протонов и 22 нейтрона, являются ли эти изотопы одним и тем же элементом?
Ответы:Вопрос 18 18.Когда электрон переходит из возбужденного состояния в основное состояние, он будет _____.
Ответы:Вопрос 19 19. ВСЕ атомы одного и того же элемента имеют:
Ответы:Вопрос 20 20.Что говорится в первой части правила Хунда?
Ответы:стр. 5
Вопрос 21 21. X и Y — элементы, которые являются изотопами друг друга. Что из следующего верно относительно X и Y?
Ответы:Вопрос 22 22.При записи электронных конфигураций электроны представлены в их минимально возможном энергетическом состоянии, называемом их _____.
Ответы:Вопрос 23 23. Если только один тип атома составляет вещество, как вы можете назвать это вещество?
Ответы:Вопрос 24 24.Какой ученый использовал эксперимент с каплей масла для измерения заряда отдельных электронов?
Ответы:Вопрос 25 25. Какой элемент имеет массовое число 12 и содержит 6 нейтронов?
Ответы:Стр. 6
Вопрос 26 26.Как лучше всего понять поведение материи на наноскопическом уровне?
Ответы:Вопрос 27 27.
Кусок алюминиевой фольги имеет массу 27 грамм. Сколько в нем атомов?
(Алюминий имеет молекулярную массу 27 г / моль)
Ответы:Вопрос 28 28.Магний имеет три общих изотопа. Какой из них наиболее распространен, исходя из его средней атомной массы?
Ответы:Вопрос 29 29. Сколько центов в одной десятой мола пенсов?
Ответы:Вопрос 30 30.Какое максимальное количество электронов может быть найдено в кластере 5p (или орбитали) одиночного атома?
Ответы:AP Chemistry: Глава атомной структуры инструкции к экзамену
Выберите ответы на вопросы и нажмите «Далее», чтобы просмотреть следующий набор вопросов. Вы можете пропустить вопросы, если хотите, и приходите назад к ним позже с помощью кнопки «Перейти к первому пропущенному вопросу».Когда вы сдадите пробный экзамен, появится зеленая кнопка отправки. появляться. Щелкните его, чтобы увидеть свои результаты. Удачи!
Практический тест SAT Chemistry: Atomic Structure_cracksat.net
1. Какой из следующих изотопов имеет наибольшее количество нейтронов?
A. 35 Cl
B. 31 P
C. 40 Ar
D. 41 Ca
E. 14 C
2. У атома восемь электронов в трехмерной подоболочке. Сколько орбиталей в этой подоболочке имеет неспаренный электрон?
A. 1
B. 2
C. 3
D. 4
E. 5
3. Какой главный энергетический уровень имеет ровно четыре подоболочки?
A. 1
B. 2
C. 3
D. 4
E. 5
4. Атом в основном состоянии имеет семь валентных электронов. Какая электронная конфигурация может представлять собой конфигурацию валентных электронов этого атома в основном состоянии?
А.3s 1 3p 6
B. 3s 6 3p 1
C. 3s 1 3p 4 3d 2
D. 3s 3 3p 4 3d6 E. 3s 2 3p 5
5. Сколько валентных электронов находится в атоме с конфигурацией 1s 2 2s 2 2p 6 3s 2 3p 2 ?
A. 6
B. 5
C. 4
D. 3
E. 2
6. Какая электронная конфигурация демонстрирует атом в возбужденном состоянии?
A. 1s 2 2s 1
B. 1s 2 2s 2 2p 4
C. 1s 2 2s 2
D. 1s 2 2s 2145 6 3s 2
E. 1s 2 2s 2 3s 1
7. Какая пара символов ниже показывает разные изотопы одного и того же элемента?
A. 39 18 A и 39 19 R
B. 60 27 X и 59 28 Y
C. 12 6 L и 14 6 L
D. 37 17 X и 37 X
E. 3 2 E и 3 1 G
8. Какое из нижеследующих выводов не является выводом, сделанным Резерфордом из его эксперимента с альфа-частицами, стреляющими в тонкий лист золотой фольги? ?
A. У атома очень маленькое компактное ядро.
B. Атом — это в основном пустое пространство.
C. Масса атома сосредоточена в ядре.
D. У атома очень плотное ядро.
E. У атома есть отрицательно заряженное ядро.
9. Какой атом не спарен со своей коррекцией и ионным зарядом?
A. Rb / Rb 1-
B. Mg / Mg 2+
C. F / F 1-
D. Li / Li 1+
E. Br / Br 1-
10. Какое из следующих утверждений относительно субатомных частиц неверно?
А.Протон имеет один положительный заряд.
B. Нейтрон не имеет заряда.
C. Электроны находятся в областях атома, называемых орбиталями.
D. Электроны имеют большую массу, чем протоны.
E. Протоны и нейтроны — нуклоны атома.
11. Что несовместимо с концепцией изотопа?
A. Одинаковый атомный номер
B. Различное количество нейтронов
C. Одинаковое массовое число
D. То же имя элемента
E. Такое же количество протонов
12. Таинственный элемент имеет следующие относительные содержания:
X-34 15% X-35 20% X-36 65%
Что из следующего верно?
А. Атомная масса этого элемента ближе к 34,1.
B. Атомная масса этого элемента ближе к 34,9.
C. Атомную массу этого элемента невозможно определить, не зная точно, что такое X.
D. Масс-спектрофотометр не поможет определить процентное содержание изотопов.
E. Атомная масса этого элемента примерно 35.5.
13. Какой из следующих ионов будет наименьшим в изоэлектронном ряду?
A. Osup> 2–
B. F 1–
C. Ne
D. Na 1+
E. Mg 2+
14. Какой правильный набор квантовых чисел за восьмой электрон, заполняющий орбитали в атоме кислорода?
A. n = 2, l = 1, ml = –1, ms = –1/2
B. n = 2, l = 1, ml = +1, ms = –1/2
C. n = 2, l = 1, ml = +1, ms = +1/2
D.n = 2, l = 0, ml = –1, ms = +1/2
E. n = 1, l = 1, ml = +1, ms = –1/2
15. Какой из следующее неверно об эффективном ядерном заряде, ощущаемом валентными электронами следующих атомов?
A. Z eff для валентных электронов Mg составляет 2+.
B. Z eff для валентных электронов Na составляет 2+.
C. Z eff для валентных электронов Be составляет 2+.
D. Z eff для валентных электронов Ne составляет 8+.
E. Z eff для валентных электронов Li составляет 1+.
[PDF] Практический тест атомной структуры
1 Практический тест атомной структуры Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос …
Практический тест атомарной структуры Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос. ____1. Если 6,0 г элемента K объединяются с 17 г элемента L, сколько граммов элемента K объединяется с 85 г элемента L? а.17 г б. 23 г с. 30. г д. 91 г
____
2. Что из следующего не является частью атомной теории Дальтона? а. Атомы нельзя разделить, создать или уничтожить. б. Число протонов в атоме — это его атомный номер. c. В химических реакциях атомы объединяются, разделяются или перегруппировываются. d. Вся материя состоит из очень маленьких частиц, называемых атомами.
____
3. Атомная теория Дальтона согласуется с современной атомной теорией, за исключением утверждения, что а. вся материя состоит из мелких частиц.б. атомы не разделяются в химических реакциях. c. атомы одного и того же элемента химически похожи. d. все атомы одного и того же элемента имеют одинаковую массу.
____
4. Лучи, образующиеся в катодной лампе, имеют вид a. не подвержен влиянию магнитного поля. б. отклоняется от отрицательной пластины.
г. обнаружено, что несет положительный заряд. d. ударяя по катоду.
____
5. После измерения отношения заряда электронно-лучевой частицы к ее массе Томсон пришел к выводу, что частицы a.не имел массы. c. имел очень большую массу. б. имел очень маленькую массу. d. несет положительный заряд.
____
6. В чьей серии экспериментов идентифицировано ядро атома? а. Резерфорд б. Далтон с. Чедвик
г. Бор
____
7. Поскольку большинство частиц, выстреливающих металлическую фольгу, проходили прямо сквозь нее, Резерфорд пришел к выводу, что a. атомы были в основном пустым пространством. c. электроны образовали ядро. б. атомы не содержали заряженных частиц. d. атомы были неделимы.
____
8. Ядерная частица, которая имеет примерно такую же массу, как протон, но не имеет электрического заряда, называется a (n) a. нуклид. б. нейтрон. c. электрон. d. изотоп.
____
9. Какая часть атома имеет массу, примерно равную 1/2000 массы протона или нейтрона? а. ядро b. электрон c. протон d. нейтрон
____ 10. Наименьшей единицей элемента, который может существовать отдельно или в комбинации с другими такими же частицами того же или разных элементов, является a.электрон. б. протон. c. нейтрон. d. атом. ____ 11. Атомный номер кислорода, 8, указывает на то, что существует восемь а. протоны в ядре. c. нейтроны вне ядра. б. кислородные нуклиды. d. уровни энергии в ядре. ____ 12. Общее количество протонов и нейтронов в ядре атома равно его a. атомный номер. б. атомный вес. c. массовое число. d. атомная масса.
____ 13. По мере увеличения массового числа изотопов элемента, количество протонов a. уменьшается.б. увеличивается. c. остается такой же. d. удваивается каждый раз, когда массовое число увеличивается. ____ 14. Все атомы одного и того же элемента имеют одинаковый a. атомная масса. б. # нейтронов.
г. массовое число.
____ 15. Средняя атомная масса элемента а. — масса самого распространенного изотопа. б. не может равняться массе каких-либо изотопов.
г. невозможно рассчитать. d. всегда складывается до 100.
d. атомный номер.
____ 16. Изотоп алюминия состоит из 13 протонов, 13 электронов и 14 нейтронов.Его массовое число равно a. 13. б. 14. c. 27. г. 40. ____ 17. Углерод-14 (атомный номер 6), радиоактивный нуклид, используемый при датировании окаменелостей, имеет a. 6 нейтронов. б. 8 нейтронов. c. 10 нейтронов. d. 14 нейтронов. ____ 18. Фосфор-33 (атомный номер 15) содержит а. 33 протона. б. 18 нейтронов.
г. 33 нейтрона.
г. 18 протонов.
Краткий ответ 19. Каков закон сохранения массы? 20. Опишите ядро атома. 21. Укажите местоположение и относительный заряд протона.22. Какой порядковый номер у атома? 23. Какое массовое число у атома? 24. Какая связь между изотопами, массовым числом и нейтронами? Эссе 25. Почему ученые используют теорию Далтона, хотя некоторые ее части оказались неверными? Какую часть теории Далтона ученые все еще принимают? 26. Что вы можете определить об атомной структуре элемента, если знаете атомный номер элемента и массовые числа его изотопов? Какая дополнительная информация необходима для определения средней атомной массы элемента? Как определить среднюю атомную массу элемента? 27.Неизвестный имеет два общих изотопа, уизвестий-85 и неизвестный-87. Содержание 85Uk составляет 72,2%, а его масса — 84,96 а.е.м. Распространенность средней атомной массы неизвестного? Какой элемент неизвестен?
87
Uk составляет 27,8%, а его масса составляет 86,976 а.е.м. Что такое
Раздел ответов практического теста атомной структуры НЕСКОЛЬКИЙ ВЫБОР 1. ОТВЕТ: C Решение:
2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16 . 17. 18.
PTS: STA: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ : ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ: ANS: OBJ:
1 SC.B.1.4.2 B 2 B 2 B 1 B 1 A 2 A 2 B 3 B 3 D 4 A 2 C 2 C 2 D 2 B 2 C 3 B 3 B 3
КОРОТКИЙ ОТВЕТ
DIF: III
REF: 1
OBJ: 1
PTS: 1
DIF: I
REF: 1
PTS: 1
DIF: I
REF: 1
PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA: PTS: STA:
DIF: I
REF: 2
DIF: I
REF: 2
DIF: I
REF: 2
DIF: II
REF: 2
DIF: IEF
DIF: I
REF: 2
DIF: I
REF: 2
DIF: II
REF: 3
DIF: I
REF: 3
DIF: IEF
DIF: I
REF: 3
DIF: I
REF: 3
DIF: III
REF: 3
DIF: III
REF: 3
DIF: III
REF: 3
1 SC.A.2.4.1 1 SC.A.2.4.1 1 SC.A.2.4.1 1 SC.A.2.4.1 1 SC.C.2.4.2 1 SC.C.2.4.2 1 SC.A. 2.4.2 1 SC.A.2.4.3 1 SC.A.2.4.3 1 SC.A.2.4.3 1 SC.A.2.4.3 1 SC.A.2.4.3 1 SC.A.2.4. 1 1 SC.A.2.4.1 1 SC.A.2.4.1
19. ОТВЕТ: Заявление о том, что масса не может быть создана или разрушена в обычных химических реакциях. PTS: 1 DIF: I REF: 1 OBJ: 1 STA: SC.B.1.4.2 20. ANS: очень маленькая центральная область атома, состоящая из протонов и нейтронов. PTS: 1 DIF: I REF: 2 OBJ: 2 STA: SC.A.2.4.1 21. ANS: Протон — это субатомная частица с положительным зарядом, которая находится в ядре атома.PTS: 1 DIF: I REF: 2 STA: SC.C.2.4.2 22. ANS: Число протонов в ядре атома.
OBJ: 3
PTS: 1 DIF: I REF: 3 STA: SC.A.2.4.3 23. ANS: сумма количества протонов и нейтронов в атоме.
OBJ: 1
PTS: 1 DIF: I REF: 3 OBJ: 1 STA: SC.A.2.4.3 24. ANS: Изотопы — это атомы одного и того же элемента с разным числом нейтронов и, следовательно, с разной массой. числа. PTS: 1 STA: SC.A.2.4.3
DIF: II
REF: 3
OBJ: 2
ESSAY 25.ОТВЕТ: Теория Дальтона привела к современной теории атома. Хотя теперь ученые знают, что атомы можно разделить и что элементы существуют в виде изотопов, большая часть его ранней теории все еще принимается. PTS: 1 DIF: II REF: 1 OBJ: 3 STA: SC.B.1.4.2 26. ANS: атомный номер равен количеству протонов в ядре атома, а также количеству электронов в нейтральном атоме. . Массовое число представляет собой сумму количества протонов и нейтронов и может использоваться вместе с атомным номером, чтобы найти количество нейтронов в каждом изотопе.Каждый изотоп элемента имеет различное массовое число, но тот же атомный номер, что и элемент. Чтобы определить среднюю атомную массу элемента, вам нужно было знать относительное содержание и точную массу каждого изотопа. Затем умножьте относительное содержание (в десятичной форме) на атомную массу каждого изотопа и сложите результаты.
PTS: 1 STA: SC.A.2.4.3 27. ANS: unknownium-85 unknownium-87 АТОМНАЯ МАССА
PTS: 1
DIF: II
84.96 amu
REF: 3
x
86,976 amu x
0,722 0,278
OBJ: 2
= 61,34112 = 24,179328 = 85,520448 amu = 85,52 amu
2.1: История проблем атома
ПРОБЛЕМА \ (\ PageIndex {1} \)
На следующем рисунке зеленые сферы представляют атомы определенного элемента. Пурпурные сферы представляют собой атомы другого элемента. Если сферы разных элементов соприкасаются, они являются частью единого целого.Следующее химическое изменение, представленное этими сферами, может нарушить одну из идей атомной теории Дальтона. Который из?
- Ответ
Исходные материалы состоят из одной зеленой сферы и двух фиолетовых сфер. Продукция состоит из двух зеленых и двух фиолетовых сфер. Это нарушает постулат Дальтона о том, что атомы не создаются во время химического изменения, а просто перераспределяются.
ПРОБЛЕМА \ (\ PageIndex {2} \)
Какой постулат теории Дальтона согласуется со следующим наблюдением относительно масс реагентов и продуктов?
При нагревании 100 граммов твердого карбоната кальция получается 44 г CO 2 и 56 г CaO.
- Ответ
Атомы не создаются и не разрушаются во время химического изменения, а вместо этого перестраиваются, чтобы получить вещества, которые отличаются от тех, что присутствовали до изменения (на основе закона сохранения массы).
ПРОБЛЕМА \ (\ PageIndex {3} \)
Образцы соединения X, Y и Z проанализированы, результаты показаны здесь. Представляют ли эти данные пример (ы) закона определенных пропорций, закона множественных пропорций, ни того, ни другого или того и другого? Что эти данные говорят вам о соединениях X, Y и Z?
| Соединение | Описание | Масса углерода | Масса водорода |
|---|---|---|---|
| X | прозрачная, бесцветная, жидкость с сильным запахом | 1.776 г | 0,148 г |
| Y | прозрачная, бесцветная, жидкость с сильным запахом | 1,974 г | 0,329 г |
| Z | прозрачная, бесцветная, жидкость с сильным запахом | 7,812 г | 0,651 г |
- Ответ
X + Z — аналогичные соединения (те же отношения C и H), соответствующие Закону определенных пропорций
X + Y и Y + Z — разные соединения (с разными соотношениями C и H), соответствующие Закону множественных пропорций
- Щелкните здесь, чтобы просмотреть видео решения.
ПРОБЛЕМА \ (\ PageIndex {4} \)
Чем похожи электроны и протоны? Насколько они разные?
- Ответ
Электроны и протоны являются заряженными субатомными частицами.
Протоны намного крупнее электронов (дают большую массу всего атома).
Изменение количества протонов изменяет идентичность атома, при этом изменение количества электронов изменяет заряд .
ПРОБЛЕМА \ (\ PageIndex {5} \)
Чем похожи протоны и нейтроны? Насколько они разные?
- Ответ
Протоны и нейтроны находятся в ядре атома.
Протоны и нейтроны вносят вклад в общую массу атома.
Протоны несут заряд , а нейтроны нейтральны.
ПРОБЛЕМА \ (\ PageIndex {6} \)
Предскажите и протестируйте поведение α-частиц, выпущенных на модельный атом «сливового пудинга».
(a) Предсказание траектории α-частиц, выстреливаемых по атомам, со структурой модели сливового пудинга Томсона. Объясните, почему вы ожидаете, что α-частицы пойдут по этим путям.
(b) Если α-частицы с большей энергией, чем в (a), выстреливают в атомы сливового пудинга, спрогнозируйте, как их траектория будет отличаться от траекторий α-частиц с более низкой энергией. Объясните свои рассуждения.
(c) Теперь проверьте свои прогнозы из (a) и (b).
Выберите вкладку «Plum Pudding Atom» выше.Установите «Энергия альфа-частиц» на «мин» и выберите «показать следы». Нажмите на пистолет, чтобы начать стрелять α-частицами. Соответствует ли это вашему предсказанию из пункта (а)? Если нет, объясните, почему фактический путь будет таким, как показано в моделировании. Нажмите кнопку паузы или «Сбросить все». Установите «Энергия альфа-частиц» на «максимум» и начните стрелять альфа-частицами. Соответствует ли это вашему прогнозу из пункта (б)? Если нет, объясните влияние увеличения энергии на фактические пути, как показано в моделировании.
- Ответьте на
Модель сливового пудинга показывает, что положительный заряд равномерно распределен по всему атому, поэтому мы ожидаем, что α-частицы (возможно) несколько замедлятся из-за положительно-положительного отталкивания, но будут следовать прямолинейным путям (т.е., не отклоняться), когда они проходят через атомы.
- Ответ b
α-частицы с более высокой энергией будут двигаться быстрее (и, возможно, меньше замедляться), а также будут следовать по прямолинейным путям через атомы.
- Ответ c
α-частицы следовали прямолинейным путем через атом сливового пудинга. Явного замедления α-частиц при прохождении через атомы не наблюдалось.
ПРОБЛЕМА \ (\ PageIndex {7} \)
Предскажите и проверьте поведение α-частиц, выпущенных на модель атома Резерфорда.
(a) Предскажите траектории α-частиц, которые выстреливают по атомам со структурой модели атомов Резерфорда. Объясните, почему вы ожидаете, что α-частицы пойдут по этим путям.
(b) Если α-частицы с большей энергией, чем в (a), выстреливают в атомы Резерфорда, предскажите, как их траектория будет отличаться от траекторий α-частиц с более низкой энергией.Объясните свои рассуждения.
(c) Предскажите, как будут отличаться траектории α-частиц, если они будут выпущены на резерфордские атомы других элементов, кроме золота. Какой фактор, по вашему мнению, вызовет эту разницу в путях и почему?
(d) Теперь проверьте свои прогнозы из (a), (b) и (c).
Выберите вкладку «Rutherford Atom» выше. Из-за масштаба моделирования лучше всего начать с небольшого ядра, поэтому выберите «20» для протонов и нейтронов, «мин» для энергии, покажите следы, а затем начните запускать α-частицы.Соответствует ли это вашему предсказанию из пункта (а)? Если нет, объясните, почему фактический путь будет таким, как показано в моделировании. Сделайте паузу или сбросьте, установите энергию на «максимум» и начните стрелять α-частицами. Соответствует ли это вашему прогнозу из пункта (б)? Если нет, объясните влияние увеличения энергии на фактический путь, как показано в моделировании. Приостановите или сбросьте настройки, выберите «40» для протонов и нейтронов, «мин» для энергии, покажите следы и выстрелите. Соответствует ли это вашему прогнозу из пункта (c)? Если нет, объясните, почему фактический путь будет таким, как показано в моделировании.Повторите это с большим количеством протонов и нейтронов. Какое обобщение вы можете сделать относительно типа атома и влияния на путь α-частиц? Будьте ясны и конкретны.
- Ответьте на
Атом Резерфорда имеет небольшое положительно заряженное ядро, поэтому большинство α-частиц проходят через пустое пространство вдали от ядра и не отклоняются. Те α-частицы, которые проходят рядом с ядром, будут отклоняться со своего пути из-за положительно-положительного отталкивания.Чем ближе к ядру направляются α-частицы, тем больше будет угол отклонения.
- Ответ b
α-частицы с более высокой энергией, проходящие рядом с ядром, все равно будут отклоняться, но чем быстрее они движутся, тем меньше ожидаемый угол отклонения
- Ответ c
Если ядро меньше, положительный заряд меньше и ожидаемые отклонения меньше — как с точки зрения того, насколько близко α-частицы проходят мимо ядра без отклонения, так и с точки зрения угла отклонения.Если ядро больше, положительный заряд больше и ожидаемые отклонения больше — больше α-частиц будет отклонено, и углы отклонения будут больше.
- Ответ d
Пути, по которым следуют α-частицы, соответствуют предсказаниям (а), (б) и (в)
6, 7 и 8 классы | Наука | Средняя школа | Химия
Эта викторина по естествознанию называется «Химия — атом» и написана учителями, чтобы помочь вам, если вы изучаете этот предмет в средней школе.Воспроизведение образовательных викторин — отличный способ узнать, что вы в 6-м, 7-м или 8-м классе — в возрасте от 11 до 14 лет.
Играть в эту викторину и еще более 3500 других, которые помогут вам с вашей помощью, стоит всего 12,50 долларов в месяц. Школьная работа. Вы можете подписаться на странице Присоединяйтесь к нам
Химия — это изучение состава, структуры, свойств и изменений материи. В основном это касается атомов и их взаимодействия с другими атомами.
Атом — самая основная единица всей материи.Он содержит плотное центральное ядро, окруженное облаком отрицательно заряженных электронов. Оно происходит от греческого слова atomos , которое буквально означает нечто неразрезанное или то, что нельзя разделить.
В центре атома или его ядра находится ядро . Ядро содержит протоны и нейтроны.
Протон — частица, несущая положительный электрический заряд.
Электрон — частица, несущая отрицательный электрический заряд.Электроны определяют химические свойства элемента.
Нейтрон — субатомная адронная частица, не имеющая электрического заряда. Его масса немного больше, чем у протона. Ядро каждого атома содержит по крайней мере один нейтрон, за исключением водорода-1. Нейтроны связываются с протонами, чтобы стабилизировать ядро атома.
Вместе протоны и нейтроны обозначаются как « нуклон ».
Число протонов в ядре атома известно как атомный номер .Поскольку каждый элемент имеет разное количество протонов, у них есть свой атомный номер.
Атом классифицируется по количеству нейтронов и протонов, имеющихся в его ядре. Количество протонов определяет химический элемент, а количество нейтронов определяет изотоп элемента.
Изотоп — это вариант, содержащийся в определенном химическом элементе. Изотопы имеют одинаковое количество протонов в каждом атоме, но количество нейтронов может варьироваться.
Элемент — это любое вещество, которое не может быть разделено на два или более простых вещества. Есть четыре общих элемента, которые включают землю, воздух, воду и огонь.
A химический элемент — это вещество, состоящее из одного типа атомов. Химические элементы делятся на металлы, металлоиды и неметаллы. Примеры включают углерод, азот, кислород, кремний, алюминий, железо, золото, свинец, ртуть, медь и мышьяк. Самые легкие химические элементы включают гелий, водород, литий и бериллий.Любые два атома, которые имеют одинаковое количество протонов в соответствующем ядре, принадлежат одному и тому же химическому элементу.
MCAT General Chemistry Practice Test 1: Atomic Structure_maintests.com
1. Что из следующего является правильной электронной конфигурацией для Zn 2+ ?
2. Какой из следующих наборов квантовых чисел возможен?
3. Какое максимальное количество электронов разрешено на одном атомном энергетическом уровне с точки зрения главного квантового числа n ?
4. Какое из следующих уравнений описывает максимальное количество электронов, которое может заполнить подоболочку?
5. Какой из следующих атомов имеет только спаренные электроны в основном состоянии?
6. Электрон возвращается из возбужденного состояния в свое основное состояние, испуская фотон с длиной волны λ = 500 нм. Какова была бы величина изменения энергии, если бы один моль этих фотонов был испущен? (Примечание: ч = 6,626 × 10 -34 Дж · с)
7. Предположим, что электрон падает с n = 4 в свое основное состояние, n = 1. Какой из следующих эффектов наиболее вероятен?
8. Какой из следующих изотопов углерода НАИМЕНЕЕ вероятен для обнаружения в природе?
9. Что из следующего лучше всего объясняет невозможность точного и одновременного измерения положения и импульса в соответствии с принципом неопределенности Гейзенберга?
10. Какой из следующих электронных переходов приведет к наибольшему выигрышу в энергии для одиночного электрона водорода?
11. Предположим, что атом заполняет свои орбитали, как показано:
Такая электронная конфигурация наиболее ясно иллюстрирует какой из следующих законов атомной физики?
12. Сколько всего электронов находится в катионе 133 Cs?
13. Атомный вес водорода 1,008 а.е.м. Каков процентный состав водорода по изотопам, если предположить, что единственными изотопами водорода являются 1 H и 2 D?
14. Рассмотрим два набора квантовых чисел, показанные в таблице, которые описывают два разных электрона в одном атоме.
| n | l | m l | m s |
| 1 | -1 |
Какой из следующих терминов лучше всего описывает эти два электрона?
15. Какой из следующих видов представлен электронной конфигурацией 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 д 5 ?
I. Cr
II. Mn +
III. Fe 2+
Базовая атомная структура: TEAS || RegisteredNursing.org
Глоссарий терминов и терминологии атомной структуры
- Атом: Наименьший и самый незначительный из всех компонентов материи
- Четыре состояния материи: твердые тела, жидкости, газы и плазма
- Твердые тела: состояние вещества, которое не так гибко, как другие формы материи, с точки зрения сжимаемости, формы и объема.
- Жидкости: состояние вещества, которое может изменять свою форму в зависимости от формы контейнера, в который оно наливается.
- Газ: состояние вещества, которое сжимается и может изменять свою форму и объем в соответствии с формой и размером контейнера, который помещается в .
- Плазма: состояние вещества, обнаруженное за пределами Земли.
- Атом: Наименьший компонент и самая основная часть материи, которая все еще сохраняет свою идентичность
- Структура атома: атомы имеют ядро и электроны.Его ядро содержит протоны и нейтроны
- Ядро: Часть атома, в которой находятся протоны и нейтроны
- Протоны: положительно заряженные (+) компоненты атома. Число протонов, определяющих химическую идентичность атома
- Нейтроны: Часть атома, у которой нет заряда; они нейтральны и не имеют положительного или отрицательного электрического заряда; часть атома, придающая ему его изотопную идентичность.
- Электроны: часть атома, имеющая отрицательный (-) заряд
- Ион: электрически заряженный атом
- Катион: положительно заряженный атом
- Анион: отрицательно заряженный атом
- Периодическая таблица элементов: разработана русским химиком Менделеевым в середине 1800-х годов для отображения всех известных элементов
Дело
Проще говоря, атом — самый маленький и мельчайший из всех компонентов материи.Есть четыре состояния материи.
Дело определяется как все:
- Твердые
- Жидкости
- Газы
- Плазма
Твердые вещества
Монокристаллическая форма твердого инсулина.
Твердые тела уникально отличаются от всех остальных состояний материи. Они не так гибки, как другие формы материи, с точки зрения сжимаемости, формы и объема. Объем и форма твердых тел фиксированы и неизменны; и они не могут быть сжаты, потому что между частицами твердого тела мало места.Атомы и частицы твердых тел плотно упакованы вместе, и этот образец частиц обычно очень регулярный и однородный.
Жидкости
В отличие от твердых тел, жидкости могут изменять форму, и, хотя частицы в жидкостях расположены близко друг к другу и между этими частицами не остается небольшого промежутка, как этот интервал в твердых телах, жидкости могут перемещаться и изменять свою форму в соответствии с формой контейнера. заливается. Частицы в жидкости также могут скользить мимо других частиц в жидкости и вокруг них.Таким образом, гибкость и жесткость твердых тел намного больше, чем гибкость и жесткость жидкостей. Кроме того, жидкости не имеют регулярного и однородного рисунка частиц, как твердые тела.
Подобно твердым телам и в отличие от газов, жидкости не изменяют своего объема.
Газы
Частицы дыма указывают на движение окружающего газа.
Газы характеризуются способностью изменять свою форму и объем в зависимости от формы и размера контейнера, в который они помещены.Газы также очень сжимаемы, в отличие от твердых тел и жидкостей, потому что их составные частицы имеют гораздо больше пространства между этими частицами, чем жидкости и твердые тела. Как и жидкости, частицы в газах легко текут.
Газы не имеют регулярного и однородного расположения, как твердые тела, газы движутся свободно, и они могут двигаться с высокими скоростями.
Плазма
В отличие от других состояний материи, включая твердые тела, жидкости и газы, плазма не встречается в природе на нашей Земле.Вместо этого плазма создается искусственно или находится за пределами нашей атмосферы и Вселенной.
Плазма может быть полностью или частично ионизированной. Частично ионизированная плазма встречается в таких вещах, как неоновые вывески, а полностью ионизированная плазма — в звездах.
Популярная научная мысль сейчас склоняется к тому факту, что плазма является самым большим и наиболее часто встречающимся типом материи в нашей Вселенной. Другими словами, плазмы, вероятно, будет больше, чем твердых тел, жидкостей и газов.
Атомов
Иллюстрация атома гелия с изображением ядра (розовый) и распределения электронного облака (черный). Ядро (вверху справа) в гелии-4 на самом деле сферически симметрично и очень похоже на электронное облако, хотя для более сложных ядер это не всегда так. Черная полоса — один ангстрем (10-10 м или 100 пм).
Атомы — это мельчайший компонент и самая основная часть материи, включая твердые тела, жидкости, газы и плазму, которые все еще сохраняют исходные свойства химического элемента, частью которого он является.Атомы очень маленькие; однако их можно увидеть в электронный микроскоп.
В настоящее время мы обнаружили и идентифицировали 118 элементов, следовательно, существует 118 различных элементов, и есть 118 различных атомов, которые сохраняют характеристики и свойства каждого из этих элементов. Периодическая таблица элементов будет рассмотрена ниже.
Все атомы состоят из:
- Ядро, содержащее протоны и нейтроны
- Электронов
Подавляющее большинство атома составляет его ядро с точки зрения общей массы атома.
Ядро
Ядро атома — это часть атома, в которой находятся протоны и нейтроны.
Протоны
Протоны атома, как следует из названия, являются положительно заряженными (+) компонентами атома; протоны находятся в ядре атома. Это количество протонов, которые определяют химическую идентичность атома.
Нейтроны
Нейтроны атома, как следует из названия, являются частью атома, которая не имеет заряда; они нейтральны, без положительного или отрицательного электрического заряда.Нейтроны делят пространство с протонами в ядре атома. Количество нейтронов в атоме определяет его изотопную идентичность.
Электронов
Электроны атома — это часть атома, имеющая отрицательный (-) заряд. Нейтроны окружают ядро атома и связаны с ним; они не делят пространство с нейтронами и протонами в ядре атома. Электроны с отрицательным (-) зарядом остаются с атомом, потому что эти отрицательные части атома притягиваются и застревают рядом с положительно заряженными протонами атома почти так же, как отрицательный и положительный полюса магнита. притягиваются друг к другу и становятся привязанными друг к другу.
Очень часто атомы имеют одинаковое количество протонов и нейтронов. Например, атом с 3 протонами обычно также имеет 3 нейтрона.
Атомы нейтральны, когда число протонов и число электронов одинаковы; атомы имеют положительный заряд, когда количество протонов в ядре атома больше, чем количество электронов на его атомной орбите, окружающей ядро, и атом будет иметь отрицательный заряд, когда количество протонов в ядре атома меньше, чем количество электронов на его атомной орбите, окружающей ядро.
Когда атом заряжен положительно или отрицательно, он называется ионом. Проще говоря, ион — это электрически заряженный атом. Когда ион имеет положительный заряд, он называется катионом; и когда ион имеет отрицательный заряд, он называется анионом.
Периодическая таблица элементов
Полная периодическая таблица элементов с символом атомного номера и весом.
Это количество протонов, которые определяют химическую идентичность атома, и именно количество нейтронов в атоме определяет его изотопную идентичность.
Периодическая таблица элементов, первоначально разработанная русским химиком Менделеевым в середине 1800-х годов, является высокоорганизованной и упорядоченной, несмотря на то, что на первый взгляд кажется, что ей не хватает связного порядка и логики.
Теперь мы покажем вам, как читать Периодическую таблицу элементов и понимать ее компоненты относительно простым и понятным способом.
Периодическая таблица элементов организована последовательно в соответствии с числом протонов, равным числу электронов, которые делают атом нейтральным.Итак, как вы можете видеть в Периодической таблице элементов выше, она организована от №1 до №181 в соответствии с количеством протонов или электронов в каждом элементе. Например, первым элементом Периодической таблицы элементов является водород, который имеет один протон и один электрон; вторым элементом в Периодической таблице элементов является гелий, который имеет два протона и такое же количество электронов, а последним элементом в текущей Периодической таблице элементов является No 118, то есть Оганессон, который был добавлен в соответствии с названием в 2016 году.
Элементы Периодической таблицы элементов также организованы в столбцы, как вы можете видеть на изображении Периодической таблицы элементов выше. Эти столбцы показывают, что элементы в каждом столбце похожи друг на друга с точки зрения их валентности. Проще говоря, валентность или валиантность — это способность одного атома соединяться и объединяться с другими атомами с образованием молекул и соединений.
СВЯЗАННЫЕ ЧАИ ЖИЗНЬ И ФИЗИЧЕСКИЕ НАУКИ СОДЕРЖАНИЕ:
Alene Burke, RN, MSN
Alene Burke RN, MSN является национально признанным преподавателем сестринского дела.Она начала свою карьеру учителем начальной школы в Нью-Йорке, а затем поступила в общественный колледж Квинсборо, чтобы получить степень младшего специалиста по медсестринскому делу. Она работала дипломированной медсестрой в отделении интенсивной терапии местной общественной больницы, и в то время она решила стать преподавателем сестринского дела. Она получила степень бакалавра наук по медсестринскому делу в колледже Excelsior, который входит в состав Университета штата Нью-Йорк, и сразу по окончании школы она поступила в аспирантуру в университете Адельфи на Лонг-Айленде, штат Нью-Йорк.Она закончила Summa Cum Laude в Адельфи, получив двойную степень магистра в области сестринского образования и сестринского администрирования, и сразу же получила докторскую степень по сестринскому делу в том же университете. Она является автором сотен курсов для медицинских работников, включая медсестер, работает медсестрой-консультантом в медицинских учреждениях и частных корпорациях, она также является утвержденным поставщиком непрерывного образования для медсестер и других дисциплин, а также была членом Американской ассоциации медсестер Целевая группа ассоциации по компетентности и обучению членов медсестер.
