Входная контрольная работа по химии (10 класс)
Входная контрольная работа 10 класс
Вариант 1.
А 1. Химический элемент, имеет следующее распределение электронов по энергетическим уровням в атоме: 2е, 8е, 4е. Какое положение занимает в Периодической системе
1) 4-й период, главная подгруппа III группа 3) 3-й период, главная подгруппа IV группа 2) 2-й период, главная подгруппа IV группа 4) 3-й период, главная подгруппа II группа
А 2. Элемент с наиболее ярко выраженными неметаллическими свойствами: 1) кремний 2) магний 3) сера 4) фосфор
А 3. Схеме превращения N+2 → N+4 соответствует химическое уравнение: 1) N2 + 3Mg = Мg3N2 3) N2 + О2 = 2NO 2) N2 + 3Н2 = 2NН3 4) 2NO + О2 = 2NО2
А 4. Количество водорода, выделившегося при взаимодействии 2 моль серной кислоты с цинком, равно …(моль).
А 5. Углекислый газ проявляет свойства кислотного оксида, реагируя с … 1)Mg 2) Ca(OH)2 3) С 4) HCl
А 6. Ион SO42- можно обнаружить с помощью раствора, содержащего катион: 1) бария 2) водорода 3) калия 4) меди
А 7. Коэффициент перед окислителем в уравнении реакции Ca + N2 Ca3N2 равен: 1) 1 2) 2 3) 3 4) 6
А 8. Азот имеет степень окисления +3 в ряду веществ: 1) N2О3, HNО3, KNО2 3) NaNО2
А 9. Кристаллическое вещество тёмно-фиолетового цвета, плохо растворяется в воде, но хорошо в спирте, при нагревании из твердого состояния переходит в газообразное, минуя жидкое, соединяется с водородом при нагревании, в его растворе крахмал синеет. 1)S 2) I2 3) CuO 4) KMnО4
1)S 2) I2 3) CuO 4) KMnО4
А 10. Сокращенное ионное уравнение Fe2++2OH—=Fe(OH)2 соответствует взаимодействию 1) гидроксида калия и фосфата железа (II) 3) нитрата железа (III) и гидроксида натрия 2) нитрата железа (II) и гидроксида меди (II) 4) хлорида железа (II) и гидроксида бария
Часть В.
Ответом к заданию В 1 является последовательность цифр в порядке возрастания.
В 1. С раствором гидроксида натрия реагируют:
1) CuSO4 2) CuO 3) KOH 4) HNO3 5) Zn(OH)2 6) CO2
В2.Установите соответствие между правой и левой частями уравнений
1122
33
44
Часть С.
C1. Какой объем водорода (н.у.) образуется при взаимодействии 60г кальция с водой, если объёмная доля выхода продукта составляет 90%?
C2. По схеме превращений составьте уравнения реакций в молекулярном виде. Превращение № 1 рассмотрите с точки зрения ОВР.
По схеме превращений составьте уравнения реакций в молекулярном виде. Превращение № 1 рассмотрите с точки зрения ОВР.
Ca CaO Ca(OH)2 CaCO3
Мониторинг качества знаний по химии 9 класс.
Вариант 2.
А 1. Химический элемент, имеет следующее распределение электронов по энергетическим уровням в атоме:
1) 2-й период, главная подгруппа VII группа 3) 3-й период, главная подгруппа VI группа 2) 2-й период, главная подгруппа VI группа 4) 2-й период, главная подгруппа II группа
А 2. Элемент с наиболее ярко выраженными металлическими свойствами: 1) калий 2) литий 3) натрий 4) рубидий
А 3. Схеме превращения S -2 → S+4 соответствует химическое уравнение: 1) SO2 + Н2О = Н2SO3 3) 2SO2 + O2 = 2SO3 2) Н2 + S = Н2S 4) 2Н2S + 3O2
А 4. Количество водорода, выделившегося при взаимодействии 3 моль серной кислоты с магнием, равно …(моль). 1) 1 моль 2) 2 моль 3) 3 моль 4) 6 моль
Количество водорода, выделившегося при взаимодействии 3 моль серной кислоты с магнием, равно …(моль). 1) 1 моль 2) 2 моль 3) 3 моль 4) 6 моль
А 5. Оксид серы (IV) проявляет свойства кислотного оксида, реагируя с … 1)NaOH 2) Ca 3) P2O5 4) HCl
А 6. Ион Cl— можно обнаружить с помощью раствора, содержащего катион: 1) бария 2) серебра 3) калия 4) меди
А 7. Коэффициент перед восстановителем в уравнении реакции Na + N2 Na3N равен: 1) 1 2) 2 3) 3 4) 6
А 8.
А 9. Порошок красного цвета, не ядовит, не растворяется в воде, при нагревании быстро загорается с образованием «белого дыма», который жадно поглощает воду, образуя кислоту, называется
1) оксид фосфора (V) 3) фосфорная кислота
2) фосфор 4) фосфат натрия
А 10. Сокращенное ионное уравнение 2H++CO32- = H2O + CO2 соответствует взаимодействию 1) серной кислоты с оксидом углерода (IV) 3) азотной кислоты с гидроксидом кальция 2) углекислого газа с гидроксидом кальция 4) карбоната натрия с соляной кислотой
Сокращенное ионное уравнение 2H++CO32- = H2O + CO2 соответствует взаимодействию 1) серной кислоты с оксидом углерода (IV) 3) азотной кислоты с гидроксидом кальция 2) углекислого газа с гидроксидом кальция 4) карбоната натрия с соляной кислотой
Часть В.
Ответом к заданию В 1 является последовательность цифр в порядке возрастания.
В1. С соляной кислотой реагируют:
1) Zn 2) Mg(OH)2 3) Na2O 4) Na2CO3 5) BaCl2 6) SO2
В2.Установите соответствие между правой и левой частями уравнений
- 11
22
33
44
Д)CuCl2+BaSO4↓
Часть С.
Запишите номер задания и полное решение
C1. Какой объем оксида углерода (IV) образуется при взаимодействии 60г карбоната кальция, содержащего 10% примесей, с соляной кислотой?
Какой объем оксида углерода (IV) образуется при взаимодействии 60г карбоната кальция, содержащего 10% примесей, с соляной кислотой?
С2. По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения.
Fe(OH)3 Fe2O3 FeCl3 Fe(OH)3
Инструкция по проверке заданий
Минимальное число баллов за тест — 22, из них за задания части А – 10 (по 1 баллу за задание), части В – 4 (по 2 балла за задание), части С – 8 (по 4 балла за задание)
ЧастьА
Часть В.Вариант 1.
В1. 1, 4, 5, 6
В2.
Вариант 2.
В1. 1, 2, 3, 4
В2.
Часть С.
С1
Вариант 1.
1.Составлено уравнение реакции: Ca + 2H2O = Ca(OH)2 + H2
2. Рассчитано количество вещества Ca: n(Ca) = 60:40 =1,5 моль
Рассчитано количество вещества Ca: n(Ca) = 60:40 =1,5 моль
3.Найдено количество вещества водорода и объём водорода по уравнению реакции (теоретический V): n(H
4. Рассчитан V(H2) практический: V(H2)= 33,6 * 0,9=30,24 л.
За каждый элемент задачи по 1 баллу, всего за задание 4 балла.
(Возможно решение другим способом)
Вариант 2.
1.Составлено уравнение реакции: CaCO3 + 2HCl = CaCl2 + H2O + CO2
2. Рассчитана масса чистого вещества карбоната кальция: n(CaCO3) = 60*0,9 =54 г. 3.Найдено количество вещества карбоната кальция: n(CaCO3) = 54:100=0,54 моль.
4. Рассчитано количество вещества и объём углекислого газа по уравнению реакции n(CO
За каждый элемент задачи по 1 баллу, всего за задание 4 балла.
(Возможно решение другим способом)
С2. Вариант 1.
Ca CaO Ca(OH)2 CaCO3
2Ca + O2 = 2 CaO (1б)
CaO + H2O = Ca(OH)2 (1б)
Ca(OH)2 + CO2 = CaCO3 + H2O (1б)
Записан электронный баланс для 1 реакции. (1б)
С2. Вариант 1.
Fe(OH)3 Fe2O3 FeCl3 Fe(OH)3
2Fe(OH)3= Fe2O3 + 3H2O (1б)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (1б)
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl (1б)
Записано ионное и сокращённое ионное уравнение для 3 реакции. (1б)
Шкала перевода баллов в отметку:
8 — 14 «3»
15 – 18 «4»
19 – 22 «5»
стартовая контрольная работа 10 класс | Тест по химии (10 класс) по теме:
Стартовая контрольная работа 10 класс
1. Соединением с ковалентной неполярной связью является 1) НС1 2) 02 3) СаС12 4) Н20
Соединением с ковалентной неполярной связью является 1) НС1 2) 02 3) СаС12 4) Н20
2. Путем соединения атомов одного и того же химического элемента образуется связь
Ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3. В аммиаке и хлориде бария химическая связь соответственно
ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
ковалентная полярная и ионная 4) ковалентная неполярная и ионная
4.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
вода и сероводород 2) бромид калия и азот 3) аммиак и водород 4) кислород и метан
5. В каком ряду все вещества имеют ковалентную полярную связь?
НС1, NaCl, С12 2) 02, Н20, С02 3) Н20, Nh4, Ch5 4) NaBr, HBr, СО
6. В молекуле фтора химическая связь
ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
7. Химическая связь в молекуле фтороводорода
Химическая связь в молекуле фтороводорода
ковалентная полярная 2) ковалентная неполярная 3) ионная 4) водородная
8. В иодиде калия химическая связь
ковалентная неполярная 2) ковалентная полярная 3) металлическая 4) ионная
9. Кислотным является оксид, формула которого 1) Сг03 2) СаО 3) А1203 4) N0
10. К двухосновным слабым кислородсодержащим кислотам относится1) h3S04 2) h3S 3) h3C034) HN03
11. Кислотным и основным оксидом являются соответственно
S02 и MgO 2) С02 и А1203 3) Na20 и FeO 4) ZnO и S03
12. К основным оксидам относится 1) ZnO 2) Si02 3) BaO 4) A1203
13.Только кислоты расположены в ряду
HN03, Ca(N03)2, N02 3) HN02, HN03, Ch4C00H
КНС03, Ba(HS04)2, ZnOHCl 4) h3S, Na2S03, S02
К средним солям относится каждое из двух веществ
Fe(OH)2Cl и Fe(HS04)2 3) MgCl2 и Mg(OH)N03
КНС03 и NaHSi03 4) K3P04 и BaSi03
А) 2Na(K) + С12(г) = 2NaCl(K) + Q Б) 2AgN03(TB) = 2Ag(TB) + 2N02(r) + 02(r) — Q
Объем воздуха (н. у.), необходимый для полного сгорания 60 л (н.у.) этилена С2Н2, равен л. (Запишите число с точностью до целых.)
у.), необходимый для полного сгорания 60 л (н.у.) этилена С2Н2, равен л. (Запишите число с точностью до целых.)
Дана схема превращений:
Cu → CuCl2 → Cu (OH)2 → X
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения расставьте коэффициенты методом электронного баланса, для второго превращения составьте сокращенное ионное уравнение реакции.
СТЕПЕНЬ ОКИСЛЕНИЯ | ||
А) Б) В) Г) | 1) -4 2) -2 3) 0 4) +2 5) +4 |
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА |
А) Б) В) Г) |
| 1) от –3 до +2 2) от –3 до 0 3) от 0 до –3 4) от +5 до +2 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА |
A) Б) B) Г) | 1) -3 2) -2 3) +2 4) +3 5) +4 6) +5 |
Входные контрольные работы по химии 9-11 классы
Дифференцированные контрольные работы.
Входная контрольная работа по химии – 10 класс.
I вариант.
Задание 1. Дайте полную характеристику элементу с порядковым номером 25.
Задание 2. Уравняйте реакцию методом электронного баланса:
Н2О2 + КMnO4 + H2SO4 O2 + MnSO4 + K2SO4 + H2O
Задание 3. Допишите реакцию и напишите её в ионной форме:
BaCI2 + H3PO4
Задание 4. Напишите гидролиз соли, в том числе в ионных формах:
Na2S
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей с серной кислотой.
II вариант.
Задание 1. Дайте полную характеристику элементу с порядковым номером 30.
Задание 2. Уравняйте реакцию методом электронного баланса:
Na2 SО3 + КMnO4 + H2O Na2SO4 + MnO2 + KOH
Задание 3.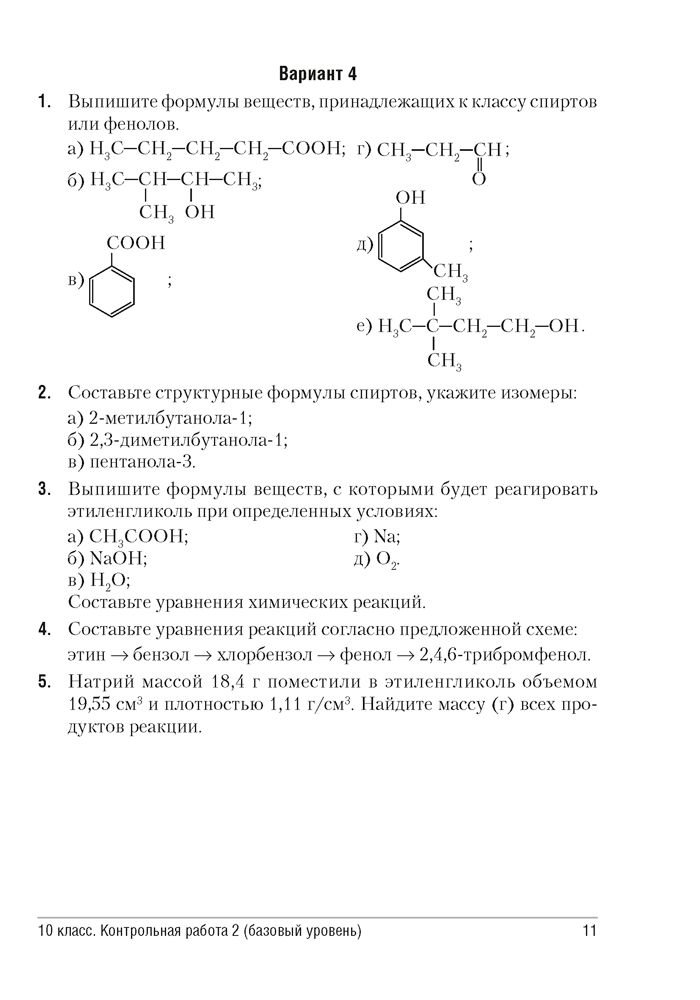 Допишите реакцию и напишите её в ионной форме:
Допишите реакцию и напишите её в ионной форме:
AICI3 + AgNO3
Задание 4. Напишите гидролиз соли, в том числе в ионных формах:
FeCI3
Задание 5. Рассчитайте объём водорода (при н.у.), если он выделился при взаимодействии 240 г магния, содержащего 12 % примесей с соляной кислотой.
Входная контрольная работа по химии – 11 класс.
I вариант.
Задание 1 Дайте названия веществам. К каким классам органических веществ они относятся?
а) СН2 = СН – СН3
б) СН3 – О – СН3
в) СН3 – СН2 – СН – СООН г) СН3
СН3
СН3
Задание 2. Составьте формулы веществ по названиям, подпишите названия под формулами веществ. К каким классам органических веществ они относятся?
а) пентадиен – 1,3 в) 4 – метилпентанол — 2
б) бутен – 2 г) 2,5 – диметил, 3 – этилгексан
Задание 3. Допишите реакции, дайте названия органическим веществам, укажите условия протекания реакций:
Допишите реакции, дайте названия органическим веществам, укажите условия протекания реакций:
а) С2 Н5ОН + О2 в) СН = С – СН3 + Н2О
б) СН2 = СН – СН2 – СН3 + НCI
Задание 4. Как распознать химическим путём:
а) фенол б) уксусную кислоту
Задание 5. Вычислите объём этилена при (н.у.), если он выделяется в результате реакции дегидратации 350 г раствора, содержащего 15 % спирта.
II вариант.
Задание 1 Дайте названия веществам. К каким классам органических веществ они относятся?
а) СН3 – СН3
б) СН3 – CH2 — ОH г) OH
в) C6H6
Задание 2. Составьте формулы веществ по названиям, подпишите названия под формулами веществ. К каким классам органических веществ они относятся?
а) 1 — метилбензол в) 2,2 – диметилбутанол — 1
б) бутан г) пентин — 2
Задание 3. Допишите реакции, дайте названия органическим веществам, укажите условия протекания реакций:
Допишите реакции, дайте названия органическим веществам, укажите условия протекания реакций:
а) СН4 + О2 в) С2Н5ОН
б) С2 Н6 + CI2
Задание 4. Как распознать химическим путём:
а) ацетилен б) раствор куриного белка
Задание 5. Вычислите объём и количество вещества хлороводорода при (н.у.), если он выделяется в результате реакции хлорирования 78,2 л пропана.
Входная контрольная работа по химии – 9 класс.
I вариант.
Задание 1. Дайте полную характеристику элементу с порядковым номером 15.
Задание 2. Допишите реакции, назовите сложные вещества, укажите тип реакции:
а) AI + O2
б) Mg + H2SO4
в) CaCO3
г) HCI + Na2CO3
Задание 3. Допишите реакции и напишите их в ионных формах? Дайте названия веществам:
а) BaCI2 + H3PO4
б) НСI + AgNO3
Задание 4. Составьте реакции, расставьте коэффициенты, укажите тип реакций:
Составьте реакции, расставьте коэффициенты, укажите тип реакций:
а) фосфор + кислород оксид фосфора (V)
б) цинк + азотная кислота нитрат цинка + водород
в) хлорид бария + серная кислота
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей с серной кислотой.
Входная контрольная работа по химии – 9 класс.
II вариант.
Задание 1. Дайте полную характеристику элементу с порядковым номером 19.
Задание 2 Допишите реакции, назовите сложные вещества, укажите тип реакции:
а) Zn + O2
б) Mg + HCI
в) H2O
г) H2SO4 + K2CO3
Задание 3. Допишите реакции и напишите их в ионных формах? Дайте названия веществам:
а) Ba(NO3)2 + H3PO4
б) NaСI + AgNO3
Задание 4. Составьте реакции, расставьте коэффициенты, укажите тип реакций:
Составьте реакции, расставьте коэффициенты, укажите тип реакций:
а) фосфор + кислород оксид фосфора (III)
б) цинк + соляная кислота хлорид цинка + водород
в) хлорид меди + гидроксид натрия
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 230 г раствора содержащего 10 % карбоната натрия с азотной кислотой.
Входная диагностика по химии 11 класс
Входной контроль 11 класс
Вариант 1.
1. Число электронных слоев и число электронов на внешнем электронном слое атомов брома соответственно равны:
1) 7 и 4; 2) 4 и 7; 3) 35 и 7; 4) 4 и 35.
2. Электронная конфигурация атома железа:
1) ls22s22p63s23p6 ;2) 1s22s22p63s23p64s24p 2 ; 3) ls22s22p63s23p63d8 ;
4) 1s22s22p63s23p63d64s2 .
3. Номер периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
4. Элементу, электронная формула атома которого ls22s22p63s23p63d54s2 соответствует высший оксид, формула которого: 1) Вг2О7; 2) MnО2; 3) MnO; 4) Mn2О7.
5. Наибольшую электроотрицательность имеет:
1) фосфор; 2) хлор; 3) кремний; 4) сера.
6. В ряду химических элементов фтор → хлор → бром:
1) усиливаются неметаллические свойства;
2) увеличивается радиус атома;
3) увеличивается степень окисления в летучих водородных соединениях;
4) увеличивается электроотрицательность.
7. Ряд химических элементов, в котором неметаллические свойства усиливаются:
1) фтор → бром → иод;
2) кремний → фосфор → хлор;
3) кислород → сера → селен
8. Вещества
только с ионной связью приведены в ряду:
Вещества
только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2. P4 , CaF2
4) H2S, Br2, K2S
9. Установите соответствие между формулой вещества и степенью окисления атома хлора в нём.
ФОРМУЛА ВЕЩЕСТВА
A) Ca(OCl)2
Б) KClO3
B) HClO2
Г) FeCl3
СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА
1) +1
2) +3
3) -1
4) +5
10. Распредели вещества, формулы которых приведены по классам соединений и назови их.
Входной контроль 11 класс
Вариант 2.
1. Число электронных слоев и
число электронов на внешнем электронном слое атомов марганца соответственно
равны: 1) 4 и 7; 2) 4 и 2; 3) 7 и 4; 4) 4 и 5.
2. Электронная конфигурация атома ванадия: 1) ls22s22p63s23p63d5 ;
2) ls22s22 p63s23p63d34s2 ; 3) ls22s22p63s23p63d44s1 ; 4) ls 22s22p63s23p64s24p 3
3. Номер группы элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
4. Наименьшую электроотрицательность имеет:
1) фтор; 3) бром; 2) хлор; 4) иод.
5. В ряду химических элементов барий → кальций → магний:
1) увеличивается радиус атома; 2) усиливаются металлические свойства;
3) уменьшается радиус атома;
4) увеличивается степень окисления в высших оксидах.
6. Ряд химических элементов, в котором металлические свойства ослабевают:
1) литий → бериллий → бор;
2) натрий → магний → алюминий;
3) углерод → кремний → германий
7. Элементу, электронная формула атома которого ls22s22p63s23p4 , соответствует высший оксид, формула которого: 1) SО2; 2) SO3; 3) SeO2; 4) CrО3.
8. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2
2) O2, H2O, CO2
3) H2O.NH3.CH4
4) CH3OH, HBr, CO
9. Установите соответствие между формулой вещества и степенью окисления атома азота в нём.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
A) NH4Cl 1) -3
Б) HNO3 2) +3
B) NH4NO3 3) +5
Г) N2O3 4) -3, +5
10. Распредели вещества, формулы которых приведены по классам соединений и назови
их.
Распредели вещества, формулы которых приведены по классам соединений и назови
их.
Входная контрольная работа по биологии 10 класс
Входная контрольная работа по биологии 10 класс с ответами. Входная контрольная работа состоит из 17 тестовых заданий.
1. Какая наука изучает химический состав, строение и процессы жизнедеятельности клетки?
1) Гистология
2) Эмбриология
3) Экология
4) Цитология
2. Возбудитель СПИДа – это
1) Вирус
2) Бактерия
3) Одноклеточный гриб
4) Простейшее
3. Как называют организмы, которым для жизнедеятельности необходим свободный кислород?
1) Автотрофами
2) Анаэробами
3) Гетеротрофами
4) Аэробами
4. Какие растения состоят из сходных по строению клеток, не образующих тканей?
1) Водоросли
2) Плауны
3) Папоротники
4) Мхи
5. Жабы, в отличие от лягушек, могут жить вдали от водоёма. Чем это можно объяснить?
Жабы, в отличие от лягушек, могут жить вдали от водоёма. Чем это можно объяснить?
1) Они размножаются на суше
2) У них лучше развиты лёгкие и более сухая кожа
3) У них короткие задние конечности и длинные передние
4) Они питаются наземными беспозвоночными животными
6. Каких из древних животных считают предками земноводных?
1) Стегоцефалов
2) Ихтиозавров
3) Археоптериксов
4) Латимерий
7. Социальная природа человека проявляется в
1) Приспособленности к прямохождению
2) Речевой деятельности
3) Наличие гортани с голосовыми связками
4) Образовании условных рефлексов
8. Желчь, вырабатываемая печенью, по желчным протокам поступает в
1) Пищевод
2) Желудок
3) Толстую кишку
4) Тонкую кишку
9. Эритроциты могут переносить кислород и углекислый газ, так как они содержат
1) Воду и минеральные соли
2) Антитела
3) Фибриноген
4) Гемоглобин
10. Длительное повышение содержания глюкозы в крови свидетельствует о нарушении обмена
Длительное повышение содержания глюкозы в крови свидетельствует о нарушении обмена
1) Белкового
2) Жирового
3) Углеводного
4) Минерального
11. Неподвижно соединены между собой кости
1) Плечевая и локтевая
2) Теменная и височная
3) Бедренная и большая берцовая
4) Грудина и рёбра
12. Какие биотические связи существуют между раком-отшельником и актинией?
1) Паразит-хозяин
2) Хищник-жертва
3) Конкурентные
4) Взаимовыгодные
13. Главным фактором, ограничивающим рост травянистых растений в еловом лесу, является недостаток
1) Света
2) Воды
3) Тепла
4) Минеральных солей
14. Большинство бактерий и некоторые грибы в круговороте веществ, выполняют роль
1) Производителей органического вещества
2) Потребителей органического вещества
3) Разрушителей органического вещества
4) Концентратов органического вещества
15. В чём проявляется сходство покрытосеменных и голосеменных растений?
В чём проявляется сходство покрытосеменных и голосеменных растений?
Выберите три верных ответа.
1) Характеризуется многообразием видов
2) Имеют хорошо развитые вегетативные органы
3) Способны образовывать обширные леса
4) Размножаются семенами
5) Опыляются насекомыми и птицами
6) Образуют сочные и сухие семена
16. Установите соответствие между признаком организма и царством, для которого он характерен.
Признак
А) Растут в течение всей жизни
Б) Активно перемещаются в пространстве
В) Питаются готовыми органическими веществами
Г) Образуют органические вещества в процессе фотосинтеза
Д) Имеют органы чувств
Е) Являются основным источником кислорода на Земле
Царство
1) Растения
2) Животные
17. Установить последовательность передачи вещества и энергии в пищевой цепи.
A) Насекомое
Б) Растение
B) Цапля
Г) Лягушка
Д) Орёл
Ответы на входную контрольную работу по биологии 10 класс
1-4
2-1
3-4
4-1
5-1
6-1
7-2
8-4
9-4
10-3
11-2
12-4
13-1
14-3
15-234
16-211122
17-БАГВД
Входная контрольная работа по географии 11 класс
on 28 Июль 2014.
1 ВАРИАНТ
ЧАСТЬ I.
1.По географическому положению Австрия, Монголия, Непал, Парагвай, Чад, Чехия относятся к странам:
А)Приморским Б)Полуостровным
В)Островным Г)Внутриконтинентальным
2.Дополни:
Государство, обладающее политической независимостью, самостоятельностью во внутренних и внешних делах называется …
3.Обрабатываемые земли мирового земельного фонда составляют:
А)11% Б)21% В)31% Г)41%
4.Ресурсами пресной воды наиболее обеспечены страны пояса
А)Экваториального Б)Субтропического
В)Южной части умеренного Г)Северной части умеренного
5.Численность населения Земли в настоящее время составляет:
А)2,5 млрд. человек Б)6,5 млрд. человек
В)10,5 млрд. человек Г) 20,5 млрд. человек
6.Для какого из перечисленных регионов характерен наиболее высокий естественный прирост населения:
А)Северная Европа Б)Восточная Европа
В)Восточная Африка Г)Северная Америка
7. В какой из перечисленных стран осуществляется активная государственная политика, направленная на стимулирование рождаемости?
В какой из перечисленных стран осуществляется активная государственная политика, направленная на стимулирование рождаемости?
А)Алжир Б)Индия
В)Франция Г)Кения
8. Для какой из перечисленных стран характерен миграционный прирост населения?
А)Индонезия Б)Дания
В)Пакистан Г)Египет
9.Какая из перечисленных стран входит в состав ОПЕК?
А)Норвегия Б)Саудовская Аравия
В)Канада Г)Казахстан
10.В эпоху НТР среди отраслей промышленности наиболее высокими темпами развиваются:
А)Электроэнергетика и текстильная промышленность
Б)Текстильная промышленность и машиностроение
В)Машиностроение и электроэнергетика
Г)Черная и цветная металлургия
11. Новыми факторами размещения производства в эпоху НТР стали:
А)Транспортный фактор
Б)Фактор наукоемкости
В)Фактор наукоемкости и экологический
Г)Фактор наукоемкости, экологический и природyо-ресурсный
12. В структуре производства электроэнергии какой страны наиболее велика доля АЭС?
В структуре производства электроэнергии какой страны наиболее велика доля АЭС?
А)Италия Б)Германия
В)Франция Г)Россия
13.Для какой страны характерна структура ВВП, показанная в таблице?
|
Непроизводственная сфера |
67% |
|
Промышленность |
31% |
|
Сельское хозяйство |
2% |
А)Япония Б)Индия
В)Лаос Г)Ангола
14.В какой из перечисленных стран развито интенсивное молочное скотоводство?
А)Австралия Б)Индия
В)Мексика Г)Финляндия
15. В какой из перечисленных стран международный туризм является одной из ведущих отраслей экономики?
В какой из перечисленных стран международный туризм является одной из ведущих отраслей экономики?
А)Канада Б)Кипр
В)Австралия Г)Иран
16.Население Южной Европы исповедует:
А)Католицизм
Б)Протестантство
В)Православие
17.Определить по карте страну:
А, В,Д
ЧАСТЬ II.
1.Подберите пары по принципу «страна- столица»:
1.Австралия А)Алжир
2.Алжир Б)Каракас
3.Белоруссия В)Найроби
4.Венесуэла Г)Минск
5.Кения Д)Канберра
2. Распределите страны, относящиеся к 1 и 2 типу воспроизводства:
А)Австрия Б)Индия В)Иордания Г)Италия Д)Польша Е)Судан Ж)Таджикистан З)Уганда И)Филиппины К)Эстония
3.Установите соответствие между странами и типами их отраслевой структуры:
1. Великобритания А.Аграрная
Великобритания А.Аграрная
2.Чехия Б.Индустриальная
3.Эфиопия В.Постиндустриальная
4.Расположите электростанции по мере уменьшения их доли в мировом производстве электроэнергии:
А)ГЭС
Б)АЭС
В)ТЭС
5.Установите соответствие между сельскохозяйственной культурой, определяющей международную специализацию, и страной:
1.Пшеница А.Колумбия
2.Рис Б. Канада
3.Кофе В.Китай
6.Расположите перечисленные страны в порядке возрастания в них доли горожан в общей численности населения:
А)Индия Б)Швеция
В)Эфиопия Г)Болгария
2 ВАРИАНТ контрольной работы по географии
ЧАСТЬ I.
1. По географическому положению Великобритания, Исландия, Куба, Мальта, Шри-Ланка, Япония относятся к странам:
А)Приморским Б)Полуостровным
В)Странам-архипелагам и островным Г)Внутриконтитентальным
2. Государство, главой которого является император, король, князь и т.д., а верховная власть передается по наследству, называется….
Государство, главой которого является император, король, князь и т.д., а верховная власть передается по наследству, называется….
3. Леса и кустарники в мировом земельном фонде составляют:
А)10% Б)20% В)30% Г)50%
4.Ресурсами хвойной древесины наиболее обеспечены страны пояса
А)Экваториального Б)Субтропического
В)Умеренного Г)Субэкваториального
5.Численность населения Земли в 2000 году составляла:
А)2,5 млрд. человек Б)4,5 млрд. человек
В)6,1 млрд. человек Г) 8,5 млрд. человек
6.Для какого из перечисленных регионов характерен наиболее низкий естественный прирост населения:
А)Зарубежная Европа Б)Юго-Восточная Азия
В)Восточная Африка Г)Северная Америка
7.В какой из перечисленных стран осуществляется активная государственная политика, направленная на снижение рождаемости?
А)Австрия Б)Индия
В)Франция Г)Канада
8. Для какой из перечисленных стран характерен миграционный прирост населения?
Для какой из перечисленных стран характерен миграционный прирост населения?
А)Индия Б)Сомали
В)Афганистан Г)Германия
9.Какая из перечисленных стран входит в состав ОПЕК?
А)Египет Б)Дания
В)Китай Г)Иран
10.Наиболее быстрыми темпами в современной промышленности развивается группа отраслей:
А)Автомобилестроение и металлургия
Б)Металлургия и нефтехимия
В)Нефтехимия и судостроение
Г)Микробиологическая и роботостроение
11.Какие факторы являлись решающими на более ранних этапах индустриализации?
А)Транспортный и природно-ресурсный
Б)Фактор наукоемкости
В)Фактор наукоемкости и экологический
Г) Экологический и трудовых ресурсов
12.В структуре производства электроэнергии какой страны наиболее велика доля ГЭС?
А)Финляндия Б)Норвегия
В)Франция Г)Канада
13. Для какой страны характерна структура ВВП, показанная в таблице?
Для какой страны характерна структура ВВП, показанная в таблице?
|
Непроизводственная сфера |
30% |
|
Промышленность |
19% |
|
Сельское хозяйство |
51% |
А)Великобритания Б)Канада
В)Лаос Г)Австрия
14.В какой из перечисленных стран развито субтропическое земледелие?
А)Австралия Б)Индия
В)Испания Г)Финляндия
15.В какой из перечисленных стран находится крупнейший мировой порт?
А)Канада Б)Нидерланды
В)Австралия Г)Бразилия
16. Население Северной Европы исповедует:
Население Северной Европы исповедует:
А)Католицизм
Б)Протестантство
В)Православие
17.Определить по карте страну:
Б, Г,Е
СМОТРЕТЬ КАРТУ ВЫШЕ
ЧАСТЬ II.
1.Подберите пары по принципу «страна- столица»:
1.Мексика А)Дели
2.Норвегия Б)Мехико
3.Индия В)Бангкок
4.Таиланд Г)Осло
5.Чехия Д)Прага
2. Распределите страны, относящиеся к 1 и 2 типу воспроизводства:
А)Австралия Б)Индия В)Италия Г)Ботсвана Д)Перу Е)Узбекистан Ж)Руанда З)Камбоджа И) Латвия К)США
3.Установите соответствие между странами и типами их отраслевой структуры:
1.США А.Аграрная
2.Нигерия Б.Индустриальная
3.Румыния В.Постиндустриальная
4.Расположите электростанции по мере увеличения их доли в мировом производстве электроэнергии:
А)ГЭС
Б)АЭС
В)ТЭС
5. Установите соответствие между отраслью животноводства, определяющей международную специализацию, и страной:
Установите соответствие между отраслью животноводства, определяющей международную специализацию, и страной:
1.Свиноводство А.Австралия
2.КРС Б. Индия
3.Овцеводство В.Китай
6.Расположите перечисленные страны в порядке возрастания в них доли горожан в общей численности населения:
А)Алжир Б)Мексика
В)Нигер Г)Япония
Ключ ответов
|
№ задания |
1 вариант |
2 вариант |
|
ЧАСТЬ I. |
||
|
1 |
Г |
В |
|
2 |
суверенным |
монархия |
|
3 |
А |
В |
|
4 |
А |
В |
|
5 |
Б |
В |
|
6 |
В |
А |
|
7 |
В |
Б |
|
8 |
Б |
Г |
|
9 |
Б |
Г |
|
10 |
В |
Г |
|
11 |
В |
А |
|
12 |
В |
Б |
|
13 |
А |
В |
|
14 |
Г |
В |
|
15 |
Б |
Б |
|
16 |
А |
Б |
|
17 |
Исландия, Германия, Португалия |
Франция, Италия, Норвегия |
|
ЧАСТЬ II. |
||
|
1 |
1Д2А3Г4Б5В |
1Б2Г3А4В5Д |
|
2 |
1 тип: АГДК; 2 тип: БВЕЖЗИ |
1 тип: АВИК; 2 тип: БГДЕЖЗ |
|
3 |
1В2Б3А |
1В2А3Б |
|
4 |
ВАБ |
БАВ |
|
5 |
1Б2В3А |
1В2Б3А |
|
6 |
ВАГБ |
ВАБГ |
Оценивание контрольной работы по географии в 11 классе
Каждый правильный ответ Части I оценивается одним баллом.
Каждый правильный ответ Части II оценивается двумя баллами. Если дана половина или большая часть правильных ответов на поставленный вопрос Части II, то они оцениваются 1 баллом.
Максимальное количество баллов за выполнение работы- 29.
1-10 баллов- «2»;
11-17 баллов- «3»;
18-24 балла- «4»;
25-29 баллов- «5»
Если материал полезен для Вас, пожалуйста, поделитесь с друзьями в соцсетях!
| < Предыдущая | Следующая > |
|---|
Экзамен по химии — CLEP — College Board
Обзор
Экзамен по химии охватывает материал, который обычно преподается в течение годичного курса общей химии в колледже. Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена в составе программного обеспечения для тестирования доступны онлайн-калькулятор и таблица Менделеева.
Во время этого экзамена в составе программного обеспечения для тестирования доступны онлайн-калькулятор и таблица Менделеева.
Научный калькулятор
Научный калькулятор TI-30XS MultiView ™ интегрирован в программу экзамена и доступен студентам в течение всего времени тестирования.
Чтобы использовать калькулятор во время экзамена, студенты должны выбрать значок Калькулятор . Информация об использовании калькулятора доступна на значке Help на вкладке Calculator . Ожидается, что студенты знают, как и когда правильно пользоваться калькулятором.
Информация о научном калькуляторе, включая возможности для практики, доступна здесь .
Студенты найдут онлайн-научный калькулятор полезным при выполнении вычислений (например, арифметических, показателей, корней, логарифмов).
Периодическая таблица
Чтобы использовать Периодическую таблицу элементов во время экзамена, выберите значок Help в меню вверху экрана, а затем выберите вкладку Periodic Table .
Требуемые знания и навыки
Экзамен содержит примерно 75 вопросов, на которые нужно ответить за 90 минут. Некоторые из этих вопросов представляют собой предварительные вопросы, которые не будут оцениваться. Время, потраченное на обучение и предоставление личной информации, добавляется к фактическому времени тестирования.
Вопросы на экзамене по химии требуют, чтобы кандидаты продемонстрировали одну или несколько из следующих способностей.
- Напомнить — запомнить конкретные факты; продемонстрировать прямое знание информации и знакомство с терминологией
- Приложение — понимать концепции и переформулировать информацию в других эквивалентных терминах; применять знания в незнакомых и / или практических ситуациях; использовать математику для решения задач по химии
- Интерпретация — делать выводы и делать выводы из имеющихся данных и объединять информацию для формирования выводов; признать неустановленные допущения
Экзамен по химии состоит из следующих тем.Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Структура вещества (20%)
Атомная теория и структура атома
- Доказательства атомной теории
- Атомные массы; определение химическими и физическими методами
- Атомный номер и массовое число; изотопы и масс-спектроскопия
- Уровни энергии электронов: атомные спектры, атомные орбитали
- Периодические зависимости, включая, например, атомные радиусы, энергии ионизации, сродство к электрону и степени окисления
Ядерная химия: уравнения ядра, период полураспада и радиоактивность; химические приложения
Химическая связь
- Связующие силы
- Типы: ковалентные, ионные, металлические, макромолекулярные (или сетчатые), дисперсионные, водородные связи
- Связь со структурой и недвижимостью
- Полярность связей, электроотрицательности
- Теория VSEPR и электронно-точечные диаграммы Льюиса
- Гибридизация орбиталей
- Геометрия молекул, ионов и координационных комплексов
- Структурная изомерия
- Резонанс
- Сигма и пи-облигации
- Дипольные моменты молекул
- Отношение собственности к структуре
Состояния вещества (19%)
Газы
- Законы идеальных газов; уравнения состояния идеального газа
- Концепция крота; Число Авогадро
- Кинетико-молекулярная теория
- Интерпретация законов идеального газа на основе этой теории
- Зависимость кинетической энергии молекул от температуры: распределение Больцмана
- Отклонения от законов об идеальном газе
Жидкости и твердые вещества
- Жидкости и твердые тела с кинетико-молекулярной точки зрения
- Фазовые диаграммы однокомпонентных систем
- Изменения состояния, критические явления
Решения
- Типы растворов и факторы, влияющие на растворимость
- Методы выражения концентрации
- Коллигативные свойства; например, закон Рауля
- Влияние межионного притяжения на коллигативные свойства и растворимость
Типы реакций (12%)
Кислотно-основные реакции; концепции Аррениуса, Бронстеда-Лоури и Льюиса; амфотеризм
Реакции с участием координационных комплексов
Реакции осаждения
Окислительно-восстановительные реакции
- Окислительное число
- Роль электрона в окислительно-восстановительном процессе
- Электрохимия; электролитические ячейки, стандартные потенциалы полуэлементов, прогнозирование направления окислительно-восстановительных реакций, влияние изменения концентрации
Уравнения и стехиометрия (10%)
Ионные и молекулярные частицы, присутствующие в химических системах; чистые ионные уравнения
Стехиометрия: соотношение массы и объема с акцентом на концепцию родинки
Баланс уравнений, в том числе для окислительно-восстановительных реакций
Равновесие (7%)
Концепция динамического физико-химического равновесия; Принцип ЛеШателье; константы равновесия
Количественная обработка
- Константы равновесия газовых реакций с точки зрения как молярных концентраций, так и парциального давления (K c , K p )
- Константы равновесия реакций в растворах
- Константы для кислот и щелочей; pK; pH
- Константы произведения растворимости и их применение к осаждению и растворению малорастворимых соединений
- Константы для комплексных ионов
- Обычный ионный эффект; буферы
Кинетика (4%)
Понятие скорости реакции
- Порядок реакции и константа скорости
- Определение порядка реакции и константы скорости по экспериментальным данным
- Влияние изменения температуры на показатели
Энергия активации и роль катализаторов
Взаимосвязь между стадией, определяющей скорость, и механизмом реакции
Термодинамика (5%)
Государственные функции
Первый закон:
- Теплота образования
- Теплота реакции, изменение энтальпии, закон Гесса
- Теплоемкость; теплота испарения и плавления
Второй закон:
- Свободная энергия образования
- Свободная энергия реакции
- Зависимость изменения свободной энергии от изменений энтальпии и энтропии
Связь изменения свободной энергии с константами равновесия и потенциалами электродов
Начертательная химия (14%)
Накопление определенных конкретных фактов по химии необходимо для того, чтобы студенты могли
- понять развитие принципов и концепций
- демонстрируют применение принципов
- соотносить факт с теорией и свойства со структурой
- развивают понимание систематической номенклатуры, что облегчает общение.
Экзамен обычно включает следующие области:
- Химическая активность и продукты химических реакций
- Соотношения в периодической таблице Менделеева: горизонтальное, вертикальное и диагональное
- Химия основных групп и переходных элементов, включая типичные примеры каждой
- Органическая химия, включая такие темы, как функциональные группы и изомерия (может рассматриваться как отдельная единица или как примерный материал в других областях, таких как связывание)
Экспериментальная химия (9%)
Некоторые эксперименты основаны на лабораторных экспериментах, широко проводимых в общей химии, и включают вопросы об используемом оборудовании, проведенных наблюдениях, выполненных расчетах и интерпретации результатов.Вопросы разработаны, чтобы обеспечить понимание основных инструментов химии и их приложений к простым химическим системам.
Учебные ресурсы
Большинство учебников, используемых в курсах химии на уровне колледжа, охватывают темы, указанные в схеме, приведенной ранее, но подходы к определенным темам и акценты, которые им уделяются, могут различаться. Чтобы подготовиться к экзамену по химии, рекомендуется изучить один или несколько учебников колледжа, которые можно найти в книжных магазинах большинства колледжей.Выбирая учебник, сверьте оглавление со знаниями и навыками, необходимыми для этого теста.
Учебники
Опрос, проведенный CLEP, показал, что следующие учебники входят в число тех, которые используются преподавателями колледжей, которые преподают аналогичный курс. Вы можете приобрести один или несколько из них в Интернете или в книжном магазине местного колледжа.
- Chang, Общая химия: основные понятия (McGraw-Hill)
- Cracolice and Peters, Введение в химию (Cengage)
- Gilbert et al., Химия: наука в контексте (W.W. Norton)
- Голдберг, Основы химии (МакГроу-Хилл)
- Хилл и Колб, Химия для изменения времен (Прентис-Холл)
- Joesten et al., The World of Chemistry: Essentials (Cengage)
- Kelter et al., Химия: мир выбора (McGraw-Hill)
- McQuarrie, Gallogly and Rock, Общая химия (Университетские научные книги)
- Snyder, Необычная химия обычных вещей (Wiley)
- Zumdahl and DeCoste, Введение в химию (Cengage)
Интернет-ресурсы
Эти ресурсы, составленные комитетом по разработке тестов CLEP и сотрудниками, могут помочь вам подготовиться к экзамену.Однако ни один из этих источников не предназначен специально для подготовки к экзамену CLEP. Совет колледжей не контролирует их содержание и не может поручиться за точность.
Оценка информации
Проходной балл по химии
Рекомендуемый балл ACE *: 50
Семестровые часы: 6
Каждое учреждение оставляет за собой право устанавливать свою собственную политику предоставления кредитов, которая может отличаться от политики ACE. Свяжитесь с вашим колледжем как можно скорее, чтобы узнать, какой балл требуется для предоставления кредита, количество предоставленных кредитных часов и курс (ы), которые можно пропустить с удовлетворительным баллом.
* Служба рекомендаций колледжей Американского совета по образованию (ACE CREDIT) провела оценку процессов и процедур CLEP для разработки, проведения и оценки экзаменов. Указанный выше балл эквивалентен баллу C по соответствующему курсу. Американский совет по образованию, главный координирующий орган для всех высших учебных заведений страны, стремится обеспечить лидерство и объединить голос по ключевым вопросам высшего образования и влиять на государственную политику посредством пропаганды, исследований и программных инициатив.Посетите веб-сайт ACE CREDIT для получения дополнительной информации.
Практический тест по химии HESI A2 (обновлен в 2021 г.)
Тест по химии HESI A2 состоит из 25 вопросов, связанных с научной нотацией, метрической системой и температурой; Атом; Периодическая таблица; Химические уравнения; Решения; Химические реакции; Окислительно-восстановительные реакции; Кислоты и основания; Ядерная химия; и биохимия.
Научная нотация, метрическая система и температура
В этом подразделе вам потребуется продемонстрировать свои знания в экспоненциальной нотации, метрических префиксах и основных единицах измерения, единицах измерения СИ и температуре.Ниже приведены несколько примеров вопросов:
- Используйте научную нотацию для сокращения 0.00002509
- Метрические единицы измерения включают:
- Метры, литры и граммы
- Футы, унции и фунты
- Метры, унции, и граммы
Первый ответ: 2,509 x 10-5. Вы можете прийти к этому ответу, упростив и используя экспоненты. Второй ответ: а. Метры, литры и граммы.
Атом
Этот подраздел состоит из вопросов, связанных со структурой атома, включая ядра, электроны, протоны, атомный радиус, ионы, электронные облака и другие связанные термины и концепции.Например:
- Число протонов в ядре атома определяет:
- Число отрицательно заряженных электронов, вращающихся вокруг ядра иона
- Атомный номер элемента
- Он определяет массовое число атома
- Число протонов в ядре атома определяет:
Правильный ответ: б. Атомный номер элемента.
Периодическая таблица
Этот подраздел состоит из вопросов, связанных с группировкой элементов в периодической таблице, а также атомным весом, атомным радиусом, электроотрицательностью, сродством к электрону и другими связанными терминами и понятиями.Например:
- Стандартная атомная масса отличается от атомной массы и относится к:
- Отношение средней массы атомов элемента к 1/12 массы атома углерода-12
- Отношение углерода -12 атом к относительной массе атома на основе его наиболее стабильного изотопа
- Средняя масса атомов в элементе за вычетом массы атома углерода-12
- Стандартная атомная масса отличается от атомной массы и относится к:
Правильный ответ: a. Отношение средней массы атомов элемента к 1/12 массы атома углерода-12.
Практический тест по химии Hesi A2
Химические уравнения
Этот подраздел состоит из вопросов, связанных с химическими уравнениями, включая реагенты, продукты, коэффициенты, а также сбалансированные и несбалансированные уравнения, а также другие связанные термины и концепции. Например:
- Несбалансированное уравнение
- Следует закону сохранения массы, поэтому коэффициенты на каждой стороне будут равны
- Не следует закону сохранения массы, что означает, что коэффициенты на каждой стороне не будут равно
- Означает, что коэффициенты являются целыми числами и должны быть дробными.
Правильный ответ: b.Не соблюдается закон сохранения массы, а значит, коэффициенты с каждой стороны не будут равны . Уравнение необходимо сбалансировать, умножив коэффициенты на константу, чтобы получить небольшое целое число.
Растворы
В этом подразделе содержатся вопросы, касающиеся процентных концентраций, молярности, числа Авогадро, распространенных растворов и их свойств, полярных и неполярных растворителей, растворенных веществ, влияния давления и температуры на растворимость, а также других связанных терминов и понятий.Например:
- Гидрофильные молекулы…
- Отталкивают воду и плохо с ней соединяются
- Привлекают воду и легко с ней соединяются
- Неполярны и обычно входят в состав благородных газов
- Гидрофильные молекулы…
правильный ответ: б. Привлекает воду и легко с ней соединяется . Суффикс philic указывает на то, что эти молекулы «похожи» на воду. Противоположное — гидрофобное; фобический указывает на то, что молекулы не притягиваются к воде.
Химические реакции
Вопросы в этом подразделе охватывают скорость и катализаторы химических реакций, а также влияние температуры на скорость реакции, реакции сочетания и разложения, реакции одиночного и двойного замещения, а также ковалентные и ионные связи, среди прочего связанные термины и понятия. Например:
- Распределение Максвелла-Больцмана относится к:
- Реакция объединения двух или более реагентов с образованием единого продукта
- Скорость разложения
- Топливо и окислители, необходимые для процесса горения
- A график или график, показывающий энергию и / или скорость молекул или частиц газа в системе
Правильный ответ на первый вопрос: d.График, показывающий энергию и / или скорость молекул или частиц газа в системе.
Реакции окисления-восстановления
Этот подраздел содержит вопросы, связанные с реакциями метатезиса, восстановителями и окислителями, реакциями одиночного замещения, а также степенью окисления и числом, среди других связанных понятий и терминов. Например:
- Одиночные реакции замещения:
- Реакции окисления / восстановления, в которых электроны передаются от одного химического вещества к другому
- Реакции окисления / восстановления, в которых степень окисления увеличивается за счет потери электронов
- Окисление / восстановление реакции, в которых электроны расщепляются между связями
Правильный ответ: a.Реакции окисления / восстановления, в которых электроны передаются от одного химического вещества к другому.
Кислоты и основания
Этот подраздел содержит вопросы, связанные с сильными и слабыми кислотами и основаниями, суперкислотами, супероснованиями и потенциалом водорода (pH), среди других связанных понятий и терминов. Например:
- Суперкислоты:
- Сильнее водорода по балансу pH
- Сильнее 100% серной кислоты
- Сильнее магической и хлорной кислот
- Сильнее соляной и бромистоводородной кислот
- Суперкислоты:
Правильный ответ: б.Сильнее 100% серной кислоты . Эти кислоты включают хлорную, магическую и фторантимоновую кислоты.
Ядерная химия
Этот подраздел содержит вопросы, связанные с ядерной силой, периодом полураспада радиоактивных веществ, изотопами, радиоактивными изотопами, радиоактивностью и радиоактивным распадом, а также альфа-, бета- и гамма-лучами, среди других связанных понятий и терминов. Например:
- ____ — это процесс, который может вызвать отрыв электрона от атома
- Ионизирующее излучение
- Изотропное излучение
- Бета-лучи
- Гамма-лучи
Правильный ответ: a.Ионизирующее излучение.
Биохимия
Этот подраздел состоит из вопросов, связанных с углеводами, включая гликолиз, движущую силу протонов, путь Эмбдена-Мейерхофа, белки, реакцию конденсации, пептиды, аминокислоты, липиды и нуклеиновые кислоты, среди других связанных понятий и терминов. . Например:
- Аминокислоты включают:
- Глютамин и аспарагин
- Жирные кислоты и фосфолипиды
- Аргинин, лизин и гистидин
- Аминокислоты включают:
Правильный ответ: c.Аргинин, лизин и гистидин.
Подготовка к тесту
Теперь, когда вы лучше понимаете химический тест HESI A2, что будет дальше? Подготовка! Убедитесь, что вы делаете все возможное с HESI A2, используя самые полные материалы для подготовки к тесту на рынке. Компания Mometrix Test Preparation разработала все необходимое: учебное пособие по секретам HESI A2 и практический тест HESI A2, а также систему изучения карточек HESI A2. Учебное пособие по HESI A2 Secrets было написано исследователями стандартизированных тестов Mometrix и включает реальное содержание экзамена в рамках практического теста HESI A2.Мало того, система изучения карточек HESI A2 включает еще больше вопросов практического теста HESI A2. Пройдите HESI A2 с первой попытки, проверив и оценив свои знания и навыки с помощью учебного пособия HESI A2 Secrets, системы изучения карточек HESI A2 и практического теста HESI A2.
Mometrix также предлагает комплексный онлайн-курс HESI A2. Этот курс включает содержание нашего учебного пособия, практических тестов и карточек в удобном для восприятия формате. Вы можете отслеживать свой прогресс, смотреть более 60 обучающих видео, чтобы разбить сложные идеи, и учиться где угодно с помощью наших бесплатных приложений для iOS и Android.Онлайн-курс HESI A2 разработан, чтобы стать вашим универсальным средством для достижения успеха в день тестирования.
HESI A2 Test — Home
Экзамен по химии AP — AP Central
Информация об экзамене 2021
Обновлено 8 апреля. Теперь студенты могут загрузить приложение для цифрового тестирования и пройти цифровую практику, чтобы подготовиться к тестированию. См. Ниже дополнительную информацию о цифровой практике и сдаче цифрового экзамена.
Экзамены по химии AP будут предлагаться в бумажном виде в начале мая и в конце мая, а в виде цифрового экзамена — в начале июня.Как бумажная, так и цифровая версии экзамена AP по химии будут иметь полную длину и измерять диапазон навыков и знаний, указанных в описании курса и экзамена (CED), что даст учащимся возможность претендовать на получение кредита в колледже и размещение.
Бумажные экзамены будут проходить в стандартном формате с множественным выбором и свободным ответом, указанном в CED. Цифровой экзамен займет столько же времени, но будет содержать больше вопросов с несколькими вариантами ответов и меньше вопросов с бесплатными ответами.На цифровом экзамене студенты будут отвечать на вопросы с бесплатными ответами с клавиатуры, а не вручную. Приложение цифрового экзамена будет включать любые символы, которые понадобятся учащимся для ввода ответов. Студентов, сдающих цифровые экзамены, не попросят рисовать или рисовать в качестве части ответа — скорее, эти навыки можно оценить, попросив учащихся дать объяснения по поводу представленных диаграмм или других стимулов. Рукописные или сфотографированные работы не принимаются.
Обратите внимание, что калькуляторы будут разрешены на всех разделах цифрового экзамена в 2021 году.
Существуют различия между бумажной и цифровой версиями некоторых экзаменов AP 2021 года, и эти варианты различаются в зависимости от курса. Приведенная ниже информация относится только к AP Chemistry. Просмотрите сводку всех форматов экзаменов AP 2021.
Узнайте больше о тестировании 2021 года.
AP Daily и AP Classroom
Короткие видеоролики AP Daily с возможностью поиска могут быть назначены вместе с тематическими вопросами, чтобы помочь вам охватить все содержание курса, навыки и модели задач, а также проверить понимание учащимися.Разблокируйте личные проверки успеваемости, чтобы учащиеся могли продемонстрировать свои знания и навыки шаг за шагом, а также использовать панель управления прогрессом для выделения своего прогресса и дополнительных областей для поддержки. По мере приближения экзамена назначьте практические экзамены AP в банке вопросов AP Classroom и предложите студентам воспользоваться преимуществами AP Daily: Live Review с 19 по 29 апреля.
Войти в AP Classroom
Руководство к экзамену AP Chemistry
Знаете ли вы разницу между эндотермическими и экзотермическими процессами? Сможете ли вы сбалансировать окислительно-восстановительную реакцию? Экзамен по химии AP ® проверяет темы и навыки, обсуждаемые в вашем продвинутом курсе химии.Если вы наберете достаточно высокий балл, ваша оценка AP Chemistry может принести вам кредит в колледже!
Ознакомьтесь с нашим Руководством по химии AP, чтобы получить важную информацию, необходимую для экзамена:
Что сдают экзамен по химии?Экзамен AP Chemistry длится 3 часа 15 минут. Экзамен состоит из двух разделов: раздела с несколькими вариантами ответов и раздела с бесплатными ответами.
Сроки | Количество вопросов | % баллов за экзамен | |
Раздел 1 | 90 минут | 60 вопросов с несколькими вариантами ответов * Использование калькулятора запрещено. | 50% |
Раздел 2 | 105 минут | 3 длинных вопроса с бесплатными ответами * Использование калькулятора разрешено. | 50% |
Темы экзамена AP по химии сгруппированы по девяти разделам.
- Раздел 1: Атомная структура и свойства. Темы могут включать: моли и молярную массу, масс-спектроскопию элементов, элементный состав чистых веществ, состав смесей, атомную структуру и электронную конфигурацию, фотоэлектронную спектроскопию, периодические тенденции, валентные электроны и ионные соединения.
- Раздел 2: Структура и свойства молекулярных и ионных соединений. Темы могут включать: типы химических связей, внутримолекулярную силу и потенциальную энергию, структуру ионных твердых тел, структуру металлов и сплавов, диаграммы Льюиса, резонанс и формальный заряд, VSEPR и гибридизацию связей.
- Раздел 3: Межмолекулярные силы и свойства. Темы могут включать: межмолекулярные силы, твердые тела, жидкости и газы, кинетическую молекулярную теорию, растворы и смеси, фотоэлектрический эффект.
- Раздел 4: Химические реакции. Темы могут включать: введение в реакции, чистые ионные уравнения, представления реакций, физические и химические изменения, стехиометрию, типы химических реакций.
- Раздел 5: Кинетика. Темы могут включать: скорость реакции, введение в закон скорости, элементарные реакции, модель столкновений, введение в механизмы реакции, профиль энергии многоступенчатой реакции и катализ.
- Раздел 6: Термодинамика.Темы могут включать: эндотермические и экзотермические процессы, теплопередачу и тепловое равновесие, теплоемкость и калориметрию, энергию фазовых переходов, введение в энтальпию реакции, энтальпию образования, закон Гесса.
- Блок 7: Равновесие. Темы могут включать: введение в равновесие, расчет константы равновесия, расчет равновесных концентраций, введение в принцип Ле Шателье, введение в равновесие растворимости, pH и растворимость, свободную энергию растворения.
- Блок 8: Кислоты и основания. Темы могут включать: введение в кислоты и основания, pH и pOH сильных кислот и оснований, кислотно-основные реакции и буферы, молекулярную структуру кислот и оснований, pH и pK a , свойства буферов.
- Раздел 9: Приложения термодинамики. Темы могут включать: введение в энтропию, свободную энергию Гиббса и термодинамическую благоприятность, термодинамический и кинетический контроль, свободную энергию и равновесие, гальванические (гальванические) и электролитные элементы, электролиз и закон Фарадея.
Разделы с множественным выбором AP Chem содержат отдельные вопросы или наборы вопросов, в которых учащимся предоставляется стимул или набор данных и ряд связанных вопросов. Вам не разрешается использовать калькулятор во время этого раздела экзамена.
Оценка: Этот раздел оценивается компьютером.
Бесплатный ответбесплатных ответов на вопросы AP Chemistry, позволяющие оценить вашу способность:
- Объяснять, анализировать и интерпретировать модели и представления химических свойств или явлений
- Разработка экспериментов и процедур для проверки предсказания или теории
- Представляйте данные и химические явления в виде графиков и диаграмм
- Решать задачи с помощью математических соотношений
- Сделать или оправдать научное утверждение и подкрепить его доказательствами и / или аргументацией
К участию в этом разделе экзамена допускаются четырехфункциональные, научные или графические калькуляторы.
Оценка: Вы получите больше всего очков в этом разделе за то, что показываете процесс, который привел вас к ответу. Оценщики частично доверяют, когда вы показываете им, что знаете, что делаете. Ответы оцениваются комитетом учителей средних школ и колледжей и оцениваются в соответствии со стандартом, установленным в начале оценочного периода главными консультантами факультета.
AP Chem Equation SheetТаблицы, содержащие часто используемые уравнения и константы в химии, предоставляются вместе с экзаменом AP Chemistry и могут использоваться как для вопросов с множественным выбором, так и для вопросов со свободным ответом.Тестируемым также предоставляется периодическая таблица элементов. Ознакомьтесь с курсом AP Chem и описанием экзамена от College Board для получения дополнительной информации.
Как интерпретировать результаты химического анализа AP
Оценки AP указываются от 1 до 5. Колледжи обычно ищут 4 или 5 на экзамене AP Chemistry, но некоторые могут предоставить зачетные 3 балла (ознакомьтесь с нашим обзором того, как заработать зачет AP). Каждый тест имеет изогнутую форму, поэтому баллы меняются от года к году. Вот как студенты сдали экзамен AP Chemistry в мае 2020 года:Оценка | Значение | Процент испытуемых |
5 | Высоко квалифицированный | 10.6% |
4 | Хорошо квалифицированный | 18,6% |
3 | Квалифицированный | 26,9% |
2 | Возможно квалифицированный | 24% |
1 | Нет рекомендаций | 29.9% |
Источник: College Board
. Как подготовиться?классов AP — это здорово, но для многих студентов этого недостаточно! Для тщательного изучения содержания и стратегии AP Chemistry выберите вариант подготовки AP, который лучше всего подходит для ваших целей и стиля обучения.
The Staff of Princeton Review
Более 35 лет учащиеся и семьи доверяют изданию Princeton Review помочь им попасть в школу своей мечты.Мы помогаем учащимся добиться успеха в средней школе и за ее пределами, предоставляя им ресурсы для получения более высоких оценок, более высоких результатов тестов и более сильных заявлений в колледж. Следуйте за нами в Twitter: @ThePrincetonRev.Общий экзамен по химии — Химический факультет
Информация о вступительном испытании
- Все учащиеся без с минимальным баллом 24 по естествознанию или математическим рассуждениям ACT, желающим поступить на CHEM 1402-Общая химия Я должен сначала сдать вступительный тест CHEM 1402 с оценкой 60 или выше.
- Тест состоит из 40 вопросов с несколькими вариантами ответов (20 вопросов по математике и 20 вопросов по химии), которые необходимо выполнить за 40 минут.
- Студенты с соответствующей документацией DRC получат продленное время.
- Вам будет предоставлен научный калькулятор без графического представления для использования в тесте.
- Каждый студент может пройти тест на определение уровня дважды в семестр с перерывом не менее одной недели, чтобы иметь право пройти тест во второй раз в том же семестре.
Тест проводится в Службе тестирования в главном кампусе UA Little Rock. Они расположены в комнате 315 Центра обслуживания студентов. Вы можете зарегистрироваться для прохождения теста онлайн на сайте Службы тестирования здесь.
Тестовые темы
Для того, чтобы учащийся смог сдать тест на определение уровня владения языком, он должен уметь делать следующее:
- 20 основных математических вопросов, которые включают следующие учебные цели:
- Управляйте простыми алгебраическими уравнениями и решайте их, включая порядок операций и способы работы с дробями
- В экспоненциальном представлении
- Используйте логические рассуждения, чтобы вывести ответ
- Расшифровка графиков
- 20 вопросов по общей химии, охватывающих следующие учебные цели:
- Различия между химическими и физическими свойствами и изменениями
- Классифицируйте различные типы веществ
- Вывести свойства элементов на основе их положения в таблице Менделеева
- Определить компоненты атомов и то, как они изменяются, чтобы произвести изотопы и ионы
- Различать разные типы соединений и их свойства
- Преобразование между единицами
- Считать прибор до числа значащих цифр
- Чтение и анализ фазовых диаграмм
Примеры вопросов:
1.(2,80 × 10
-3 ) (1,28 x 10 1 ) / (3,20 x 10 -4 ) = __________ A) 27 x 10 1
B) 0 x 10 2
C) 2 x 10 6
D) 12 x 10 2
2. Решите следующее уравнение относительно x: 4x — b = 2x + c
A) c — b — 6
B) (c + b) / 2
C) (c + b) / 6
D) (c — b) / 2
3. Сколько всего атомов в формуле Al
2 (CO 3 ) 3 ? A) 12
B) 14
C) 9
D) 8
4.Сколько электронов в Br
_ ? A) 4
B) 7
C) 36
D) 34
5. Что из перечисленного является металлоидом?
A) S
B) Ge
C) C
D) Pb
6. У определенного атома заряд -2, а в ядре 16 протонов и 16 нейтронов. Сколько электронов у этого атома?
A) 34
B) 14
C) 32
D) 18
Ответы:
- Д
- B
- B
- С
- B
- D
Стоматологический допуск (DAT)
DAT измеряет…
- Академические способности
- Научное понимание
- Восприятие
DAT — это…
- На английском языке
- Множественный выбор
- На базе компьютера
- Посетите веб-сайт Американской стоматологической ассоциации (ADA) , чтобы узнать о стоимости тестирования.
- Дано наибольшее количество дней в году
- Требуется всеми стоматологическими школами США
- Тест на полдня: более четырех часов
- Снято в указанных испытательных центрах по всей стране
Какие разделы DAT?
- Естественные науки (биология, общая химия, органическая химия)
- Перцепционная способность (решение двух- и трехмерных задач)
- Понимание прочитанного (стоматологические и фундаментальные науки)
- Количественные рассуждения (математические задачи алгебры, численные вычисления, преобразования и т. Д.)
Когда мне следует сдавать тест?
- После того, как вы завершите необходимые знания по биологии, общей химии и органической химии.
- Рекомендуется пройти тест по крайней мере за год до того, как вы захотите пойти в стоматологическую школу. Большинство из тех, кто сдает экзамен DAT, делают это после третьего года обучения в колледже.
- Просмотрите содержание и схему самого экзамена.
- Изучите ключевые принципы биологии и химии, которым вы научились.
- Пройдите практические тесты, чтобы оценить свои способности перед экзаменом, и старайтесь совершенствоваться каждый раз, когда вы его сдаете.
- Ознакомьтесь со всеми Информация DAT на веб-сайте ADA, такая как Руководство для кандидатов DAT и онлайн-руководство.
Какие правила и положения?
- Вы можете проходить тест только раз в 90 дней.
- Вы можете пройти тест только трижды, не более, если у вас нет специального разрешения ADA.
Как записаться на тест?
- Посетите веб-сайт ADA, чтобы подать заявку на сдачу DAT (взимается невозвращаемая комиссия).
- Вам будет предложено создать DENTPIN, ваш личный стоматологический идентификационный номер, прежде чем вы сможете заполнить заявку на регистрацию в DAT.Этот номер будет использоваться в процессе подачи заявления в стоматологическую школу и при любом другом тестировании, проводимом ADA.
- Получить письмо о праве на участие от ADA.
- После того, как вы получите письмо о праве на участие, вы можете назначить встречу для прохождения теста с Прометрическое тестирование. Вы должны запланировать тест за 60-90 дней до того дня, когда вы хотите его пройти.Ознакомьтесь со списком тестовых центров здесь.
- Если вам требуются специальные условия для тестирования, посетите Раздел «Особые помещения» на сайте Prometric.
Прочие важные примечания:
- Если вы планируете поступать в канадскую стоматологическую школу, вам нужно будет пройти Канадский DAT администрируется Канадской стоматологической ассоциацией.
- Большинство канадских стоматологических школ требуют канадского DAT, но некоторые принимают DAT США. Свяжитесь с Программа тестирования стоматологических способностей Канадской стоматологической ассоциации для получения дополнительной информации.
- стоматологические школы США принимают канадский DAT в дополнение к американскому DAT.
- Вам не нужно откладывать подачу заявки на ADEA AADSAS® до тех пор, пока вы не пройдете DAT; однако большинство стоматологических школ не сочтут ваше заявление заполненным до тех пор, пока не получат ваши оценки DAT.
- Обзор требований отдельных школ в отношении DAT можно найти в ADEA.
Официальный справочник стоматологических школ . Отдельные списки школ в этом руководстве также касаются требований относительно времени и баллов на DAT.
10 советов по сдаче экзамена по химии
Сдать экзамен по химии может показаться непростой задачей, но вы справитесь! Вот 10 лучших советов по сдаче экзамена по химии.Примите их близко к сердцу и пройдите это испытание!
Подготовка к экзамену
Изучение. Хорошо выспитесь. Есть завтрак. Если вы пьете напитки с кофеином, сегодня не тот день, чтобы отказываться от этого. Точно так же, если вы никогда не пьете кофеин, сегодня не стоит начинать. Придите к экзамену как можно раньше, чтобы у вас было время собраться и расслабиться.
Запишите то, что вы знаете
Не рискуйте вытащить бланк, столкнувшись с расчетом! Если вы запомнили константы или уравнения, запишите их еще до просмотра теста.
Прочтите инструкцию
Прочтите инструкцию к тесту! Узнайте, будут ли вычитаться баллы за неправильные ответы и нужно ли вам отвечать на все вопросы. Иногда тесты по химии позволяют выбрать, на какие вопросы отвечать. Например, вам может понадобиться проработать всего 5 из 10 задач. Если вы не читаете инструкции к тесту, вы можете выполнить больше работы, чем нужно, и потратить драгоценное время.
Предварительный просмотр теста
Отсканируйте тест, чтобы узнать, какие вопросы приносят наибольшее количество баллов.Расставьте по приоритетам самые важные вопросы, чтобы убедиться, что вы их ответили.
Решите, как использовать свое время
У вас может возникнуть соблазн торопиться, но найдите минутку, чтобы расслабиться, прийти в себя и понять, где вам нужно быть, когда отведенное вам время наполовину истекло. Решите, на какие вопросы вы собираетесь ответить в первую очередь и сколько времени вы дадите себе, чтобы вернуться к своей работе.
Прочитать все вопросы полностью
Вы можете подумать, что знаете, к чему ведет вопрос, но лучше перестраховаться.Кроме того, вопросы по химии часто состоят из нескольких частей. Иногда вы можете получить подсказку о том, как решить проблему, увидев, в чем заключается вопрос. Иногда таким образом можно даже найти ответ на первую часть вопроса.
Ответьте на известные вам вопросы
На это есть две причины. Во-первых, это вселяет уверенность, которая помогает расслабиться и улучшает ваши результаты в оставшейся части теста. Во-вторых, это дает вам несколько быстрых очков, поэтому, если у вас не хватает времени на тест, по крайней мере, вы получили несколько правильных ответов.Может показаться логичным проработать тест от начала до конца. Если вы уверены, что у вас есть время и вы знаете ответы на все вопросы, это хороший способ избежать случайного пропуска вопросов, но большинство студентов добиваются большего успеха, если пропускают более сложные вопросы, а затем возвращаются к ним.
Покажи свою работу
Запишите, что вы знаете, даже если не знаете, как решить проблему. Это может служить наглядным пособием, которое нарушит вашу память, или может принести вам частичную пользу. Если вы в конечном итоге ошибетесь в вопросе или оставите его незавершенным, это поможет вашему преподавателю понять ваш мыслительный процесс, чтобы вы все равно могли усвоить материал.Также не забудьте показать свою работу аккуратно, . Если вы решаете проблему целиком, обведите или подчеркните ответ, чтобы инструктор мог его найти.
Не оставляйте пробелов
Тесты редко наказывают вас за неправильные ответы. Даже если они это сделают, если вы можете исключить хотя бы одну возможность, стоит сделать предположение. Если вас не наказывают за угадывание, то нет причин, по которым или могут ответить на вопрос. Если вы не знаете ответа на вопрос с несколькими вариантами ответов, постарайтесь исключить возможные варианты и сделать предположение.Если это верное предположение, выберите «Б» или «В». Если это проблема, и вы не знаете ответа, запишите все, что вы знаете, и надейтесь на частичную оценку.
Проверьте свою работу
Убедитесь, что вы ответили на все вопросы. Вопросы по химии часто позволяют проверить свои ответы, чтобы убедиться, что они имеют смысл. Если вы не определились с двумя вариантами ответа на вопрос, руководствуйтесь своим первым инстинктом.
.


 Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) СH4 ; 3) СO ; 4) H2O
Два газообразных вещества с ковалентной неполярной связью образовали соединение с ковалентной полярной химической связью. Определите формулу полученного вещества: 1) СO2 ; 2) СH4 ; 3) СO ; 4) H2O Массовая доля фосфора в фосфате магния равна
Массовая доля фосфора в фосфате магния равна И. Менделеева?
И. Менделеева? Элементу, электронная формула атома которого ls22s22p63s23p4 , соответствует высший оксид, формула которого: 1) SО2; 2) SO3; 3) SeO2;
Элементу, электронная формула атома которого ls22s22p63s23p4 , соответствует высший оксид, формула которого: 1) SО2; 2) SO3; 3) SeO2; Установите соответствие между формулой вещества и степенью окисления атома азота в нём.
Установите соответствие между формулой вещества и степенью окисления атома азота в нём. Массовая доля кислорода в сульфате железа (III) равна
Массовая доля кислорода в сульфате железа (III) равна
 Элементу, электронная формула внешнего электронного слоя атома которого …3s23p2, соответствует водородное соединение, формула которого: 1) РН3; 2) СН4; 3) SiH4; 4) HI.
Элементу, электронная формула внешнего электронного слоя атома которого …3s23p2, соответствует водородное соединение, формула которого: 1) РН3; 2) СН4; 3) SiH4; 4) HI.

 Заряд ядра + 16 имеют атомы химического элемента:
Заряд ядра + 16 имеют атомы химического элемента: Вещества молекулярного строения характеризуются:
Вещества молекулярного строения характеризуются: Установите соответствие между уравнениями реакций и изменением степени окисления азота.
Установите соответствие между уравнениями реакций и изменением степени окисления азота.