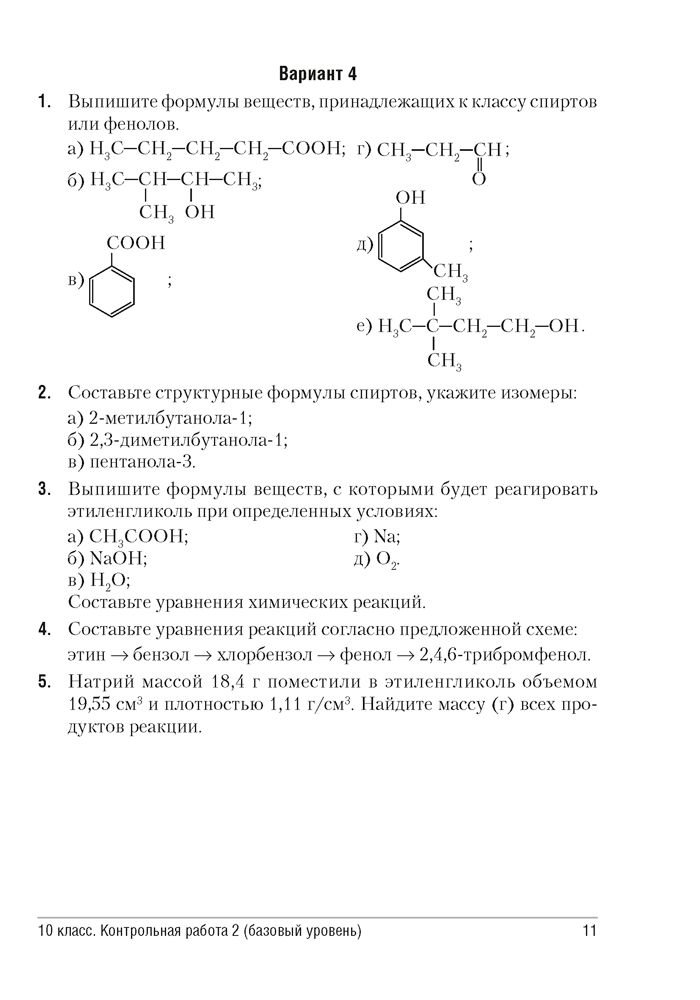
Контрольная работа по химии (11 класс)
Контрольная работа по химии 11 класс к учебнику Габриелян О.С.
Контрольная работа № 1 по теме «Строение атома»
I вариант
Зная формулу внешнего энергетического уровня атома химического элемента – 4s24p3, определите: а) название элемента и заряд ядра его атома; б) положение элемента в периодической системе; в) к каким элементам (s-,p-,d-, f-) он принадлежит; г) его степень окисления в высшем оксиде и характер свойств этого оксида.
Напишите электронную формулу, отражающую порядок распределения электронов по орбиталям в атоме этого элемента.
Напишите формулы соединений с водородом следующих химических элементов: C, N, S, CL, Ca, I. Выберите формулы соединений, обладающих кислотными свойствами, и расположите их в ряд в порядке убывания кислотных свойств.

Охарактеризуйте ковалентную полярную химическую связь на примере HI, поясните механизм ее образования.
Охарактеризуйте валентные возможности атома фосфора.
Выведите формулу газообразного соединения, массовая доля азота в котором 30,43%, а кислорода – 69,57%. Относительная плотность его по кислороду 1,44.
Составить и назвать изомеры для пентена-1.
II вариант
Составьте электронные формулы и графические схемы, отражающие порядок распределения электронов по орбиталям в атомах кремния и никеля. Определите: а) к каким элементам (s-, p-, d-, f-) они принадлежат; б) какие подуровни занимают валентные электроны этих атомов.
Напишите формула водородных соединений химических элементов 2-го периода.
 Выберите из них: а) наиболее типичный гидрид металла; б) формулу соединения, проявляющего кислотные свойства.
Выберите из них: а) наиболее типичный гидрид металла; б) формулу соединения, проявляющего кислотные свойства.
Найдите в периодической системе химических элементов Д.И. Менделеева такие химические элементы, водородные соединения которых будут обладать более выраженными свойствами гидрида металла и кислоты, чем те, которые вы выбрали. Напишите формулы этих водородных соединений.
Охарактеризуйте ковалентную неполярную химическую связь на примере N2, поясните механизм ее образования.
Охарактеризуйте валентные возможности атома кислорода.
Выведите формулу газообразного соединения, массовая доля вольфрама в котором 61,745%, а фтора – 38,255%. Относительная плотность его по водороду 149.
Составить и назвать изомеры для гексина-1.
«Итоговая контрольная работа по химии 11 класс (углубленный уровень)» | Учебно-методический материал по химии (11 класс):
ПУ Итоговая контрольная работа
Вариант 2
Часть 1
- (1 балл) Определите, атомы каких из указанных в ряду элементов валентные электроны находятся как на s-, так и на d-подуровнях.

Запишите в поле ответа номера выбранных элементов.
Ответ:
- (1 балл) Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите эти элементы в порядке усиления основных свойств образуемых ими оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности
Ответ:
- (1 балл) Из числа указанных в ряду химических элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6.
Запишите в поле ответа номера выбранных элементов
Ответ:
4. (1 балл) Из предложенного перечня веществ выберите два соединения, в
молекулах которых присутствует ионная связь.
1) хлороводород 4) аммиак
2) хлорид натрия 5)оксид натрия
3) оксид серы(IV)
Запишите в поле ответа номера выбранных заданий.
Ответ :
- (1 балл) Установите соответствие между формулой вещества и классом/группой в которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА | КЛАСС /ГРУППА |
А) HClO3 | 1) основание |
Б) NaHCO3 | 2) кислота |
B) Cu(OH)2 | 3) соль кислая |
4) соль средняя |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ :
- (1 балл) Из предложенного перечня веществ выберите два вещества, которые взаимодействуют с раствором гидроксида калия.

1) железо 4) цинк
2) фосфор 5) медь
3) магний
Запишите в поле ответа номера выбранных заданий.
Ответ :
- (2 балла) Нитрат алюминия прокалили. Полученный твёрдый остаток Х обработали раствором гидроксида калия, при этом образовалось вещество Y. Из предложенного перечня выберите вещества X и Y, которые соответствуют приведенному описанию.
1) K[Al(OH)4] 2) KAlO2 3) K3AlO3 4) Al 5) Al2O3
Запишите в таблицу выбранные цифры под соответствующими буквами
Ответ:
- (2 балла) Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
9. (2 балла) Задана следующая схема превращений веществ:
(2 балла) Задана следующая схема превращений веществ:
X Y
ZnO→ ZnCl2 → Zn(NO3)2
Определите, какие из указанных веществ являются веществами Х и Y.
- KNO3 2) Cl2 3) KCl 4) HCl 5) AgNO3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
10 (1 балл)
11(2 балла)
Запишите в таблицу выбранные цифры под соответствующими буквами.
12(2 балла) .
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
13 (2 балла).
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
14(2 балла) . Установите соответствие между фактором, действующим на равновесную систему: 2NO(г) + Cl2(г) ↔ 2NOCl2(Г)
и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
Ответом к заданиям 15–16 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин писать не нужно.
15 (1 балл). Вычислите массовую долю ацетата натрия (в процентах) в растворе, полученном при добавлении 120 г воды к 200 г раствора с массовой долей соли 8%.
Ответ:_____________________ % (Запишите число с точностью до целых.)
16(1 балл) При сливании раствора хлорида бария и избытка раствора сульфата натрия образовался осадок массой 58,25 г. Вычислите массу хлорида бария (в граммах) в исходном растворе.
Ответ:___________________ г (Запишите число с точностью до целых.)
Часть 2. Задание со свободным ответом
17(4 балла). К раствору, полученному при добавлении 4 г гидрида калия к 100 мл воды, прилили 100 мл 39%-ного раствора азотной кислоты (ρ = 1,24 г/мл). Определите массовые доли всех веществ (включая и воду) в конечном растворе.
Определите массовые доли всех веществ (включая и воду) в конечном растворе.
СТЕПЕНЬ ОКИСЛЕНИЯ | ||
А) Б) В) Г) | 1) -4 2) -2 3) 0 4) +2 5) +4 |
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА |
А) Б) В) Г) |
| 1) от –3 до +2 2) от –3 до 0 3) от 0 до –3 4) от +5 до +2 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА |
A) Б) B) Г) | 1) -3 2) -2 3) +2 4) +3 5) +4 6) +5 |
Входная контрольная работа по химии. 11 класс.
Просмотр содержимого документа
«Входная контрольная работа по химии. 11 класс.»
Стартовая контрольная работа по химии – 11 класс.
I вариант.
Задание 1. Дайте полную характеристику элементу с порядковым номером 15.
Задание 2. Уравняйте реакцию методом электронного баланса:
HNO3 + H2S = H2SO4 + NO + H2O
Задание 3. Допишите реакцию и напишите её в ионной форме:
BaCI2 + H3PO4
Задание 4. Определите молекулярную формулу органического вещества, если массовая доля углерода в нем 72%, водорода – 12%, кислорода – 16%. Относительная плотность этого вещества по кислороду равна 3,125.
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей с серной кислотой.
II вариант.
Задание 1. Дайте полную характеристику элементу с порядковым номером 16.
Задание 2. Уравняйте реакцию методом электронного баланса:
HNO2 + Cl2 + H2O → HNO3 + HCl
Задание 3. Допишите реакцию и напишите её в ионной форме:
AICI3 + AgNO3
Задание 4. Определите молекулярную формулу органического вещества, если массовая доля углерода в нем 40%, водорода – 6,67%, кислорода – 53,33%. Относительная плотность этого вещества по водороду равна 30.
Задание 5. Рассчитайте объём водорода (при н.у.), если он выделился при взаимодействии 240 г магния, содержащего 12 % примесей с соляной кислотой.
Контрольная работа по химии за курс 11 класса
Просмотр содержимого документа
«Контрольная работа по химии за курс 11 класса»
Итоговая контрольная работа по химии 11 класс
Выберите один правильный ответ
Степень окисления азота в карбонате аммония равна
А) -3 | В) +1 |
Б) -1 | Г) +3 |
Вещества с металлической кристаллической решеткой
А) летучие | В) проводят ток |
Б) растворимы в воде | Г) обладают низкой электропроводностью |
Только окислительные свойства проявляет
А) сульфид натрия | В) серная кислота |
Б) сера | Г) сульфит калия |
Какому типу реакции соответствует уравнение Zn + H2SO4 → ZnSO4 + H2
А) обмена | В) разложения |
Б) соединения | Г) замещения |
В схеме превращений ZnO X Y ZnO веществами X и Y могут быть
А) Zn(OH)2 и Zn | В) Zn(OH)2 и ZnCl2 |
Б) ZnCl2 и ZnF2 | Г) Zn(NO3)2 и Zn(OH)2 |
Верны ли следующие суждения о меди и ее соединениях?
а. Медь – элемент I A группы
Медь – элемент I A группы
б. Медь не взаимодействует с кислотами
А) верно только а | В) оба суждения верны |
Б) верно только б | Г) оба суждения не верны |
К экзотермическим реакциям не относится взаимодействие
А) оксида натрия с водой | В) оксида фосфора с водой |
Б) фосфора с кислородом | Г) азота с кислородом |
Установите соответствия
Установите соответствия между химическим элементом и электронной конфигурацией его атомов
Элемент | Электронная формула | ||||||||
1. 2. Ar 3. Na 4. Cl 5. Mg | А) 1s22s22p63s1 Б) 1s22s22p63s23p5 В) 1s22s22p3 Г) 1s22s22p63s23p6 Д) 1s22s22p63s2 | ||||||||
1 | 2 | 3 | 4 | 5 | |||||
Установите последовательность
Установите соответствия между формулой вещества и степенью окисления углерода в ней
Вещество | Степень окисления | |||||||
1. 2. Ch4OH 3. HCOH 4. HCOOH | А) -4 Б) -2 В) 0 Г) +2 Д) +4 | |||||||
1 | 2 | 3 | 4 | |||||
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции
Реагирующие вещества | Признаки | ||||||||||||||
1. CuSO4 и KOH 2. CuSO4 и Na2S 3. Cu(OH)2 и H2SO4 4. Cu(OH)2 и HNO3 5. 6. CaCl2 + Na2CO3 7. Ca(HCO3)2 + Ca(OH)2 8. Ca(HCO3)2 + NaOH | А) Растворение осадка Б) Выделение бесцветного газа В) Образование синего осадка Г) Образование белого осадка Д) Образование черного осадка Е) Изменение окраски раствора | ||||||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||||||||
Дайте развернутый ответ
12 г соли растворили в 100 г воды. Чему равна массовая доля соли в полученном растворе?
Атом элемента имеет на 1 электрон меньше, чем ион алюминия. Назовите этот элемент и составьте электронную формулу его атома.
Назовите этот элемент и составьте электронную формулу его атома.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения Al2S2 ←Al →AlCl3 → Al(OH)3 →Al2O3. В реакции 2 укажите окислитель и восстановитель, охарактеризуйте реакцию 4
Рассчитать массу фосфорной кислоты, которую можно получить из 80 г фосфата кальция при его взаимодействии с концентрированной серной кислотой. Массовая доля выхода кислоты 96%.
К раствору, содержащему 16 г сульфата меди(II), прибавили 12 г железных стружек. Рассчитайте массу меди, выделившейся при этом.
Ответы
А
В
В
Г
Г
Г
Г
1В;2Г;3А;4Б;Д
1А;2Б;В;4Г
1В;2Д;3А;4А;5Б;6Г;7Г;8Г
w(раств. в-ва) = m(раств. в-ва) / m(р-ра) * 100% =12/112 * 100% =10,71%
в-ва) = m(раств. в-ва) / m(р-ра) * 100% =12/112 * 100% =10,71%
ответ: 10,71%
Этот элемент фтор (F) 1s22s22p5
1) 2Al+3S→Al2S3
2) 2Al +3Cl →2AlCl3
Al0 -3e → Al+3 восстановитель
Cl02 +2e → 2Cl— окислитель
3) AlCl3+3NaOH→Al(OH)3↓+3NaCl
4) 2Al(OH)3→Al2O3+3H2O
Реакция разложения, не окислительно-восстановительная, необратимая, не каталитическая, эндотермическая.
.
.
Химия 11 класс Контрольная работа за первое полугодие.
Банк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
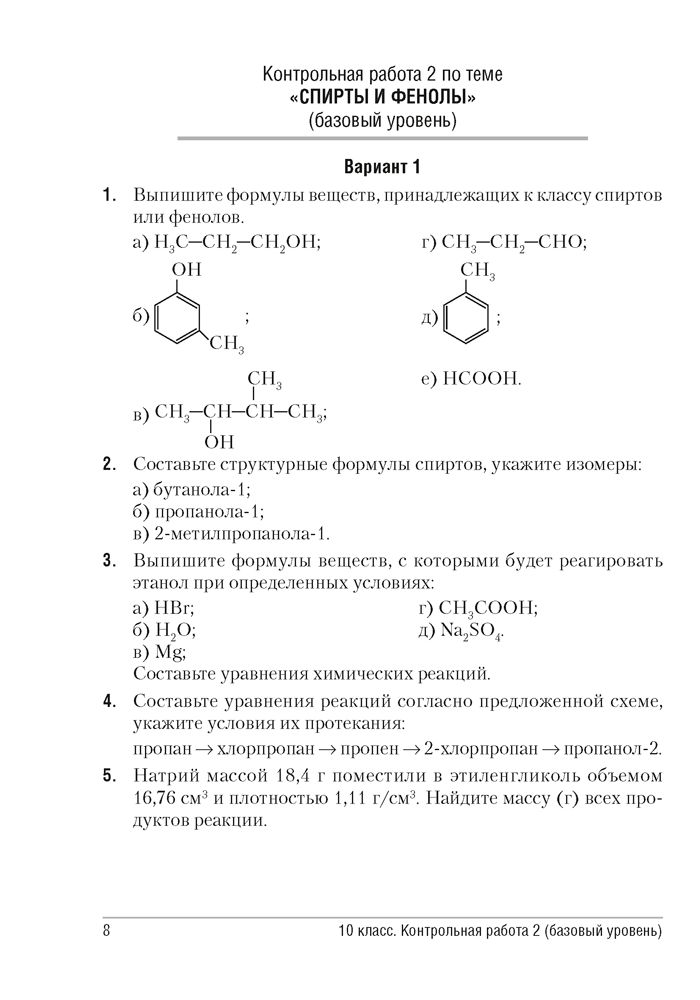
Варианты контрольных работ по «Химии»
Варианты контрольных работ по «Химии» Задание к контрольной работе составлено в 4 вариантах. Студент должен выполнить работу по варианту, номер которого соответствует начальной букве фамилии. Вариант 1
ПодробнееПояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
Подробнее5. В соединениях Nh4, N2O3 и HNO3 азот имеет степени окисления, соответственно равные а) +3, +3, +5 ; б) 3, 3, +5; в) 3, +3, +5; г) 3, +3, 5.

Вариант 1 Выберите правильный вариант ответа. Возможен только один вариант правильного ответа. 1. Чем определяется место химического элемента в периодической системе? а) количеством электронов на внешнем
ПодробнееДемонстрационный вариант
Демонстрационный вариант Ссылка на вариант: https://bingoschool.ru/ege/chemistry/variants/demo/ Часть 1 1. 1) Na 2) K 3) Si 4) Mg 5) C Определите, атомы каких из указанных в ряду элементов в основном состоянии
ПодробнееДиагностическая работа 1 по ХИМИИ
Район Город (населенный пункт) Школа Класс Фамилия Имя Отчество Диагностическая работа 1 по ХИМИИ 21 ноября 2011 года 9 класс Вариант 1 Химия. 9 класс. Вариант 1 2 Инструкция по выполнению работы На выполнение
ПодробнееЧасть 3 С3. Часть 3 С4
ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
При правильном ответе
с. Веселая Лопань, 2015 год
Муниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
ПодробнееБилеты по химии 6 класс
Билеты по химии 6 класс Билет 1 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости
Подробнее1) 2,24 л 2) 6,72 л 3) 8,96 л 4) 11,2 л. 1) F- 2) Ca2+ 3) P+5 4) Br- 1) Sr, Ca, Mg 2) Mg, Al, Si 3) Mg, Al, Ca 4) F, Cl, Br
Вариант демо14 стр. 1 из 9 Тест по химии Демонстрационный вариант 2014 г. ИНСТРУКЦИЯ Тест состоит из частей А и В. На его выполнение отводится 120 минут. Задания рекомендуем выполнять по порядку. Если
На его выполнение отводится 120 минут. Задания рекомендуем выполнять по порядку. Если
ID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
Подробнее1) 2 2) 0 3) +4 4) +6
Химия Демонстрационный вариант 2015 г. (стр. 1 из 5) Тест по химии 6 Демонстрационный вариант 2015 г. ИНСТРУКЦИЯ Тест состоит из 30 заданий. На его выполнение отводится 120 минут. Задания рекомендуем выполнять
ПодробнееДемоверсия по химии 10 класс Вариант 1
Демоверсия по химии 10 класс Вариант 1 Для выполнения заданий 1 3 используйте следующий ряд химических элементов. Ответом в заданиях 1 3 является последовательность цифр, под которыми указаны химические
Ответом в заданиях 1 3 является последовательность цифр, под которыми указаны химические
ЗАДАНИЕ 3. Примеры решения задач
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
ПодробнееБанк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
ПодробнееКонтрольная работа по химии (11 класс) строение вещества
Контрольная работа по химии (11 класс)
СТРОЕНИЕ ВЕЩЕСТВА
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором
ответа
Тестовые задания с выбором
ответа
(2 балла). Формула вещества с ковалентной полярной связью: А.Cl2. Б. KCl. В. NH3 Г. O2.
(2 балла). Вещество, между молекулами которого существует водородная связь: А. Этанол. Б. Метан. В.Водород. Г. Бензол.
(2 балла). Число общих электронных пар в молекуле водорода: А. Одна. Б. Две. В. Три. Г. Четыре.
(2 балла). Полярность химической связи увеличивается в ряду соединений, формулы которых: А. NH3, HI, O2 Б. CH4, H2O, HF. В. PH3, H2S, H2 Г. HCl, CH4, Cl2.

(2 балла). Вид гибридизации электронных орбиталей атома фосфора в молекуле соединения, формула которого РН3: А. sp2. Б. sp3. В. sp. Г. Не гибридизированы.
(2 балла). Кристаллическая решётка хлорида магния:
А. Атомная. Б. Ионная. В. Металлическая. Г. Молекулярная.
(2 балла). Число σ — и π – связей в молекуле этина: А. 5σ и π — нет. Б. 2σ и 3 π . В. 3σ и 2 π. Г. 4σ и 1π .
(2 балла). Вещества, формулы которых СН3 – СН2 – ОН и СН3 – О – СН3, — это: А. Гомологи. Б. Изомеры. В. Одно и то же вещество.
(2 балла).
 Гомологом вещества, формула
которого СН2 = СН – СН3,
является:
Гомологом вещества, формула
которого СН2 = СН – СН3,
является:
А. Бутан. Б.Бутен-1. В. Бутен-2. Г. Бутин-1.
(2 балла). Вещество, формула которого СН3 – СН – СН – СН3 , называют:
СН3 ОН
А. 2-Метилбутанол-3. Б. 1,3-Диметилпропанол-1. В. 3-Метилбутанол-2. Г. Пентанол-2.
ЧАСТЬ Б. Задания со свободным ответом
(8 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Магния и фтора. Б. Селена и водорода. Укажите тип химической связи в каждом соединении.
(4 балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
(8 баллов).
 Расположите соединения, формулы
которых CH2ClCOOH,
C6H5OH,
CH3COOH,
C2H5OH,
в порядке возрастания кислотных свойств.
Объясните ответ.
Расположите соединения, формулы
которых CH2ClCOOH,
C6H5OH,
CH3COOH,
C2H5OH,
в порядке возрастания кислотных свойств.
Объясните ответ.(6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава С4Н6 . Назовите эти вещества.
(4 балла). Какой объём кислорода потребуется для полного сгорания 1 кг этилена (этена) ?
Контрольная работа по химии (11 класс)
СТРОЕНИЕ ВЕЩЕСТВА
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Формула вещества с ионной связью: АНCl. Б. KBr. В. P4 Г. CH3 OH.
(2 балла). Вещество c металлической связью: А. Оксид калия. Б. Медь.
 В.Кремний. Г.
Гидроксид магния.
В.Кремний. Г.
Гидроксид магния.(2 балла). Число общих электронных пар в молекуле азота: А. Одна. Б. Две. В. Три. Г. Четыре.
(2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых: А. Cl2, H2S, CO2 Б. HCl, HBr, HI. В. NH3, PH3, SO2 Г. BHCl3, NH3, HF.
(2 балла). Вид гибридизации электронных орбиталей атома серы в молекуле соединения, формула которого Н2S: А. sp3. Б. sp2. В. sp. Г. Не гибридизированы.
(2 балла). Кристаллическая решётка оксида кремния (IV):
А. Атомная. Б. Ионная. В. Металлическая.
Г. Молекулярная.
Б. Ионная. В. Металлическая.
Г. Молекулярная.
(2 балла). Число σ — и π – связей в молекуле этена: А. 6σ и π — нет. Б. 3σ и 3 π . В. 4σ и 2 π. Г. 5σ и 1π .
(2 балла). Вещества, формулы которых СН2 = СН — СН2 – СН3 и СН2 – С – СН3, — это:
А. Гомологи. Б. Изомеры. В. Одно и то же вещество. СН3
(2 балла). Гомологом вещества, формула которого СН3 — СН2 – СН2 – ОН, является: А.Бутаналь. Б.Бутанол -2. В. Этаналь. Г. Этанол.
(2 балла). Вещество, формула которого СН3 – С – СН2 , называют:
СН3 СН2
А. 2-Метилбутен — 1. Б. 2 – Этилпропен
-1. В. 2 – Этилпропен -2. Г. 2-Метилбутен
— 2 .
2-Метилбутен — 1. Б. 2 – Этилпропен
-1. В. 2 – Этилпропен -2. Г. 2-Метилбутен
— 2 .
ЧАСТЬ Б. Задания со свободным ответом
(8 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Кальция и фтора. Б. Мышьяка и водорода. Укажите тип химической связи в каждом соединении.
(4 балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
(8 баллов). Расположите соединения, формулы которых CH3NH2, NH3, C6H5NH2, C2H6NH2, в порядке возрастания кислотных свойств. Объясните ответ.
(6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава С4Н8O2 . Назовите эти вещества.
(4 балла). Какой объём кислорода потребуется для полного сгорания 1 м3 пропана ?
Контрольная работа по химии (11 класс)
СТРОЕНИЕ ВЕЩЕСТВА
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором
ответа
Тестовые задания с выбором
ответа
1. (2 балла). Формула вещества с ковалентной неполярной связью: А MgCl2. Б. HF. В. N2 Г. Al.
(2 балла). Вещество c ионной связью: А. Кислород. Б. Метан. В.Фторид натрия. Г. Этаналь.
(2 балла). Число общих электронных пар в молекуле фтора: А. Одна. Б. Две. В. Три. Г. Четыре.
(2 балла). Полярность химической связи увеличивается в ряду соединений, формулы которых: А. HI, HCl, HF Б. H2S, NH3, CH4. В. HBr, O2, H2S. Г. H2O, PH3, HI.
(2 балла). Вид гибридизации электронных орбиталей атома углерода в молекуле соединения, формула которого С2 Н2 .
 А. sp3.
Б. sp2.
В. sp. Г. Не
гибридизированы.
А. sp3.
Б. sp2.
В. sp. Г. Не
гибридизированы.(2 балла). Кристаллическая решётка сахарозы:
А. Атомная. Б. Ионная. В. Металлическая. Г. Молекулярная.
(2 балла). Число σ — и π – связей в молекуле метаналя: А. 2σ и 2π . Б. 4σ и π- нет . В. 3σ и 1 π. Г. 4σ и 1π .
(2 балла). Вещества, формулы которых СН3 СН3 СН3
С ≡ С – СН2 и СН3 – С ≡ С – СН2, это:
А. Гомологи. Б. Изомеры. В. Одно
и то же вещество.
Б. Изомеры. В. Одно
и то же вещество.
(2 балла). Гомологом вещества, формула которого СН3 — СН = СН – СН3, является:
А.Бутан. Б. Бутин -2. В. Метилциклопропан. Г. Бутадиен – 1,3.
(2 балла). Вещество, формула которого NaH2PO4, называют:
А. Гидрофосфат натрия. Б. Фосфат натрия. В. Дигидрофосфат натрия. Г. Фосфид натрия.
ЧАСТЬ Б. Задания со свободным ответом
(8 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Бора и фтора. Б. Калия и серы. Укажите тип химической связи в каждом соединении.
(4 балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
(8 баллов).
 Расположите соединения, формулы
которых Н – СО — ОН, СН3 – ОН,
С6Н5 – ОН, Н — ОН, в порядке
увеличения подвижности атома водорода
в гидроксогруппе. Обоснуйте ответ.
Расположите соединения, формулы
которых Н – СО — ОН, СН3 – ОН,
С6Н5 – ОН, Н — ОН, в порядке
увеличения подвижности атома водорода
в гидроксогруппе. Обоснуйте ответ.(6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава С5Н12O2 . Назовите эти вещества.
(4 балла). Какой объём водорода потребуется для получения 1 т аммиака ?
Контрольная работа по химии (11 класс)
СТРОЕНИЕ ВЕЩЕСТВА
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа
1. (2 балла). Формула вещества с металлической связью: А О2. Б. H2О. В. Ca Г. NH3.
(2 балла). Вещество c ковалентной полярной связью: А. Фтороводород.
 Б. Хлор. В.
Пероксид натрия. Г. Фторид натрия.
Б. Хлор. В.
Пероксид натрия. Г. Фторид натрия.(2 балла). Число общих электронных пар в молекуле бромоводорода: А. Одна. Б. Две. В. Три. Г. Четыре.
(2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых: А. PH3, HCl, HF. Б. HF, H2O, NH3. В. CH4, PH3, H2O. Г. H2O, PI, NH3.
(2 балла). Вид гибридизации электронных орбиталей атома углерода в молекуле соединения, формула которого С6 Н6 . А. sp3. Б. sp2. В. sp. Г. Не гибридизированы.
(2 балла). Кристаллическая решётка белого фосфора:
А. Атомная. Б. Ионная. В. Металлическая.
Г. Молекулярная.
Атомная. Б. Ионная. В. Металлическая.
Г. Молекулярная.
(2 балла). Число σ — и π – связей в молекуле уксусной кислоты: А. 7σ и 1π . Б. 6σ и 2 π. В. 8σ и π- нет. Г. 5σ и 3π .
8. (2 балла). Вещества, формулы которых : С2Н5СООН и СН3СООН, — это
А. Гомологи. Б. Изомеры. В. Одно и то же вещество.
(2 балла). Изомером вещества, формула которого СН3 — СН2 — СН2 – ОН, является:
А.Метиловый эфир. Б. Бутанол -1. В. Диметиловый эфир Г. Бутанол – 2.
(2 балла). Вещество, формула которого Na2S, называют:
А. Гидрофосфат натрия. Б. Сульфит
натрия. В. Сульфат натрия. Г. Сульфид
натрия.
Гидрофосфат натрия. Б. Сульфит
натрия. В. Сульфат натрия. Г. Сульфид
натрия.
ЧАСТЬ Б. Задания со свободным ответом
(8 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Кремния и водорода. Б. Натрия и кислорода. Укажите тип химической связи в каждом соединении.
(4 балла). Какую геометрическую форму имеет молекула соединения с ковалентной связью из задания 11?
(8 баллов). Расположите соединения, формулы которых С2Н5ОН, НСООН, ClCH2 — COOH, C6H5OH, в порядке возрастания кислотных свойств. Объясните ответ.
(6 баллов). Составьте структурные формулы не менее трёх возможных изомеров веществ состава С4Н8 . Назовите эти вещества.
(4 балла). Какой объём ацетилена можно получить из 1 кг карбида кальция ?
Химия 11
Преподаватель (и)
Клинт Сарри и Анна Кратофил
Необходимое условие
Science 10 и Foundations and Precalculus Math 10 или разрешение от преподавателя курса.
Описание
Этот недавно разработанный курс Chemistry 11 полностью соответствует результатам обучения по новой учебной программе Британской Колумбии. Это предварительное условие для химии 12 и рекомендуется для биологии 12.
Этот курс был разработан, чтобы быть увлекательным, простым в навигации и помочь учащимся прийти к концептуальному и математическому пониманию стехиометрии, мола, химии растворов, атомов и органической химии на уровне 11 класса.Каждый урок содержит тщательно отобранные практические задачи и дополнительные ресурсы.
Онлайн-уроки основаны на видео, и учащиеся могут полностью контролировать темп своего обучения — уроки можно приостанавливать, возобновлять и повторять с помощью простых кнопок навигации. Примеры интерактивны с анимированными пошаговыми флеш- и видео-досками. Дополнительные ресурсы, включая альтернативные уроки и примеры, были тщательно отобраны, чтобы помочь учащимся, нуждающимся в дополнительных инструкциях.
Химия 11 состоит из следующих разделов: * Блок 1: Безопасность и измерения * Блок 2: Суть и наименование * Блок 3: Крот * Блок 4: Стехиометрия * Блок 5: Атомы, Периодическая таблица и решения * Раздел 6: Органическая химия
Студенты будут оценены с помощью присланных заданий, которые можно будет отправить онлайн, модульных тестов, лабораторных отчетов, исследовательских проектов и заключительного экзамена.
Каждый модульный тест и заключительный экзамен включают практический тест, идентичный по длине и стилю настоящему тесту, чтобы помочь студентам подготовиться и учиться.
Тип
онлайн
Кредит
4
Срок обучения
Студенческий темп — студентов просят составить расписание для себя, используя встроенный планировщик в качестве одного из первых занятий в курсе. Это даст учащимся полную картину их приверженности и прогресса к завершению.
Резюме
В конце большинства разделов есть задание, которое учитель будет использовать, чтобы оценить понимание учащимся и дать учащимся конкретные отзывы об их сильных сторонах и способах совершенствования в курсе.
Существует 5 контролируемых модульных тестов и заключительный экзамен по химии 11. Каждый модульный тест рассчитан примерно на 1,5 часа. Студенты должны запланировать до 3 часов для написания финала.
Студенты из района Greater Victoria напишут свои тесты в кампусе SIDES Royal Oak, расположенном по адресу 4575 Wilkinson Road.
Студенты-заочники несут ответственность за привлечение куратора тестирования в школе или академическом учреждении (например, колледж, университет или библиотека).Руководители тестирования должны быть одобрены администрацией SIDES. Студенты должны активно привлекать к себе руководителя тестирования при завершении первого раздела курса. Студенты должны будут планировать тесты на время, удобное для руководителя тестирования.
Оценка
Задание для отправки блока 1 5%
Лабораторный отчет блока 1 5%
Лабораторный отчет блока 2 2,5%
Тестирование блоков 1 и 2 (под наблюдением) 12%
Тестирование блока 3 (под наблюдением) 12%
Блок 4 Лабораторный отчет 2.5%
Тестирование модуля 4 (под наблюдением) 12%
Тестирование модуля 5 (под наблюдением) 12%
Тестирование модуля 6 (под наблюдением) 12%
Заключительный экзамен (под руководством) 20%
Стандарты деятельности BC
Поддержка
Местные студенты имеют доступ к Центру обучения студентов SIDES, где студенты могут получить личную поддержку от учителя математики и естественных наук SIDES. Учитель также может помочь студентам, обучающимся на дальних дистанциях, по телефону, электронной почте или в виртуальных онлайн-классах.
Учитель также может помочь студентам, обучающимся на дальних дистанциях, по телефону, электронной почте или в виртуальных онлайн-классах.
Материалы
Учащимся необходим доступ к компьютеру и принтеру для доступа к урокам и заданиям, сканеру для сканирования работ учащихся, которые будут отправлены онлайн, научному калькулятору и линейке. Все задания необходимо подавать в электронном виде. Бумажные копии не принимаются, но в кампусе Royal Oak SIDES есть сканер для студентов.
University of Waterloo’s Chem 13 News Exam и Avogadro Exam | Химия
Ученики и учителя средней школы химии , это возможность проверить свои навыки и знания в области химии с другими учениками и старшими школами Канады и всего мира.
Chem 13 News и Avogadro Exams — это сложные онлайн-экзамены, которые сдают более 6000 учеников средней школы химии 11 и 12 классов каждый май, и состоят из 40 вопросов с несколькими вариантами ответов, написанных за 75 минут экзаменационного периода.
Все участники имеют право на получение сертификата Университета Ватерлоо. Лучшие ученики из Северной Америки и их школы получат табличку ограниченного выпуска с изображением элемента из нашего плаката «Хронология элементов».
Новостной экзамен по химии 13 предназначен для учащихся-химиков 12-го класса и учащихся средней школы, изучающих второй курс химии.Темы включают: органическую химию, равновесие, кинетику, окисление-восстановление, связывание, структуру, реакции, растворы и газы.
Экзамен Avogadro предназначен для учеников 11 классов и старшеклассников, изучающих первый курс химии в старшей школе. Темы включают: структуру вещества, связи, реакции, растворы и газы. Тест включает несколько сложных вопросов по основным темам школьной химии.
Результаты экзаменов
Chem 13 News и результаты экзамена Avogadro доступны учителям в Интернете.Учителя могут видеть, как их собственные ученики сдали экзамен в целом, а также по каждому вопросу относительно всех учеников, которые сдали экзамен. Мы также публикуем сводку результатов наших последних экзаменов, а также информацию о наградах за экзамены для самых успешных студентов.
Мы также публикуем сводку результатов наших последних экзаменов, а также информацию о наградах за экзамены для самых успешных студентов.
Обратите внимание: : результаты экзаменов не используются в качестве критерия для приема в университет. Мы не показываем и не передаем результаты приемной комиссии.
Вопросы
Если у вас возникнут вопросы, дайте нам знать.Напишите Кэти Джексон по адресу [email protected].
Химия 11 — Веб-сайт миссис Джадж
Повестка дня:
Пт 6 дек
1) Чтение о том, как произвести формальный заряд (требуется только для многоатомных ионов)
2) Практика
Четверг 5 декабря
1) Резонансные структуры
2) Практические листы
Среда 4 декабря
1) Примечания к структуре Льюиса
2) Практические рабочие листы
Вт 3 декабря
1) Сегодня мы закончили тенденции Продолжение примечания pkg
2) Сделайте рабочий лист электроотрицательности
3) Завершите все предыдущие измерения и назначьте Q во всех примечаниях pkgs
Понедельник, декабрь 2
1) Сегодня мы продолжили с заметками о тенденциях PT в классе
2) Пожалуйста, сделайте все Чтения и Hebden Q, указанные в примечаниях, рассмотренных до сих пор. Остановились на Trends Cont’d pkg, слайд на Electronegativity.
Остановились на Trends Cont’d pkg, слайд на Electronegativity.
Пт, 29 ноября
1) Сегодня мы начали периодические заметки о тенденциях
2) Мы построили график Атомный номер против Атомного радиуса
3) Мы продолжим с ПОЧЕМУ в понедельник
4) Закончим весь Хебден показания и Q, присвоенные в примечаниях на данный момент
Чт 28 ноября
1) Сегодня мы сделали два набора примечаний. Один на периодической таблице и ученых, а другой на регионах периодической таблицы
2) Завершите все чтения и вопросы, указанные в этих двух записках pkgs
Среда 27 ноября
1) Сегодня был блок атомной теории test
2) Ежедневно просматривайте предыдущий материал
Вт 26 ноября
1) Сегодня был дополнительный блок обзора для модуля атомной теории
2) Завершить обзор всех модулей и практиковаться
3) Дон Не забудьте завтра просмотреть заметки для вашего теста!
Пн 25 ноября
1) Сегодня был блок обзора для блока атомной теории
2) Завтра будет дополнительный блок обзора, тест перенесен в среду
Пт 22 ноября
1 ) Примечания к электронному расположению ИОНОВ
2) Завершить рабочие листы по ионам и предыдущие рабочие листы с ионами на них
3) Начать один из листов обзора
Чт 21 ноября
1) Завершить все рабочие листы с электронным расположением атомов
2) Завтра лабораторная викторина по изотопам и массе: опирайтесь на цифры, указанные в ваших данных (масса).
20 ноября, среда
1) Beanium Lab
2) Завершающие примечания по конфигурации только ATOMS
3) Лабораторная викторина перенесена в пятницу
вторник 19 ноября
1) Примечания по Изотоп и процентное содержание в процентах
2) Примечания к электронному расположению атомов
3) Закончите обозначение ядра «вы попробуете» слайд в примечаниях
Понедельник, 18 ноября
1) Примечания по теории атома, часть 1 (ученые и изотопы)
2) рабочие листы и ключи
пятница 15 ноября
1) Сегодня был Стоич.Тест
2) Ежедневный обзор / практика и хороших выходных
Четверг, 14 ноября
1) Завершите все разделы и потренируйтесь, отметьте и исправьте, используя ключи
Все студенты должны присутствовать завтра для стоя. unit test
среда, 13 ноября
1) Блок обзора блока сегодня с раздаточными материалами обзора блока
2) Тест лаборатории титрования был сегодня в классе
вторник 12 ноября
1) Задан рабочий блок сегодня, чтобы больше практиковаться
Чт 7 ноября
1) Практика / рабочий блок для отработки ограничения / превышения и выхода
Среда 6 ноября
1) Примечания по расчетам ограничения и превышения и урожайности
2) Сегодня дается много практики, которую нужно завершить в течение следующих нескольких дней. Для отметки используйте изображения ключей.
Для отметки используйте изображения ключей.
Вт 5 ноября
1) Примечания по энергии и стех. (Используйте энергию и коэффициенты в качестве CF)
2) Рабочий лист энергии должен быть составлен и отмечен с помощью ключа
3) Прочтите и ответьте на вопросы для пакета ограничения активности реагента, данного в классе. Это поможет вам понять завтрашний урок.
Понедельник, 4 ноября
1) Сегодня мы провели титровальную лабораторию
2) Завершите вопросы лабораторного титрования для лабораторной викторины на следующей неделе
3) Все практические листы по стичу должны быть заполнены и отмечены
Пт, ноябрь 1
1) Мы добавили треугольник плотности на нашу карту кротов / stoich.
2) Практический / рабочий блок
3) Предварительное чтение лаборатории титрования, чтобы вы знали, как начать работу в понедельник
Четверг 31 октября
1) Мы закончили вчерашние записи pkg (по титрованию)
2) Завершите рабочие листы на различных стейхах. задачи
задачи
3) Отметьте / исправьте, используя картинки ключей ответов
Ср 30 октября
1) Примечания к треугольнику C, n, V и тому, как он связан с картой кротов и стоич.
2) Завершите оба рабочих листа, данных сегодня, чтобы попрактиковаться в том, что мы делали
Вт 29 октября
1) Сегодня был рабочий блок для практики смешанного стеича.проблемы преобразования
2) Заполните все листы, данные сегодня и вчера, и отметьте, используя ключи ответов
Пн 28 октября
1) Примечания по Stoich. Преобразование массы, молей, объема, молекул между двумя различными химическими веществами
2) Завершите Hebden Q, назначенные в сегодняшних примечаниях, и отметьте, используя клавишу на задней стороне
3) Завершите как минимум 2 разных рабочих листа, данных сегодня в классе
Завтра будет блок практической работы
Четверг 24 октября
1) Сегодня был модульный тест реакций
2) Ежедневно просматривайте / практикуйте предыдущий материал
Среда 23 октября
1) Лабораторная викторина была сегодня
2) Остальная часть класса была посвящена обзору модуля и практике / получению помощи
Тестирование модуля завтра, все студенты должны присутствовать!
Вт 22 октября
1) Завершите лабораторные расчеты сегодня дома, чтобы завтра пройти лабораторную викторину
2) Продемонстрируйте свою работу (с единицами измерения и правильным форматом), когда вы практикуетесь
Пн 21 октября
1) Сегодня был обзорный блок для вашего предстоящего модульного теста реакций
2) Знать все типы (и подтипы) и как сбалансировать уравнения и писать уравнения
3) Завершить все проверочные пакеты и рабочие листы для данного модуля
(Завтра мы будем делать лабораторию)
Пт 18 октября
1) Лаборатория хлоридов алюминия и меди (II) была сегодня. Я собрал ваши наблюдения.
Я собрал ваши наблюдения.
2) Был дан пакет Обзора модуля, начните обзор модуля в эти выходные.
* Многим из вас необходимо изучить заметки, особенно о ТИПАХ реакций. Предлагаю вам сделать билет как инструмент изучения этого или SRQ.
Чт 17 октября
1) Примечания по энергии и реакциям
2) Энергетический лист
3) Завершить Hebden Q’s, назначенные в сегодняшних примечаниях
4) Убедитесь, что вы ответили на вопросы относительно выполненной демонстрации энергии сегодня в классе с кувшином для молока
Среда 16 октября
1) Сегодня был рабочий / практический блок для завершения вашей практической работы и листы по типам реакций
2) К завтрашнему дню все рабочие листы, данные до сих пор уравновешивание и написание уравнений должны быть завершены и отмечены / исправлены
* Завтра мы делаем заметки по энергии и реакциям
T у.е. 15 октября
1) Сегодня был практический / рабочий блок для практики определение и запись типов реакций (и уравновешивание)
2) Выполните и отметьте / исправьте все практические листы, данные в классе
Пт 11 октября
1) Сегодня мы сделали заметки о типах реакций
2) Были даны два практических пакета, поработайте хотя бы над одним из них в эти выходные. Используйте свои заметки, если вы застряли! Ключи были вывешены в задней части комнаты.
Используйте свои заметки, если вы застряли! Ключи были вывешены в задней части комнаты.
Чт 10 октября
1) Сегодня практический блок для работы над написанием сбалансированных уравнений
2) Выполняйте все практические задания и отметьте / исправьте с помощью клавиш
Среда 9 октября
1 ) Заметки о реакциях
2) выполните один из заданных сегодня рабочих листов для практики
3) Промежуточные отчеты: самооценка и покажите, и попросите родителей заполнить и подписать, вернитесь в Джадж как можно скорее
(Завтра будет практика блок для записи и уравновешивания уравнений, и завтра вы получите кротовые тесты)
Вт 8 октября
1) Сегодня у нас был модульный тест крота
2) Ежедневный обзор / практика.Некоторым из вас нужно тратить больше времени на просмотр классных заметок !!
Понедельник, 7 октября
1) Завершите обзор блока и потренируйтесь, чтобы подготовиться к завтрашнему тесту. Обратите внимание на детали: формат показа ваших работ, все числа с единицами, установка коэффициентов пересчета и окончательные ответы на соответствующие сигноги!
Обратите внимание на детали: формат показа ваших работ, все числа с единицами, установка коэффициентов пересчета и окончательные ответы на соответствующие сигноги!
Пт 4 октября
1) Сегодня у вас был обзорный блок для обзора кротовой установки. Все 3 пакета обзора были предоставлены, чтобы помочь вам подготовиться к предстоящему модульному тесту.
Чт 3 октября
1) Обзор / тренировочный блок для кротов
2) Мы добавили треугольник плотности на карту кротов
3) Плотность отделки, моль и моль 10.0 лист и отметьте / исправьте с помощью клавиши
среда, 2 октября
1) Мы закончили записи молярности pkg сегодня
2) закончили все заданные рабочие листы и отметьте / исправьте с помощью ключей
Вт октябрь 1
1) Примечания по молярности / концентрации Треугольник C, n, V
2) Составьте таблицы молярности (не таблицы разведения)
3) Практические листы преобразования единиц моля
4) Выполните ли Hebden Q, назначенные в сегодняшнем разделе заметок
(завтра мы закончим сегодняшние заметки pkg)
Пт, 27 сентября
1) Сегодня мы провели лабораторию кротов в классе, просто чтобы попрактиковаться и применить преобразование единиц моль
2) Лабораторная викторина во вторник по преобразованию кротов
900 04 3) Поработайте над всеми рабочими листами практики для% комп. , Эмпирических и молекулярных.формула
, Эмпирических и молекулярных.формула4) Отметьте практическую работу с помощью ключей (фотографии из класса или Хебдена)
Четверг 26 сентября
1) Примечания к формулам% comp, emp и molc
2) Много листов практики для работы сегодня и завтра
3) Кротовая лаборатория завтра!
Среда 25 сентября
1) Сегодня мы прошли тест блока 1
2) Рабочий блок для отработки преобразования единиц измерения моль
3) Завершите предоставленные рабочие листы и отметьте / исправьте с помощью ключей
Вт сен 24
1) Просмотрите все записи кротов на данный момент
2) Завершите все рабочие листы, данные сегодня в классе, и отметьте их с помощью клавиш !!!
Понедельник, 23 сентября
1) Введение в лист примечаний по молям для чтения
2) Рабочий лист молекулярной массы
3) Примечания по коэффициенту преобразования молей в частицы и коэффициенту преобразования молей в массу
4) Рабочие таблицы по молей на молекулы и моли на граммы
5) Пожалуйста, сделайте и ОТМЕТЬТЕ / ИСПРАВИТЕ с помощью клавиш
Пт 20 сентября
1) Сегодня был тест по блоку 1 по всем вводным навыкам (sc. обозначение для усл. ед.)
обозначение для усл. ед.)
2) Ежедневный обзор и практика
Четверг 19 сентября
1) Завершить и отметить обзор модуля
2) Вы можете дополнительно потренироваться в Хебдене, чтобы подготовиться к завтрашнему тесту
, среда, 18 сентября
1) Лабораторная викторина была сегодня
2) Завершите все упражнения для модуля 1 (плотность, сигнатуры, условные обозначения, преобразование единиц измерения и т. Д.), Чтобы подготовиться к предстоящему модульному тесту. Отметьте, используя изображения ключей ответа.
Вт, 17 сентября
1) Сегодня у вас была лаборатория жевательной резинки (ключевая идея: измерение разницей)
2) Лабораторная викторина завтра
3) Практический день для сиг-инжира и преобразования единиц измерения (новые листы не предоставляются )
Пн, 16 сентября
1) Сегодня у нас был тест «Проверьте свое понимание» на Sig Figs
2) Мы сделали заметки о преобразовании единиц измерения и о том, как их настроить
3) Завершить практические задания на устройстве преобразований и пометить с помощью клавиш (их изображения)
Пт 13 сентября
1) Сегодня у нас была лабораторная викторина
2) Примечания: точность, точность, плотность
3) Готово подписать листы и маркировать с помощью ключа на понедельник
четверг 12 сентября
1) Примечания: sig figs
2) измерительная лаборатория сегодня (викторина на этой tmro)
3) 2 рабочих листа sigfig завершат это сегодня
-keys будут быть опубликовано завтра
Среда 11 сентября
1) Примечания: Измерение
2) Практические рабочие листы по измерению (делать и делать отметки с помощью ключей)
Вт 10 сентября
1) Сегодня у нас были контрольные вопросы безопасности и карты должны были быть выполнены
2) Примечания: Научная нотация
3) Рабочие листы по научной нотации и калькулятору
-до
-Отметьте, используя ключи ответов, размещенные в классе (сделайте снимки)
Пн 9 сентября
1) Сегодня у нас была номенклатурная викторина
2) Назначение карты безопасности: срок сдачи (большой лист)
— скрепить лист критериев к нему
— имя, дата, блок
— карандаш / ручка в порядке (делать не нужно раскрашивать, делайте это простым и чистым)
3) Тест по безопасности: Завтра (из пакета и вопросов, данных в пятницу)
Пт 6 сентября
1) Закончите все практики номенклатуры и отметьте / исправьте использование g ключи ответов (у вас есть викторина, которая засчитывается в понедельник)
2) Прочтите пакет безопасности и выполните пакет вопросов по безопасности (ответы на вопросы по символам WHMIS и общей безопасности)
Четверг 5 сентября
) ЖЕЛТЫЕ ФОРМЫ
2) Сегодня мы провели проверку вашего понимания практической викторины по ионной и ковалентной номенклатуре, обязательно попрактикуйтесь в том, с чем вы боролись
3) Завершите номенклатуру кислот и гидратов в упаковке, Q’s 81-110
4) Рабочие листы для дополнительных тренировок, которые даются в классе, делайте и отметьте
среда, 4 сентября
1) Контактная форма для родителей и договор безопасности (желтый) подписываются и возвращаются в Jhaj как можно скорее!
2) Показать веб-сайт родителей и расписание занятий !! НЕ ЗАПИСЫВАЙТЕ вещи на даты ТЕСТА / викторины
3) Пакет номенклатуры сделайте и отметьте / исправьте все Ionic и Covalent Q 1-80
4) Дополнительный пакет практики все ионные и ковалентные
Химия 11 Периодическая таблица ПТ — без имен многоатомные ионы
Обзор
Раздел 1: Материя и Химическая связь
Блок 2: Количество в Химические реакции
Блок 3: Решения и Растворимость
Блок 4: Газы и Атмосферная химия
Блок 5: Углеводороды и Энергия
|
Первый год размещения | Программы бакалавриата | Кафедра химии
Первый год обучения в CHEM 11A, 15A или 25A
Занимайтесь химией
Успех студентов на вводном курсе химии зависит в первую очередь от двух вещей: навыков и приверженности. Последнее зависит от вас, но мы можем помочь вам с первым. Поскольку студенты поступают в колледж с разными навыками решения проблем, полученными в результате школьного обучения, в Университете Брандейса предлагаются различные вводные последовательности химии.
Последнее зависит от вас, но мы можем помочь вам с первым. Поскольку студенты поступают в колледж с разными навыками решения проблем, полученными в результате школьного обучения, в Университете Брандейса предлагаются различные вводные последовательности химии.
CHEM 11 (Общая химия) — это курс для студентов, изучающих химию в средней школе не более одного года. CHEM 11 предполагает успешную подготовку по математике через предварительное исчисление, и его сдают примерно 3/4 студентов, изучающих вводную химию.CHEM 11 требует свободного владения алгебраическими выражениями, экспоненциальными членами и логарифмами. Студентам, которые не прошли предварительный расчет, настоятельно рекомендуется сдать MATH 5 в первом (или втором) семестре в Brandeis и отложить изучение общей химии до второго года обучения. Если вы не уверены в своей подготовке к математике, попробуйте пройти установочный экзамен Chemistry 11a / 15a без калькулятора. Нажмите ответ на каждый вопрос , чтобы определить свой балл. Адекватным баллом по Chem 11a будет примерно 7 правильных ответов; Для Chem 15a большинство студентов пропустят только пару пунктов в этом упражнении.
Нажмите ответ на каждый вопрос , чтобы определить свой балл. Адекватным баллом по Chem 11a будет примерно 7 правильных ответов; Для Chem 15a большинство студентов пропустят только пару пунктов в этом упражнении.
CHEM 15 (с отличием по общей химии) предназначен для студентов с более сильной подготовкой и / или желающих получить специализацию в области химии, химической биологии или биохимии. CHEM 15 предполагает базовую подготовку по химии и математике и изучает сложные темы, относящиеся к специальностям химических наук. Это курс по выбору для студентов с двухгодичным курсом химии в средней школе или успешным курсом химии в средней школе с AP-химией (3-5), AP-физикой или AP-расчетом.
Чтение . В дополнение к секции лекций, которая собирается три раза в неделю утром, в CHEM 11 есть обязательная декламация во второй половине дня. В неделю проводится три чтения. Студенты CHEM 11 зарегистрируются в одной секции, но могут посещать другие. Многие студенты считают полезным иметь время, чтобы посещать более одного чтения в неделю. Контрольные вопросы и тесты в CHEM 11 проводятся в пятницу утром.
Многие студенты считают полезным иметь время, чтобы посещать более одного чтения в неделю. Контрольные вопросы и тесты в CHEM 11 проводятся в пятницу утром.
CHEM 15 имеет обязательную вечернюю сессию в среду, но без дополнительных требований к чтению.
Рекомендации по выбору курсов:
- Если вам не нравится математика , подумайте о том, чтобы отложить вводный курс химии до тех пор, пока вы не закончите математику 5a, особенно если у вас не было успешного года обучения химии или физике в средней школе. Помните, что успешное прохождение курса важнее, чем его в начале ! Вопросы о переносе вводного курса химии вы можете задать профессору Новаку (novack @bradeis.эду).
- Если у вас было два года обучения химии в средней школе или успешный год химии в средней школе и / или вы хорошо успели по химии AP (3-5), физике AP или исчислению AP, тогда вам следует записаться на CHEM 15a и ассоциированная лаборатория CHEM 19a.
 Вопросы о зачислении на химию с отличием можно адресовать профессорам Гизекингу ([email protected]), Шмидту-Рору ([email protected]) или Снайдеру ([email protected]).
Вопросы о зачислении на химию с отличием можно адресовать профессорам Гизекингу ([email protected]), Шмидту-Рору ([email protected]) или Снайдеру ([email protected]). - Студенты с AP (4 или 5), IB Chemistry (оценка 5 или выше) или британским экзаменом A-level (оценка A, B или C) могут пройти лекции по органической химии и лабораторные курсы (CHEM 25a и ХИМ 29а).Органическая химия фокусируется на структуре и реакционной способности молекул на основе углерода и имеет прямое значение во множестве областей, включая биологию и биохимию. Эти курсы необходимы для большинства программ бакалавриата, связанных с наукой, а также для подачи заявки на многие программы магистратуры. Если вы изучите органическую химию на первом курсе, в последующие годы у вас будет больше времени, чтобы пройти курсы повышения квалификации и провести исследования. Студентам, рассматривающим этот вариант, рекомендуется проконсультироваться с профессором Мюрреем (murray @bradeis.edu) или Снайдер (snider@brandeis.
 edu). Примечание: студенты, выбравшие зачет AP для первого курса химии, должны начать свою карьеру в области химии в университете Брандейса с CHEM 25a. Большинство студентов, которые начинают учебу с CHEM 25/29, получают оценки по этим курсам в диапазоне от A до B-минус, при этом студенты AP 4 показывают уровень немного ниже, чем у студентов AP 5.
edu). Примечание: студенты, выбравшие зачет AP для первого курса химии, должны начать свою карьеру в области химии в университете Брандейса с CHEM 25a. Большинство студентов, которые начинают учебу с CHEM 25/29, получают оценки по этим курсам в диапазоне от A до B-минус, при этом студенты AP 4 показывают уровень немного ниже, чем у студентов AP 5.
Если у вас нет AP 4, AP 5 , балла IB 5 или выше или статуса продвинутого A-level, вы не можете начинать с CHEM 25/29 и должны сдавать CHEM 11/18 или CHEM15 / 19 первый.
Предварительная запись:
- Перед регистрацией :
Внимательно рассмотрите свой предыдущий опыт и выберите лекцию по химии и лабораторный курс. Помните, что и ваш успех, и ваше удовольствие от курса химии в этом году будут зависеть от честной оценки программы, которая наилучшим образом соответствует вашим потребностям и целям.
Обязательно просмотрите другие варианты курса, чтобы иметь возможность гибкости во второй половине дня.
 В секции химической лаборатории количество участников ограничено, и вам нужно будет поработать в других классах над наличием свободных мест в лаборатории.
В секции химической лаборатории количество участников ограничено, и вам нужно будет поработать в других классах над наличием свободных мест в лаборатории. - Регистрация :
- Запишитесь на курс лекций по химии, CHEM 11a или 15a. Курс лекций представляет собой полный курс стоимостью четыре кредита.
- Запишитесь на соответствующий лабораторный курс химии, CHEM 18a для студентов CHEM 11a и CHEM 19a для студентов CHEM 15a. Каждую неделю (10 недель / семестр) студент посещает четырехчасовую лабораторную сессию и 80-минутную лабораторную лекцию.Лекции для CHEM 18 и CHEM 19 запланированы в одном временном блоке, чтобы обеспечить гибкость при размещении. Лабораторный курс представляет собой половину курса, стоимость которого составляет два кредита.
- Завершение регистрации :
Подтвердите регистрацию. Не принимайте просто заявление о том, что запрошенные вами транзакции были завершены. Убедитесь, что вас записали на лекционный и лабораторный курс.
Убедитесь, что вас записали на лекционный и лабораторный курс.
UW Консультации для студентов: сдача экзаменов по химии
CHEM 142 (Общая химия)
Общая химия требует одного из следующих:
- Сдача установочного экзамена CHEM 142
- Проходные баллы = 11-26
- Также допускается сдача экзамена по химии с отличием 52% или выше
- Примечание. Размещающий тест по химии 142 указан как необработанный результат, а зачетный тест по химии с отличием указан в процентах.
- Завершение строительства ХИМ 110
- Оценка по химии 1 или выше
CHEM 143, CHEM 153 (ускоренная общая химия)
Ускоренный курс по общей химии разработан для студентов, которые имеют большой опыт и интересуются химией. Требуется владение основными понятиями стехиометрии и газовых законов. Этот курс будет проходить быстрее, чем CHEM 142. Для успеха в этой последовательности требуются отличные навыки решения задач и математического мышления.
Последовательность CHEM 143 и CHEM 153 охватывает тот же материал, который преподается в последовательностях CHEM 142, CHEM 152 и CHEM 162, но состоит из двух частей.
Чтобы зарегистрироваться на CHEM 143, студенты теперь должны выполнить один из следующего:
- Успешный результат на вступительном экзамене CHEM 142 (11–26) и право на зачисление по математике 124 (настоятельно рекомендуется одновременное зачисление)
- Оценка AP CHEM 1 или выше и право на участие в математике 124 (настоятельно рекомендуется одновременное зачисление)
- Любой балл по химическому тесту IB и право на участие в программе MATH 124 (настоятельно рекомендуется одновременное зачисление)
CHEM 143 будет предложено осеннее помещение, а CHEM 153 — зимнее.
CHEM 145 (с отличием)
с отличием по химии, CHEM 145 предполагает полное владение основными понятиями элементарной химии, поэтому в курсе не будет рассматриваться этот материал. На курсах для отличников также высоки ожидания по математике и умению решать задачи.
На курсах для отличников также высоки ожидания по математике и умению решать задачи.
CHEM 145 открыт для студентов с:
- Оценка 3, 4 или 5 на тесте AP и регистрация или зачет по математике 124
- Оценка 5, 6 или 7 на экзамене High Level Chemistry IB и регистрация или зачет по математике 124
- Процент успешной сдачи квалификационного экзамена по химии с отличием и регистрации или зачета по математике 124
Проходной балл по экзамену с отличием составляет 66% или выше.Граничный проход от 52% до 62% может быть одобрен для зачисления в Chem 145 советниками по химии. Оценка ниже 52% не считается проходной.
Дополнительную информацию можно найти на веб-сайте UW Chemistry.
Chem 11 Unit 3 Стехиометрия
Понедельник 17 декабря / вторник 18 декабря: Рабочие листы для отработки уравнений баланса: 3.1 Chem 11 3.2 Chem 11 3.3 Chem 11 ОТВЕТНЫЕ КЛЮЧИ: KEY Chem 11 3.1 KEY Chem 11 3. 2 Key Chem 11 3.3
2 Key Chem 11 3.3
Среда, 19 декабря / Четверг, 19 декабря: Миссис Тумбс покажет демонстрационные ролики, чтобы помочь вам вспомнить типы реакций.Мы будем отслеживать каждый образец реакции на передней доске, и вы получите «шпаргалку» / концептуальную карту типов реакций, которую вы можете использовать для проработки некоторых практических вопросов в январе 2020 года.
6 и 7 ЯНВАРЯ 2020 мы рассмотрим Типы реакций:
Каждый студент должен использовать «шпаргалку», созданную в декабре.
Понедельник, 6 января / вторник, 7 января: Типы реакций разложения Chem 11 и типы реакций разложения Chem 11 КЛЮЧ ОТВЕТА
6, 7, 8, 9 января мы завершим пакет рабочего листа «Путешествие по уравнениям» в классе.Используйте учебное время с умом, чтобы вам не пришлось работать над этим для HW! Путешествие через eqns KEY p1 и Путешествие через eqns KEY p2
Вводные примечания к сальдо от 17/18 декабря:
https://twitter. com/ToombsETeaches/status/552518877536874496
com/ToombsETeaches/status/552518877536874496
Некоторые примеры сбалансированных уравнений:
https://twitter.com/ToombsETeaches/status/55251
513
Некоторые сбалансированные уравнения «РЕДОКС»:
https://twitter.com/ToombsETeaches/status/55251
29895681
Некоторые более сложные уравнения для баланса:
https: // twitter.com / ToombsETeaches / status / 55251
79749634Среда, 8 января / Четверг, 9 января: После того, как мы завершим серию рабочих листов «ВОЯЖ ЧЕРЕЗ УРАВНЕНИЯ», мы рассмотрим: «Уравновешивание окислительно-восстановительных уравнений ПЛЮС КЛЮЧ в качестве введения в реакции однократного замещения».
Пт 10 января / Пн 13 января Более пристальный взгляд на реакции однократного замещения. «Серия мероприятий», чтобы определить, когда в результате однократной замены фактически будут производиться продукты: Далее следует серия мероприятий виртуальной лаборатории Chem 11 с рабочим листом и справочной таблицей. Серия действий с единичным ответом Wksht и Key
Серия действий с единичным ответом Wksht и Key
http://intro.chem.okstate.edu/1515F01/Laboratory/ActivityofMetals/home.html
Вт, 14 января / среда, 15 января: открытая книга «Викторина» по прогнозированию продуктов, классификации реакций и уравнениям баланса. (охватывающий все, что перечислено на этой веб-странице) БЛОК 5 напишет этот тест в ПЯТНИЦУ 17 ЯНВАРЯ. Это займет 55 минут.
Чт 16 января / Пт 17 января: Пакет коротких заметок по ЭКЗОТЕРМИЧЕСКИМ И ЭНДОТЕРМИЧЕСКИМ РЕАКЦИЯМ Сегодня мы начинаем ОЧЕНЬ ВАЖНУЮ ТЕМУ «СТОХИОМЕТРИИ» Введение в СТОХИОМЕТРИЮ (заполнен ключом ответа) и рабочий лист для практики. выходные: Рабочий лист уравнений и стехиометрии и ключ ответа и 3.5 Chem 11 Мольные реакции STOICH и условный обозначение
Пн, 20 января / вторник, 21 января: ЛАБОРАТОРНЫЙ ЭКСПЕРИМЕНТ: Полная официальная запись (как указано в раздаточном материале лаборатории) — , сдана в понедельник 27 января / вторник 28 января Лаборатория Mg HCl Chem 11
Среда, 22 января / четверг, 23 января: Сегодня во время урока проводится апгрейд теста на крот 2 блока: для тех, кто разговаривал с миссис Тумбс к концу дня в прошлую пятницу.
Остальные студенты работают над отчетом лабораторной работы и рабочими листами пакета Stoichiometry Intro Package.
Пт, 24 января Блок 1: Пора поработать над своим лабораторным отчетом, а также над новым РАБОЧИМ ЛИСТОМ: Стехиометрия Больше практики ВКЛЮЧИТЕ КЛЮЧ ОТВЕТА
ОТЧЕТ ПО ЛАБОРАТОРИИ должен быть представлен в понедельник 27 января / вторник 28 января
Пн, 27 января Блок 5: Учебник во время урока с РАБОЧИЙ ТАБЛИЦА ВРЕМЯ (чтобы получить больше практики стехиометрии при поддержке учителя), а также новый рабочий лист: Стехиометрия Больше практики ВКЛЮЧИТЕ ANS KEY
Вт, 28 января / среда, 29 января: Практическая викторина.
Чт 30 января Блок 1 / Пт 31 января Блок 5: ВИКТОРИНА ПО СТОХИОМЕТРИИ
Видеоурок по молекулярной стехиометрии (как рассчитать отношения):
Типичный (начальный уровень) Расчет стехиометрии:
Сложный вопрос о стехиометрии:
Четверг, 30 января: После нашей ВИКТОРИНА ПО СТОХИОМЕТРИИ… СТОХИОМЕТРИЯ ограничивающих и избыточных реагентов !!! Введение в избыточную стойкость и избыточную стойкость INTRO ANS. Во время занятий в классе вы можете получить помощь от миссис Тумбс. Используйте свое учебное время с умом!
Во время занятий в классе вы можете получить помощь от миссис Тумбс. Используйте свое учебное время с умом!
ОБУЧАЮЩЕЕ ВИДЕО для ОГРАНИЧЕНИЯ и ИЗБЫТОЧНОЙ СТОХИОМЕТРИИ:
Ссылка на видео на YouTube: http://www.youtube.com/watch?v=htzcgkjURKc Сделано с объяснением всего
Еще одно обучающее видео, чтобы убедиться, что вы понимаете эту ограничивающую и избыточную стехиометрию:
Ссылка на это видео: https://youtu.be/wyyWaoMpEXY Сделано на Explain Everything
пн 3 фев / вторник 4 фев: г-жаНа передней доске Toombs продемонстрирует еще две ограничивающие и избыточные задачи стехиометрии. Затем вы заполните рабочий лист INTRO to Lim / XS stoich (только 4 вопроса), который мы начали в четверг / пятницу: Intro To Excess Stoich и Excess Stoich INTRO ANS key
среда, 5 февраля / четверг, 6 февраля: Рабочий лист по ограничению / превышению стехиометрии , который миссис Тумбс соберет, чтобы мы могли перейти к совершенно новой теме в понедельник / вторник.
В следующие 5 дней вам следует поработать: Еще один взгляд на предельную и избыточную стехиометрию 2019
, пт, 7 февраля: Pro D DAY!
Пн, 10 февраля / Вт, 11 февраля: Продолжение нашей стехиометрической практики с процентным и теоретическим выходом.Вот вопрос, который я продемонстрировал на передней доске: Теоретическая и процентная доходность Lim Xs Stoich И 3 вопроса для практики для HW (хотя у вас было 45 минут в классе, чтобы выполнить их все!): Процент и теоретическая доходность с KEY
Учебное видео: молекулярная стехиометрия с теоретическим и процентным выходом ПРИМЕЧАНИЕ! Это также включает в себя ограничение и избыточную стехиометрию — так что посмотрите это видео, если вам все еще нужна помощь по этой теме!
среда 12 февраля, четверг 13 февраля, пятница 14 февраля (все короткие 1-часовые занятия):
Последняя тема раздела 3 : Процентный состав, эмпирические формулы и молекулярные формулы. Примечания и пакет рабочего листа: Emp Forms примечания и пакет рабочего листа и ключ ответа к приложенным рабочим листам: Percent Comp Emp Formulas KEY, а также: Emp Form Perc Comp (Этот второй документ включает дополнительный рабочий лист и набор вопросов под названием Эмпирические формулы из химических реакции , а также клавиши ответов )
Примечания и пакет рабочего листа: Emp Forms примечания и пакет рабочего листа и ключ ответа к приложенным рабочим листам: Percent Comp Emp Formulas KEY, а также: Emp Form Perc Comp (Этот второй документ включает дополнительный рабочий лист и набор вопросов под названием Эмпирические формулы из химических реакции , а также клавиши ответов )
ОБУЧАЮЩЕЕ ВИДЕО: Как рассчитать процентный состав
ОБУЧАЮЩЕЕ ВИДЕО: Как найти эмпирическую формулу
Обратите внимание! На видео выше… это явно оксалат марганца (II).Придется исправить это видео. УРА.
Учебное видео: как найти эмпирическую формулу (видео № 2)
Учебное видео: как найти эмпирические и молекулярные формулы
ОБУЧАЮЩЕЕ ВИДЕО: Как найти молекулярные формулы
Пн 17 фев: ПРАЗДНИК!
Вт, 18 февраля / среда, 19 февраля: Один последний тип вопросов, который нужно выучить сегодня, а затем остальная часть класса, чтобы начать ТЕСТОВЫЙ ПАКЕТ / ОБЗОР ПАКЕТА / РАБОЧИЙ ДЕНЬ / УЧЕБНИК
Учебное видео: как найти эмпирические формулы на основе химических реакций
Чт 20 февраля / Пт 21 февраля: ОПИСАНИЕ ТЕСТА / ОБЗОР ПАКЕТА / РАБОЧИЙ ДЕНЬ / УЧЕБНИК
Практический тест Unit 3 Chem 11 2019
Пн 24 февраля (блок 5) / Вт 25 февраля (блок 1): ТЕСТ стехиометрии, блок 3 — Последняя отметка для 2-го табеля успеваемости.

 И. Менделеева?
И. Менделеева?
 Установите соответствие между формулой вещества и степенью окисления атома хлора в нём.
Установите соответствие между формулой вещества и степенью окисления атома хлора в нём.
 Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления элемента в ней.
Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления элемента в ней. Массовая доля кислорода в сульфате железа (III) равна
Массовая доля кислорода в сульфате железа (III) равна
 Элементу, электронная формула внешнего электронного слоя атома которого …3s23p2, соответствует водородное соединение, формула которого: 1) РН3; 2) СН4; 3) SiH4; 4) HI.
Элементу, электронная формула внешнего электронного слоя атома которого …3s23p2, соответствует водородное соединение, формула которого: 1) РН3; 2) СН4; 3) SiH4; 4) HI.
 Заряд ядра + 16 имеют атомы химического элемента:
Заряд ядра + 16 имеют атомы химического элемента: Вещества молекулярного строения характеризуются:
Вещества молекулярного строения характеризуются: Установите соответствие между уравнениями реакций и изменением степени окисления азота.
Установите соответствие между уравнениями реакций и изменением степени окисления азота. N
N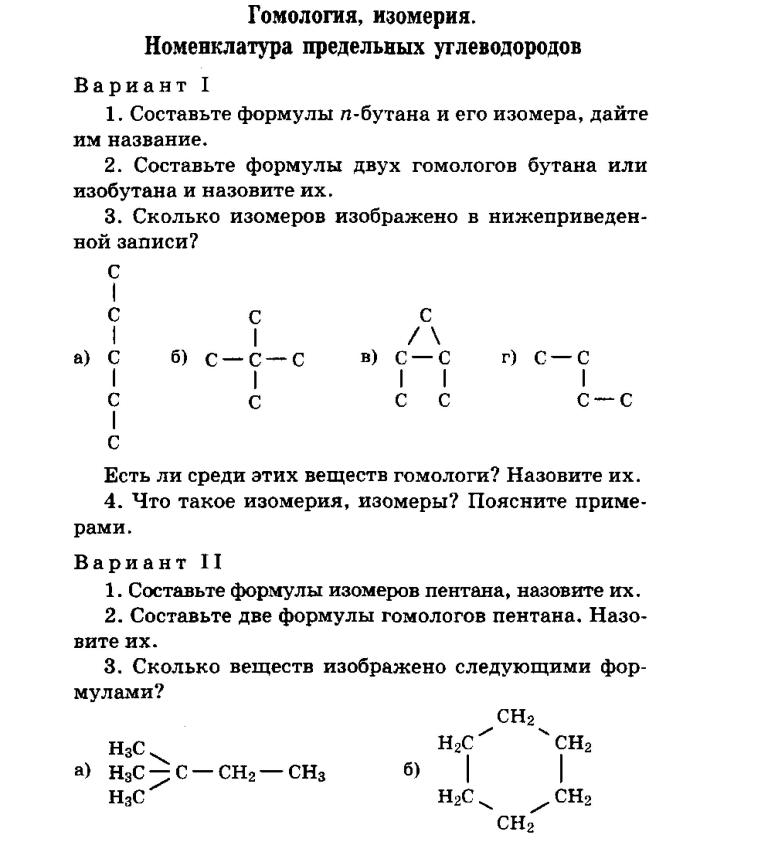 CH4
CH4 HCl + Na2CO3
HCl + Na2CO3 Все материалы размещены
здесь предназначены для использования в образовательных некоммерческих целях.
Не стесняйтесь использовать их в классе или в личных целях. Однако их нельзя передавать, продавать или распространять без разрешения.
Все материалы размещены
здесь предназначены для использования в образовательных некоммерческих целях.
Не стесняйтесь использовать их в классе или в личных целях. Однако их нельзя передавать, продавать или распространять без разрешения.

 Сегодняшнее задание
это хороший способ для учащихся оценить свои
понимание этой темы.
Сегодняшнее задание
это хороший способ для учащихся оценить свои
понимание этой темы.



 грамм. MgCl 2 (водн.)
на самом деле означает Mg 2+ (водн.) + 2Cl — (водн.).
грамм. MgCl 2 (водн.)
на самом деле означает Mg 2+ (водн.) + 2Cl — (водн.).

 Последняя демонстрация
более драматично с кроликом из воздушного шара. Этот
Урок короткий, чтобы дать время для сдачи тестов из Модуля 3.
Последняя демонстрация
более драматично с кроликом из воздушного шара. Этот
Урок короткий, чтобы дать время для сдачи тестов из Модуля 3.

 Студенты изучают эти правила и пробуют несколько
Примеры.
Студенты изучают эти правила и пробуют несколько
Примеры. Это лаборатория, но может быть
лучше как демонстрация.
Это лаборатория, но может быть
лучше как демонстрация.