2 Н2О + 2 Na = 2NaOH + h3
Н2О + 2 Na = 2NaOH + h3
C aCl2 + Na2CO3 = CaCO3 + 2NaCl
aCl2 + Na2CO3 = CaCO3 + 2NaCl
2
 KMnO4t K2MnO4 + MnO2 + O2
KMnO4t K2MnO4 + MnO2 + O2
2SO2 + O2 = 2 SO3
Контрольная работа
«Типы химической реакции»
Вариант 1
1. Расставьте коэффициенты, определите тип реакции:
а) h3 + N2 →Nh4
б) CO +O2 → CO2
в) HNO3 → NO2+h3O+O2↑
г ) Ca3N2 + h3O → Ca(OH)2 + Nh4↑
д) Ba + h3O → Ba(OH)2 + h3↑
2. Рассчитать степени окисления для каждого элемента в веществе
Al2(SO4)3
3. записать формулы веществ:
А) хлорид магния
Б) сульфат железа (III)
В) соляная кислота
4. В реакции меди с кислородом (О2) образовалось 800 г оксида меди (II). Рассчитать, какая масса меди вступила в реакцию с кислородом?
5. Составить уравнения и определить тип реакции:
А) хлорид железа (II) + гидроксид натрия
Б) цинк + серная кислота
Контрольная работа
«Типы химической реакции»
Вариант 2
1. Расставьте коэффициенты, определите тип реакции:
а) Mg + N2 →Mg3N2
б) C +Cr2 O3→ CO2 +Cr
в) HNO3 + CaO→ Ca(NO3)2+h3O
г ) Na + h3O → NaOH+ h3↑
д) Ba O+ h3SO4 → BaSO4 ↓+ h3O
2. Рассчитать степени окисления для каждого элемента в веществе
Fe(NO3)3
3. Записать формулы веществ:
А) сульфид железа (III)
Б) серная кислота
В) гидроксид меди (II)
4. По уравнению реакции CuCl2 +Mg →MgCl2 +Cu, вычислите количество вещества меди , если в реакцию с хлоридом меди (II) вступило 480 г магния.
5. Составить уравнение и определить тип реакции
А) сульфат бария + серная кислота
Б) соляная кислота + карбонат кальция
Контрольная работа
«Типы химической реакции»
Вариант 3
1. Расставьте коэффициенты, определите тип реакции:
а) P + S →P2S3
б) CuO +Al → Al2O3 +Cu
в) HNO3 + CaCO3→ Ca (NO3)2+h3O +CO2↑
г ) KClO3 → KCl+ O2↑
д) KOH+ h4PO4 → K3PO4 + h3O
2. Рассчитать степени окисления для каждого элемента для вещества
Na2SiO3
3. Записать формулы веществ:
А) сульфат натрия
Б) нитрат железа (II)
В) гидроксид магния
4. По уравнению реакции O2 +K →K2O, вычислите объём кислорода (н.у) , если в реакцию с кислородом вступило 390 г калия.
5. Составить уравнение и определить тип реакции
А) силикат натрия + соляная кислота
Б) фосфорная кислота + гидроксид алюминия
Контрольная работа
«Типы химической реакции»
Вариант 4
1. Расставьте коэффициенты, определите тип реакции:
а) P2О5 + Н2О →Н3РО4
б) Cl2+Al → AlCl3
в) NaNO3 → NaNO2+O2↑
г ) KBr +Cl2 → KCl+ Br2↑
д) K2O+ h4PO4 → K3PO4 + h3O
2.Раставить степени окисления для каждого элемента в веществе
K2CO3
3. Записать формулы веществ:
А) нитрат натрия
Б) сульфат железа (II)
В) кремневая кислота
4. По уравнению реакции Al + O2 →Al2O3, вычислите количество молекул кислорода, если в реакцию вступило 270 г алюминия.
5. Составить уравнение и определить тип реакции
А) алюминий + серная кислота
Б) карбонат калия + соляная кислота
Контрольная работа «Типы химических реакций» (Костя)
Какие реакции называются реакциями горения?
Какие реакции называются экзотермическими и эндотермическими реакциями?
Что называется веществом? Какие вещества называются простыми и сложными?
Какими признаками сопровождаются химические реакции?
Какие явления называются химическими и чем они отличаются от физических явлений?
Какими признаками сопровождаются химические реакции?
Перечислите, в каких случаях реакции обмена идут до конца.
xn--j1ahfl.xn--p1ai
Вариант - 1
1.Дайте характеристику следующей реакции:
N2(г) + О2 (г) ⇄ 2NО (г) - Q
2. Расставьте коэффициенты методом электронного баланса в следующем уравнении химической реакции:
KMnO4 +KNO2+h3O→KNO3 + MnO2 + KOH
3. При 150 градусах по Цельсию некоторая реакция заканчивается за 16 минут. Принимая, что температурный коэффициент скорости реакции равен 2, рассчитайте, через какое время закончится эта реакция при 200 градусах.
4. Как будет влиять на состояние равновесия уменьшение температуры, увеличение давления и увеличение концентрации СО2 в системах:
Fe2 O3 (т)+3CO(г) = 2Fe(т) + 3CO2 (г) - Q
CO2 (г) + C(т) = 2CO(г) – 72,6кДж
5. Напишите возможные уравнения гидролиза следующих солей: хлорида никеля(III), перманганата калия, карбоната калия. Укажите характер среды.
6. По краткому ионному уравнению составьте полное ионное и молекулярное уравнения реакций:
3Ca2+ + 2PO43- → Ca3(PO4)2
Вариант - 2
1. Дайте характеристику следующей реакции:
2Н2S(г) + 3О2 (г) ⇄ 2SО2 (г) + 2h3O(г) - Q
2. Расставьте коэффициенты методом электронного баланса в следующем уравнении химической реакции:
S + KClO3 + h3O → K2SO4 + Cl2 + h3SO4
3. Как изменится скорость реакции 3А(г)+ В(г) =2С(г)+Д(г), если: а) увеличить давление в системе в 4 раза, б) уменьшить концентрацию веществ в 3 раза.
4. Как будет влиять на состояние равновесия уменьшение температуры, увеличение давления и увеличение концентрации Н2О в системах:
4Nh4(г)+5O2(г) = 4NO(г) + 6h3O(г) - Q
Fe2O3 (т)+3Н2(г) = 2Fe(т) + 3Н2О (г) – 89,6кДж
5. Напишите возможные уравнения гидролиза следующих солей: бромида алюминия, сульфата кальция, сульфида натрия. Укажите характер среды.
6. По краткому ионному уравнению составьте полное ионное и молекулярное уравнения реакций:
2H + + CO32- → h3O + CO2
Вариант – 3
1. Дайте характеристику следующей реакции:
Fe2O3(т)+3CO(г) ⇄ 2Fe(т) + 3CO2(г) - Q
2. Расставьте коэффициенты методом электронного баланса в следующем уравнении химической реакции:
KMnO4 + HBr →KBr + MnBr2 + Br2 + h3O
3. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 81 раз? Температурный коэффициент скорости реакции равен 3.
4. Как будет влиять на состояние равновесия увеличение температуры, уменьшение давления и уменьшение концентрации О2 в системах:
2Ch4OH(г) +3O2(г)= 4h3O(г)+2CO2(г)+Q
2Mg(к) +O2 (г) = 2MgO(к) + Q
5. Напишите возможные уравнения гидролиза следующих солей: хлорида железа(III), нитрата калия, сульфата аммония. Укажите характер среды.
6. По краткому ионному уравнению составьте полное ионное и молекулярное уравнения реакций:
Zn2+ + 2OH- → Zn(OH)2
Вариант – 4
1. Дайте характеристику следующей реакции:
Fe2O3(т) + 3Н2(г) → 2Fe(т) + 3Н2О(г) – 89,6кДж
2. Расставьте коэффициенты методом электронного баланса в следующем уравнении химической реакции:
KBrO+MnCl2+KOH→ KBr + MnO2 + KCl + h3O
3. При температуре 40 градусов по Цельсию реакция протекает за 25 минут, при 60 градусах – за 4 минуты. Рассчитайте температурный коэффициент скорости реакции.
4. Как будет влиять на состояние равновесия уменьшение температуры,увеличение давления и увеличение концентрации Cl2 в системах:
4HCl(г) +O2 (г) = 2Cl2 (г) +2h3O(г) + Q
2Fe(к) + 3Cl2 (г) = 2FeCl3(к) + Q
5. Напишите возможные уравнения гидролиза следующих солей: хлорида алюминия, сульфата калия, сульфида калия. Укажите характер среды.
6. По краткому ионному уравнению составьте полное ионное и молекулярное уравнения реакций:
Al3+ + 3OH- → Al(OH)3
xn--j1ahfl.xn--p1ai
11 класс Контрольная работа № 2
по теме «Химические реакции» Вариант 1.
Приведите по одному примеру реакции замещения и разложения: а) с органическими соединениями; б) с неорганическими веществами.
При взаимодействии газообразных сероводорода и недостатка кислорода выпадет желтый осадок серы. Напишите уравнение реакции, разберите его сущность как окислительно-восстановительного процесса и рассчитайте объемы каждого газа, если известно, что в осадок выпадет 96 мг серы.
Напишите уравнение реакции гидролиза для солей сульфид лития, нитрат аммония, силикат натрия. Какова среда раствора этих солей?
При каких условиях можно сместить равновесие реакций:
а) синтеза аммиака N2(Г)+3Н2(г)=2Nh4(г)+Q,
б) этерификации
Ch4COOH(Ж)+С2Н5ОН(ж)=СН3СООС2Н5(ж)+Н2О(Ж)?
Сравните эти условия и объясните причину их различия.
Вариант 2
Приведите по одному примеру реакций соединения и обмена: а) с органическими соединениями; б) с неорганическими веществами.
Цинк при нагревании с оксидом серы (IV) образует сульфид и оксид цинка. Напишите уравнение реакции, разберите её сущность как окислительно-восстановительного процесса и рассчитайте массы продуктов реакции, если известно, что в реакции с избытком оксида серы (IV) участвовало 13 г цинка.
Даны растворы солей: нитрат свинца, хлорид алюминия, сульфат калия. Как при помощи индикатора распознать их? Для солей, подвергающихся гидролизу, напишите уравнения соответствующих реакций.
Напишите уравнение реакции обратимого гидролиза хлорэтана. Какие условия используют для усиления и ослабления гидролиза этого соединения? Дайте объяснение.
11 класс Контрольная работа № 2
по теме «Химические реакции». Вариант 3.
Приведите по одному примеру реакции обмена и разложения: а) с органическими соединениями; б) с неорганическими веществами.
При взаимодействии газообразных этана и кислорода образуется углекислый газ и вода. Напишите уравнение реакции, разберите его сущность как окислительно-восстановительного процесса и рассчитайте объемы каждого газа, если известно, что образуется 4,8 г воды.
Напишите уравнение реакции гидролиза для солей сульфид бария, нитрат цинка, сульфат натрия. Какова среда раствора этих солей?
При каких условиях можно сместить равновесие реакций:
а) синтеза аммиака 2NО (г)+ О2(г)=2NО2(г)+Q,
б) этерификации
HCOOH(Ж)+СН3ОН(ж)= НСООСН3(ж)+Н2О(Ж)?
Сравните эти условия и объясните причину их различия.
11 класс Контрольная работа № 2
по теме «Химические реакции». Вариант 4
Приведите по одному примеру реакций замещения и разложения: а) с органическими соединениями; б) с неорганическими веществами.
Железо при нагревании с серой образует сульфид железа. Напишите уравнение реакции, разберите её сущность как окислительно-восстановительного процесса и рассчитайте массу продукта реакции, если известно, что в реакции с избытком серы участвовало 14 г железа.
Даны растворы солей: нитрат алюминия, хлорид натрия, ацетат натрия. Как при помощи индикатора распознать их? Для солей, подвергающихся гидролизу, напишите уравнения соответствующих реакций.
Напишите уравнение реакции обратимого гидролиза метилацетата. Какие условия используют для усиления и ослабления гидролиза этого соединения? Дайте объяснение.
infourok.ru
11 класс
Контрольная работа №1 по теме «Химические реакции»
Вариант №1
Часть А
1. Характеристика реакции, уравнение которой 4Fe + 6h3O + 3O2 →4Fe(OH)3:
1) Соединения, ОВР 2) Замещения, ОВР 3) Обмена, не ОВР 4) Разложения ,ОВР
2. Окислитель в реакции синтеза аммиака, уравнение которой N2 + 3h3 = 2Nh4 + Q
1) N0 2) H0 3) H+1 4) N–3
3. Наиболее сильной кислотой из перечисленных является:
1) h3CO3 2) h4PO4 3) h3SO4 4) h3SO3
4. Осадок образуется при взаимодействии хлорида калия с:
1) AgNO3 2) NaOH 3) h3SO4 4) NaCl
5. Укажите уравнение реакции обмена
2 Н2О + 2 Na = 2NaOH + h3
Н2О + 2 Na = 2NaOH + h3
C aCl2 + Na2CO3 = CaCO3 + 2NaCl
aCl2 + Na2CO3 = CaCO3 + 2NaCl
2
 KMnO4t K2MnO4 + MnO2 + O2
KMnO4t K2MnO4 + MnO2 + O2
2SO2 + O2 = 2 SO3
Часть В.
1.Дайте характеристику данной реакции по всем признакам классификации
t,Ni
C4h20 (г) ↔ С4H8 (г)+ h3(г)+Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель
и окислитель этой реакции.
Mg + HCl = MgCl2 + h3
3.Написать реакции ионного обмена между:
а) сульфит натрия + соляная кислота;
б) гидроксид калия + бромоводородная кислота;
в) нитрат серебра + хлорид калия;
11 класс
Контрольная работа №1 по теме «Химические реакции»
Вариант №2
1. Характеристика реакции, уравнение которой 4KClO3 → 2KCl + 3O2:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
2. Восстановитель в реакции, уравнение которой 2СО + О2 = 2СО2 + Q
1) С+2 2) С+4 3) О0 4) О–2
3. К неэлектролитам относится:
1) ZnO 2) Ba(OH)2 3) h3SO4 4) Na2SO3
4.Определите коэффициент перед восстановителем в уравнении реакции по схеме:
C a + h3O Ca(OH)2 + h3
a + h3O Ca(OH)2 + h3
2
1
3
4
5. Верно утверждение, что реакция: Zn + 2 HCl → ZnCl2 + Н2
а) окислительно-восстановительная;
б) обмена;
в) обратимая;
г) каталитическая.
Часть В.
1.Дайте характеристику данной реакции по всем признакам классификации
t,Ni
2SO2 (г) + O2(г ) ↔ 2SO3 (г) + Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель
и окислитель этой реакции.
N2 + h3 = Nh4
3.Написать реакции ионного обмена между:
а) карбонат калия + азотная кислота;
б) гидроксид кальция + серная кислота;
в) хлорид бария + сульфат магния;
Вариант№3
1.Дайте характеристику данной реакции по всем признакам классификации
C(т) + O2 (г) = CO2 (г) + Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) гомогенная, гетерогенная;
Д) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель
и окислитель этой реакции. S + N2O = SO2 +N2
3.Кака нужно изменить температуру ,давление и концентрацию кислорода, чтобы химическое
равновесие сместить в сторону образования продуктов реакции:
N2 +O2 ↔ 2NO -- Q
4.Написать реакции ионного обмена между: а) гидроксид натрия + серная кислота
б) сульфид калия + соляная кислота
в) сульфат натрия +нитрат бария
5.При сгорании 14 г этилена выделяется 700 кДж теплоты. Составьте
термохимическое уравнение этой реакции.
Вариант №4
1.Дайте характеристику данной реакции по всем признакам классификации
CaCO3 (т) = CaO( т) + CO2 (г) -- Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) гомогенная, гетерогенная;
Д) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель и
окислитель этой реакции. C + O2 = CO2
3.Кака нужно изменить температуру ,давление и концентрацию кислорода, чтобы химическое
равновесие сместить в сторону образования продуктов реакции:
2SO2 + O2 ↔ 2SO3 +Q
4.Написать реакции ионного обмена между: а) уксусная кислота + гидроксид натрия
б) хлорид меди (II) +гидроксид калия
в) хлорид бария + сульфат натрия
5.При сжигании 15г кальция до оксида кальция выделилось 238,5 кДж энергии.
Составьте термохимическое уравнение этой реакции.
kopilkaurokov.ru
Контрольная работа по теме «Химические реакции»
Вариант 1.
1.Дайте характеристику химической реакции
NaNO3→ͭO2↑+NaNO2-Q.
2.Как проявляет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на химическое равновесие системы: 2CO(г)+О2(г)→←2CO2(г)+Q
Дайте обоснованный ответ.
3.Определить среду раствора солей
K2CO3 , BaBr2 , Pb(NO3)2 . Напишите уравнения реакций.
4.На сколько градусов надо повысить температуру, чтобы скорость реакции увеличилась в 27 раз, если температурный коэффициент равен 3.
5.Напишите уравнения электролиза расплава и раствора иодида калия.
Вариант 2.
1. Дайте характеристику химической реакции
Fe+h3SO4→FeSO4+h3↑+Q
2.Дано уравнение обратимой химической реакции
C2h5(г)+h3O↔katC2H5OH(г)+Q
Укажите условия, которые вызывают смещения химического равновесия в сторону образования этилового спирта. Дайте обоснованный ответ.
3. Определить среду раствора солей
Na2SO3 , Mg(NO3)2 , CaCI2 . Напишите уравнения реакций.
4.Во сколько раз увеличится скорость химической реакции при увеличении температуры на 30 градусов, если температурный коэффициент равен 2.
5. Напишите уравнения электролиза расплава и раствора бромида натрия
Вариант 3.
1.Дайте характеристику химической реакции
SO2+O2↔katSO3+Q
2. Дано уравнение обратимой химической реакции
C4h20(г) ↔katC4H6(г)+2Н2(г)-Q
В какую сторону будет смещаться химическое равновесие данной реакции при: а) понижении температуры; б) уменьшении давления; в) уменьшении концентрации водорода? Дайте обоснованный ответ.
3. Определить среду раствора солей
К2S , NaBr , ZnSO4. Напишите уравнения реакций.
4.Температурный коэффициент реакции равен 2. Во сколько раз увеличится скорость химической реакции при увеличении температуры на 100 градусов.
5. Напишите уравнения электролиза расплава и раствора гидроксида натрия.
Вариант 4.
1.Дайте характеристику химической реакции
CaCO3↔CaO+CO2↑-Q
2. Как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации водорода на химическое равновесие системы: СО(г)+2Н2(г) ↔СН3ОН+Q. Дайте обоснованный ответ.
3.Определить среду раствора солей:
КСI, Zn(NO3)2 , Na2S. Напишите уравнения реакций.
4.Во сколько раз увеличится скорость химической реакции при увеличении температуры на 30 градусов. Температурный коэффициент равен 4.
5.Напишите уравнения электролиза расплава и раствора хлорида кальция.
Вариант 5.
1.Дайте характеристику химической реакции
C2h5+h3↔katC2H6+Q
2. Как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кисорода на химическое равновесие системы:
2SO2+O2↔kat2SO3+Q. Дайте обоснованный ответ.
3.Определить среду раствора солей:
NaNO3 , CuCI2 , K2CO3. Напишите уравнения реакций.
4.На сколько градусов надо повысить температуру, чтобы скорость химической реакции увеличилась в 16 раз, если температурный коэффициент равен 2.
5. Напишите уравнения электролиза расплава и раствора бромида бария.
Вариант 6.
1.Дайте характеристику химической реакции
NaOH+h3SO4→Na2SO4+h3O+Q
2.Дано уравнение обратимой химической реакции
CO2(г)+Ств↔2СО+Q
Укажите условия, которые вызывают смещения химического равновесия в сторону образования угарного газа. Дайте обоснованный ответ.
infourok.ru
Контрольная работа
Химические реакции
Вариант – 1.
Часть – 1.
| Выберите один правильный ответ. |
А1. Процесс окисления отражен схемой
SO3 → SO42- 2. SO32- → SO2
S → SO2 4. SO42- → S
А2. Процесс восстановления отражен схемой
NO2- → NO3- 2. NO3- → N2O
NO2 → NO3- 4. N2O3 → NO2-
А3. Последовательности изменения степени окисления азота
N+4 → N+5 → N0 → N-3
соответствует схема превращений
NO2 → NO3- → N2 → Nh4 2. NO2 → NO3- → N2 → N2O3
NO2- → NO3- →N2 → Nh4 4. NO2- → NO3- → N2 → N2O3
А4. Только окислителем за счет атомов марганца может быть соединение, формула которого
`MnO2 2. K2MnO4 3. KMnO4 4. Mn2O3
А5. При электролизе водного раствора сульфата меди (II) на катоде выделяется
Медь 2. Водород 3. Кислород 4. Оксид серы (IV)
А6. Кислород выделиться на аноде при электролизе водного раствора
Хлорида меди (II) 2. Алюмокалиевых квасцов
Бромида цинка 4. Сульфида натрия
А7. При электролизе водного раствора хлорида натрия на катоде и аноде соответственно выделяются
Натрий и хлор 2. Водород и хлор
Водород и кислород 4. Натрий и кислород
А8. Электролиз водного раствора соли можно использовать для получения
Кальция 2. Бария 3. Цинка 4. Лития
Часть – 2.
В1. Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней
| СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ |
| А) FeO + CO = Fe + CO2 | 1) Fe+2 → Fe0 |
| Б) FeSO4 + KMnO4 + h3SO4→Fe2(SO4)3 + + MnSO4 + K2SO4 + h3O | 2) Mn+7 → Mn+2 |
| В) h3O2 + KClO3 → KCl + h3O + O2 | 3) O- → O-2 |
| Г) h3O2 + KNO2 → KNO3 + h3o | 4) N+3 → N+6 |
| 5) Cl+5 → Cl- | |
| 6) O- → O0 7) Fe+2 → Fe+3 |
В2. Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе его водного раствора.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ НА КАТОДЕ |
| А) NaI | 1) металл |
| Б) AgNO3 | 2) водород |
| В) ZnSO4 | 3) оксид азота (IV) |
| Г) NiBr2 | 4) металл, водород |
| 5) галоген |
Контрольная работа
Химические реакции
Ответы.
| № ответа | Вариант-1 |
| А1 | 3 |
| А2 | 2 |
| А3 | 1 |
| А4 | 3 |
| А5 | 1 |
| А6 | 2 |
| А7 | 2 |
| А8 | 3 |
| В1 | 1253 |
| В2 | 2111 |
Школа оценивания.
Задания части 1 оцениваются одним баллом за правильный ответ. Задания части 2 оцениваются в 2 балла при полном ответе, 1 баллом при допуске 1 ошибки и 0 баллов при двух и более ошибках.
Отметка «2» - от 0 до 4 баллов
Отметка «3» - от 5 до 8 баллов
Отметка «4» - от 9 до 10 баллов
Отметка «5» - от 11 до 12 баллов
multiurok.ru
Х–11 Контрольная работа №3 «Химические реакции» Вариант №1
А1. Характеристика реакции, уравнение которой 4Fe + 6h3O + 3O2 →4Fe(OH)3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
А3. Химическая реакция, уравнение которой: 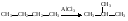
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Щелочную среду имеет водный раствор соли, формула которой:
1) AlCl3 2) KNO3 3) K2CO3 4) FeCl3
А5. Наиболее сильной кислотой из перечисленных является:
1) h3CO3 2) h4PO4 3) h3SO4 4) h3SO3
А6. Осадок образуется при взаимодействии хлорида калия с:
1) AgNO3 2) NaOH 3) h3SO4 4) NaCl
А7. Гидролизу не подвергается:
1) ZnSO4 2) Ba(NO3)2 3) Na2S 4) Nh5Cl
В1. Установите соответствие между схемой ОВР и коэффициентом перед формулой восстановителя:
Схема реакции
Коэффициент
А) Nh4 + CuO = Cu + N2 + h3O
1) 2
Б) Nh4 + O2 = NO + h3O
2) 6
В) HNO3 + Cu = Cu(NO3)2 + NO2 + h3O
3) 4
Г) Li + N2 = L3N
4) 1
5) 5
В2. Установите соответствие между солью и реакцией среды раствора
Соль
Среда раствора
А) Nh5NO3
1) Кислая
Б) K2SO4
2) Щелочная
В) CaS
3) Нейтральная
Г) BaI2
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Соль
Отношение к гидролизу
А) Al(NO3)3
1) гидролиз по катиону
Б) Na2SO4
2) гидролиз по аниону
В) K2SO3
3) гидролиз по катиону и аниону
Г) (Nh5)2CO3
4) гидролизу не подвергается
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
KI + h3SO4 → I2 + h3S + K2SO4 + h3O
Определите окислитель и восстановитель.
Х–11 Контрольная работа №3 «Химические реакции» Вариант №2
А1. Характеристика реакции, уравнение которой 4KClO3 → 2KCl + 3O2:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты выделится при взаимодействии 5,6 л водорода и избытком хлора. Термохимическое уравнение Н2+Сl2 = 2HCl + 92,3 кДж.
1) 2,3 кДж 2) 23 кДж 3) 46 кДж 4) 230 кДж
А3. Химическая реакция, уравнение которой: 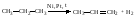
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Кислую среду имеет водный раствор соли, формула которой:
1) KCl 2) ZnSO4 3) Na2CO3 4) NaNO3
А5. К неэлектролитам относится:
1) ZnO 2) Ba(OH)2 3) h3SO4 4) Na2SO3
А6. Газ образуется при взаимодействии серной кислоты с:
1) AgNO3 2) NaOH 3) ZnS 4) Na2SO4
А7. Гидролизу не подвергается:
1) K2SO4 2) Ni(NO3)2 3) Na2SO3 4) (Nh5)2CO3
В1. Установите соответствие между схемой ОВР и формулой восстановителя в ней:
Схема реакции
формула восстановителя
А) Cl2 + KOH = KCl + KClO + h3O
1) KOH
Б) h3O2 + Ag2O = Ag + O2 + h3O
2) Cl2
В) h3O2 + Cl2 = HCl + O2
3) h3O2
Г) O2+ NO = NO2
4) Ag2O
5) NO
В2. Установите соответствие между солью и реакцией среды раствора
Соль
Среда раствора
А) K3PO4
1) Кислая
Б) Ba(Ch4COO)2
2) Щелочная
В) Cr(NO3)3
3) Нейтральная
Г) NaNO3
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
Соль
Отношение к гидролизу
А) Ch4COOK
1) гидролиз по катиону
Б) Nh5Cl
2) гидролиз по аниону
В) Na2CO3
3) гидролиз по катиону и аниону
Г) Nh5NO2
4) гидролизу не подвергается
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + Na2SO3+ h3SO4 → MnSO4 + Na2SO4 + K2SO4 + h3O
Определите окислитель и восстановитель.
infourok.ru