Контрольная работа по теме «Строение атома и типы химической связи»
Вариант 1.
ЧАСТЬ А (11 баллов)
1. Число протонов в атоме фосфора равно:
а) 3 б) 5 в) 15 г) 16
2. Число нейтронов в атоме хлора равно:
а) 7 б) 18 в) 19 г) 17
3. Число энергетических уровней в атоме магния равно:
а) 3 б) 2 в) 4 г) 1
4. Химический элемент ртуть находится в Периодической таблице Д. И Менделеева:
а) в шестом периоде, второй группе, главной подгруппе
б) во втором периоде, четвёртой группе, главной подгруппе
в) во втором периоде, четвёртой группе, побочной подгруппе
г) в шестом периоде, второй группе, побочной подгруппе
5. Число электронов на внешнем энергетическом уровне атома серы равно:
а) 3 б) 6 в) 32 г) 16
6. Строение внешнего энергетического уровня, выражаемое формулой …2s22p4 характерно для элемента:
Строение внешнего энергетического уровня, выражаемое формулой …2s22p4 характерно для элемента:
а) кремния б) бора в) кислорода г) лития
7. Ряд химических элементов, в котором происходит уменьшение радиуса атома:
а) углерод – бор – бериллий б) азот – фосфор — мышьяк
в) сера – фосфор — кремний г) алюминий – кремний – фосфор
8.Ряд химических элементов, в котором происходит уменьшение электроотрицательности:
в) кремний-фосфор-сера г) селен-сера-кислород
9. Вещества с ионным типом химической связи представлены в ряду:
а) NaCl, HCl, K2O б) N2, N2O3, Fe2O3 в) KCl, MgO, K2S г) CuS, CH4, CO2
10. Ковалентная полярная химическая связь образуется между элементами следующих веществ:
а) H2, H2O, NH3 б) NH3, K2S, CO2, в) CO2, NH3, H2O г) C, Cl2, N2
11. Верны ли следующие суждения:
Верны ли следующие суждения:
А) У химических элементов в главных подгруппах с увеличением порядкового номера металлические свойства ослабевают.
Б) Ковалентная неполярная химическая связь образуется между атомами разных неметаллов.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения неверны
ЧАСТЬ В (6 баллов)
1. Расположите элементы, символы которых приведены ниже в порядке уменьшения металлических свойств:
P, Cl, S, Na, Mg.
2. Установите соответствие:
- Вид химической связи
Химическое соединение
А. Ковалентная неполярная связь.
Б. Ионная связь.
В. Ковалентная полярная связь.
1. N2O5
2. CaCl2
3.
 Br2
Br24. K3P
5. HF
3. Установите соответствие:
Обозначение частицы (атом, ион)
А. 1s2
Б. 1s22s22p3
В. 1s22s22p6
Г. 1s22s2
1. N0
2. Na+
3. Li+
4. Na0
5.Be0
6. Ca2+
ЧАСТЬ С (5 баллов)
Составьте электронную и электронно-графическую формулы атома элемента под номером 16. Покажите распределение электронов по энергетическим уровням в атоме этого элемента.
Вариант 2.
ЧАСТЬ А (11 баллов)
1. Число протонов в атоме азота равно:
а) 7 б) 5 в) 2 г) 14
2. Число нейтронов в атоме фосфора равно:
а) 10 б) 16 в) 31 г) 15
3. Число энергетических уровней в атоме серы равно:
а) 16 б) 2 в) 3 г) 6
4. Химический элемент медь находится в Периодической таблице Д. И Менделеева:
а) в четвертом периоде, первой группе, главной подгруппе
б) в первом периоде, четвёртой группе, главной подгруппе
в) в первом периоде, четвёртой группе, побочной подгруппе
г) в четвёртом периоде, первой группе, побочной подгруппе
5. Число электронов на внешнем энергетическом уровне атома брома равно:
Число электронов на внешнем энергетическом уровне атома брома равно:
а) 3 б) 35 в) 7 г) 6
а) фосфора б) азота в) кислорода г) натрия
7. Ряд химических элементов, в котором происходит увеличение радиуса атома:
а) калий – натрий – литий б) фосфор – сера — хлор
в) углерод – кремний — германий г) алюминий – кремний – фосфор
8.Ряд химических элементов, в котором происходит увеличение электроотрицательности:
а) фтор-хлор-бром б) бром-селен-мышьяк
в) магний-алюминий-кремний г) литий-натрий-калий
9. Вещества с ионным типом химической связи представлены в ряду:
а) AlCl3, HCl, H2O б) KCl, CO, Li2S в) N2, N2O, FeO г) CаS, MgO, CaCl2
10. Ковалентная полярная химическая связь образуется между элементами следующих веществ:
Ковалентная полярная химическая связь образуется между элементами следующих веществ:
а) N2, F2O, NH3 б) PH3, H2S, SO2, в) NO2, NH3, K2O г) P2O5, Cl2, Li
11. Верны ли следующие суждения:
А) У химических элементов в периодах с увеличением порядкового номера металлические свойства ослабевают.
Б) Ионная химическая связь возникает за счёт образования общих электронных пар.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения неверны
ЧАСТЬ В (6 баллов)
1. Расположите элементы, символы которых приведены ниже в порядке увеличения металлических свойств:
С, Be, Li, O, F.
2. Установите соответствие:
- Вид химической связи
Химическое соединение
А.
 Ковалентная неполярная связь.
Ковалентная неполярная связь.Б. Ионная связь.
В. Ковалентная полярная связь.
1. MgCl2
2. N2
3. H2
4. CO
5. K2O
3. Установите соответствие:
- Электронная формула частицы (атом, ион)
Обозначение частицы (атом, ион)
А. 1s22s22p1
Б. 1s22s
В. 1s22s22p5
Г. 1s22s22p2
1. C0
2. Na+
3. Li+
4. F0
5.B0
6.
 Ca2+
Ca2+
ЧАСТЬ С (5 баллов)
Составьте электронную и электронно-графическую формулы атома элемента под номером 12. Покажите распределение электронов по энергетическим уровням в атоме этого элемента. Какой тип связи будет характерен для химического соединения этого элемента с фтором? Приведите механизм образования этой связи.
Вариант 3.
ЧАСТЬ А (11 баллов)
1. Число протонов в атоме натрия равно:
а) 12 б) 11 в) 23 г) 3
2. Число нейтронов в атоме аргона равно:
а) 18 б) 8 в) 22 г) 21
3. Число энергетических уровней в атоме хлора равно:
а) 7 б) 2 в) 3 г) 1
4. Химический элемент цинк находится в Периодической таблице Д. И Менделеева:
а) в четвертом периоде, второй группе, главной подгруппе
б) в первом периоде, четвёртой группе, главной подгруппе
в) в первом периоде, четвёртой группе, побочной подгруппе
г) в четвёртом периоде, второй группе, побочной подгруппе
5. Число электронов на внешнем энергетическом уровне калия равно:
Число электронов на внешнем энергетическом уровне калия равно:
а) 3 б) 4 в) 1 г) 5
6. Строение внешнего энергетического уровня, выражаемое формулой …3s23p3 характерно для элемента:
а) фосфора б) азота в) кислорода г) натрия
7. Ряд химических элементов, в котором происходит увеличение радиуса атома:
а) калий – натрий – литий б) азот – углерод — бор
в) германий – кремний -углерод г) алюминий – кремний – фосфор
8.Ряд химических элементов, в котором происходит увеличение электроотрицательности:
а) фтор-хлор-бром б) бром-селен-мышьяк
в) магний-алюминий-кремний г) литий-натрий-калий
9. Вещества с ионным типом химической связи представлены в ряду:
а) AlCl3, HCl, H2O б) KCl, MgO, Li2S в) N2, N2O, FeO г) CаS, CaCl2, CO
10. Ковалентная полярная химическая связь образуется между элементами следующих веществ:
Ковалентная полярная химическая связь образуется между элементами следующих веществ:
а) Н2, F2O, P2O5 б) PH3, H2S, K2O в) NO2, NH3,SO2, г) NH3, Cl2, Li2O
11. Верны ли следующие суждения:
А) У химических элементов в пределах периода с увеличением порядкового номера радиус атома уменьшается.
Б) Ковалентная химическая связь возникает за счёт образования общих электронных пар.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения неверны
ЧАСТЬ В (6 баллов)
1. Расположите элементы, символы которых приведены ниже в порядке увеличения металлических свойств:
Сs,Na, Li, Rb, K.
2. Установите соответствие:
- Вид химической связи
Химическое соединение
А.
 Ковалентная неполярная связь.
Ковалентная неполярная связь.Б. Ионная связь.
В. Ковалентная полярная связь.
1. HCl
2. F2
3. N2O
4. CaO
5. LiCl
3. Установите соответствие:
- Электронная формула частицы (атом, ион)
Обозначение частицы (атом, ион)
А. 1s22s22p2
Б. 1s22s22p63s23p6
В. 1s22s22p5
Г. 1s22s22p6
1. C0
2. Na+
3. Li+
4. F0
5.B0
6.
 Ca2+
Ca2+
ЧАСТЬ С (5 баллов)
Составьте электронную и электронно-графическую формулы атома элемента под номером 7. Покажите распределение электронов по энергетическим уровням в атоме этого элемента. Какой тип связи будет характерен для химического соединения этого элемента с натрием? Приведите механизм образования этой связи.
Вариант 4.
ЧАСТЬ А (11 баллов)
1. Число протонов в атоме серы равно:
а) 32 б) 6 в) 14 г) 16
2. Число нейтронов в атоме алюминия равно:
а) 27 б) 13 в) 14 г) 3
3. Число энергетических уровней в атоме кальция равно:
а) 4 б) 2 в) 3 г) 6
4. Химический элемент калий находится в Периодической таблице Д. И Менделеева:
а) в четвертом периоде, первой группе, главной подгруппе
б) в первом периоде, четвёртой группе, главной подгруппе
в) в первом периоде, четвёртой группе, побочной подгруппе
г) в четвёртом периоде, первой группе, побочной подгруппе
5. Число электронов на внешнем энергетическом уровне атома кремния равно:
Число электронов на внешнем энергетическом уровне атома кремния равно:
а) 3 б) 4 в) 14 г) 6
6. Строение внешнего энергетического уровня, выражаемое формулой …3s23p1 характерно для элемента:
а) фосфора б) алюминия в) бора г) серы
7. Ряд химических элементов, в котором происходит уменьшение радиуса атома:
а) кремний – алюминий – магний б) хлор– сера — фосфор
в) углерод – кремний — германий г) кальций – магний – бериллий
8.Ряд химических элементов, в котором происходит увеличение электроотрицательности:
а) фтор-хлор-бром б) бром-селен-мышьяк
в) магний-алюминий-кремний г) литий-натрий-калий
9. Вещества с ионным типом химической связи представлены в ряду:
а) СаBr2, MgCl2, Na2O б) KCl, CO, Li2S в) N2, N2O, FeO г) CаS, N2O, MgCl2
10. Ковалентная полярная химическая связь образуется между элементами следующих веществ:
Ковалентная полярная химическая связь образуется между элементами следующих веществ:
а) N2, F2O, NH3 б) PH3, H2S, SO2, в) NO2, NH3, K2O г) P2O5, Cl2, Li2O
11. Верны ли следующие суждения:
А) У химических элементов в группе с увеличением порядкового номера металлические свойства ослабевают.
Б) Ионная химическая связь возникает за счёт образования общих электронных пар.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения неверны
ЧАСТЬ В (6 баллов)
1. Расположите элементы, символы которых приведены ниже в порядке увеличения металлических свойств:
С, Be, Li, O, F.
2. Установите соответствие:
- Вид химической связи
Химическое соединение
А.
 Ковалентная неполярная связь.
Ковалентная неполярная связь.Б. Ионная связь.
В. Ковалентная полярная связь.
1. Cl2
2. Na2O
3. CaH2
4. CO
5. K2O
3. Установите соответствие:
- Электронная формула частицы (атом, ион)
Обозначение частицы (атом, ион)
А. 1s22s22p5
Б. 1s22s22p63s23p6
В. 1s22s22p3
Г. 1s2
1. C0
2. Cl0
3. Li+
4. F0
5.N0
6. Ca2+
ЧАСТЬ С (5 баллов)
Составьте электронную и электронно-графическую формулы атома элемента под номером 17. Покажите распределение электронов по энергетическим уровням в атоме этого элемента. Какой тип связи будет характерен для химического соединения этого элемента с магнием? Приведите механизм образования этой связи.
Покажите распределение электронов по энергетическим уровням в атоме этого элемента. Какой тип связи будет характерен для химического соединения этого элемента с магнием? Приведите механизм образования этой связи.
Ответы 8 класс Контрольная работа №1.
Контрольная работа «Атомы» (8 класс)
Контрольная работа №1.
«Атомы химических элементов, химическая связь».
по химии 8 класс
Вариант – I
А1. Каков заряд ядра атома хлора?
А) +24 Б) +17 В) +12 Г) -17
А2. Определите элемент, если в его атоме 33 электронов
А) алюминий Б) мышьяк В) германий Г) криптон
А3. Чему равняется количество протонов, нейтронов и электронов в атоме фосфора?
А) р=31, n=16, е=31 Б) р=15, n=15, е=15 В) р=15, n=31, е=15 Г) р=15, n=16, е=15
А4. Каков физический смысл порядкового номера элемента
Каков физический смысл порядкового номера элемента
А) это число энергетических уровней в атоме Б) это заряд ядра атома В) это относительная атомная масса Г) это число нейтронов в ядре
А5. Каков физический смысл номера периода таблицы Д.И.Менделеева?
А) это число энергетических уровней в атоме Б) это число электронов в атоме
В) это заряд ядра атома Г) это число электронов на внешнем энергетическом уровне
А6. Чему равно число электронов на внешнем энергетическом уровне атома
А) порядковому номеру Б) номеру группы
В) номеру периода Г) числу нейтронов в ядре
А7. Укажите количество электронов на внешнем энергетическом уровне в атоме хлора
А) 2 Б) 5 В) 7 Г) 17
А8. Укажите пару химических элементов, между которыми может возникнуть ковалентная неполярная связь
А) водород и хлор Б) калий и фтор В) азот и азот Г) кислород и натрий
А9. Укажите формулу соединения с ковалентной полярной связью
А) O3 Б) KCl2 В) HBr Г) PH3
А10. Атому, какого химического элемента соответствует электронная формула 1S22S22P4
Атому, какого химического элемента соответствует электронная формула 1S22S22P4
А) углерод Б) сера В) магний Г) кислород
А11. В ядре атома, какого химического элемента 19 протонов и 20 нейтронов
А) фтор Б) калий В) фосфор Г) кислород
А12. Какова относительная молекулярная масса вещества с химической формулой C2H2O4
А) 100 Б) 90 В) 56 Г) 124
В1. Установите соответствие между типом химической связи и формулой соединения
Вид химической связи
А) Ковалентная неполярная
Б) Ионная
В) Ковалентная полярная
Г) Металлическая
Химическое соединение
1) P2O5 2) KCl2
3) HF 4) O3
5) K3P 6) Zn
С1. Найдите массовую долю натрия в составе молекулы Na3PO4
С2. Определите тип химической связи и составьте схему образования связи у следующих веществ:
а) MgCl2 б) F2 в) h3S
Контрольная работа №1.
«Атомы химических элементов, химическая связь».
по химии 8 класс
Вариант – II
А1. Каков заряд ядра атома цезия?
А) -55 Б) +35 В) +55 Г) +30
А2. Определите элемент, если в его атоме 35 электронов
А) титан Б) хром В) марганец Г) бром
А3. Чему равняется количество протонов, нейтронов и электронов в атоме кальция?
А) р=20, n=40, е=20 Б) р=40, n=20, е=40 В) р=20, n=20, е=20 Г) р=40, n=40, е=40
А4. Каков физический смысл порядкового номера элемента
А) это число нейтронов в ядре Б) это число протонов в ядре атома В) это число энергетических уровней в атоме Г) это относительная атомная масса
А5. Каков физический смысл номера периода таблицы Д.И.Менделеева?
А) это заряд ядра атома Б) это число электронов на внешнем энергетическом уровне В) это число электронов в атоме Г) это число энергетических уровней в атоме
А6. Чему равно общее число электронов атома
Чему равно общее число электронов атома
А) номеру группы Б) номеру периода
В) порядковому номеру Г) числу нейтронов в ядре
А7. Укажите количество электронов на внешнем энергетическом уровне в атоме бериллия
А) 2 Б) 5 В) 7 Г) 17
А8. Укажите пару химических элементов, между которыми может возникнуть ионная связь
А) водород и кислород Б) фтор и углерод В) хлор и хлор Г) натрий и хлор
А9. Укажите формулу соединения с ковалентной неполярной связью
А) CF4 Б) H2 В) KBr Г) P2O5
А10. Атому, какого химического элемента соответствует электронная формула 1S22S22P3
А) литий Б) натрий В) калий Г) азот
А11. В ядре атома, какого химического элемента 7 протонов и 7 нейтронов
А) фтор Б) азот В) фосфор Г) кислород
А12. Какова относительная молекулярная масса вещества с химической формулой H2CrO4
А) 142 Б) 118 В) 150 Г) 124
В1. Установите соответствие между типом химической связи и формулой соединения
Установите соответствие между типом химической связи и формулой соединения
Вид химической связи
А) Ковалентная неполярная
Б) Ионная
В) Ковалентная полярная
Г) Металлическая
Химическое соединение
1) O2 2) Br2
3) Zn 4) MgCl2
5) CaO 6) HCl
С1. Найдите массовую долю калия в составе молекулы K2SiO3
С2. Определите тип химической связи и составьте схему образования связи у следующих веществ:
а) NaCl б) O2 в) HF
Тесты по теме «Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома» (вариатив)
Модуль по теме «Вещество», подразделу «Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома.», уроку «Контрольная работа по теме «Периодический закон и периодическая система химических элементов Д. И.Менделеева и строение атома»»
И.Менделеева и строение атома»»
Тип: Контрольный;
версия: 1.0.0.2 от 24.02.2009
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Категория пользователей
Обучаемый, ПреподавательКласс
8Контактное время
15 минутИнтерактивность
ВысокаяДисциплины
Химия / Неорганическая химия / Понятия, определения и законы неорганической химии / Периодический закон и периодическая система химических элементов Д. И.Менделеева. Строение атома
/ Периодический закон и периодическая система химических элементов Д.И.Менделеева. Характеристика химического элемента по его положению в Периодической системе
И.Менделеева. Строение атома
/ Периодический закон и периодическая система химических элементов Д.И.Менделеева. Характеристика химического элемента по его положению в Периодической системе Статус
Завершенный вариант (готовый, окончательный)Тип ИР сферы образования
Контрольный модульМесто издания
МоскваЯзык
РусскийКлючевые слова
тестыАвтор
Издатель
Правообладатель
Морозов Михаил Николаевич
Марийский государственный технический университет
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл. , 3,
, 3,
Сайт — http://www.mmlab.ru
Эл. почта — [email protected]
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул. , 51
, 51
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/htmlОбъем цифрового ИР
1 474 126 байтПроигрыватель
OMS-player версии от 2.0Категория модифицируемости компьютерного ИР
открытыйПризнак платности
бесплатныйНаличие ограничений по использованию
есть ограниченияРубрикация
Ступени образования
Основное общее образованиеЦелевое назначение
УчебноеТип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)Классы общеобразовательной школы
8Уровень образовательного стандарта
ФедеральныйХарактер обучения
Базовое▶▷▶ контрольная работа строение атома химическая связь 8 класс химия
▶▷▶ контрольная работа строение атома химическая связь 8 класс химияконтрольная работа строение атома химическая связь 8 класс химия — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по химии 8 класс на тему » Строение атома infourokru/kontrolnaya-rabota-po-himii-klass-na Cached › Тесты › Контрольная работа по химии 8 класс на тему » Строение атома » , » Химическая связь » Контрольная работа по химии 8 класс на тему » Строение атома » , » Химическая связь » Контрольная работа по теме «Периодический закон и infourokru/kontrolnaya-rabota-po-teme-periodic Cached 8 класс Контрольная работа № 4 по теме «ПЗ и ПСХЭ Строение атома Химическая связь » КОНТРОЛЬНАЯ РАБОТА «СТРОЕНИЕ АТОМА ХИМИЧЕСКАЯ СВЯЗЬ» | Химия iighjghblogspotcom/2012/04/blog-post_19html Cached 1 Дать характеристику элементам по положению в периодической системе по плану: название, химический знак, относительная атомная масса, порядковый номер, номер периода, большой или малый, номер группы, главная или Контрольная работа по химии 8 класс «Строение атома и pedportalnet/starshie-klassy/fizkultura-i-sport/ Cached Контрольная работа по химии 8 класс » Строение атома и химическая связь » (Физкультура и спорт) Учебное пособие для учителей Контрольная работа №1 по теме «Строение атома, химическая multiurokru/files/kontrol-naia-rabota-1-po Cached Контрольная работа №1 по теме « Строение атома , химическая связь » 2 варианта с ответами и шкалой оценивания Контрольная работа №1 химия 8 класс «Атомы химических multiurokru/files/kontrol-naia-rabota-1-khimiia Cached Контрольная работа №1 по химии в 8 классе «Атомы химических элементов, химическая связь » На выполнения контрольной работы по химии дается 40 минут 11 класс Химия Контрольная работа по теме «Строение атома wwwkursotekaru/course/5414 Cached Контрольная работа по теме « Строение атома Химическая связь Агрегатное состояние вещества» (за 1-ое полугодие) Контрольная работа по химии в 8-м классе по теме «Строение открытыйурокрф/статьи/570737 Cached Контрольная работа по химии в 8 -м классе по теме » Строение атома Химическая связь и её образование в химической реакции» Контрольная работа по химии «Строение атома» 8 класс uchitelyacom/himiya/131016-kontrolnaya-rabota-po-himii Cached Скачать Контрольная работа по химии » Строение атома » 8 класс Ионная химическая связь » 11 Контрольная работа №1 по химии 8 класс по теме «Атомы kopilkaurokovru/himiya/testi/kontrol-naia Cached Контрольная работа №1 по химии в 8 классе «Атомы химических элементов, химическая связь » Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 17,500 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
контрольная работа строение атома химическая связь 8 класс химия — Все результаты Контрольная работа по химии 8 класс на тему » Строение атома › Химия Похожие материалов Контрольная работа №1 по теме: « Строение атома » 8 класс Вариант 1 Контрольная работа №2 по теме: « Химическая связь » 8класс Контрольная работа по химии для 8 класса по теме: Строение › Химия 17 мая 2018 г — Cкачать: Контрольная работа по химии для 8 класса по теме: Строение атома и виды химической связи К/р «Строение атома, химическая связь» — Инфоурок › Химия 6 окт 2016 г — Контрольная работа по химии « Строение атома Химическая связь » Контрольная работа по 8 класс 1 вариант 8 класс 2 вариант 1 Контрольная работа по теме «Строение атома Химическая связь › Химия Похожие 26 нояб 2015 г — Скачать: Контрольная работа по теме » Строение атома Химическая связь «, 8 класс « Строение атома Химическая связь » 8 класс Вариант 1 Какой вид химической связи в Na2S (сульфиде натрия)? 1) ионная Контрольная работа по химии в 8-м классе по теме «Строение открытыйурокрф/статьи/570737/ Целью занятия является проверка знаний и умений по темам « Строение атома Химическая связь и её образование в химической реакции» Контрольная работа 8 класс Тема: Строение атома Химическая 24 мар 2017 г — Контрольная работа 8 класс Тема: Строение атома Химическая связь Простые вещества Перейти к файлу Заказать учебную [DOC] «Строение атома Химическая связь» 150vosk-ximikedusiteru/DswMedia/krabota-1doc Похожие КОНТРОЛЬНАЯ РАБОТА №1 ( 8класс ) Определить вид химической связи ( ионная, металлическая, ковалентная полярная или неполярная) Записать Строение атома Химическая связь — Мультиурок 12 янв 2016 г — В данной разработке представлен тематический контроль для десятого класса по теме строение атома и химическая связь в двух [DOC] Контрольная работа по химии в 8 классе по теме: «Строение wwweduportal44ru//Контрольная%20работа%20по%20химии%208%20класс% Контрольная работа по химии в 8 классе по теме: « Строение атома Химическая связь » 1 вариант Расположите элементы в порядке возрастания Варианты контрольной работы в 8 классе по теме «Строение 2 окт 2016 г — Варианты контрольной работы в 8 классе по теме » Строение атома » Сколько протонов, нейтронов и электронов содержит атом Al Для формул приведенных веществ, определите вид химической связи : Контрольная работа по химии 8 класс «Строение атома и 27 окт 2014 г — Методическая разработка по химии ( 8 класс ) по теме: Контрольная работа по химии 8 класс » Строение атома и химическая связь » Тест по химии (8 класс) на тему: Строение атома Виды 19 мар 2015 г — Типы кристаллических решеток» в 8 классе , состоит из частей А тест по темам » Строение атома , виды химической связи , типы Контрольная работа по химии 8 класс » Строение атома и химическая связь » Тест по химии (8 класс) на тему: Тест quot;Строение атома 4 янв 2013 г — Два варианта контрольного теста по темам » Строение атома Закономерности таблицы ДИМенделеева Химическая связь » В тесте Контрольная работа по теме: «Строение атома Химическая связь :4/ 16 мая 2015 г — Работа по теме: Строение атома и химическая связь Глава: атомов следующих химических элементов: железо, иттрий, неон, барий Многовариантная контрольная работа по теме «Строение атома Похожие 14 нояб 2016 г — Контрольные / проверочные работы для учителя-предметника для 8 класса по Типы химической связи » ( 8 класс , базовый уровень) Картинки по запросу контрольная работа строение атома химическая связь 8 класс химия «cl»:12,»cr»:6,»ct»:3,»id»:»Xk3UvcU7Phtw0M:»,»ml»:»600″:»bh»:90,»bw»:72,»oh»:903,»ou»:» \u003d1390980113″,»ow»:638,»pt»:»imageslidesharecdncom/8-140129072034-phpapp01/95″,»rh»:»mari-tuzru»,»rid»:»u7t8Nafsh7nm2M»,»rt»:0,»ru»:» \u003dkontrolnaya-rabota-po-himii-stroenie-atoma-8-klassa»,»sc»:1,»th»:102,»tu»:» \u003dtbn:ANd9GcQijI_kLJr6Fd0pIsK5r074eB5AQ-vZ4VF0adzvByBPACCWIp8RJc3x6g»,»tw»:72 «cb»:3,»cl»:3,»cr»:3,»id»:»hKLlDrRwfEKonM:»,»ml»:»600″:»bh»:90,»bw»:120,»oh»:542,»ou»:» «,»ow»:643,»pt»:»arhivurokovru/multiurok/d/d/e/dde2ae5552dc4375a8a»,»rh»:»multiurokru»,»rid»:»SNsq8czfrkABtM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Мультиурок»,»th»:101,»tu»:» \u003dtbn:ANd9GcQTr35sA8ccQEK-Nor8ialLktgkhHZJUw7DJthgOsrKbgEmA8v_WmbvoQ»,»tw»:120 «id»:»5ZREJEmXefyQ2M:»,»ml»:»600″:»bh»:90,»bw»:131,»oh»:480,»ou»:» «,»ow»:640,»pt»:»arhivurokovru/kopilka/uploads/user_file_54681f81a»,»rh»:»kopilkaurokovru»,»rid»:»Jbs0j8E8UeaA7M»,»rt»:0,»ru»:» «,»sc»:1,»th»:98,»tu»:» \u003dtbn:ANd9GcSnDkjl6OYECh56jYOAMesNRm6UNRQl8oZj6JuC0PyGT_xUkMVIUSR-GlI»,»tw»:131 «id»:»wi7xFWJqcF0gDM:»,»ml»:»600″:»bh»:90,»bw»:131,»oh»:720,»ou»:» «,»ow»:960,»pt»:»ds03infourokru/uploads/ex/02f7/000630fe-9e01087a»,»rh»:»infourokru»,»rid»:»Lf6l_4297dPpbM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:98,»tu»:» \u003dtbn:ANd9GcRE7O6trRGmEMYkwf6n9KQLi_MqOI1S6Y5Z3b85yu7rYhu7cdCtXZHgpFUF»,»tw»:131 «id»:»FEr5a-NxGLkX6M:»,»ml»:»600″:»bh»:90,»bw»:130,»oh»:720,»ou»:» «,»ow»:960,»pt»:»ds03infourokru/uploads/ex/02f7/000630fe-9e01087a»,»rh»:»infourokru»,»rid»:»Lf6l_4297dPpbM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:98,»tu»:» \u003dtbn:ANd9GcRoE6X74q4sjcszZPyRjIMxLATps9zbMikM-V_gU5EIrhGTOaeyVYAKafiH»,»tw»:130 Другие картинки по запросу «контрольная работа строение атома химическая связь 8 класс химия» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты 11 класс Химия Контрольная работа по теме «Строение атома Похожие Химия Контрольная работа по теме « Строение атома Химическая связь Первоначальные химические представления Биология и химия 8 класс 10 класс Химия Контрольная работа Классы неорганических веществ Тема 9 «Строение атома Периодический закон и периодическая › Архив › Химия › Средняя школа Периодический закон и периодическая система химических элементов Д И Менделеева (ПСХЭ)» Проверочные работы уменьшается радиус атомов,; увеличивается прочность связи электронов с ядром (энергия ионизации) Периодический закон — Периодический закон и строение атомов 8 –9 класс КОНТРОЛЬНАЯ РАБОТА «СТРОЕНИЕ АТОМА ХИМИЧЕСКАЯ iighjghblogspotcom/2012/04/blog-post_19html Похожие 24 апр 2012 г — Строение атома : заряд ядра, число электронов вокруг ядра, число протонов, Определить вид химической связи (ионная, металлическая, Готовимся к итоговой контрольной работе по химии за 8 класс [DOC] Химическая связь Строение веществ — Электронное образование Похожие Рабочая программа по химии 8 класса составлена на основе: Строение электронных оболочек атомов химических элементов малых периодов ( № 1- 20) Понятие об 9/27, Контрольная работа № 2 « Химическая связь Контрольная работа по Химии «Периодический закон, строение › Химия 9 июн 2017 г — Химическая связь Классы по теме: «Периодический закон, строение атома Контрольная работа по химии за 3 четверть 8 класс Контрольная работа по теме «Периодическая система химических 31 мая 2017 г — Химическая связь »Цели урока:1) контроль за качеством усвоения учебного Урок химии в 8 классе (с использованием технологии [DOC] Рабочая программа — Константиновская средняя (1_chas)docx РАБОЧАЯ ПРОГРАММА по ХИМИИ (профильный уровень) 11 класс от их состава и строения; природу химической связи (ионной, ковалентной, системы химических элементов с теорией строения атомов Контрольные работы , Практические работы 2/ 8 , Металлическая и водородная связь Контрольная работа к уроку химии «Строение атома Химическая 30 мар 2013 г — Химическая связь Контрольная работа к уроку химии » Строение атома Работа предназначена для учащихся 11 класса, занимающихся по программе и учебнику ОСГабриеляна Геометрия — 8 класс Часть 5 Контрольная работа по Химии «Периодический закон, строение Похожие Скачать к уроку химии Контрольная работа по Химии «Периодический закон, строение атома Химическая связь Классы неорганических соединений» 9 Контрольная работа по химии 8 класс Строение атома и 27 нояб 2017 г — Контрольная работа по химии 8 класс Строение атома и по 4 колонкам в зависимости от типа химической связи : CF4, C4H8 , Fe, HCl Контрольная работа по химии строение атома 8 класса — всё для mari-tuzru/?ojj=kontrolnaya-rabota-po-himii-stroenie-atoma-8-klassa Контрольная работа по химии в 8 -м классе по теме » Строение атома Химическая связь и её образование в химической реакции» Контрольная работа обобщающий урок в 8 классе по теме: «строение атома и docplayerru/56216249-Obobshchayushchiy-urok-v-8-klasse-po-teme-stroenie-atoma Периодический закон и периодическая система химических элементов ДИ Менделеева «Кто быстрее?» (6 баллов) 1Это было Кроссворд « Строение атома » (работа в паре) ( 8 баллов) 1 Подготовиться к контрольной работе Химические связи и реакции в основании материальной структуры мира Тест по теме: «Строение атома и химическая связь» Инструкция Тест по теме: « Строение атома и химическая связь » Инструкция Ковалентная полярная связь и степени окисления химических элементов -3 и +1 в [DOC] Календарный план — РГУ нефти и газа wwwgubkinru/faculty/chemical_and_environmental/chairs/planzandoc Похожие Текущий контроль по теме «Первоначальные понятия химии » 2 Правила Лабораторная работа №1 Часть 1 « Классы неорганических соединений Свойства Изучение теории по темам: « Строение атома Химическая связь », «Химическая кинетика и химическое равновесие» 1 контрольная неделя Контрольная работа по химии в 8 классе по теме: «Строение pandiaru/text/80/453/61067php Вид работы – контрольная работа Предмет – химия Класс – 8 Тема, время на выполнение – « Строение атома Химическая связь », 1 урок (40 минут) Цель и критерии оценивания: проверка знаний, умений, навыков по указанной [DOC] Рабочая программа по химии 8 класс skola10ru/wp-content/uploads/2014//Рабочая-программа-по-химии-8-классdocx Изучение химии в 8 классе направлено на достижение следующих целей: освоение основные сведения о строении атомов химических элементов малых периодов, процесс, химическая связь , химическая реакция и её классификации, Контрольная работа №1 «Первоначальные химические понятия» Строении атомов Химическая связь» Обобщающий урок химии в 8 wwwmysharedru/slide/859151/ Химическая связь » Обобщающий урок химии в 8 классе Выполнила учитель МБОУ Презентация 8 класса по предмету » Химия » на тему: «« Строении атомов Подготовка к контрольной работе « Атомы химических элементов строение атома химическая связь 31 вариант 5 VIII A 5 I B 7 III B7 › 5 — 9 классы › Химия 31 вариант 5 VIII A 5 I B 7 III B7 SeO3, Na2, S 5 — 9 классы · Химия ; 5 баллов Строение атома химическая связь 31 вариант 5 VIII A 5 I B 7 III B7 [PDF] Untitled soshcem66ucozru/newdocuments/zamena/khimija7-9_combinepdf окисления элемента в соединениях, тип химической связи в соединениях, возможность строения атомов первых 20 элементов периодической системы ДИМенделеева; 8 класс (68 часов) Контрольная работа по теме [PDF] РАБОЧАЯ ПРОГРАММА предмета «Химия» для 8 класса edumariru//Рабочая%20программа%20по%20химии%20%208%20классpdf химических элементов, строение и свойства веществ и сущности Контрольная работа №4 « Строение атома Основные виды химической связи , Рабочая программа Химия 8 кл tim-rogru/obychenie/metod-kopilka//129-rabochaya-programma-ximiya-8-klhtml Рабочая программа по химии для 8 класса составлена на основе Федерального Л МБрейгер Контрольные и самостоятельные работы по химии для 8 класса система химических элементов ДИМенделеева Строение атома 10 — — 7 Строение вещества Химическая связь 10 — 1 8 Закон Авогадро Украинцева И | Программа по учебнику «Химия — 8» ОС him1septemberru/articlephp?ID=200400103 Похожие Для работы в своей школе я выбрала программу для 8 –11-х классов мы рассматриваем связь между строением атома химического элемента и [DOC] Тема 7 Строение веществ Химическая связь (9 ч) schooltmn67ru/FOTO/DOKI/rab_xim_89docx Настоящая рабочая программа по химии для 8 -9 класса составлена в соответствии с групповые, фронтальные формы работы учащихся через самостоятельную, и контрольных работ соответствует Примерной программе по химии химических элементов ДИ Менделеева Строение атома – 8 часов 8 класс Контрольная работа по теме «Атомы химических элементов» Похожие 8 янв 2015 г — 8 класс Контрольная работа по теме «Атомы химических элементов» указывает в строении атома Указать вид химической связи [DOC] Химическая связь engschool30narodru/ximiadocx Рабочая программа по химии 11 класса разработана на основе 1, Контрольная работа №1 по темам « Строение атома », « Химическая связь », «Вещество» 8 Химия 11 кл: Контрольные и проверочные работы к учебнику ОС [PDF] тематическое планирование — ГБОУ школа №430 school430ru/DswMedia/2_%2011_chemipdf Похожие образования, а также программы курса химии для 8 -11 классов общеобразовательных Тема 1 Строение атома и периодический закон ( 5ч) Атом – сложная частица Состояние связь Обобщение Химическая связь Единая природа химической связи Контрольная работа № 2« Химические реакции» Контрольные работы Тесты — сайт учителя биологии и химии keramikosru/tablephp?ap=table1000305 Похожие СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д И МЕНДЕЛЕЕВА 9005575, Электронная Радиоактивность ХИМИЧЕСКАЯ СВЯЗЬ Задачи на дом 8 класс 9005562, Контрольная работа Атомы химических элементов [DOC] Рабочая программа по химии 8-9 класс — Главная школа-26рф/images/uh_prog/TP_himia_baza_8-9doc Тематическое планирование по химии для 8 класса (2 часа в система химических элементов Д И Менделеева и строение атомов Ковалентная полярная связь Контрольная работа по теме «Атомы химических элементов Контрольная работа по теме Строение атома Химическая связь, 8 5 сент 2017 г — Контрольная работа по теме Строение атома Химическая связь , 8 класс Какой вид химической связи в Na2S (сульфиде натрия)? Урок №58 Контрольная работа №4 по темам « Периодический Похожие Звонок на урок 8 класс — первый год обучения Урок №58 Контрольная работа №4 по темам « Периодический закон и Периодическая система химических элементов Д И Менделеева Строение атома » и « Химическая связь Напишите формулы этих веществ и определите тип химической связи [DOC] «Согласовано» «Утверждаю» Тематическое планирование курса « Химия » 8 класс Контрольная работа №1 « Строение атома химических элементов» 3 Металлическая связь Сборник контрольных и самостоятельных работ по химии 7—9 классы Татьяна Масловская , Елена Пашуто , Евгения Власовец — 2018 — Study Aids 4 Контрольная работа 2 по теме « Химические реакции Типы химических реакций» 54 8 класс Контрольная работа1 по теме « Строение атома и Задания по химии Демоверсия контрольной работы №1 по химии «Основные химические понятия Задания по типам связи и степени окисления · (просмотр)»/ ( 8 класс ) «Вещество: строение атома , строение вещества», 8 класс (1401 2016, doc) [DOC] Химия 8 класс Г Е Рудзитис, Ф Г Фельдман 68 часов/год 2 часа wwwsaasmarru/images/uploads/all/8_класс_4_четвертьdocx Учебник: Химия 8 класс ТЕМА 7ПЕРИОДИЧЕСКИЙ ЗАКОН И СТРОЕНИЕ АТОМА (5 ч) ТЕМА 8СТРОЕНИЕ ВЕЩЕСТВА ХИМИЧЕСКАЯ СВЯЗЬ (7 ч) 81 160516, Подготовиться к контрольной работе (повторить § 49—57) Вместе с контрольная работа строение атома химическая связь 8 класс химия часто ищут контрольная работа по теме строение атома 8 класс ответы контрольная работа по теме строение атома химическая связь окислительно восстановительные реакции контрольная работа по теме строение атома химическая связь 11 класс контрольная работа по химии 8 класс химическая связь строение вещества контрольная работа по химии строение атома 11 класс контрольная работа по химии 8 класс химическая связь ответы контрольная работа по химии 8 класс типы химической связи задания по химии 8 класс строение атома Навигация по страницам 1 2 3 4 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
▶▷▶ контрольная работа по химии по теме электронное строение атома
▶▷▶ контрольная работа по химии по теме электронное строение атомаконтрольная работа по химии по теме электронное строение атома — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по химии на тему «Строение атома» (10 класс) infourokru/kontrolnaya-rabota-po-himii-na-temu Cached 10 класс Контрольная работа 1 по теме Строение атома Вариант 1 Часть А (2балла) Электроны были о ткрыты : Контрольная работа по теме «Строение атома» химия 11 класс infourokru/kontrolnaya-rabota-po-teme-stroenie Cached Контрольная работа №1 « Строение атома » 11 класс Вариант 1 1 Число подуровней на втором уровне равно Контрольная работа по химии по теме «Строение атома», 8 класс pedportalnet/starshie-klassy/raznoe/kontrolnaya Cached Контрольная работа по химии по теме » Строение атома «, 8 класс (Разное) Учебное пособие для учителей регистрация Вход Проверочная работа по химии в 11 классе по теме «Строение атома» znanioru/media/proverochnaya_rabota_po_himii_v Cached Проверочная работа по химии в 11 классе по теме » Строение атома » Данная работа предназначена для проверки теоретических знаний учащихся 11 класса по теме » Строение атома » в профильных классах Контрольная работа по химии 8 класс по теме «Строение атома» studydocru/doc/251886/kontrol_naya-rabota-po-himii-8 Cached Контрольная работа №1 по теме : «Атомы химических Алгоритм характеристики химического элемента на основании Задание к практике № 2 » Строение атома и периодический закон» Контрольная работа «Строение атома» 11 класс скачать uchitelyacom/himiya/24954-kontrolnaya-rabota-stroenie Cached Скачать Контрольная работа » Строение атома » 11 класс После того как вы поделитесь материалом внизу появится ссылка для скачивания Контрольная работа №1 по теме «Строение атома, химическая multiurokru/files/kontrol-naia-rabota-1-po Cached Просмотр содержимого документа « Контрольная работа №1 по теме « Строение атома , химическая связь» 2 варианта с ответами и шкалой оценивания» Контрольная работа №1 по темам «Строение атома и wwwprodlenkaorg/metodicheskie-razrabotki/ Cached Контрольная работа №1 по темам » Строение атома и Периодический закон», » Строение вещества» 11 класс (базовый уровень) Контрольная работа по химии «Строение атома» 8 класс uchitelyacom/himiya/131016-kontrolnaya-rabota-po-himii Cached Контрольная работа » Строение атома и атомного ядра» 9 класс 5-06-2017, 21:55 Контрольная работа по химии » Строение и классификация органических Урок химии в 8-м классе по теме:»Строение электронной открытыйурокрф/статьи/519931 Cached Урок химии в 8-м классе по теме :» Строение электронной оболочки атома Электронные конфигурации атомов» Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 30,100 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
контрольная работа по химии по теме электронное строение атома — Все результаты Контрольная работа по химии на тему «Строение атома» (8 класс) › Химия 13 февр 2018 г — Контрольная работа по теме : « Строение атомов » Число заполняемых электронных слоев в электронной оболочке атома равно Контрольная работа по химии для 8 класса по теме: Строение › Химия 17 мая 2018 г — Контрольная работа по химии для 8 класса по теме : Строение атома и виды Атомы каких химических элементов имеют электронные Контрольная работа по химии 8 класс на тему » Строение атома › Химия Похожие Контрольная работа №1 по теме : « Строение атома » Составьте электронные и структурные формулы молекул: а) азота N 2; б) фтороводорода Н F Контрольная работа по химии на тему «Строение атома › Химия Похожие 12 окт 2016 г — Контрольная работа по химии на тему » Строение атома Запишите формулу состава атома, электронную конфигурацию и ячеистую Контрольная работа№3 по теме: «Электронное строение атомов №3-по-теме-электр/ 21 мар 2017 г — Контрольная работа №3 по теме : « Электронное строение атомов химических элементов» ПО ДИСЦИПЛИНЕ « ХИМИЯ » ОУД06 Химия Картинки по запросу контрольная работа по химии по теме электронное строение атома «cb»:3,»cl»:6,»ct»:3,»id»:»zkW4BdT1Yi3BmM:»,»ml»:»600″:»bh»:90,»bw»:98,»oh»:181,»ou»:» «,»ow»:185,»pt»:»ds04infourokru/uploads/ex/01f0/000cd32f-ca8cd951″,»rh»:»infourokru»,»rid»:»q4KOczBUj_abUM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:96,»tu»:» \u003dtbn:ANd9GcQRz9HS2RBwRClmYFVd0KbMfMoLuWmXrIOoGgpdRWWovOfquz2JNE5jX_Y»,»tw»:98 «cb»:3,»cl»:3,»id»:»6RFJerX2jAaYmM:»,»ml»:»600″:»bh»:90,»bw»:93,»oh»:179,»ou»:» «,»ow»:178,»pt»:»ds04infourokru/uploads/ex/01f0/000cd32f-ca8cd951″,»rh»:»infourokru»,»rid»:»q4KOczBUj_abUM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:94,»tu»:» \u003dtbn:ANd9GcR9WFOmXOvknF4o3NJwcGj_oG3TWQpGfp4Y8_M6DqATwNZdAQqM7cMS85k»,»tw»:93 «cb»:3,»cl»:3,»cr»:6,»ct»:3,»id»:»XCtDHNSrs455EM:»,»ml»:»600″:»bh»:90,»bw»:98,»oh»:192,»ou»:» «,»ow»:197,»pt»:»rusolverbookcom/my_images/pic2464jpg»,»rh»:»rusolverbookcom»,»rid»:»iQEz8-rWujDrFM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»SolverBook»,»th»:96,»tu»:» \u003dtbn:ANd9GcTFQoiaGYyFKe3zn_S4cFPMKFmMiHzyjLSWVj9YFAgXjERk3J2J1DqdCg»,»tw»:98 «cb»:3,»cr»:3,»ct»:6,»id»:»Te56hOX4Af_SbM:»,»ml»:»600″:»bh»:90,»bw»:97,»oh»:256,»ou»:» «,»ow»:250,»pt»:»rusolverbookcom/my_images/pic2367jpg»,»rh»:»rusolverbookcom»,»rid»:»FdPyozFjA9nUyM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»SolverBook»,»th»:99,»tu»:» \u003dtbn:ANd9GcTlOrxcOIWM-80l0tXucwCt6dmidtangRyf4gR6L7fB83G9nhupmYeQyg»,»tw»:97 «cl»:3,»cr»:6,»id»:»cbRQUIdVs08U_M:»,»ml»:»600″:»bh»:90,»bw»:95,»oh»:253,»ou»:» «,»ow»:263,»pt»:»rusolverbookcom/my_images/pic2399jpg»,»rh»:»rusolverbookcom»,»rid»:»_RSfGRjcxUW-lM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»SolverBook»,»th»:94,»tu»:» \u003dtbn:ANd9GcR5uUtTbhour5P-BeLaQEugZ8b3rRb_g9in_QwNYn4h3_dioB3JvtS4eA»,»tw»:98 «cl»:3,»cr»:3,»ct»:3,»id»:»SrlzAfpBJ_rlAM:»,»ml»:»600″:»bh»:90,»bw»:99,»oh»:181,»ou»:» «,»ow»:192,»pt»:»rusolverbookcom/my_images/pic2483jpg»,»rh»:»rusolverbookcom»,»rid»:»eIG0G1XVZTb9eM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»SolverBook»,»th»:93,»tu»:» \u003dtbn:ANd9GcSr4hZLQMD3pPjw_NY3lRCGQp20AzIBEP0tWqPe_SwW9Halv8TvIjRkLvQ»,»tw»:99 Другие картинки по запросу «контрольная работа по химии по теме электронное строение атома» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты Многовариантная контрольная работа по теме «Строение атома Похожие 14 нояб 2016 г — Учебно-дидактические материалы по Химии для 8 класса по УМК ОС Многовариантная контрольная работа по теме « Строение атома Составьте схемы образования химической связи ( электронные и Тема 9 «Строение атома Периодический закон и периодическая › Архив › Химия › Средняя школа Урок по теме Тема 9 Периодический закон и периодическая система химических элементов Д И Примеры электронного строения атомов : Тест по химии (8 класс) по теме: Строение атома 8 класс | скачать 26 июл 2012 г — Проверочная работа, которая предназначена для теущего Укажите химический элемент, атомы которого имеют электронную формулу Контрольная работа по химии по теме » Строение атома «, 8 класс Контрольная работа по химии 8 класс «ПСХЭ ДИ Менделеева 20 мая 2017 г — Контрольная работа по химии 4 четверть Перриодическая система химических элементов ДИ Менделеева, строение атома , виды Контрольная работа по теме: «Строение атома Химическая связь :2/ 16 мая 2015 г — Работа по теме : Строение атома и химическая связь Глава: Напишите электронные конфигурации атомов следующих химических Контрольная работа по химии по теме электронное строение атома Электронное строение атома 8мин Контрольная работа по химии , 8 класс для проведения контрольной работы №1 по теме «Атомы химических Проверочная работа по теме: «Строение атома» 8 класс — Документ Документ — нейтронов и электронов в изотопах: Проверочная работа по теме : « Строение атома » 8 класс Вариант 3 Составьте схему электронного Варианты контрольной работы в 8 классе по теме «Строение 2 окт 2016 г — Дайте определение понятиям: химия , простое вещество, химическое явление 2 содержит атом Al Запишите электронную структуру атома 5 Контрольная работа по теме : Строение атома и вещества [DOC] Контрольная работа по химии в 8 классе по теме: «Строение wwweduportal44ru//Контрольная%20работа%20по%20химии%208%20класс% Контрольная работа по химии в 8 классе по теме : « Строение атома системе, неумеют составлять электронные схемы, электронные формулы, [DOC] Контрольная работа 8 класс wwweduportal44ru//Кодификатор%20для%20кр%208%20класс%20ФГОСdoc Электронное строение атома 8мин Контрольная работа по химии , 8 класс для проведения контрольной работы №1 по теме «Атомы химических элементов» Строение электронных оболочек атомов первых 20 элементов Строение атома кальция (Ca), схема и примеры — SolverBook rusolverbookcom › Справочник › Химия › 11 класс › Строение атома Похожие Электронное строение атома кальция в химии , Ca Схема строения атома кальция: состоит из положительно заряженного ядра (+20), внутри которого 20 протонов Контрольные работы на заказ Решаем контрольные по всем [PDF] Рабочая программа Химия 10-11 классы (ФГОС) — «Средняя school50beluo31ru/wp/Рабочая-программа-Химия-10-11-классы-ФГОСpdf дается практическая и контрольная работы Соответственно « Химия 11 класс» Тема 1 Строение атома и периодический закон Д И Менделеева (2/ 4 ч) Особенности строения электронных оболочек атомов элементов 4-го Электронное строение атома для студентов всех форм обучения Электронное строение атома для студентов всех форм обучения Контрольная работа по курсу химии выполняется по индивидуальному варианту, Далее следует разобраться с типовыми задачами по изучаемой теме , Контрольная работа по теме «Строение атома» | Doc4webru Похожие Скачать к уроку химии Контрольная работа по теме « Строение атома » Электронная формула внешнего электронного слоя атома химического Украинцева И | Программа по учебнику «Химия — 8″ ОС him1septemberru/articlephp?ID=200400103 Похожие Для работы в своей школе я выбрала программу для 8–11-х классов Начинается изучение предмета химии с темы «Введение в химию», мы рассматриваем связь между строением атома химического элемента и Электронные орбитали и электронные формулы атомов 14 Контрольная работа [DOC] РАЗВЁРНУТЫЙ ТЕМАТИЧЕСКИЙ ПЛАН 11 КЛАСС Тема №1 Похожие Знать:сущность понятий электронная орбиталь и электронное облако, формы орбиталей,взаимосвязь номера Электронная конфигурация атомов химических элементов Контрольная работа №1 по теме « Строение атома » [DOC] Химия 8 класс Г Е Рудзитис, Ф Г Фельдман 68 часов/год 2 часа wwwsaasmarru/images/uploads/all/8_класс_4_четвертьdocx Календарно-тематическое планирование по химии ТЕМА 7 ПЕРИОДИЧЕСКИЙ ЗАКОН И СТРОЕНИЕ АТОМА (5 ч) схемы образования ионных соединений и их электронные формулы Пони- Контрольная работа по темам [XLS] Маршруты (осенний семестр 2012/2013) Похожие 10, Контрольная работа Опрос Продолжение Контрольная работа по всей теме Опрос Электронное строение атома атомных орбиталей [DOC] по проведению тематической диагностической работы № 1 krasnogvard-nmcspbru/ZIP/Chim_DR1-11-12zip?PHPSESSID Похожие Данная работа может заменить контрольную работу , проводимую в ОУ ТЕМА : Периодический закон и периодическая система химических элементов основных закономерностей строения атомов , свойств химических элементов и их соединений; (в электронном виде на адрес ingvik@yandexru) Подраздел 3 Периодический закон и периодическая система mmlabru/omschemcat/8p0drazdel23html Похожие Периодическая система химических элементов ДИ Менделеева, И, 103, 7 360- Тесты по теме » Строение электронных оболочек атомов элементов 1 -20″ Контрольная работа по теме «Периодический закон и периодическая Строение атома — Викиверситет Похожие 16 янв 2018 г — Эта статья — часть материалов: Аналитическая химия Размер атома полностью определяется размером его электронного облака, [PDF] K»^o»uoouý — Лицей ТГУ lyceumtsuru/wp-content/uploads/2017/09/химияpdf Электронное строение атома углерода, его валентные состояния безопасной работы со средствами бытовой химии Бытовая Тематическое планирование учебного материала 10 класс Номер темы Контрольная работа подготовка к контрольной работе по химии на тему строение атома wwwpaolochiariit//podgotovka-k-kontrolnoi-rabote-po-khimii-na-temu-stroenie-at подготовка к контрольной работе по химии на тему строение атома закон ДИМенделеева Контрольная работа » Строение атома » 11 класс скачать работа №1 по теме : Изобразите схему электронного строения атома Мg Химия: Контрольные работы Читать бесплатно онлайн в windoweduru/catalog/pdf2txt/743/64743/35834 Похожие Читать бесплатно книгу онлайн без регистрации в электронном виде на сайте Контрольная работа должна быть правильно и аккуратно оформлена: для СТРОЕНИЕ АТОМОВ И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ [DOC] Пояснительная записка Программа по химии предназначена для ciurru/uva/uva_sot/DocLib2/рабочие%20программы/химия%2011%20Аdocx 3, Электронные конфигурации атомов химических элементов, Особенности строения 8, Контрольная работа №1 по теме : Строение атома » II Контрольная работа по химии в 8-м классе по теме «Строение открытыйурокрф/статьи/570737/ Целью занятия является проверка знаний и умений по темам « Строение атома Химическая связь и её образование в химической реакции» Контрольная работа по химии 9 класс — Знанио Строение атома Строение электронных оболочек атомов первых 20 элементов Периодической системы ДИ Менделеева Периодический закон и 10 класс Химия Электронное строение атома углерода — Курсотека Похожие Химия 10 класс Химия Электронное строение атома углерода Химия 7 класс Биология Тематическая контрольная работа Черви Биология Контрольная работа «ПСХЭ и строение атома» 11 класс Вариант 2 Контрольная работа по теме «Неорганическая химия » Вариант I А-1 Зная формулу внешнего электронного слоя атома химического элемента — 3s Результаты поиска по «строение атома» — Руконт Данная работа представляет собой базой курс лекций по трем Каждая тема оснащена контрольными вопросами и заданиями, а также содержит Предпросмотр: Строение атома и периодическая система химических химии Электронное строение атома азота N 2s22p3 (донор) У атома азота есть Контрольная работа по химии по теме « Строение атома» 11 Контрольная работа по химии по теме « Строение атома » 11 класс А1 Какую электронную конфигурацию имеет атом наиболее активного металла ? [PDF] СТРОЕНИЕ АТОМА И ХИМИЧЕСКАЯ СВЯЗЬ libmadiru/fel/fel1/fel14E211pdf Похожие автор: АА ЛИТМАНОВИЧ — Похожие статьи задач, предлагаемых студентам МАДИ (ГТУ) на контрольных и экзаменационных теме « Строение атома и химическая связь» общего курса химии , изучаемого же элемента имеют одинаковое электронное строение, а сами [DOC] Тематическое планирование уроков химии в 11 классе — Ледовская sovetskii672edusiteru/DswMedia/11klassdoc Знать: электронное строение атомов , правило и принципы заполнения Подготовка к контрольной работа по теме «Строение вещества» Решение [PDF] Общая и неорганическая химия электронные и электронно-графические формулы атомов химических элементов; По прохождении курса «Общая и неорганическая химия » студенты должны знать: Выполнение индивидуального задания по теме : « Основные понятия и законы химии » Контрольная работа № 3 « Строение атома и Ответы MailRu: Контрольная работа по химии № 4 по теме Химия › Домашние задания › Другие предметы Похожие Составьте электронные формулы для атомов кальция и алюминия какой из этих элементов является более сильным восстановителем? Почему? PS Электронное строение атомов | Химия Четвёртый год изучения iighjghblogspotcom/2012/03/blog-post_7499html 20 мар 2012 г — Электронное строение атомов You might also like: Интерактивные модели строения атомов · Linkwithin Ярлыки: Тема 10 Периодический закон Готовимся к итоговой контрольной работе по химии за 8 класс Практическая работа «Получение этилена и изучение его свойств» [DOC] Атомы химических элементов shkola-kosjuvomucozru/PROGRAMMA/khimijadocx Чтобы провести практическую работу по когда-то изученной теме , требуется Электроны Строение электронных оболочек атомов химических элементов №1-20 Контрольная работа №1 « Атомы химических элементов» 1 строение атома и периодический закон контрольная работа 8 класс wwwaluminium-indiaorg//stroenie-atoma-i-periodicheskii-zakon-kontrolnaia-rabot строение атома и периодический закон контрольная работа 8 класс Cached Контрольная работа по химии на тему » Строение атома и периодический Электронное строение атома Контрольная работа по химии , 8 класс Контрольные работы по химии — Айумка iumkaru/himiya/kontrolnye-raboty/ Контрольная работа по теме «Неметаллы» 9 класс Вариант 2 ЧАСТЬ А Тестовые Тест по химии по теме » Строение атома » Ответы Современные контрольная работа 1 по теме строение атома и — Ljudmila wwwljudmilaorg//kontrolnaia-rabota-1-po-teme-stroenie-atoma-i-stroenie-veshche контрольная работа 1 по теме строение атома и строение вещества которое может быть размещено на первом электронном уровне, равно 2-м, элемента Контрольная работа по химии 11 класс Тема : Строение атома [DOC] Химия» 11 класс (базовый уровень) Тема 2 Теория строения атома Периодический закон и Периодическая Описывать электронное строение атома с помощью электронных конфигураций 26, 9, Контрольная работа № 1 Тема 5 Химические реакции (15 ч) Тема 4 Строение атома Электронные формулы — Dist-TutorInfo Подготовка к ЕГЭ по химии Тема 4 Строение атома Электронные формулы атомов и ионов Основное и возбуждённое состояния Когда Вы будете [DOC] Тема 6 Периодический закон и периодическая система ozr-shkozeedumskoru/uploads/2000/1849/section/122375/rab/rphimiya_8docx Электроны Изотопы Строение электронных оболочек атомов первых 20 18, Контрольная работа № 1 по теме : «Первоначальные химические Kostuk_kh21: Контрольная работа № 2 по теме «Строение Контрольная работа по теме «Строение вещества» изобразите электронную схему образования химических связей в молекуле аммиака Изобразите схему строения атома этого элемента, его электронную конфигурацию, Вместе с контрольная работа по химии по теме электронное строение атома часто ищут контрольная работа по химии строение атома 11 класс контрольная работа по теме строение атома 8 класс ответы контрольная работа по химии 8 класс строение атома ответы контрольная работа по химии 11 класс строение атома с ответами контрольная работа номер 1 по теме строение атома периодический закон периодическая система химических элементов строение атома вариант 1 контрольная работа по теме строение атома ответы контрольная работа по химии 8 класс периодический закон и строение атома Навигация по страницам 1 2 3 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Контрольная работа «Строение атома.
 Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение вещества. Окислительно-восстановительные реакции.» 8 класс
Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение вещества. Окислительно-восстановительные реакции.» 8 классХимия. 8 класс. Тематическая контрольная работа | 0 |
Контрольная работа по ХИМИИ
по теме: «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение вещества.
Окислительно-восстановительные реакции.»
8 класс
II вариант
Инструкция по выполнению работы
На выполнение работы по химии отводится 40 минут. Работа состоит из двух частей и включает в себя 15 заданий.
Ответы к заданиям 1–12 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
Ответом к заданиям 13–14 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
На задание 15 следует дать полный развёрнутый ответ.
При выполнении заданий можно пользоваться черновиком. Записи в черновике не учитываются при оценивании работы.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, то можно вернуться к пропущенным заданиям.
Баллы, полученные Вами за все выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
Ответом к заданиям 1–12 является одна цифра, которая соответствует номеру правильного ответа. Запишите эту цифру в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1 справа от номера соответствующего задания.
Запишите эту цифру в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1 справа от номера соответствующего задания.
1
Какому химическому элементу она соответствует?
1) магния
2) кальция
3) лития
4) калия
2
1) и
2) и
3) и
4) и
3
1) общее число электронов
2) число завершенных энергетических уровней
3) число электронов на внешнем уровне
4) число протонов в ядре
4
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
5
1) усиливаются неметаллические свойства
2) уменьшаются металлические свойства
3) изменяется валентность в водородных соединениях
4) остается постоянной высшая валентность
6
1) кальция
2) бериллия
3) калия
4) бария
7
1) хлороводороде
2) гидроксиде натрия
3) оксиде углерода(II)
4) оксиде углерода(IV)
8
1)
2)
3)
4)
9
1) оксида кальция
2) хлорида лития
3) натрия
4) серы
10
1)
2)
3)
4)
11
1)
2)
3)
4)
12
1)
2)
3)
4)
При выполнении задания 13 из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны. Получившуюся последовательность цифр запишите в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
Получившуюся последовательность цифр запишите в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
В ряду химических элементов уменьшается
1) заряд ядра атома
2) радиус атома
3) электроотрицательность элемента
4) валентность в летучем водородном соединении
5) число заполненных электронами энергетических уровней
13
При выполнении задания 14 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите под соответствующими буквами таблицы. Цифры в ответе могут повторяться. Получившуюся последовательность цифр запишите в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
14
СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ |
A) | 1) |
Б) | 2) |
B) | 3) |
4) | |
5) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Для задания 15 запишите в поле ответа в тексте работы полный развёрнутый ответ, включающий необходимые уравнения реакций и расчёты. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции, соответствующее схеме превращений
Определите окислитель и восстановитель.
15
Ответы к заданиям
№ задания | Ответ |
1 | 1 |
2 | 2 |
3 | 2 |
4 | 1 |
5 | 4 |
6 | 2 |
7 | 2 |
8 | 3 |
9 | 4 |
10 | 3 |
11 | 1 |
12 | 2 |
13 | 24 |
14 | 245 |
Критерии оценивания задания с развёрнутым ответом
15
Определите окислитель и восстановитель.
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
1) Составлен электронный баланс: 2) Определён окислитель и восстановитель: — окислитель, — восстановитель. 3) Составлено уравнение реакции: | |
Ответ правильный и полный, включает все названные элементы. | 3 |
В ответе допущена ошибка только в одном из элементов. | 2 |
В ответе допущены ошибки в двух элементах. | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 3 |
2017 г.
Положение о XIII международной олимпиаде в сфере информационных технологий «IT-Планета»
Документы и рекомендации по дистанционному обучению
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ КУЗБАССА Против коррупции в образовании!
Профилактика гриппа и коронавирусной инфекции
УВАЖАЕМЫЕ СТУДЕНТЫ!
Совершайте удобно платежи в адрес
Ленинск-Кузнецкого политехнического техникума
Через бесплатный интернет-банк Сбербанк Онлайн(или мобильное приложение Сбербанк онлайн):
На компьютере, подключенном к сети Интернет, наберите в адресной строке браузера https://online.
sberbank.ru
Пройдите онлайн-регистрацию или введите постоянный логин и пароль, подтвердите вход SMS-паролем (потребуется карта Сбербанка с подключенной услугой «Мобильный банк»).
Для совершения платежа следуйте пунктам меню:
Платежи > в поисковой строке наберите: Л-Кузнецкий политехнический или 4212002624 >Л-Кузнецкий политехнический техникум > оплата по реквизитам> выберите карту списания > введите ФИО ребенка (студента), назначение платежа > продолжить > продолжить > оставляем паспорт, продолжить > введите серию и номер паспорта, продолжить > введите сумму, продолжить > Подтвердите оплату.
Чек об оплате доступен сразу после совершения платежа или в любое удобное время через пункт «История операций».
Горячая линия информационного сопровождения поиска и подбора работы для выпускников
+7 (38456)2-08-53, +7 (38456)2-26-60
953 total views, 418 views today
построить атом — атомы | Атомная структура | Обозначения изотопов
Темы
- Атомы
- Атомная структура
- Символы изотопов
- Атомные ядра
Описание
Постройте атом из протонов, нейтронов и электронов и посмотрите, как изменяются элемент, заряд и масса. Тогда сыграйте в игру, чтобы проверить свои идеи!
Тогда сыграйте в игру, чтобы проверить свои идеи!
Примеры целей обучения
- Используйте количество протонов, нейтронов и электронов, чтобы нарисовать модель атома, идентифицировать элемент и определить массу и заряд.
- Предскажите, как сложение или вычитание протона, нейтрона или электрона изменит элемент, заряд и массу.
- Используйте имя элемента, массу и заряд, чтобы определить количество протонов, нейтронов и электронов.
- Определите протон, нейтрон, электрон, атом и ион.
- Создайте изотопный символ для атома, учитывая количество протонов, нейтронов и электронов.
Версия 1.6.15
СимуляторыHTML5 могут работать на iPad и Chromebook, а также в системах ПК, Mac и Linux.
iPad:
iOS 12+ Safari
iPad-совместимые sim-карты
Android:
Официально не поддерживается. Если вы используете симуляторы HTML5 на Android, мы рекомендуем использовать последнюю версию Google Chrome.
Chromebook:
Последняя версия Google Chrome
Симуляторы HTML5 и Flash PhET поддерживаются на всех устройствах Chromebook.
SIM-карты, совместимые с Chromebook
Системы Windows:
Microsoft Edge, последняя версия Firefox, последняя версия Google Chrome.
Macintosh Системы:
macOS 10.13+, Safari 13+, последняя версия Chrome.
Системы Linux:
Официально не поддерживается. Пожалуйста, свяжитесь с phethelp @ colorado.edu с проблемами устранения неполадок.
Обзор теста атомной структуры — Grodski AP Chemistry
Атомная структура / электронная конфигурация / Обзор теста на периодичность
1. Эксперименты с субатомными частицами — Каковы были значение и вклад в атомную структуру
A) Катодный луч / JJ Томпсон —
B) Капля масла Милликина —
C) Золотая фольга / Эрнест Резерфорд
D) волны Мозли K, L-
E) Открытие Чедвика
2. Методы количественного анализа — Какие концепции используются в этих методах?
Методы количественного анализа — Какие концепции используются в этих методах?
A) Масс-спектроскопия (изотопы) —
B) PES — Фотонно-эмиссионная спектроскопия
C) Спектрофотометрия — — Почему мы можем использовать эту технику для определенных
3.Вклад в развитие квантово-механической модели атома —
A) Макс Планк
B) Эйнштейн — фотоэлектрический эффект
C) Нилс Бор
D) Де Бройль
E) Шредингер
F) Гейзенберг / Макс Борн (Копенгагенская интерпретация квантовой механики_
4 .Теории света —
A) Положительная теория света — Спектры излучения
B) Отрицательная теория света — Поглощение Спектры
5. Вопросы по математике —
Вопросы по математике —
| Расчет взвешенной массы | ||
| Расчет взвешенной массы с помощью масс-спектрометров — изотопы | Атомная структура — масс-спектроскопия.pdf | Структура атома — Ключ масс-спектроскопии.pdf Просмотр Загрузить |
| Длина волны, частота, Расчет энергии | ||
| расчет длины волны, частоты и энергии ( сторона этого документа) ) | Атомная структура 2 — bohrs.pdf Просмотр Загрузить | Атомная структура 2 — Ключ Бора p.pdf Просмотр Загрузить |
| Лекция Гродского (сторона 1) | Гродский обзор видео лицевой стороны рабочий лист выше. | https://youtu.be/cfq93vOpyhY |
| расчет длины волны, частоты и энергии (сторона 1 этого рабочего листа) | атомная структура — 1 — фотоэлектрический эффект. pdf pdf Просмотр Загрузить | атомная структура — 1 — фотоэлектрический эффект KEY.pdf Просмотр Загрузить |
| Лекция Гродского (сторона 1) | Видео-обзор Гродского на рабочий лист выше. (сторона 1) вопросов 1-3 похожи на вопросы рабочего листа атомной структуры 2.Вопрос 4 запускает фотоэлектрический эффект. | https://youtu.be/m57dytnRNWQ |
| Расчеты фотоэлектрического эффекта | ||
| Я рассмотрю концепции, которые связаны с фотоэлектрическим эффектом и включают его. | ||
| Вопрос 4 об атомной структуре 2 Вопрос 4 Ссылка справа начинается с вопроса 4, чтобы просмотреть вопрос. | атомная структура 1 — фотоэлектрический эффект.pdf Просмотр Загрузить | https://youtu.be/m57dytnRNWQ?t=22m50s |
| Фотоэлектрический эффект — сторона 2, вопрос 5,6 | Grodski review видео структуры атома — 1 — photoelectric effect.  pdf (сторона 2) pdf (сторона 2) | https://youtu.be/R-iqDHNweCg |
| Вопрос 1 рабочего листа де Бройля — вопрос о фотоэлектрическом эффекте . * вычислений де Бройля не будет, но вам необходимо знать его вклад. | Атомная структура 3 — де Бройль.pdf Просмотр Загрузить | атомная структура 3 — de Broglie Key.pdf Просмотр Загрузить |
| Вычисления Бора- Уравнение Бальмера- | | |
| СТОРОНА 2 этого рабочего листа | — bohrs.pdf Просмотр Загрузить | атомная структура 2 — Ключ Бора p.pdf Просмотр Загрузить |
| Гродски Лекция — Рассматриваются эти концепции, ведущие к расчетам с использованием уравнения Бальмера для модели Бора, и включающие их.Видео также рассматривает сторону 2 рабочего листа атомной структуры 2. | https://youtu. be/PynWdRsbFhA be/PynWdRsbFhA | |
| Вопрос 2 — | Атомная структура 3 — de Broglie.pdf Просмотр Загрузить | Атомная структура 2 — Ключ Бора p.pdf Просмотр Загрузить |
| Квантовые числа | ||
Структура атома 4 — квантовые числа.pdf | Атомная структура 4 — квантовые числа key.pdf | |
| Лекция Гродского о квантовых числах | https://youtu.be/gHtoVFs8_lU | |
| Квантовая форма числа находится в режиме автоматической оценки и отправит вам по электронной почте ваши ответы и ключ, если вы захотите переделать форму. | Ссылка на форму квантового числа | |
| Примечания к квантовым числам | Атомная структура 2 презентация | слайд 115 — |
* Важные термины — Принцип Ауфбау, Принцип исключения Паули, Правило Хунда
ПРОЧИТАЙТЕ 285 — 311 — СИНЯЯ КНИГА, в которой 3 последних периода периодичности сформированы на основе:
AP Periodicity and Electron Configurations Form 1 — оценено и возвращено — Ссылка на форму — Ссылка для просмотра формы AP Периодичность и электронные конфигурации Форма 3 — оценено и возвращено — Ссылка для просмотра формыТермины и концепции:
основное состояние, возбужденное состояние, валентные электроны, ядро (электроны ядра), парамагнетизм, диамагнетизм, энергия ионизации, сродство к электрону, фотонно-эмиссионная спектроскопия (PES)
9003 2 рабочие листы с 10 заметками по неделям:| 1 | Электронная конфигурация и периодичность. pdf pdf Просмотр Загрузить | Электронный рабочий лист конфигурации 1 Ключ p.pdf Просмотр Загрузить |
| 2 | Электронный рабочий лист конфигурации и периодичности 2.pdf Просмотр Загрузить | Электронный рабочий лист 2 Ключевой pdf Просмотр Загрузить |
| 3 | Электронный рабочий лист конфигурации и периодичности 3.pdf Просмотр Загрузить | Электронный рабочий лист 3 Ключ p.pdf Просмотр Загрузить |
| 4 | Электронный рабочий лист конфигурации и периодичности 4.pdf Просмотр Загрузить | Электронная конфигурация рабочего листа 4 Ключ p.pdf Просмотр Загрузить |
Атомная структура 2 — Эмиссионная спектроскопия Бора
Атомная структура 2 — Эмиссионная спектроскопия Бора
Прочтите ПРИМЕЧАНИЯ с 10 недели!
* Connections — Когда мы пишем конфигурации электронов, мы на самом деле записываем уровни энергии каждого электрона, определяемые 4 уникальными квантовыми числами (3 из которых являются решениями уравнения Хредингера S ).
Принцип исключения Паули — Электроны должны иметь набор из 4 уникальных квантовых чисел.
Смысл этой работы состоял в том, чтобы полностью понять, почему электронные «оболочки» или основные энергетические уровни содержат даже электронов. Этот принцип также был расширен, чтобы объяснить, почему электроны не могут занимать одно и то же квантовое состояние и, следовательно, должны «складываться» в атоме. Эта «укладка» повторяется и приводит к химическим веществам, имеющим разные химические свойства в зависимости от их валентных электронов — крайних электронов.
Ядро = Основные электроны = Наиболее стабильные электроны
Валентные электроны = нестабильные электроны — используются в химической связи
 Это состояние идентифицируется электронной конфигурацией, которая не соответствует принципу Aufbau и, таким образом, не заполняет орбитали с более низкой энергией (ближе к ядру) перед заполнением орбиталей с более высокой энергией (дальше от ядра). Конфигурация возбужденного состояния представляет собой расположение электронов в атоме непосредственно перед тем, как он испускает фотоны в ярком линейчатом спектре
Это состояние идентифицируется электронной конфигурацией, которая не соответствует принципу Aufbau и, таким образом, не заполняет орбитали с более низкой энергией (ближе к ядру) перед заполнением орбиталей с более высокой энергией (дальше от ядра). Конфигурация возбужденного состояния представляет собой расположение электронов в атоме непосредственно перед тем, как он испускает фотоны в ярком линейчатом спектреИспользуя орбитальные диаграммы (прямоугольники для форм орбиталей), мы также можем идентифицировать конфигурации возбужденных состояний:
Помните, что электроны на одном и том же типе орбиталей сначала займут пустые орбитали, прежде чем объединиться в пары — ПРАВИЛО СОТНИ.
* Обратите внимание, что электроны в одном ящике (орбитали) имеют противоположные электронные спины, в то время как электроны на одном подуровне имеют параллельные спины (идущие в одном направлении). Эти неспаренные электроны приводят к парамагнетизму (притяжению к магнитному полю)..PNG)
Важный словарь, который вам понадобится в этом модуле:
Z = # протонов синонимов : Z = ядерный заряд и Z = атомный номер (спасибо Мозли!)
Z eff = эффективный заряд ядра — (заряд ядра, который испытывает электрон в результате электрон-электронного взаимодействия (экранирование или электрон-электронное отталкивание).
n = основной уровень энергии, чем больше n, тем больше число электронов ядра
и больше орбитали. n определяет близость электронов к ядру
. Чем дальше электрон от ядра, тем меньше кулоновское притяжение
, которое испытывает электрон, и, следовательно, менее стабильно
, чем электронов ближе к ядру.
Вооружившись Z , Z eff и n, вы можете объяснить почти все с помощью периодичности и электронных конфигураций
.
**** Поскольку мы постоянно оцениваем уровни энергии электронов, которые связаны в атоме или ионе, в этом устройстве, значения энергии ионизации очень полезны для определения стабильности электрона.
Энергия ионизации = энергия, необходимая для удаления электрона (энергия связи Эйнштейна).
Электроны с более высоким IE более стабильны (для удаления требуется больше энергии!)
Электроны с более низким IE менее стабильны (для удаления требуется меньше энергии!)
Пример для Na (натрий): IE 1 + Na —-> Na + + e-
первая энергия ионизации
Энергия ионизации часто описывается как энергия первой ионизации (1-й IE) или Вторая энергия ионизации (2-й IE) и так далее…
IE 2 + Na + —-> Na +2 + e-
Энергия второй ионизации
Итак, второй IE — это энергия, необходимая для удаления второго электрона. Потребовалось бы столько же, сколько и для первого IE? Нет, для этого потребуется гораздо больше, потому что Na + , второй электрон, будет удален с заполненного основного энергетического уровня !! Это остовные электроны, которые более стабильны. Не теряйте сайт, что IE является мерой электронной стабильности.
Потребовалось бы столько же, сколько и для первого IE? Нет, для этого потребуется гораздо больше, потому что Na + , второй электрон, будет удален с заполненного основного энергетического уровня !! Это остовные электроны, которые более стабильны. Не теряйте сайт, что IE является мерой электронной стабильности.
Стабильные электроны = сильное кулоновское притяжение к ядру = орбитали с более низкой энергией = высокий IE
Более низкая энергия n, более высокое Z эфф ближе к ядру
Последовательные значения IE подтвердили существование Валентные электроны !!! Посмотрите на диаграмму ниже.
Уведомление, когда следующий IE «ПРОПЫГАЕТ ЧЕРЕЗ КРЫШУ».
Na (атом): 1s 2 2s 2 2p 6 3s 1 Na +1 (атом): 1s 2 2s 2 2p 6
Удаление валентного электрона (менее стабильный) Удаление остовного электрона (более стабильный)
3s-электрон имеет более высокое n 2p-электрон имеет более низкий n
3s электрон имеет более низкую Zeff 2p электрон имеет более высокую Zeff
Z = 11 Z = 11
IE 1 = 500 кДж / моль —— 9-кратное увеличение ——-> IE 2 = 4560 кДж / моль
удаление валентности e — «прыгает через крышу» удаление ядра e —
Таким образом, Na имеет 1 валентный электрон
Энергия ионизации vs. Сродство к электрону
Сродство к электрону
| Энергия ионизации (IE) | Сродство к электрону (EA) |
| Энергия, необходимая для удаления электрона | Энергия, выделяемая или поглощаемая при добавлении электрона |
| , измеряет стабильность электронов тока | измеряет стабильность добавленного электрона |
| Создает положительные ионы (катионы) | Создает отрицательные ионы (анионы) |
| ∆H = положительный (эндотермический) | ∆H = отрицательный (экзотермический) или положительный (эндотермический) |
| .50 кДж / моль + Na ——> Na + + e — | F + e — ——> F — + 328 кДж / моль |
| 1681 кДж / моль + F ——> F + + e- | 53 кДж / моль + Na + e — ——> Na — |
| Чем больше IE, тем более стабильный e — | Чем больше отрицательный EA, тем стабильнее добавленный e — |
| Используется для всех атомов — Clear Trend | Используется в основном для неметаллов, но тенденция не ясна / много исключений |
Учитывая следующий EA для галогенов — группа 17
Фтор (F) -328 кДж / моль Хлор (Cl) -349 кДж / моль 9 0017 Бром (Br) -324 кДж / моль Йод (I) -295 кДж / моль |
EA «обычно уменьшается» вниз по группе из-за увеличения экранирования, которое происходит с большим количеством орбиталей электроны (ядро) между крайними электронами (валентность) при увеличении n компенсируются большим Z, возникающим при движении вниз по группе.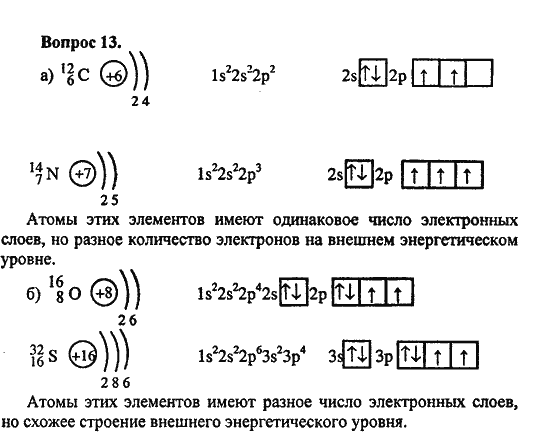 По мере того, как вы перемещаетесь вниз по группе, n является самым большим фактором, почему внешний электрон становится менее стабильным и удерживается более свободно. Вот почему валентные электроны менее стабильны, чем остовные электроны.
По мере того, как вы перемещаетесь вниз по группе, n является самым большим фактором, почему внешний электрон становится менее стабильным и удерживается более свободно. Вот почему валентные электроны менее стабильны, чем остовные электроны.
Что касается фтора, мы ожидаем, что он будет иметь самый высокий EA в группе, так как его валентные электроны находятся в наименьшем n (n = 2) и должны выделять наибольшее количество энергии (показывать большую стабильность), когда он захватывает один электрон, НО ЭТО НЕ. Поскольку электроны фтора существуют в очень маленьком пространстве с n = 2, дополнительный электрон будет немного дестабилизирован электрон-электронным отталкиванием, которое произойдет в этом маленьком пространстве. Zeff для этого добавляемого электрона не будет таким высоким, как можно было бы ожидать, из-за тесноты небольшого пространства для электрона на втором основном энергетическом уровне. Остальная часть группы следует ожидаемой тенденции, потому что их валентные электроны существуют на все больших и больших орбиталях, поскольку n увеличивается, что приводит к более низким Zeff из-за увеличения расстояния от ядра.
EA, как и IE, также имеет EA 2 , и эти значения почти всегда ОЧЕНЬ положительны, поскольку требуется энергия, чтобы добавить электрон к уже отрицательной частице (если Z не достаточно велик для смещения).Этого никогда не бывает при малых значениях n.
Мы узнали, что расхождение трехмерной орбитали отвечает за свойства переходных металлов, которые являются элементами в d-блоке. D 0rбиталь, в отличие от s и p, содержит максимум 10 электронов и в сочетании с самой внешней s-орбиталью, которая очень близка по энергии с самой внешней d-орбиталью, обеспечивает «супер-подуровень», где 12 электронов находятся в том, что становится чем-то вроде валентная оболочка для этих элементов.
1. Высокая проводимость электричества — Большое количество подвижных электронов (низкий IE) в металлических связях
2. Самый большой парамагнетизм — Наибольшее количество вырожденных орбиталей, которые могут содержать
наибольшее количество неспаренных параллельных спиновых электронов.
3.Состояния множественного окисления — Множество вариантов стабильности электронов на основе , минимизирующих
электронов — отталкивания электронов с учетом 6 орбиталей (s и d), которые
электроны могут перемещаться туда и обратно. Переходные элементы не могут достичь конфигурации с благородным газом, потому что они не могут потерять или получить большое количество электронов, которое для этого потребуется.
Fe должно ПОТЕРЯТЬ 8 электронов ИЛИ получить 10 электронов для достижения электронной конфигурации
Kr или Xe. Fe имеет слишком высокое Z, чтобы потерять 8
электронов, и его Z недостаточно велик, чтобы получить 8 электронов.
4. Валентные электроны с нескольких основных энергетических уровней (n) —
Электроны теряются металлами из-за относительно низкого IE, но
электронов теряются из-за d — блочные металлы происходят из «супер-подуровня»
(n) s и (n-1) d электронов, которые очень похожи по энергии.
5. Цветные решения — расщепление кристаллического поля !!!!! Помните!!!!
Поскольку они могут иметь высокие степени окисления из-за большого количества электронов на их «супер-подуровне», они могут вытягивать пары электронов из других молекул (лигандов), чтобы образовывать стабильные комплексы, которые вызывают расщепление вырожденной d-орбитали на 2 энергетических уровня . Это расщепление d-орбитали, основанное на том, что электроны втягиваются на d-орбитали металла d-блока из-за большого кулоновского притяжения элементов d-блока, которые имеют высокое Z и большую степень окисления, создает возможность для этих элементов поглощать фотоны видимого света (отрицательная теория света), в результате чего образуются комплексы, передающие фотоны света, который не поглощается.
Mn +7 в KMnO 4 = фиолетовый (в лаборатории окислительного титрования) ——> Mn +2 (прозрачный)
Cu, окисленная азотной кислотой (в % по массе меди в лаборатории Брасс) = сине-зеленый раствор, и мы использовали спектрофотометр, чтобы измерить, сколько света отсутствует (поглощается):
* Помните, что растворы Cu сине-зеленые, потому что они образуют комплексы в воде:
Cu +2 + 6H 2 O ——> [Cu ( 6H 2 O) 6 ] +2
| D-орбитали, которые будут напрямую взаимодействовать с входящим лигандом (электроны из кислорода в воде), будут дестабилизировать эту d-орбиталь из-за электрон-электронного отталкивания, и, таким образом, эта орбиталь будет содержать элемент ctron с более низким Zeff. 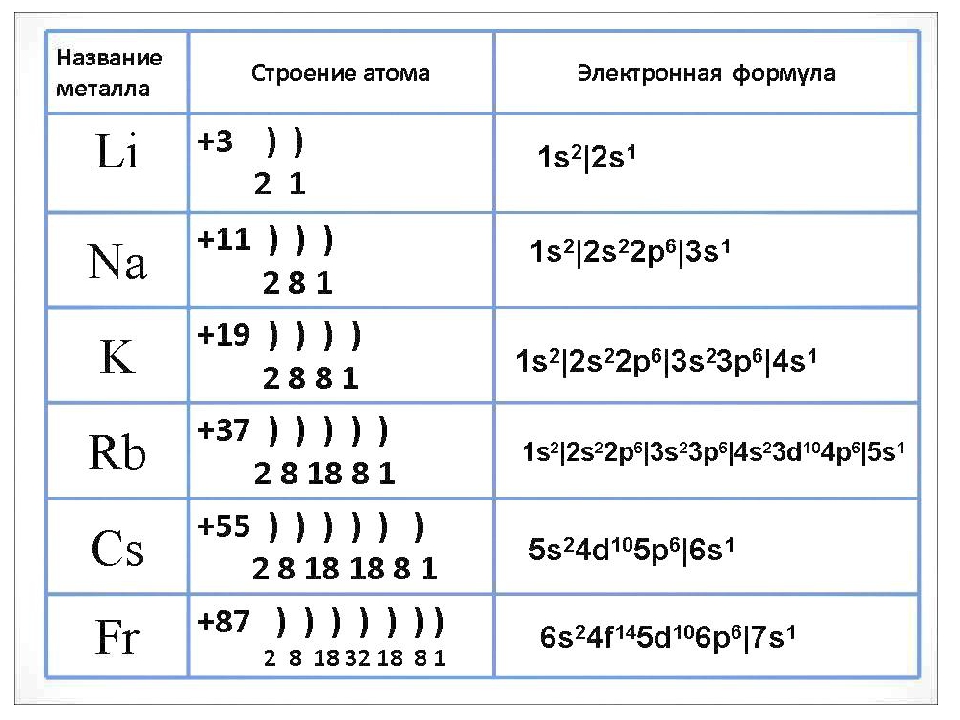 D-орбитали, которые не взаимодействуют напрямую с входящим лигандом, не так дестабилизированы, и, таким образом, создается GAP, а вырожденные d-орбитали разделяются на 2 уровня зазором, достаточно малым по энергии, чтобы фотоны видимого света могли совпадать! |
Лекция об энергии.
Лекция о расхождении, если вы не можете насытиться:
Прочтите «Войну и мир» to0! !!!
Изучите химию: практические задачи атомной структуры
Практические задачи атомной структуры : 1. ) Рассчитайте частоту красного света с длиной волны 6,50 * 10 2 нм
) Рассчитайте частоту красного света с длиной волны 6,50 * 10 2 нм
2.) 6,42 * 10-19 Дж энергии требуется для удаления электрона из атом серебра. Какая максимальная длина волны света способна это сделать?
3.) Рассчитайте DE при следующих переход происходит в атоме водорода:
n = 3 —> n = 1
3b.) Рассчитайте длину волны света, испускаемого электроном водорода. перейти от n = 1 к n = 3
4.) Приведите квантовые числа l, m l и количество орбитали для n = 4
5.) Укажите электронные конфигурации для:
a.) Sr b.) Pt c.) S
6.) Рассчитайте энергию ионизации иона Li 2+ с
электрон в основном состоянии.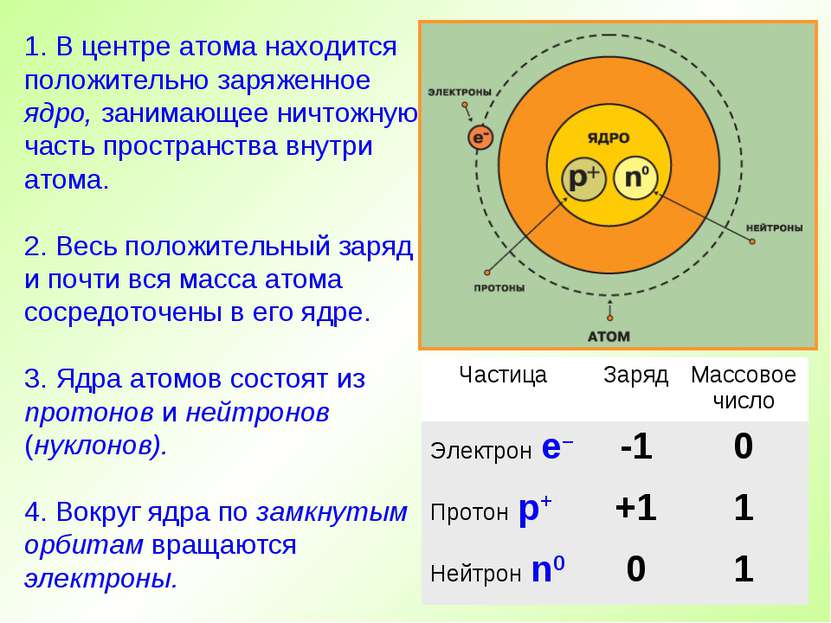
7.) Найдите длину волны, излучаемой электроном (m = 9.11 * 10 -31 кг) при движении со скоростью 2,0 * 10 -8 м / с
1.) v = c / l
c = 2,9979 * 10 8 м / с
l = 6,50 * 10 2 нм * (1 м / 10 9 нм) = 6,50 * 10 -9 м
(2,9979 * 10 8 м / с) / (6,50 * 10 -9 м) = 4,61 * 10 14 Гц
2.) DE = hv ( h = 6.6326 * 10 -34 Дж * с)
v = c / l
Замените v в первом уравнении нижним уравнением:
DE = ( hc ) / л
Вставка всех констант (помните, что h и c являются константами),
и подключившись к DE, ответ: 3,09 * 10 -7 ,
который преобразуется в 309 нм .
3.) E = -2,178 * 10 -18 Дж (Z 2 / n 2 )
E1 ==> n = 3 ===> -2,178 * 10 -18 (1 2 /3 2 ) = -2,42 * 10 -19
E2 ==> n = 1 ===> -2,178 * 10 -18 (1 2 /1 2 ) = -2,18 * 10 -18
DE = E2 — E1 = -2,18 * 10 -18 + 2,42 * 10 -19 = -1,936 * 10 -18 Дж
3б.) Выполняется тот же процесс, за исключением того, что E1 будет иметь n = 1, а E2 будет иметь n = 3. Последний шаг:
DE = E2 — E1 = -2,42 * 10 -19 + 2,18 * 10 -18 = 1,94 * 10 -18 Дж
Затем вы конвертируете в длину волны, используя l = hc / DE
l = 103 нм
4.)
л = (п-1) = 4
м л = -3, -2, -1, 0, 1, 2, 3
7 орбиталей (посчитать л )
5. )
)
a.) [Kr] 5s 2
b.) [Xe] 6s 2 4f 14 5d 8
c.) [Ne] 3s 2 3p 4
6.) Важно отметить, что это Li 2+ , а не Li 2+ имеет электронную конфигурацию 1s 1
E = — (Z 2 / n 2 ) * 1310 кДж / моль = — (3 2 /1 2 ) * 1310 кДж / моль = 1.18 * 10 2 кДж
7.) l = h / m v (v есть скорость, а не частота) (м в кг)
l = ч / (9,11 * 10 -31 ) (2,0 * 10 8 )
Кто обнаружил, что центр атома был очень маленьким и плотным с общим положительным зарядом в своем эксперименте с золотой фольгой | ||
Субатомная частица с положительным зарядом называется. | ||
формат… всегда равно количеству протонов + количеству нейтронов в атоме | ||
атом, который получает электрон, будет иметь расширение. | ||
По словам Дальтона, атомы разных элементов будут… | ||
формат. | ||
как нейтроны, так и… находятся в ядре атомов | ||
протон имеет массу примерно. | ||
Thomson обнаружил расширение… в его эксперименте с электронно-лучевым излучением | ||
. | ||
| Так сказали демократов… были неделимы, фундаментальные единицы материи | ||
Анион — это атом с общим элементом. | ||
| На атом получает общий положительный заряд… … | ||
Объясните 4 основных положения атомной теории Дальтона. | 1- Все элементы состоят из атомов 2-атома одного и того же элемента идентичны 3-атома разных элементов смешиваются или объединяются в целое число соотношения 4- происходят химические реакции.В химической реакции атомы одного элемента НИКОГДА не превращаются в другой |
MCAT Общий практический тест по химии 1: Атомная структура_maintests.com
1. Что из следующего является правильной электронной конфигурацией для Zn 2+ ?
2. Какой из следующих наборов квантовых чисел возможен?
3. Какое максимальное количество электронов разрешено на одном атомном энергетическом уровне с точки зрения главного квантового числа n ?
Какое максимальное количество электронов разрешено на одном атомном энергетическом уровне с точки зрения главного квантового числа n ?
4. Какое из следующих уравнений описывает максимальное количество электронов, которое может заполнить подоболочку?
5. Какой из следующих атомов имеет только спаренные электроны в основном состоянии?
6. Электрон возвращается из возбужденного состояния в свое основное, испуская фотон с длиной волны λ = 500 нм.Какова была бы величина изменения энергии, если бы один моль этих фотонов был испущен? (Примечание: ч = 6,626 × 10 -34 Дж · с)
7. Предположим, что электрон падает с n = 4 до своего основного состояния, n = 1. Какой из следующих эффектов скорее всего?
8. Какой из следующих изотопов углерода НАИМЕНЕЕ вероятен для обнаружения в природе?
9. Что из следующего лучше всего объясняет невозможность точного и одновременного измерения положения и импульса в соответствии с принципом неопределенности Гейзенберга?
10. Какой из следующих электронных переходов приведет к наибольшему выигрышу в энергии для одиночного электрона водорода?
Какой из следующих электронных переходов приведет к наибольшему выигрышу в энергии для одиночного электрона водорода?
11. Предположим, что атом заполняет свои орбитали, как показано:
Такая электронная конфигурация наиболее ясно иллюстрирует какой из следующих законов атомной физики?
12. Сколько всего электронов находится в катионе Cs 133 ?
13. Атомный вес водорода 1,008 а.е.м.Каков процентный состав водорода по изотопам, если предположить, что единственными изотопами водорода являются 1 H и 2 D?
14. Рассмотрим два набора квантовых чисел, показанные в таблице, которые описывают два разных электрона в одном атоме.
| н | л | м л | м с | |
| 2 | 1 | 902 902 9022 9022 9022 9022 90221 | -1 |
Какой из следующих терминов лучше всего описывает эти два электрона?
15. Какой из следующих видов представлен электронной конфигурацией 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5 ?
Какой из следующих видов представлен электронной конфигурацией 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5 ?
I. Cr
II. Mn +
III. Fe 2+
AP Chemistry Идеи атомной структуры
Второй блок в моей последовательности для AP Chemistry охватывает новый курс AP Chemistry и описание экзамена. Цели обучения, связанные с атомной структурой.Я определю и опишу действия, которые я использую для обучения студентов некоторым учебным целям, которые я связываю с этим блоком, состоящим из девяти учебных дней.
Мой блок атомной структуры включает только атомную структуру и электронные конфигурации (1,5 дня), фотоэлектронную спектроскопию (1,6), масс-спектроскопию (1,2) и электромагнитный спектр (3,11 и 3,12). (Периодичность указана в моем модуле 3.) Мы начинаем с краткого обзора атомной структуры за первый год, включая заряд, расположение и массы субатомных частиц с ионами и изотопами. Мы делаем обзор теории атомной структуры, ведущей к квантово-механической модели. Все это было рассмотрено в первый год, поэтому я делаю это за один период, но в годы, когда я преподавал химию AP в качестве курса первого года, весь этот материал был изучен с помощью перевернутых классных видео до начала этого раздела с 1- 2 периода практических задач. Я все еще занимаюсь магнетизмом, потому что я прошу студентов наблюдать за материалами (Zn, Fe, MnO 2 , KMnO 4 , CuSO 4 и т. Д.), Чтобы определить их магнитные свойства и предложить практическое правило после написания электронных конфигураций и рисования. орбитальные обозначения.Я считаю, что это отличная практика этих навыков и хорошее применение электронных конфигураций, хотя магнетизм больше не проверяется на экзамене AP Chemistry Exam (см. Рисунок 1). См. Вспомогательную информацию для раздаточного материала.
Мы делаем обзор теории атомной структуры, ведущей к квантово-механической модели. Все это было рассмотрено в первый год, поэтому я делаю это за один период, но в годы, когда я преподавал химию AP в качестве курса первого года, весь этот материал был изучен с помощью перевернутых классных видео до начала этого раздела с 1- 2 периода практических задач. Я все еще занимаюсь магнетизмом, потому что я прошу студентов наблюдать за материалами (Zn, Fe, MnO 2 , KMnO 4 , CuSO 4 и т. Д.), Чтобы определить их магнитные свойства и предложить практическое правило после написания электронных конфигураций и рисования. орбитальные обозначения.Я считаю, что это отличная практика этих навыков и хорошее применение электронных конфигураций, хотя магнетизм больше не проверяется на экзамене AP Chemistry Exam (см. Рисунок 1). См. Вспомогательную информацию для раздаточного материала.
Рисунок 1: Студенты наблюдают магнитные свойства металлов
Мы переходим к сортировке карточек (созданной Джейми Флинтом), в которой учащимся дают различные электронные конфигурации и диаграммы PES и просят сопоставить их вместе (см. Рисунок 2).Это отличный способ заставить учащихся критически задуматься о том, что пытается изобразить график, еще не изучив PES. Это действительно экономит много времени на лекциях и помогает им строить свои собственные представления о графиках, чтобы дать студентам право владения материалом и помочь им надолго запомнить цель. Мы больше практикуем PES после изучения энергии ионизации и энергии связи (концепции первого года для меня). Мы сравниваем графики PES с графиками масс-спектроскопии, чтобы выполнить другую сортировку карточек (также созданную Джейми Флинтом).Мне нравится бросать вызов мышлению студентов, показывая графики масс-спектроскопии двухатомных элементов, а также обсуждаю, какие графики соединений можно использовать в моих перелистанных видео.
Рисунок 2).Это отличный способ заставить учащихся критически задуматься о том, что пытается изобразить график, еще не изучив PES. Это действительно экономит много времени на лекциях и помогает им строить свои собственные представления о графиках, чтобы дать студентам право владения материалом и помочь им надолго запомнить цель. Мы больше практикуем PES после изучения энергии ионизации и энергии связи (концепции первого года для меня). Мы сравниваем графики PES с графиками масс-спектроскопии, чтобы выполнить другую сортировку карточек (также созданную Джейми Флинтом).Мне нравится бросать вызов мышлению студентов, показывая графики масс-спектроскопии двухатомных элементов, а также обсуждаю, какие графики соединений можно использовать в моих перелистанных видео.
Рисунок 2: Электронная конфигурация и PES cardort
Вторая часть моего модуля включает уравнения света для расчета длины волны, частоты и энергии света. Мы практикуем множество вопросов, в которых мы решаем для одиночных фотонов, используя длины волн в метрах и нанометрах. Мы определяем, какой тип излучения рассчитываем, с помощью плаката с электромагнитным излучением. Чтобы получить больше практики и понять, почему это важно для атомной структурной единицы, мы рассматриваем яркие линейчатые спектры водорода, гелия и неона и сравниваем их с опубликованными значениями. Затем мы вычисляем длину волны, частоту и энергию наблюдаемых линий. У нас нет модного оборудования, поэтому мы проводим качественные измерения и соотносим эти цвета с опубликованными значениями (см. Прилагаемую лабораторию).Мы вычисляем уровень, с которого опускаются определенные электроны, просто для понимания, хотя это не входит в экзамен AP. Хотя это требует больших вычислений, мои ученики любят рассматривать спектры и ценят практику больше, чем обычный рабочий лист. См. Вспомогательную информацию для раздаточного материала.
Мы определяем, какой тип излучения рассчитываем, с помощью плаката с электромагнитным излучением. Чтобы получить больше практики и понять, почему это важно для атомной структурной единицы, мы рассматриваем яркие линейчатые спектры водорода, гелия и неона и сравниваем их с опубликованными значениями. Затем мы вычисляем длину волны, частоту и энергию наблюдаемых линий. У нас нет модного оборудования, поэтому мы проводим качественные измерения и соотносим эти цвета с опубликованными значениями (см. Прилагаемую лабораторию).Мы вычисляем уровень, с которого опускаются определенные электроны, просто для понимания, хотя это не входит в экзамен AP. Хотя это требует больших вычислений, мои ученики любят рассматривать спектры и ценят практику больше, чем обычный рабочий лист. См. Вспомогательную информацию для раздаточного материала.
Некоторые люди спрашивают, как я структурирую домашнее задание. Мой школьный округ требует, чтобы мы давали домашнее задание и считали его десятью процентами от средней четверти учащихся. Я предоставляю перевернутое видео, которое я снимал каждую ночь (кроме ночи перед экзаменами) на бесплатном веб-сайте Edpuzzle.Я размещаю все видео в начале раздела, чтобы у студентов было время посмотреть их в удобном для них темпе. Я также прошу студентов выполнить одно письменное домашнее задание на каждый блок. Письменные задания содержат 2-3 очень старых экзаменационных вопроса AP, а также чтение и мои собственные вопросы (все эти домашние задания можно найти на моем веб-сайте www.chemisme.com). Я знаю, что студенты могут легко найти ответы и скопировать их для старых вопросов AP Exam, но мы обсуждаем ценность пробовать примеры самостоятельно и использовать ответы, найденные в Интернете, как способ проверить свою работу и извлечь уроки из своих ошибок.Домашнее задание для практики, и без практики у них ничего не получится. Выполнение домашнего задания мало влияет на их общую оценку, и вопросы, которые я написал в домашнем задании, будут иметь больший вес.
Я предоставляю перевернутое видео, которое я снимал каждую ночь (кроме ночи перед экзаменами) на бесплатном веб-сайте Edpuzzle.Я размещаю все видео в начале раздела, чтобы у студентов было время посмотреть их в удобном для них темпе. Я также прошу студентов выполнить одно письменное домашнее задание на каждый блок. Письменные задания содержат 2-3 очень старых экзаменационных вопроса AP, а также чтение и мои собственные вопросы (все эти домашние задания можно найти на моем веб-сайте www.chemisme.com). Я знаю, что студенты могут легко найти ответы и скопировать их для старых вопросов AP Exam, но мы обсуждаем ценность пробовать примеры самостоятельно и использовать ответы, найденные в Интернете, как способ проверить свою работу и извлечь уроки из своих ошибок.Домашнее задание для практики, и без практики у них ничего не получится. Выполнение домашнего задания мало влияет на их общую оценку, и вопросы, которые я написал в домашнем задании, будут иметь больший вес.
Какие действия вы включаете для достижения этих целей обучения? Как вы выполняете домашние задания на уроках? Присоединяйтесь к обсуждению ChemEd X!
Обзор атомной структуры | Введение в химию
Цель обучения
- Обсудить электронные и структурные свойства атома
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает свои электроны на орбите вокруг ядра.

- Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10-24 грамма, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один Дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся в ядре.
Условия
- протон Положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента.Он весит 1 а.е.м.
- атом Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящее из ядра, окруженного электронами.
- нейтрон Субатомная частица, составляющая часть ядра атома. Это бесплатно. По массе он равен протону или весит 1 а.е.м.
Атом — это наименьшая единица вещества, которая сохраняет все химические свойства элемента. Атомы объединяются в молекулы, которые затем взаимодействуют с образованием твердых тел, газов или жидкостей. Например, вода состоит из атомов водорода и кислорода, которые объединились в молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составляющие их атомы, чтобы из них можно было собрать более полезную молекулу.
Например, вода состоит из атомов водорода и кислорода, которые объединились в молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составляющие их атомы, чтобы из них можно было собрать более полезную молекулу.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные).Атомы имеют разные свойства в зависимости от расположения и количества их основных частиц.
Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это можно определить, используя атомный номер и массовое число элемента (см. Понятие атомных номеров и массовых чисел).
Строение атома Изображенные здесь элементы, такие как гелий, состоят из атомов. Атомы состоят из протонов и нейтронов, расположенных внутри ядра, а электроны находятся на орбиталях, окружающих ядро.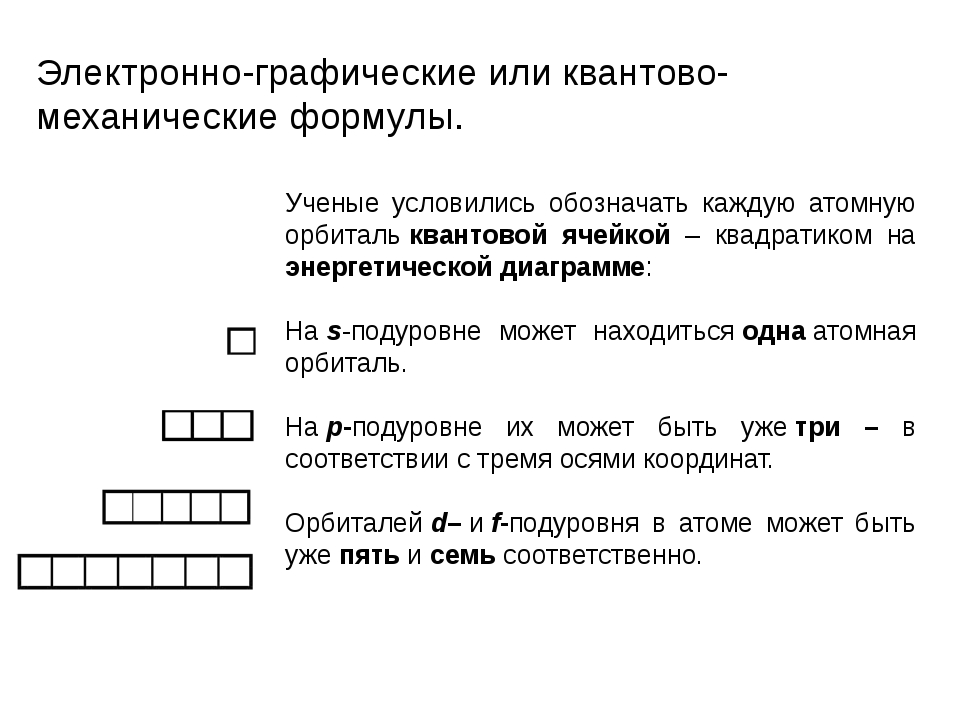
Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67 × 10 -24 граммов. Ученые определяют это количество массы как одну атомную единицу массы (а.е.м.) или один дальтон. Протоны схожи по массе, но заряжены положительно, а нейтроны не имеют заряда. Следовательно, количество нейтронов в атоме существенно влияет на его массу, но не на его заряд.
Электроны намного меньше по массе, чем протоны, всего 9,11 × 10 -28 граммов, или примерно 1/1800 атомной единицы массы.Следовательно, они не вносят большой вклад в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, исходя только из числа протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти обвинения как «+1» и «-1». В незаряженном нейтральном атоме количество электронов, вращающихся вокруг ядра, равно количеству протонов внутри ядра. В этих атомах положительный и отрицательный заряды нейтрализуют друг друга, в результате чего получается атом без чистого заряда.
В этих атомах положительный и отрицательный заряды нейтрализуют друг друга, в результате чего получается атом без чистого заряда.
Объем атомов
С учетом размеров протонов, нейтронов и электронов большая часть объема атома — более 99 процентов — фактически является пустым пространством. Несмотря на все это пустое пространство, твердые объекты не проходят сквозь друг друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой предмет, как стул.

 Br2
Br2 Ковалентная неполярная связь.
Ковалентная неполярная связь. Ca2+
Ca2+ Ковалентная неполярная связь.
Ковалентная неполярная связь. Ca2+
Ca2+ Ковалентная неполярная связь.
Ковалентная неполярная связь.
 sberbank.ru
sberbank.ru ..
.. .. заряд
.. заряд .. элемента — это средневзвешенное значение масс различных изотопов этого элемента
.. элемента — это средневзвешенное значение масс различных изотопов этого элемента ..
.. ..это атомы, которые имеют одинаковый атомный номер, но разные массовые числа
..это атомы, которые имеют одинаковый атомный номер, но разные массовые числа .. заряд
.. заряд
