Контрольная работа «Алканы»
Контрольная работа по теме «Предельные углеводороды»
Вариант №1
1. Напишите формулу 2,3,3,4-тетраметилпентана. Приведите формулу его изомера, в молекуле которого имеются только первичные и вторичные атомы углерода.
2. Укажите число атомов углерода и водорода в соединении, строение которого
3. Какое строение имеет кислота, если при декарбоксилировании ее натриевой соли образуется углеводородС4Н10, напишите реакцию, назовите вещества.
4. Напишите уравнения реакций: а) изомеризации бутана; б) горения циклопропана в кислороде; в) нитрования метана; г) бромирования бутана. Дайте названия продуктам реакций.
5. Для проведения синтеза Вюрца взяли два вещества: бромметан и 1-бромпропан.
6. Напишите уравнения реакций следующих превращений:
7. Найдите молекулярную формулу органического вещества, если известно. Что массовая доля углерода в нем составляет 51.89%, водорода 9.73% и хлора 38.38%. Относительная плотность паров этого вещества по воздуху равна 3.19.
Контрольная работа по теме «Предельные углеводороды»
Вариант №2
1. Из перечисленных соединений выберите пару изомеров и напишите их структурные формулы: 2,3,3-триметилпентан, диэтилпентан, 2,5-диметил-3,4-диэтилгексан, 2-метил-3,3-диэтилпентан, 3,3,4-триметилгексан.
2. Выберите формулы соединений для которых возможно существование энантиомеров.
3. Установите строение углеводорода С6Н14, при монобромировании которого образуется третичное бромопроизводное С6Н13Br. Напишите уравнения реакций, назовите вещества.
Напишите уравнения реакций, назовите вещества.
4. Напишите уравнения реакций следующих превращений:
Назовите продукты химических реакций.
5. На сжигание углеводорода массой 29г образовалось 88 г оксида углерода (IV) и 45 г воды. Найдите молекулярную формулу углеводорода.
6. Напишите уравнения реакций: а) изомеризации гексана; б) горения пропана в кислороде; в) нитрования пропана; г) бромирования пентана. Дайте названия продуктам реакций.
7. Для проведения синтеза Вюрца взяли два вещества: 1-бромэтан и 1-бромбутан. Напишите уравнения реакций, которые будут при этом протекать, и назовите образовавшиеся углеводороды.
Проверочная работа 10 класс. Алканы
Алканы
Вариант 1
1. Для
вещества, формула которого СН3 – СН – СН2 – СН3 ,
Для
вещества, формула которого СН3 – СН – СН2 – СН3 ,
СН3
составьте структурные формулы двух изомеров и одного гомолога. Назовите все вещества по систематической номенклатуре.
Составьте структурные формулы: а) 2,2-диметилпентана; б) 2-метил-З-хлорпентана.
Напишите уравнения реакций: а) изомеризации бутана; б) горения пропана.
Вариант 2
1. Для вещества, формула которого СН3
СН3 – С – СН2 – СН3.
СН3
составьте структурные формулы
двух изомеров и одного
гомолога.
Составьте структурные формулы: а) 2-метилпропана; б) 2,3-диметилбутана.
Напишите уравнения реакций: а) первой стадии хлорирования этана; б) получения этана из хлорметана.
Вариант 3
1. Для вещества, формула которого СН3
СН3 – СН – СН2 – СН – СН3,
СН3
составьте структурные формулы двух изомеров и двух гомологов — предыдущего и последующего.
Назовите все вещества по систематической номенклатуре.
2. Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
С
СН4 СН3Вг
С2Н6 СО2.
3. Напишите уравнения реакций получения предельных углеводородов в лабораторных условиях (не мнее двух способов).
Вариант 4
1. Для вещества, формула которого СН3
СН3 – С – СН2 — СН2 – СН3 .
СН3
составьте структурные формулы двух изомеров и двух гомологов — предыдущего и последующего. Назовите все вещества по систематической номенклатуре.
2. Напишите уравнения реакции
Вюрца, при помощи которых можно
получить углеводороды:
а) пентан; б)
2,5-диметилгексан. Напишите уравнения
реакций: а) первой стадии хлорирования
Напишите уравнения
реакций: а) первой стадии хлорирования
этана;
б) получения этана из хлорметана.
3. Изобразите электронное строение
молекулы этана. Укажите тип гибридизации
электронных орбита-
лей атомов углерода
и вид химических связей.
Контрольная работа по теме :» Алканы,алкены»
Контрольная работа по теме: «Алканы. Алкены».
Вариант №1.
Часть А
1А. Алканам соответствует общая формула
1) СņН2ņ 2) СņН2ņ-6
3) СņН2ņ+2 4) СņН2ņ-2
2А. Гомологом этилена не является
1) СН2=СН-СН2-СН3 2) СН2=СН-СН2-СН2-СН3
3) СН2=СН-СН3 4) СН3-СН2-СН3
3А. Структурным изомером пентена – 1 является
1) циклопентан 2) пентен – 2
3) 2 – метилбутен 4) 2 – метилпентен 1
4А. Алкан, молекула которого содержит 6 атомов углерода, имеет формулу:
Алкан, молекула которого содержит 6 атомов углерода, имеет формулу:
1) C6H14 2) C6H12
3) C6H10 4) C6H6
5А. Номера атомов, находящихся в состоянии sp2— гибридизации в молекуле бутена – 2
1) 1 и 2 2) 2 и 3
3) 3 и 4 4) 1 и 4
6А. Изомерами являются
1) 2,2 –диметилпропан и пентан 2) гексан и 2-метилбутан
3) 3-этилгексан и 3-этилпентан 4) пропан и пропен
7.А. Только σ — связи имеются в молекуле
1) бутена 2) пропилена
3) этилена 4) пентана
Часть В
В1 . Найдите соответствие между исходными веществами и продуктами реакции:
1) СН4 + О2 → а) СН3 – СН – СН3
|
СН3
2) С2Н6 + Сl2 → б) С2Н2 + Н2
AlCl3
3) СН3 – СН2 – СН2 – СН3 → в) С2Н5Сl + НCl
t1500º
4) СН4 → г) CO2 + H2O
д) CO + H2
е) C + H2
В2.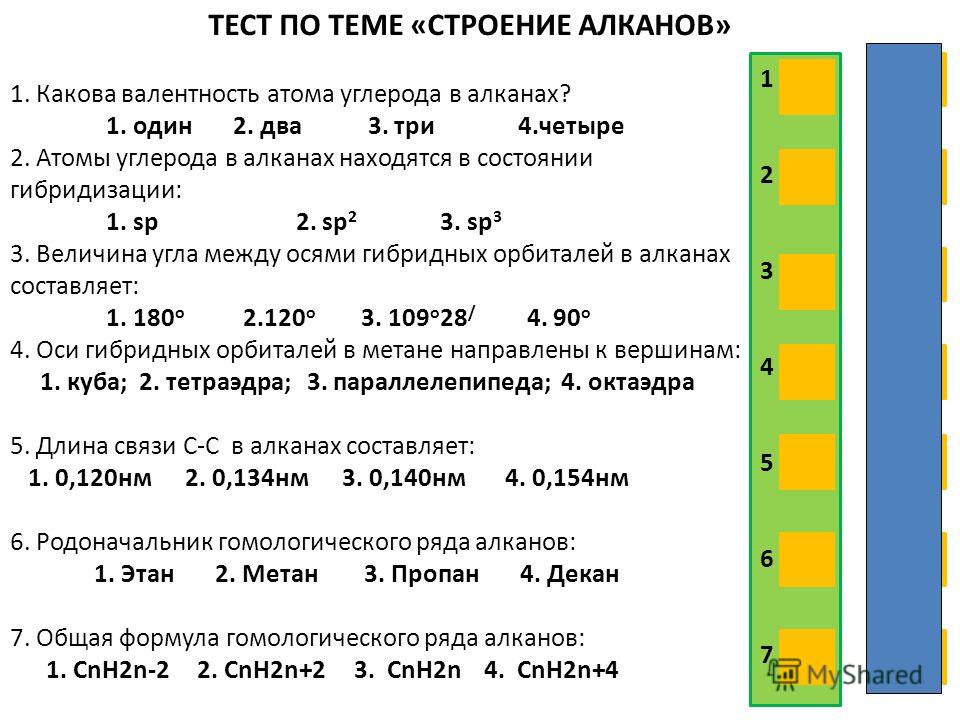 Для метана характерно:
Для метана характерно:
а) тетраэдрическое строение молекул
б) вступление в реакции гидрирования
в) плохая растворимость в воде
г) жидкое агрегатное состояние при н.у.
д) наличие одной π-связи
е) наличие четырех σ-связей
Ответ: _____________________
Часть С
С1. . Определите формулу углеводорода, массовая доля углерода в котором 85,7%, а плотность паров по водороду 56.
С2. Осуществите следующие превращения. Запишите уравнения реакций.
+ Cl2 +Na + Br2 + NaOH(спирт.)
СН3 – СН3 → Х1 → Х2 → Х3 → Х4
Контрольная работа по теме: «Алканы. Алкены».
Вариант №2.
Часть А
1А. Вещества с общей формулой CnH2n могут относиться к классам
Вещества с общей формулой CnH2n могут относиться к классам
1) алкинов и алкенов 2) алкинов и алкадиенов
3) алкенов и алкадиенов 4) алкенов и циклопарафинов
2А Гомологом С7H16 является
1) 2- метилгексан2) 3- метилоктен
3) 3- метилгексан4) октан
3А. Число σ-связей в молекуле 2 – метилпропана равно
1) 10 2) 11
3) 13 4) 12
4А. Структурным изомером пентена – 1 является
1) циклопентан 2) пентен – 2
3) 2 – метилбутен 4) 2 – метилпентен 1
5А. Тип реакции С2Н5ОН → С2Н4 + Н2О
1) замещение 2) присоединение
3) гидрирование 4) разложение
6А. Для получения углеводорода с более длинной углеродной цепью применяют реакцию:
1) Вюрца 2) Зайцева
3) Кучерова 4) Марковникова
ЧастьВ
В1. Установите соответствие между формулой вещества и коэффициентом, стоящим перед ним в уравнении реакции:
Установите соответствие между формулой вещества и коэффициентом, стоящим перед ним в уравнении реакции:
С4Н8 + О2 → СО2 + Н2О
1) С4Н8 а) 1
2) О2 б) 2
3) СО2 в) 4
4) Н2О г) 5
д) 6
е) 8
В2. Для этилена характерно
А) наличие в молекулах двойной связи
Б) хорошая растворимость в воде
В) обесцвечивание бромной воды
Г) наличие в молекулах только одинарных связей
Д) реакция полимеризации
Е) наличие тройной связи
Ответ: _____________________
ЧастьС
С1. Определите формулу углеводорода, массовая доля водорода в котором равна 20%.
Относительная плотность углеводорода по водороду равна 15.
С2. . Осуществите следующие превращения. Запишите уравнения реакций.
+H2O +1мольCl2 +Nа,t
Al4C3 →X1 → X2 → X3
Контрольная работа по теме: «Алканы. Алкены».
Алкены».
Вариант №3.
Часть А
1А. Гомолог вещества, формула которого СН2=СН-СН-СН2-СН3
ﺍ
СН3
1) 2 – метилгексан 2) гептан
3) гекан 4) 3 — метилгекен
2А. Вещество, являющееся исходным в реакции полимеризации, называется:
1) мономер 2) полимер
3) димер 4) тример
3А. Число σ связей в молекуле этилена равно
1) 1 2) 3
3) 5 4) 4
4А. Диметилпропан относится к классу углеводородов, общая формула которого
1) CnH2n+2 2) CnH2n -2
3) CnH2n4) CnH2n+1
5А. Валентный угол в молекулах алкенов составляет
1)109028 2) 1800
3)1200 4) 10405
6А.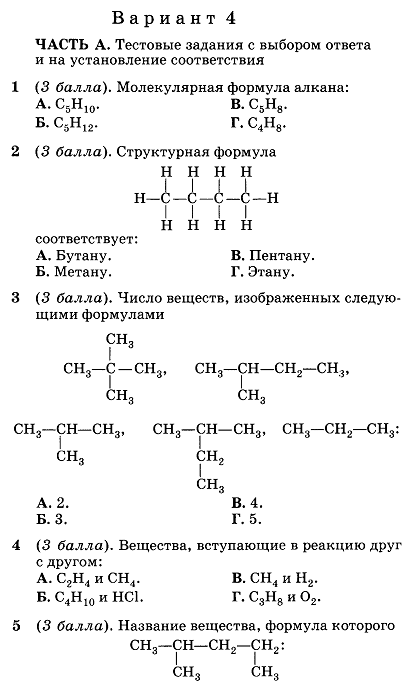 Продуктом реакции бутена-1 с хлором является
Продуктом реакции бутена-1 с хлором является
1) 2-хлрбутен-1 2) 1,2-дихлорбутан
3) 1,1-дихлорбутан 4) 1,2-дихлорбутен-1
Часть В
В1. Установите соответствие между формулой вещества и коэффициентом, стоящим перед ним в уравнении реакции:
С3Н8 + О2 → СО2 + Н2О
1) С3Н8 А) 3
2) О2 Б) 2
3) СО2 В) 8
4) Н2О Г) 4
Д) 1
Е) 5
В2. И для метана, и для пропена характерны:
А) реакции бромирования
Б) жидкое агрегатное состояние при н.у.
В) наличие π-связи в молекулах
Г) реакции гидрирования
Д) горение на воздухе
Е) малая растворимость в воде
Ответ: _____________________
Часть С
С1. Определите формулу углеводорода, массовая доля углерода в котором 85,7%, а плотность паров по водороду 56.
С2. Осуществите следующие превращения. Запишите уравнения реакций.
Осуществите следующие превращения. Запишите уравнения реакций.
Контрольная работа на тему «Предельные углеводороды (алканы) и их галогенопроизводные»
Контрольная работа на тему
«Предельные углеводороды (алканы) и их галогенопроизводные»
Вариант 1.
Решите тест.
1. Какова общая формула углеводородов ряда алканов:
1) CnH2n 2) CnHn 3) CnH2n-2 4) CnH2n+2
2. Какая химическая связь в алканах:
1) двойная 2) одинарная 3) σ-связь 4) π-связь
3. Какую геометрическую форму имеют молекулы предельных углеводородов:
1) тетраэдрическую 2) линейную 3) объемную 4) плоскую
4. Какая длина связи С-С и валентный угол в молекулах алканов:
1) 0,120 нм, 120̊ 2) 0,154 нм, 109̊28̍ 3) 0,140 нм, 120̊ 4) 0,134 нм, 109̊28̍
5. Какой тип реакции характерен для свойств алканов, обусловленных σ-связью С-Н:
Какой тип реакции характерен для свойств алканов, обусловленных σ-связью С-Н:
1) замещения 2) соединения 3) обмена 4) разложения
6. Как правильно назвать хлорпроизводный углеводород разветвленного (изомерного) строения: С2Н5-CHCl-СН2-СН-СН2-СН3
|
СН3
1) дихлоризогептан 2) 2-метилгептан-дихлор 3) 3-метил-5-хлоргептан 4) 3-хлор-5-метилгептан
7. Чем по отношению друг к другу являются вещества пропан и н-декан, а также
2-метил-3-хлорпентан и 2-метил-3-хлоргексан:
1) изомерами 2) гомологами 3) хлорпроизводными 4) углеводородами нормального строения
8. Чем различаются изомеры:
1) химическими свойствами 2) химической активностью
3) физическими свойствами 4) химическим строением
9. Чем отличается одновалентный радикал метана от молекулы метана:
1) имеет неспаренный электрон 2) является нейтральной частицей
3) нереакционноспособный 4) реакционноспособный
10. Сколько изомеров характерно для октана:
Сколько изомеров характерно для октана:
1) 3 2) 5 3) 9 4) 18
11. Чем двухвалентный радикал отличается от одновалентного:
1) имеет 1 неспаренный электрон 2) имеет 2 неспаренных электрона
3) не имеет электронов 4) не имеет неспаренных электронов
12. Укажите ряд, в котором прослеживаются только формулы типичных алканов:
1) CH4, C2H4, C5H12 2) C2H6O, C2H6, C10H22
3) C40H82, C15H32, C8H18 4) CH3Cl, CH2Cl2, CHCl3
13. Сколько разных веществ изображено на рисунке:
1) 7 2) 4 3) 3 4) 2
14. Сколько третичных атомов углерода изображено на рисунке:
1) 8 2) 4 3) 2 4) 0
Работа 1.
Предельные углеводороды (алканы) и их галогенопроизводные:
строение, номенклатура, изомерия.
Вариант 2.
Выполните задания.
1. Напишите структурные формулы всех углеводородов состава С5Н12.
2. Сколько веществ изображено следующими формулами:
СН3-СН2-СН3 СН3-СН2-СН2-СН3 (СН3)2СН-СН3
1) 1 2) 2 3) 3 4) 4
3. Из перечисленных ниже признаков выберите те, которые характерны для изомеров:
а) одинаковые свойства
б) разные свойства
в) химическое строение одинаковое
г) химическое строение разное
д) качественный состав молекулы одинаковый
е) качественный состав молекулы различный.
4. Есть ли среди приведенный ниже схем углеродных скелетов такие, которые отличаются лишь способом написания:
1) одинаковых нет 2) одинаковы 1 и 3 3) одинаковы 1 и 2 4) одинаковы 2 и 3
5. Что обозначает стрелка между атомами в формуле CH3→CH2→Br:
1) сдвиг атомов 2) сдвиг электронной плотности по цепи σ-связей
6. Соединения типа Н3С-Х, в котором Х-атом хлора, брома или иода, расположите в ряд, в котором увеличивается полярность связи С-Х.
Соединения типа Н3С-Х, в котором Х-атом хлора, брома или иода, расположите в ряд, в котором увеличивается полярность связи С-Х.
7. На какие атомы больше не распространяется влияние брома в соединении CH3-CH2-Br:
1) на атомы водорода группы СН3 2) на атомы водорода группы СН2
8. Расположите существенные признаки гомологов в логической последовательности:
а) сходные свойства
б) количественный состав отличается на гомологическую разность СН2
в) сходное химическое строение
9. Укажите первый из членов гомологического ряда нормальных углеводородов (предельного характера), находящийся при нормальных условиях в жидком состоянии.
10. В чем причина зигзагообразного строения углеродной цепи углеводородов:
1) во вращении атомов углерода вокруг простых связей
2) в тетраэдрическом направлении валентностей углеродного атома.
11. Какой валентный угол характерен для парафинов?
12.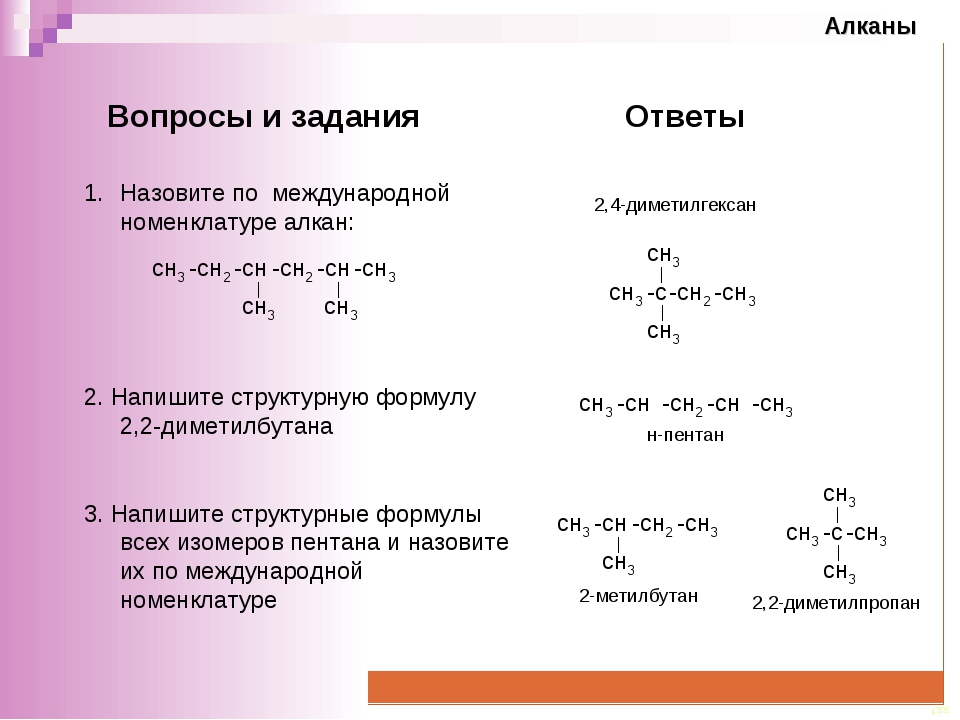 Какое изображение строения молекулы метана правильно:
Какое изображение строения молекулы метана правильно:
.
Работа 1.
Предельные углеводороды (алканы) и их галогенопроизводные:
строение, номенклатура, изомерия.
Вариант 3.
Выполните задания.
1. Каково суммарное число электронов всех атомов, входящих в состав формулы радикала метила?
2. Изобразите несколько конформеров бутана, ответьте на вопросы:
а) имеют ли они химическое строение разное или одинаковое?
б) валентные углы разные или одинаковые?
3. В приведенный ниже текст вставьте в нужных местах слова «конформер» или «изомер» (в соответствующей грамматической форме):
«…1… представляют собой геометрические формы молекул, переходящие друг в друга путем вращения вокруг простых связей. Взаимное превращение …2… осуществляется очень легко, поэтому …3… нельзя в обычных условиях выделить в виде индивидуальных веществ. В этом отличие …4… от …5… . Эти последние (…6…) различаются своим химическим строением, у …7… оно одинаково».
Эти последние (…6…) различаются своим химическим строением, у …7… оно одинаково».
4. Расположите перечисляемые ниже соединения в ряд по повышению их плотности: иодметан, хлорметан, бромметан.
5. Напишите структурную формулу простейшего алкана, в молекуле которого есть только первичные и четвертичные атомы углерода. Назовите его.
6. Сколько химических связей С-С и С-Н содержится в молекуле алкана CnH2n+2?
7. Составьте структурные формулы следующих алканов:
1) 2,2,3,4-тетраметилгептан
2) 2,3-диметил-3-изопропилгексан
3) 2-метил-3,3-диэтилоктан.
8. В одной из работ А.М. Бутлерова имеется следующий текст: «… Я называю химическим строением распределение действия химической силы (сродства), вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу… Химическая натура сложной частицы определяются натурой элементарных составных частей, количеством их и химическим строением».
Замените в этом тексте устаревшие термины (выделены жирно) современными.
9. Вывести структурные формулы всех изомерных предельных углеводородов, содержащих 12 атомов водорода в молекуле. Назвать соединения по систематической номенклатуре.
10. Какие электронные эффекты наблюдаются в молекулах у каждой группы атомов:
1) CH3-CH2-CH2-Cl
2) CH3-Br
3) CH3-I
11. Распределить по группам А, Б, В частицы, представлены в ряду: Cl—, OH—, H+, CH3COO—, CH3•, NO2+, •O•, OH•.
А: свободные радикалы
Б: электрофилы
В: нуклеофилы.
12. Назовите по систематической номенклатуре вещества:
.
▶▷▶ контрольная работа по химии 10 класс ответы углеводороды
▶▷▶ контрольная работа по химии 10 класс ответы углеводороды| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 11-11-2018 |
контрольная работа по химии 10 класс ответы углеводороды — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа «Углеводороды» 10-й класс открытыйурокрф/статьи/615054 Cached Задания к этой контрольной работе составлены по типу и на основе заданий ЕГЭ прошлых лет и сборника тестов “Химия 10 -11” [3], текста учебника “Химия 10 класс ” Рудзитис ГЕ, Фельдман ФГ [2] Контрольная работа в 10 классе по теме УГЛЕВОДОРОДЫ wwwmetod-kopilkaru/kontrolnaya_rabota_v_ 10 Cached Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа Контрольная работа по химии Алканы 10 класс testschoolru/2017/08/12/kontrolnaya-rabota-po Cached Контрольная работа по химии Алканы 10 класс Контрольная работа по химии Алканы с ответами для учащихся 10 класса Контрольная работа по химии 10 класс углеводороды габриелян docplayerru/65184197-Kontrolnaya-rabota-po Cached 1 Контрольная работа по химии 10 класс углеводороды габриелян ответы Итоговая контрольная работа по теме общая химия 11 класс по 10 Контрольная работа по химии 10 класс Углеводороды — Документ gigabazaru/doc/6733html Cached при сжигании 6,6 г пропина 3 балла Контрольная работа по химии 10 класс Углеводороды Вариант 4 ЧАСТЬ А Тестовые задания с выбором Контрольная работа № 1 по химии по теме «Углеводороды» (10 класс) infourokru/kontrolnaya-rabota-po-himii-po-teme Cached Контрольная работа по химии , по теме » Углеводороды » для учащихся 10 класса Данная контрольная работа составлена к учебнику ОСГабриеляна, для учащихся, изучающих химию на базовом уровне Контрольная работа по Химии «Органические вещества» 9 класс globuss24ru/doc/kontrolynaya-rabota-po-himii Cached 9 класс Контрольная работа №3 по теме: «Органические вещества» Вариант i ЧАСТЬ А Тестовые задания с выбором ответа 1 (2 балла) Контрольная работа к уроку химии «Углеводороды» 10 класс wwwuchportalru/load/61- 1-0 -43319 Cached Методическая разработка Контрольная работа к уроку химии » Углеводороды » 10 класс по предмету Химия Контрольная работа по теме «Углеводороды» 10 класс multiurokru/files/kontrol-naia-rabota-po-tiemie Cached Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа Проверочная и контрольная работы по теме: «Углеводороды» в 10 wwwslavkrugorg/proverochnaya-i-kontrolnaya-raboty-po Cached Итоговая контрольная работа по химии , 10 класс Вводный контроль по химии 9 класс Контрольная работа №1 по химии в 8 классе по теме “Первоначальные химические понятия” Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 14,100 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- Фельдман ФГ [2] Задачи – из сборника [1] Варианты 2-6 и ответы к ним приведены в Приложении Скрыть 5 Контрольная работа по теме » Углеводороды » 10 класс multiurokru › files/kontrol…rabota-po…10-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Вариант 1 Часть А Тестовые задания с выбором ответа За задание 1 балл Просмотр содержимого документа « Контрольная работа по теме » Углеводороды » 10 класс » Задания к контрольной работе по химии по теме » Углеводороды Спирты» ( 10 класс ) Вконтакте Одноклассники Facebook Twitter Читать ещё Вариант 1 Часть А Тестовые задания с выбором ответа За задание 1 балл Укажите общую формулу алканов 1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6 Укажите к какому классу относится УВ с формулой СН3 – СН3 1) алканов 2) алкенов 3) алкинов 4) аренов Укажите название изомера для вещества
- состоит из 9 тестовых вопросов и одной задачи Воробьева Елена Николаевна 10012016 Описание разработки 1 вариант Получите полные комплекты Электронная тетрадь по химии 10 класс Химия 11 класс ФГОС Электронная тетрадь по химии 9 класс Химия 8 класс Электронная тетрадь по химии 8 класс Химия 10 класс ФГОС Химия Вводный курс 7 класс ФГОС Химия 9 класс ФГОС Скачать разработку Сохранить у себя: Контрольная работа по химии на тему » Углеводороды » (014 MB) Проверочные работы по химии 10 класс 0 5337 Скрыть Контрольная работа по теме « Углеводороды » 10 класс videourokinet › razrabotki…rabota-po…10-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Работа состоит из двух частей: обязательной и дополнительной 4 Найдите молекулярную формулу углеводорода
- текста учебника “ Химия 10 класс ” Рудзитис ГЕ
алкины и арены
7 % углерода и 14
- изучающих химию на базовом уровне Контрольная работа по Химии «Органические вещества» 9 класс globuss24ru/doc/kontrolynaya-rabota-po-himii Cached 9 класс Контрольная работа №3 по теме: «Органические вещества» Вариант i ЧАСТЬ А Тестовые задания с выбором ответа 1 (2 балла) Контрольная работа к уроку химии «Углеводороды» 10 класс wwwuchportalru/load/61- 1-0 -43319 Cached Методическая разработка Контрольная работа к уроку химии » Углеводороды » 10 класс по предмету Химия Контрольная работа по теме «Углеводороды» 10 класс multiurokru/files/kontrol-naia-rabota-po-tiemie Cached Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа Проверочная и контрольная работы по теме: «Углеводороды» в 10 wwwslavkrugorg/proverochnaya-i-kontrolnaya-raboty-po Cached Итоговая контрольная работа по химии
- 10 класс Вводный контроль по химии 9 класс Контрольная работа №1 по химии в 8 классе по теме “Первоначальные химические понятия” Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster
- smarter
контрольная работа по химии 10 класс ответы углеводороды — Все результаты Химия 10 классКонтрольная работа «Углеводороды» — Инфоурок › Химия Похожие Контрольная работа по теме « Углеводороды » Вариант 1 1К классу алканов относится 1) C2h5 2) Ch5 3) C3H6 4) C5H 10 2Установите Контрольная работа по теме «Углеводороды» 10 класс 6 дек 2013 г — Методическая разработка по химии ( 10 класс ) по теме: Контрольная работа по теме « Углеводороды » 10 класс Опубликовано 06122013 За каждый верный ответ задания, в части 2 дается 2 балла Часть 3 (С1) Контрольная работа «Углеводороды» 10-й класс открытыйурокрф/статьи/615054/ ответа учениками Приведены 6 вариантов контрольной работы и ответы к ним Разделы: Химия Контрольная работа проводится в 10 -м классе Контрольная работа по химии 10 класс Углеводороды — Документ Контрольная работа по химии 10 класс Углеводороды Вариант 1 ЧАСТЬ А Тестовые задания с выбором ответа 1 (2 балла) Общая формула аренов: Контрольная работа по химии 10 класс углеводороды ответы на Контрольная работа по химии 10 класс углеводороды ответы на все Ответы на вопросы по истории рабочая тетрадь 6 класс крючкова параграф Контрольная работа в 10 классе по теме УГЛЕВОДОРОДЫ Похожие 7 янв 2015 г — Скачать: контрольная работа в 10 классе по теме углеводороды Напишите уравнения химических реакций для следующих превращений: 6 баллов Ch5 → Ch4Cl → C2H6 → C2H5NO Эталоны ответов № п/п Видео 0:08 10 класс Контрольная работа #1 Теория строения органических Александр Радиончик YouTube — 3 дек 2016 г 10:24 Контрольная работа по углеводородам Олег Алексндрович YouTube — 13 дек 2015 г 42:28 Химия 10 класс Обобщение Углеводороды Учебное видео YouTube — 28 июл 2015 г Все результаты контрольная работа по химии 10 класс по теме «Углеводороды контрольная работа по химии 10 класс по теме » Углеводороды » — в разделе Контроль знаний, по направлениям Химия , Методические и учебные Не найдено: ответы Полугодовая контрольная работа по химии для учащихся 10 классов Похожие 11 дек 2014 г — Данная контрольная работа для 10 класса Время Цель: контроль знаний учащихся по темам «Предельные углеводороды «, «Непре КОНТРОЛЬНЫЕ РАБОТЫ, 10 класс Контрольная работа 1 КОНТРОЛЬНЫЕ РАБОТЫ, 10 класс Контрольная работа 1 «Предельные углеводороды » 6) с преимущественным образованием 1-хлорпропана Ответ : A10 Сходство химических свойств бензола и предельных углеводородов Контрольная работа к уроку химии «Углеводороды» 10 класс 11 сент 2013 г — Контрольная работа к уроку химии » Углеводороды » 10 класс иногда просто нет времени сочинять К/р, а у Вас еще и с ответами ! Контрольная работа по теме «Углеводороды» 10 класс — Мультиурок Контрольная работа по теме » Углеводороды » 10 класс Категория: Химия 06032015 21:25 Контрольная работа по теме « Углеводороды » Вариант 1 Картинки по запросу контрольная работа по химии 10 класс ответы углеводороды «cl»:12,»cr»:3,»ct»:12,»id»:»3iax60aYieShsM:»,»ml»:»600″:»bh»:90,»bw»:62,»oh»:651,»ou»:» «,»ow»:513,»pt»:»ipinimgcom/originals/da/ea/fb/daeafb8072ab685d07″,»rh»:»pinterestcom»,»rid»:»0nYeb1_DQtnQAM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Pinterest»,»th»:94,»tu»:» \u003dtbn:ANd9GcR9qOi9PLzt0KZ_-qtKBXppBYX1aT5N6hddrUt6fDwqhdqTtKpgwZvQWA»,»tw»:74 «id»:»B_g9ivHgR22N_M:»,»ml»:»600″:»bh»:90,»bw»:120,»oh»:843,»ou»:» «,»ow»:1429,»pt»:»arhivurokovru/kopilka/uploads/user_file_54896e7f6″,»rh»:»kopilkaurokovru»,»rid»:»i0y82Vjg91CZJM»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcRoNvd3peSOIt5gxvK-xIjswk9r9aUBKT0XU-kihJ5YavDzQWac-483jWE»,»tw»:153 «cl»:12,»id»:»TdQvlV-VZdBZBM:»,»ml»:»600″:»bh»:90,»bw»:80,»oh»:800,»ou»:» «,»ow»:800,»pt»:»otvetimgsmailru/download/213241978_21bf39b1bc0ef»,»rh»:»otvetmailru»,»rid»:»odInyI-XOawxIM»,»rt»:0,»ru»:» «,»st»:»Ответы@MailRu»,»th»:90,»tu»:» \u003dtbn:ANd9GcQHrmjqFmM5wJ2xMOIP8tM3bhTdfl4sBA_h-N312kymL6p4ZuI-CQnr5Vg»,»tw»:90 «cb»:18,»cl»:12,»cr»:6,»ct»:6,»id»:»HF9qe9H6QqPkfM:»,»ml»:»600″:»bh»:90,»bw»:54,»oh»:708,»ou»:» «,»ow»:500,»pt»:»znanioru/static/files/cache/08/f9/08f91133f340802″,»rh»:»znanioru»,»rid»:»YMXIi77WYlZ1zM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Знанио»,»th»:99,»tu»:» \u003dtbn:ANd9GcQdQcb87JiSmhP0N-60l7yrD6gDm2Y0faQCDcsh4fo1GFVX57t6I33QeQ»,»tw»:70 «cl»:3,»cr»:6,»id»:»myjHrN4qqUIq7M:»,»ml»:»600″:»bh»:90,»bw»:71,»oh»:480,»ou»:» «,»ow»:411,»pt»:»ds04infourokru/uploads/ex/10ed/0012d59c-34a44cc9″,»rh»:»infourokru»,»rid»:»ahmSEvy8eUx8-M»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:90,»tu»:» \u003dtbn:ANd9GcRt89n4HNs6PlEBzsJTWrpWd7Up25ecDVy8BF-ss6V6fQA-B9DpDZOcxRw»,»tw»:77 «cl»:3,»id»:»GfHDNJDZNvt95M:»,»ml»:»600″:»bh»:90,»bw»:71,»oh»:491,»ou»:» «,»ow»:395,»pt»:»ds04infourokru/uploads/ex/10ed/0012d59c-34a44cc9″,»rh»:»infourokru»,»rid»:»ahmSEvy8eUx8-M»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:93,»tu»:» \u003dtbn:ANd9GcS2TzT61vUGBZd7lqij3PMA1bid2Q58coiQCqKgHJklz9pdLTLz7msjpw»,»tw»:75 «id»:»aedZ5C6bYZp-AM:»,»ml»:»600″:»bh»:90,»bw»:118,»oh»:576,»ou»:» «,»ow»:1024,»pt»:»iytimgcom/vi/7zLyr5uNBlM/maxresdefaultjpg»,»rh»:»youtubecom»,»rid»:»G0JaWUa0H0cZ6M»,»rt»:0,»ru»:» \u003d7zLyr5uNBlM»,»sc»:1,»st»:»YouTube»,»th»:90,»tu»:» \u003dtbn:ANd9GcSLMMvoIhT3Z2UXmXlX-47RenDJ1fScMt-I9vnfY30SYZZO_Nvt_CT0Uoo»,»tw»:160 Другие картинки по запросу «контрольная работа по химии 10 класс ответы углеводороды» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты Проверочная работа по химии «Предельные углеводороды» (10 10 нояб 2017 г — Контрольная работа №1 по теме «Предельные углеводороды » Фамилия , имя Проверочные работы по химии 10 класс 0 1517 36 Итоговая контрольная работа по химии в 10 классе — Урокрф 20 апр 2017 г — Методические разработки по Химии для 10 класса по УМК ГЕ Итоговая контрольная работа по химии в 10 классе « Углеводороды » Вывести молекулярную формулу органического вещества Ответы 1 3 24 [PDF] Химия 10 класс Контрольная работа №1 (10 класс (2)pdf Похожие Химия 10 класс Контрольная работа №1 ( 10 класс ) « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа 1 (2 балла) Общая Контрольная работа «углеводороды» (тест) — Главное меню Контрольная работа « Углеводороды » ( химия 10 класс , ОС Габриелян, контрольные и проверочные работы к учебнику ОС Габриеляна « Химия 10» ) 10 класс Химия Тематическая контрольная работа Углеводороды 10 класс Химия Тематическая контрольная работа Углеводороды Вариант 1 Проверка знаний Ответы@MailRu: Помогите решить контрольную работу по химии на › Наука, Техника, Языки › Естественные науки Похожие 25 дек 2012 г — А1 Гомологом ацетилена может быть углеводород с формулой А2 Сколько изомеров отвечают составу С6Н14 А3 С каждым из Ответы MailRu: контрольная работа по химии по теме 16 дек 2017 г Ответы MailRu: Химия 10 класс Тема: «Предельные и 13 июл 2015 г Ответы @MailRu: помогите, пожалуйста, по химии за 10 9 нояб 2014 г Другие результаты с сайта otvetmailru Контрольная работа по химии 10 класс по теме : «Углеводороды Похожие Контрольная работа по химии 10 класс по теме : « Углеводороды » получен нитробензол Какова его масса, ответ подтвердите расчётом 2 вариант 1 Контрольная работа по теме «Углеводороды» 10 класс 15 нояб 2015 г — Контрольная работа по теме » Углеводороды » 10 класс (базовый уровень) по разделу » Углеводороды » курса органической химии ( 10 класс , из 3-х частей, задания — тесты и вопросы со свободными ответами Решебник по химии за 10 класс к дидактическому материалу Решебник по химии за 10 класс к дидактическому материалу химия АМ Радецкий 10-11кл Предельные углеводороды (алканы, или парафины) Подготовка к контрольной работе по теме «Углеводороды»; 10 класс pedsovetsu › Файлы для скачивания › Химия › Презентации Похожие 23 апр 2012 г — Регистрация · Главная · Файлы · ФГОС · Методика · Приёмы · ИКТ · Форум · Вопрос- Ответ · Анализаторы · Объявления Подготовка к контрольной работе по теме « Углеводороды »; 10 класс Автор: Ким НВ Учитель химии МБОУ «СОШ № 6» г Что подготовка к ЕГЭ — тяжелая работа Контрольная работа по химии номер 1 углеводороды 10 класс Контрольная работа по химии номер 1 углеводороды 10 класс See more Билеты по bjkjubb 9 класс с ответами Windows 8, Literature, Literatura Контрольная работа» Углеводороды»10 класс физико myhimsiteru/kontrolnaya-rabota-uglevodorody-10-klass-fiziko-matematicheskiy-profil Похожие Контрольная работа » Углеводороды » 10 класс физико — математический профиль Составьте уравнения химических реакций, схемы которых: А С2 Н4+Сl2 Б С2 Н4+h3O Г СН4+Сl2 Часть С (3 варианта ответов ) 1 Разноуровневые контрольные работы по химии на тему — Компэду 3 нояб 2017 г — составлена контрольная полугодовая по химии за 10 класс на тему: Контрольная работа за 1 полугодие « Углеводороды » 10 класс Проверочная и контрольная работы по теме: «Углеводороды» в uchkopilkaru//3512-proverochnaya-i-kontrolnaya-raboty-po-teme-uglevodorody- Похожие 20 февр 2014 г — В этом разделе категории » Химия » опубликованы контрольные и Ответ подтвердите расчетом массовой доли углерода в молекулах Контрольная работа №1 « Углеводороды » 10класс Вариант3 Вариант4 1 контрольная работа химия углеводороды и их природные источники petrokomcom//kontrolnaia-rabota-khimiia-uglevodorody-i-ikh-prirodnye-istochnik контрольная работа химия углеводороды и их природные источники источники » ( 10 класс ) Контрольная работа по химии » Углеводороды и их ответ полный и правильный на основании Контрольная работа «Алканы» Химия 10 класс контрольные Комбинированные контрольные контрольные работы « Химия 10 класс Базовый уровень» последовательность из трех цифр, которые соответствуют номерам правильных ответов 1 Контрольная работа №1 « Углеводороды и их природные источники» Зыгалова Л | Контрольная работа по органической химии him1septemberru/articlephp?ID=200402806 Похожие Контрольная работа Углеводороды 11 класс ОТВЕТЫ И РЕШЕНИЯ Задания 10 %, (C2h3) = 75% Найти: V(C2h3) Решение M(CaC2) = 64 г/ моль, [PDF] Углеводороды и их природные источники wwwshkola10-baikonuredusiteru//5b2e4b1a-31b9-4c26-ae4c-fd4af2ec03e7pdf Преподавание ведется по учебнику Химия 10 класс : учебник для ответ полный и правильный на основании изученных теорий; — материал изложен в определенной Контрольная работа № 2 по теме « Углеводороды » Контрольная работа по химии 10 класс углеводороды вариант 3 Контрольная работа по химии 10 класс углеводороды вариант 3 ответы , контрольная работа окружающий мир 3 класс 2 четверть 2100 Контрольная Упр 1 Вариант 2 Работа 3 Тема 3 Непредельные углеводороды Ответы на вопрос – Упр 1 Вариант 2 Работа 3 Тема 3 Непредельные углеводороды Химия Дидактический материал 10 класс АМ Радецкий ГДЗ – читайте на Рамблер/класс [PDF] 10 класс Габриеляна ОС « Химия 10 класс программы по курсу « Химия 10 класс » использованы: 13 Контрольная работа №1 по теме: « Углеводороды » 1 [PDF] Рабочая программа по химии 10 А (соц-гум) — МОУ СОШ №33 г Ароматические углеводороды : Бензол и его гомологи: изомерия, номенклатура Сведения из истории Итоговая контрольная работа за курс 10 класса 1 ч Тема 8 ответ полный и правильный на основании изученных теорий; контрольная работа по химии 10 класс органическая химия ответы h-hostercom//kontrolnaia-rabota-po-khimii-10-klass-organicheskaia-khimiia-otvety контрольная работа по химии 10 класс органическая химия ответы по химии 10 класс углеводороды габриелян ответы Итоговая контрольная работа Контрольная работа по теме «Углеводороды» | Образовательный Похожие 5 дек 2016 г — Предмет: химия , класс : 10 (базовый уровень) УМК: программа курса химии А-7 А-8 А-9 А- 10 Номер ответа Часть В ответы в свободной форме Контрольная работа № 1 по теме: « Углеводороды » Вариант № 1 Контрольная работа по химии:»Углеводороды», 10 класс Похожие Контрольная работа по химии по разделу: » Углеводороды «, 10 класс Содержит 14 заданий: с выбором одного правильного ответа и с полным ответом3 КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «УГЛЕВОДОРОДЫ КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ « УГЛЕВОДОРОДЫ » Настольная книга учителя химии 10 класс — поурочные разработки Ответ поясните контрольная работа по химии 10 класс фенолы спирты с ответами sns-russiaru//kontrolnaia-rabota-po-khimii-10-klass-fenoly-spirty-s-otvetamixml контрольная работа по химии 10 класс фенолы спирты с ответами химия 10 класс Контрольная работа 1: Углеводороды Самостоятельная работа контрольная работа тема по химии по теме углеводороды 10 класс gpszonehu//kontrolnaia-rabota-tema-po-khimii-po-teme-uglevodorody-10-klassx контрольная работа тема по химии по теме углеводороды 10 класс Алканы 10 класс Контрольная работа по химии Алканы с ответами для учащихся Контрольная работа по теме «Углеводороды — Первый uchiucozru › Статьи › По предмету › Учителю химии Похожие Контрольная работа по теме « Углеводороды » Укажите к какому классу относится УВ с формулой СН3 – СН3 1) алканов 2) Эталоны ответов контрольная работа по химии по теме углеводороды 10 класс контрольная работа по химии по теме углеводороды 10 класс рудзитис Углеводороды » с эталонами ответов Класс : 10 Программа ГЕ Рудзитис Химия 10 класс debiomsuru/mod/book/viewphp?id=2890&chapterid=18 Похожие Программа дистанционного подготовительного курса » Химия 10 класс » Контрольная работа №1 Непредельные углеводороды – алкадиены Ответы контрольная работа по химии 10 класс тема углеводороды smokussusraru/165/ 9 апр 2018 г — Телешколы по химии 10 класс Тема: Углеводороды в природе Тема Ответы к тесту по химии на тему Углеводороды 2 варианта контрольная работа по химии 10 класс габриелян ответы — Qip aeternaqipru/blogs/post/4661737/ 25 февр 2015 г — контрольная работа по химии 10 класс габриелян ответы углеводороды Рабочая программа по химии 10 класс (по учебнику ОС Вариант контрольной работы по теме «Углеводороды и их diva106blogspotcom//Variant-kontrolnoj-raboty-po-teme-Uglevodorody-i-ih-prir Мы закончили изучение одной из важных тем курса органической химии : Вам предстоит написать контрольную работу по данной теме (1 урок = 40 минут) Главная → 10 класс → базовый уровень → Вариант контрольной Углеводороды: от алканов до аренов Химия 10 класс Разработка › › Разработки уроков (конспекты уроков) УМК « Химия 10 класс » О С Габриеляна Деятельность учащихся ( возможные варианты ответов ) Подача информации, диалог, самост работа Химия Базовый уровень 10 класс Контрольные и проверочные работы Контрольная работа по химии по теме Углеводороды, 10 класс wwwdmg-brighttimecom//proverochnaya-rabota-po-himii-10-klass-uglevodixml Контрольная работа № 3 по теме «Углеводы» Контрольная работа к уроку химии Углеводороды 10 класс Контрольные работы по химии — Химия Решебник по химии за 10 класс к дидактическому материалу Контрольная Контрольная работа по химии 10 класс по теме : «Углеводороды» Допишите возможную реакцию, назовите продукты реакции 4 Из 7,8г бензола получен нитробензол Какова его масса, ответ подтвердите расчётом Вместе с контрольная работа по химии 10 класс ответы углеводороды часто ищут контрольная работа по химии 10 класс углеводороды ответы габриелян контрольная работа по химии 10 класс алканы контрольная работа по химии 10 класс углеводороды вариант 1 ответы итоговая контрольная работа по химии 10 класс ответы контрольная работа по химии 10 класс органическая химия ответы контрольная работа по химии 10 класс углеводороды рудзитис контрольная работа по химии 10 класс 1 четверть контрольная работа по химии 10 11 класс Навигация по страницам 1 2 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Музыка Переводчик Диск Почта Коллекции Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Контрольная работа по химии » Углеводороды » ( 10 ) infourokru › kontrolnaya…himii-uglevodorodi-klass… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме « Углеводороды » 10 класс (базовый уровень) Автор: Бурмасова СМ учитель химии МБОУ СОШ №24 Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа За задание 1 балл 1 Укажите общую формулу алкенов 1) Cnh3n +2 2) Читать ещё Контрольная работа по теме « Углеводороды » 10 класс (базовый уровень) Автор: Бурмасова СМ учитель химии МБОУ СОШ №24 Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа За задание 1 балл 1 Укажите общую формулу алкенов 1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6 Укажите к какому классу относится углеводород с формулой СН3 – С = СН2 | СН3 1) алканов 2) алкенов 3) алкинов 4) аренов Скрыть 2 Методическая разработка по химии ( 10 класс ) по теме nsportalru › …kontrolnaya…po…uglevodorody-10-klass Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме « Углеводороды » (Проектирование теста учебных достижений в формате ЕГЭ) На выполнение контрольной работы по химии отводится 40 минут Работа состоит из 3 частей и включает 10 заданий Часть1 включает 7 заданий (А1-А7) базового уровня Каждому заданию Читать ещё Контрольная работа по теме « Углеводороды » (Проектирование теста учебных достижений в формате ЕГЭ) составила: Шаншаева Сапижат Исаевна учитель химии МБОУ «СОШ № 2» гТарко-Сале 2013г Кодификатор элементов содержания проверочного контроля по теме « Углеводороды » На выполнение контрольной работы по химии отводится 40 минут Работа состоит из 3 частей и включает 10 заданий Часть1 включает 7 заданий (А1-А7) базового уровня Каждому заданию дается 4 варианта ответа , из которых только один правильный За каждый верный ответ дается 1 балл Внимательно прочитай каждое задание и проанализируй все варианты предложенных ответов Скрыть 3 Тест по химии ( 10 класс ) на тему: Контрольная работа nsportalru › Школа › Химия › …-khimiiuglevodorody-10… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по химии по разделу: » Углеводороды «, 10 класс Содержит 14 заданий : с выбором одного правильного ответа и с полным Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа Общая формула алкенов: А Cnh3n Б Cnh3n+1 В Cnh3n +2 Г Читать ещё Контрольная работа по химии по разделу: » Углеводороды «, 10 класс Содержит 14 заданий : с выбором одного правильного ответа и с полным ответом 3 варианта Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа Общая формула алкенов: А Cnh3n Б Cnh3n+1 В Cnh3n +2 Г Cnh3n- 2 Углеводород состава С6Н6 относится к классу: А алконов Б Алкенов В Алкинов Скрыть 4 Контрольная работа » Углеводороды » 10 -й класс открытыйурокрф › статьи/615054/ Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа состоит из 7 заданий с выбором ответа и 1 задачи 10 -й класс Медведева Елена Леонидовна, учитель химии Задания к этой контрольной работе составлены по типу и на основе заданий ЕГЭ прошлых лет и сборника тестов “ Химия 10 -11” [3], текста учебника “ Химия Читать ещё Контрольная работа состоит из 7 заданий с выбором ответа и 1 задачи Максимальное число баллов – 13 Система оценивания уменьшает вероятность случайного выбора ответа учениками Приведены 6 вариантов контрольной работы и ответы к ним 10-й класс Медведева Елена Леонидовна, учитель химии Разделы: Химия Контрольная работа проводится в 10-м классе социально-гуманитарного профиля Задания к этой контрольной работе составлены по типу и на основе заданий ЕГЭ прошлых лет и сборника тестов “ Химия 10 -11” [3], текста учебника “ Химия 10 класс ” Рудзитис ГЕ, Фельдман ФГ [2] Задачи – из сборника [1] Варианты 2-6 и ответы к ним приведены в Приложении Скрыть 5 Контрольная работа по теме » Углеводороды » 10 класс multiurokru › files/kontrol…rabota-po…10-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Вариант 1 Часть А Тестовые задания с выбором ответа За задание 1 балл Просмотр содержимого документа « Контрольная работа по теме » Углеводороды » 10 класс » Задания к контрольной работе по химии по теме » Углеводороды Спирты» ( 10 класс ) Вконтакте Одноклассники Facebook Twitter Читать ещё Вариант 1 Часть А Тестовые задания с выбором ответа За задание 1 балл Укажите общую формулу алканов 1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6 Укажите к какому классу относится УВ с формулой СН3 – СН3 1) алканов 2) алкенов 3) алкинов 4) аренов Укажите название изомера для вещества, формула которого СН2 = СН – СН2 – СН3 Просмотр содержимого документа « Контрольная работа по теме » Углеводороды » 10 класс » Контрольная работа по теме « Углеводороды » Вариант 1 Часть А Тестовые задания с выбором ответа Задания к контрольной работе по химии по теме » Углеводороды Спирты» ( 10 класс ) Вконтакте Одноклассники Facebook Twitter Google+ 1 нравится Скрыть 6 Контрольная работа по химии 10 класс Углеводороды gigabazaru › doc/6733html Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по химии ( 9 класс ) ОРГАНИЧЕСКИЕ ВЕЩЕСТВА Вариант 4 ЧАСТЬ для сгорания 2 л этана: А 2 л Б 4 л В 3 балла Контрольная работа по теме « Углеводороды » Вариант 2 Часть А Тестовые задания с при сжигании 6,6 г пропина 3 балла Контрольная работа по химии 10 класс Читать ещё Контрольная работа по химии ( 9 класс) ОРГАНИЧЕСКИЕ ВЕЩЕСТВА Вариант 4 ЧАСТЬ для сгорания 2 л этана: А 2 л Б 4 л В 5 л Г 10 л (2 балла) Этилен не взаимодействует с веществом Контрольная работа по теме « Углеводороды » 3 балла Контрольная работа по теме « Углеводороды » Вариант 2 Часть А Тестовые задания с при сжигании 6,6 г пропина 3 балла Контрольная работа по химии 10 класс Углеводороды Вариант 4 ЧАСТЬ А Тестовые задания с выбором Скрыть 7 Разноуровневые контрольные работы по химии на тему compeduru › publication…po-khimii…uglevodorodyhtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа за 1 полугодие « Углеводороды » 10 класс Первый уровень Вариант 1 Найдите молекулярную формулу углеводорода Сохранить у себя: Разноуровневые контрольные работы по химии на тему: » Углеводороды » Скачать разработку Похожие файлы Химические свойства кислот в Читать ещё Контрольная работа за 1 полугодие « Углеводороды » 10 класс Первый уровень Вариант 1 Задание 1 Для вещества, формула которого СН3 – СН2 – СН2 – СН2 – СН3+ Найдите молекулярную формулу углеводорода Сохранить у себя: Разноуровневые контрольные работы по химии на тему: » Углеводороды » Скачать разработку Похожие файлы Химические свойства кислот в свете теории электролитической диссоциации Проектная деятельность учащихся по химии во внеурочное время Углеводы Презентация к уроку химии в 10 классе Методические рекомендации по проведению дидактических игр на уроках химии Контрольная работа № 1 Получите свидетельство о публикации сразу после загрузки работы Скрыть 8 Контрольная работа по химии 10 класс ответы углеводороды — смотрите картинки ЯндексКартинки › контрольная работа по химии 10 класс ответы Пожаловаться Информация о сайте Ещё картинки 9 Контрольная работа «Предельные углеводороды » 10 uchitelyacom › Химия › …-uglevodorody-10… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по теме «Предельные углеводороды » Вариант №1 1А Диметилпропан относится к классу углеводородов Химия — еще материалы к урокам: Контрольная работа «Непредельные углеводороды » 10 класс Контрольная работа «Периодически закон и Периодическая Читать ещё Контрольная работа по теме «Предельные углеводороды » Вариант №1 1А Диметилпропан относится к классу углеводородов , общая формула которого 1) C n Химия — еще материалы к урокам: Контрольная работа «Непредельные углеводороды » 10 класс Контрольная работа «Периодически закон и Периодическая система химических элементов ДИ Менделеева» 9 класс Самостоятельная работа «Расстановка коэффициентов» 8 класс Технологическая карта урока «Кислоты и их классификация» 8 класс Интеллектуальная игра «Последствия действий некоторых химических веществ» 11 класс Скрыть 10 Контрольная работа по химии на тему » Углеводороды » videourokinet › …rabota-po-khimii…uglevodorodyhtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа включает классы алканы, циклоалканы, алкены, диены, алкины и арены, состоит из 9 тестовых вопросов и одной задачи Получите полные комплекты Электронная тетрадь по химии 10 класс Химия 11 класс ФГОС Электронная тетрадь по химии 9 класс Химия 8 класс Читать ещё Контрольная работа включает классы алканы, циклоалканы, алкены, диены, алкины и арены, состоит из 9 тестовых вопросов и одной задачи Воробьева Елена Николаевна 10012016 Описание разработки 1 вариант Получите полные комплекты Электронная тетрадь по химии 10 класс Химия 11 класс ФГОС Электронная тетрадь по химии 9 класс Химия 8 класс Электронная тетрадь по химии 8 класс Химия 10 класс ФГОС Химия Вводный курс 7 класс ФГОС Химия 9 класс ФГОС Скачать разработку Сохранить у себя: Контрольная работа по химии на тему » Углеводороды » (014 MB) Проверочные работы по химии 10 класс 0 5337 Скрыть Контрольная работа по теме « Углеводороды » 10 класс videourokinet › razrabotki…rabota-po…10-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Работа состоит из двух частей: обязательной и дополнительной 4 Найдите молекулярную формулу углеводорода , содержащего по массе 85,7 % углерода и 14,3 % водорода; плотность вещества по Рабочая программа по химии 10 класс Разработка урока по химии на тему «Спирты» Комментарии 0 Читать ещё Работа состоит из двух частей: обязательной и дополнительной Работа составленна в соответствии с требованиями ФГОС 4 Найдите молекулярную формулу углеводорода , содержащего по массе 85,7 % углерода и 14,3 % водорода; плотность вещества по водороду равна 28 Дополнительная часть 5 При помощи каких реакций можно отличить пентин-1 от пентина-2? Рабочая программа по химии 10 класс Разработка урока по химии на тему «Спирты» Комментарии 0 Скрыть Вместе с « контрольная работа по химии 10 класс ответы углеводороды » ищут: итоговая контрольная работа по химии 10 класс контрольные работы по химии 10 класс габриелян с ответами входная контрольная работа по химии 10 класс габриелян с ответами контрольная работа по химии 11 класс итоговая контрольная работа по химии 10 класс с ответами гдз по химии 10 класс габриелян годовая контрольная работа по химии 10 класс контрольная работа по химии 9 класс сумма коэффициентов в уравнении реакции полного сгорания этана равна вещества имеющие формулы сн3 о сн3 и сн3 сн2 он являются 1 2 3 4 5 дальше Bing Google Mailru Нашлось 243 млн результатов Дать объявление Регистрация Войти 0+ Поиграйте с Алисой в города в ЯндексБраузере Установить Закрыть Попробовать еще раз Включить Москва Настройки Клавиатура Помощь Обратная связь Для бизнеса Директ Метрика Касса Телефония Для души Музыка Погода ТВ онлайн Коллекции Яндекс О компании Вакансии Блог Контакты Мобильный поиск © 1997–2018 ООО «Яндекс» Лицензия на поиск Статистика Поиск защищён технологией Protect Вы всегда успеете к началу На Яндексе можно смотреть любимые телепередачи после эфира Перейти
Тест Алканы и углеводороды с ответами по теме онлайн
Сложность: новичок. Последний раз тест пройден 20 часов назад.
Последний раз тест пройден 20 часов назад.
Вопрос 1 из 10
Связи в молекуле алканов:
- Правильный ответ
- Неправильный ответ
- Вы и еще 81% ответили правильно
- 81% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветитьВопрос 2 из 10
Укажите молекулярную формулу этана:
- Правильный ответ
- Неправильный ответ
- Вы и еще 94% ответили правильно
- 94% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 3 из 10
Укажите формулу вещества , относящегося к классу «Алканы»:
- Правильный ответ
- Неправильный ответ
- Вы и еще 82% ответили правильно
- 82% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 4 из 10
Общая формула гомологического ряда алканов:
- Правильный ответ
- Неправильный ответ
- Вы и еще 88% ответили правильно
- 88% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 5 из 10
Природный газ содержит главным образом:
- Правильный ответ
- Неправильный ответ
- Вы и еще 67% ответили правильно
- 67% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 6 из 10
Для алканов характерна гибридизация:
- Правильный ответ
- Неправильный ответ
- Вы и еще 73% ответили правильно
- 73% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 7 из 10
Угол между атомами углерода в молекулах алканов составляет:
- Правильный ответ
- Неправильный ответ
- Вы и еще 63% ответили правильно
- 63% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 8 из 10
Формулы только алканов записаны в ряду:
- Правильный ответ
- Неправильный ответ
- Вы и еще 88% ответили правильно
- 88% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 9 из 10
Для алканов характерна изомерия:
- Правильный ответ
- Неправильный ответ
- Вы и еще 77% ответили правильно
- 77% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 10 из 10
Для алканов не характерна реакция:
- Правильный ответ
- Неправильный ответ
- Вы и еще 54% ответили правильно
- 54% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Владислав Попов
10/10
Дмитрий Меразов
9/10
Таня Приходько
10/10
Анна Лось
9/10
Татьяна Исмаилова
9/10
Вячеслав Борзых
10/10
Патимат Курбанова
6/10
Екатерина Петриченко
9/10
Камилла Рахматуллаева
10/10
Аня Киреева
10/10
Едва ли кто-то будет спорить с тем, что химия – один из тех предметов, которые особенно трудно постигать самостоятельно, без помощи репетитора; но все немедленно меняется, если вы можете воспользоваться разработкой, подобной тесту «Алканы» (10 класс) с ответами, размещенной на нашем сайте. Это прекрасный обучающий инструмент, позволяющий любому заинтересованному школьнику обобщить и систематизировать всю информацию по теме, а самое главное – проконтролировать уровень своих познаний и поставить себе самому объективную оценку.
Разработанные нашими методистами специально для мотивированных старшеклассников тесты «Углеводороды алканы» посвящены химическим свойствам этих органических соединений. Разработка состоит из десяти заданий с выбором правильного ответа из нескольких предложенных; выполнение заданий помогает актуализировать знание теоретического материала (общая формула гомологического ряда алканов, гибридизация и т.п.), а также умение оставлять уравнения реакций.
Тесты помогут старшеклассникам подготовиться к тематическим контрольным работам в школе, а также повторить весь материал перед экзаменом по химии. А решить тест можно на нашем сайте в режиме онлайн.
Рейтинг теста
Средняя оценка: 3.9. Всего получено оценок: 2933.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Проверочная работа по теме Алканы, 10 класс
Алканами называются углеводороды, в молекулах которых все атомы связанысвязями. Их общая формула. . Все атомы углерода в алканах находятся в состоянии гибридизации.
Их общая формула. . Все атомы углерода в алканах находятся в состоянии гибридизации.Укажите формулу алкана: а) С2Н4; б) С3Н8; в) С4Н6; г) С6Н6. Назовите это вещество, напишите его структурную формулу.
Для алканов характерна изомерия: а) положения кратной связи; б) углеродного скелета; в)положения функциональной группы; г) межклассовая.
Составьте структурные формулы веществ, названия которых: а) 2,3-диметилбутан; б)3-этилпентан.
Пропан можно получить реакцией гидрирования (присоединения водорода): а) пентена; б) пропена; в)бутена; г)гептена. Напишите уравнение этой реакции.
Назовите вещество: а) СН3 СН2 СН СН2 СН3
СН3
Вещества, имеющие сходное строение и свойства, но отличающиеся по составу на одну или несколько групп атомов –СН2, называются. . Группа атомов _СН2 называется . ..
Укажите формулу алкана: а) С6Н14; б) С3Н6; в) С4Н6; г) С3Н4.
 Назовите это вещество, напишите его структурную формулу.
Назовите это вещество, напишите его структурную формулу.Приведите формулу метил-радикала.
Составьте структурные формулы веществ, названия которых: а) 2,2-диметилпропан; б)2-этилпентан.
Напишите уравнение реакции взаимодействия пропана с хлором по первой ступени.
Назовите вещество: а) СН3 СН СН2 СН3
СН3
Алканами называются углеводороды, в молекулах которых все атомы связанысвязями. Их общая формула. . Все атомы углерода в алканах находятся в состоянии гибридизации.
Укажите формулу алкана: а) С2Н4; б) С3Н8; в) С4Н6; г) С6Н6. Назовите это вещество, напишите его структурную формулу.
Для алканов характерна изомерия: а) положения кратной связи; б) углеродного скелета; в)положения функциональной группы; г) межклассовая.
Составьте структурные формулы веществ, названия которых: а) 2,3-диметилбутан; б)3-этилпентан.
Пропан можно получить реакцией гидрирования (присоединения водорода): а) пентена; б) пропена; в)бутена; г)гептена.
 Напишите уравнение этой реакции.
Напишите уравнение этой реакции.Назовите вещество: а) СН3 СН2 СН СН2 СН3
СН3
Алканами называются углеводороды, в молекулах которых все атомы связанысвязями. Их общая формула. . Все атомы углерода в алканах находятся в состоянии гибридизации.
Укажите формулу алкана: а) С2Н4; б) С3Н8; в) С4Н6; г) С6Н6. Назовите это вещество, напишите его структурную формулу.
Для алканов характерна изомерия: а) положения кратной связи; б) углеродного скелета; в)положения функциональной группы; г) межклассовая.
Составьте структурные формулы веществ, названия которых: а) 2,3-диметилбутан; б)3-этилпентан.
Пропан можно получить реакцией гидрирования (присоединения водорода): а) пентена; б) пропена; в)бутена; г)гептена. Напишите уравнение этой реакции.
Назовите вещество: а) СН3 СН2 СН СН2 СН3
СН3
Приложенные файлы
3.
 4: Именование алканов — Chemistry LibreTexts
4: Именование алканов — Chemistry LibreTextsЦели
После заполнения этого раздела вы сможете:
- обеспечивают правильное название IUPAC для любой данной структуры алкана (Kekulé, сокращенное или сокращенное).
- изобразить Kekulé, сжатую или сокращенную структуру алкана, учитывая его название IUPAC.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
Учебные заметки
Номенклатура IUPAC направлена на обеспечение
- , что каждое органическое соединение имеет уникальное недвусмысленное название.
- , что название IUPAC любого соединения передает структуру этого соединения человеку, знакомому с системой.
Один из способов проверить, обосновано ли имя, которое вы дали алкану, — это подсчитать количество атомов углерода, подразумеваемых выбранным именем. Например, если вы назвали соединение 3 ‑ этил-4 ‑ метилгептан, вы указали, что соединение содержит всего 10 атомов углерода — семь атомов углерода в основной цепи, два атома углерода в этильной группе и один атом углерода. в метильной группе.Если бы вы проверили данную структуру и нашли 11 атомов углерода, вы бы узнали, что сделали ошибку. Возможно, имя, которое вам следовало написать, было 3 ‑ этил-4,4 ‑ диметилгептан!
в метильной группе.Если бы вы проверили данную структуру и нашли 11 атомов углерода, вы бы узнали, что сделали ошибку. Возможно, имя, которое вам следовало написать, было 3 ‑ этил-4,4 ‑ диметилгептан!
При именовании алканов распространенной ошибкой начинающих студентов является неспособность выбрать самую длинную углеродную цепочку. Например, правильное название для указанного ниже соединения — 3 ‑ метилгептан, а не 2 ‑ этилгексан.
Помните, что у каждого заместителя должен быть номер, и не забывайте префиксы: ди, три, тетра и т. Д.
Вы должны использовать запятые для разделения чисел и дефисы для разделения чисел и заместителей. Обратите внимание, что 3 ‑ метилгексан — это одно слово.
Углеводороды, не имеющие функциональных групп с двойной или тройной связью, классифицируются как алканы, или циклоалканы, , в зависимости от того, расположены ли атомы углерода в молекуле только в цепях или также в кольцах. Хотя эти углеводороды не имеют функциональных групп, они составляют основу, на которой функциональные группы расположены в других классах соединений, и обеспечивают идеальную отправную точку для изучения и наименования органических соединений.Алканы и циклоалканы также являются членами более крупного класса соединений, называемых алифатическими соединениями и . Проще говоря, алифатические соединения — это соединения, которые не содержат ароматических колец в своей молекулярной структуре.
Хотя эти углеводороды не имеют функциональных групп, они составляют основу, на которой функциональные группы расположены в других классах соединений, и обеспечивают идеальную отправную точку для изучения и наименования органических соединений.Алканы и циклоалканы также являются членами более крупного класса соединений, называемых алифатическими соединениями и . Проще говоря, алифатические соединения — это соединения, которые не содержат ароматических колец в своей молекулярной структуре.
В следующей таблице перечислены названия IUPAC, присвоенные простым алканам с непрерывной цепью от C-1 до C-10. Общий суффикс «ane» идентифицирует эти соединения как алканы. Алканы с более длинной цепью хорошо известны, и их названия можно найти во многих справочниках и учебниках.Имена метан — декан следует запомнить, поскольку они составляют основу многих имен ИЮПАК. К счастью, для именования цепочек из пяти и более атомов углерода используются общие числовые префиксы.
| Имя | Молекулярная Формула | Структурная Формула | Изомеры | Имя | Молекулярная Формула | Структурная Формула | Изомеры | |
|---|---|---|---|---|---|---|---|---|
| мет анэ | СН 4 | СН 4 | 1 | шестигранник анэ | С 6 В 14 | Канал 3 (Канал 2 ) 4 Канал 3 | 5 | |
| eth ane | С 2 В 6 | Канал 3 Канал 3 | 1 | hept ane | С 7 В 16 | Канал 3 (Канал 2 ) 5 Канал 3 | 9 | |
| опора ane | С 3 В 8 | Канал 3 Канал 2 Канал 3 | 1 | окт анэ | С 8 В 18 | Канал 3 (Канал 2 ) 6 Канал 3 | 18 | |
| но анэ | С 4 В 10 | Канал 3 Канал 2 Канал 2 Канал 3 | 2 | без анэ | С 9 В 20 | Канал 3 (Канал 2 ) 7 Канал 3 | 35 | |
| пент анэ | С 5 В 12 | Канал 3 (Канал 2 ) 3 Канал 3 | 3 | дек анэ | С 10 В 22 | Канал 3 (Канал 2 ) 8 Канал 3 | 75 |
Некоторые важные тенденции поведения и терминология
- Формулы и структуры этих алканов равномерно увеличиваются с шагом CH 2 .

- Подобная однородная вариация в серии соединений называется гомологичной .
- Все эти формулы соответствуют правилу C n H 2n +2 . Это также максимально возможное соотношение H / C для стабильного углеводорода.
- Поскольку отношение H / C в этих соединениях максимально, мы называем их насыщенными (водородом).
Начиная с бутана (C 4 H 10 ) и становясь более многочисленным с более крупными алканами, мы отмечаем существование изомеров алканов.Например, имеется пять изомеров C 6 H 14 , которые показаны ниже в виде сокращенных формул (с A по E ):
Хотя все эти различные соединения имеют одну и ту же молекулярную формулу, только одно ( A ) может называться гексаном. Как же тогда назвать остальных?
Система IUPAC требует, чтобы, во-первых, у нас были имена для простых неразветвленных цепей, как отмечено выше, а во-вторых, чтобы у нас были имена для простых алкильных групп, которые могут быть присоединены к цепям. Примеры некоторых общих алкильных групп приведены в следующей таблице. Обратите внимание, что суффикс «ane» заменен на « yl » в группах имен. Обозначение R используется для обозначения родовой (неуказанной) алкильной группы.
Примеры некоторых общих алкильных групп приведены в следующей таблице. Обратите внимание, что суффикс «ane» заменен на « yl » в группах имен. Обозначение R используется для обозначения родовой (неуказанной) алкильной группы.
| Группа | CH 3 — | С 2 В 5 — | Канал 3 Канал 2 Канал 2 — | (CH 3 ) 2 CH– | Канал 3 Канал 2 Канал 2 Канал 2 — | (канал 3 ) 2 канал 2 — | Канал 3 Канал 2 Канал (Канал 3 ) — | (CH 3 ) 3 C– | R– |
|---|---|---|---|---|---|---|---|---|---|
| Имя | метил | Этил | Пропил | Изопропил | Бутил | Изобутил | втор-бутил | трет-бутил | Алкил |
Правила ИЮПАК по номенклатуре алканов
- Найдите и назовите самую длинную непрерывную углеродную цепь.

- Определите и назовите группы, присоединенные к этой цепочке.
- Пронумеруйте цепь последовательно, начиная с конца, ближайшего к группе заместителя.
- Обозначьте расположение каждой группы заместителей соответствующим номером и названием.
- Соберите название, перечислив группы в алфавитном порядке.
- Префиксы ди, три, тетра и т. Д., Используемые для обозначения нескольких групп одного вида, не учитываются при алфавитном порядке.
Пример \ (\ PageIndex {1} \): Алканы
Названия изомеров гексана по ИЮПАК: A гексан B 2-метилпентан C 3-метилпентан D 2,2-диметилбутан E 2,3-диметилбутан
Алкильные группы
Галогеновые заместители легко адаптируются, используя названия: фтор (F-), хлор (Cl-), бром (Br-) и йод (I-).
Пример \ (\ PageIndex {2} \): Замена галогена
Например, (CH 3 ) 2 CHCH 2 CH 2 Br будет называться 1-бром-3-метилбутаном. Если галоген связан с простой алкильной группой, можно использовать альтернативное название «алкилгалогенид». Таким образом, C 2 H 5 Cl может называться хлорэтаном (для двухуглеродной цепи не требуется номер локатора) или этилхлоридом.
Если галоген связан с простой алкильной группой, можно использовать альтернативное название «алкилгалогенид». Таким образом, C 2 H 5 Cl может называться хлорэтаном (для двухуглеродной цепи не требуется номер локатора) или этилхлоридом.
Алкильные группы
Алканы можно описать общей формулой C n H 2n +2 .Алкильная группа образуется путем удаления одного водорода из алкановой цепи и описывается формулой C n H 2n +1 . Удаление этого водорода приводит к замене стержня с -ан на -ил . Взгляните на следующие примеры.
Та же самая концепция может быть применена к любому из названий алканов с прямой цепью, представленных в таблице выше.
| Имя | Молекулярная формула | Концентрированная структурная формула |
|---|---|---|
| Метан | СН 4 | СН 4 |
| этан | С 2 В 6 | Канал 3 Канал 3 |
| Пропан | С 3 В 8 | Канал 3 Канал 2 Канал 3 |
| Бутан | С 4 В 10 | Канал 3 (Канал 2 ) 2 Канал 3 |
| Пентан | С 5 В 12 | Канал 3 (Канал 2 ) 3 Канал 3 |
| гексан | С 6 В 14 | Канал 3 (Канал 2 ) 4 Канал 3 |
| Гептан | С 7 В 16 | Канал 3 (Канал 2 ) 5 Канал 3 |
| Октан | С 8 В 18 | Канал 3 (Канал 2 ) 6 Канал 3 |
| Нонан | С 9 В 20 | Канал 3 (Канал 2 ) 7 Канал 3 |
| декан | С 10 В 22 | Канал 3 (Канал 2 ) 8 Канал 3 |
| Ундекан | С 11 В 24 | Канал 3 (Канал 2 ) 9 Канал 3 |
| Додекан | С 12 В 26 | Канал 3 (Канал 2 ) 10 Канал 3 |
| Тридекан | С 13 В 28 | Канал 3 (Канал 2 ) 11 Канал 3 |
| Тетрадекан | С 14 В 30 | Канал 3 (Канал 2 ) 12 Канал 3 |
| Пентадекан | С 15 В 32 | Канал 3 (Канал 2 ) 13 Канал 3 |
| гексадекан | С 16 В 34 | Канал 3 (Канал 2 ) 14 Канал 3 |
| Гептадекан | С 17 В 36 | Канал 3 (Канал 2 ) 15 Канал 3 |
| октадекан | С 18 В 38 | Канал 3 (Канал 2 ) 16 Канал 3 |
| Нонадекан | С 19 В 40 | Канал 3 (Канал 2 ) 17 Канал 3 |
| Эйкозан | С 20 В 42 | Канал 3 (Канал 2 ) 18 Канал 3 |
Три правила наименования алканов
- Выберите самую длинную и наиболее замещенную углеродную цепь, содержащую функциональную группу.

- Углерод, связанный с функциональной группой, должен иметь наименьшее возможное углеродное число. Если функциональные группы отсутствуют, то любой присутствующий заместитель должен иметь наименьшее возможное число.
- Учитывайте алфавитный порядок; то есть, после применения первых двух правил, приведенных выше, убедитесь, что ваши заместители и / или функциональные группы написаны в алфавитном порядке.
Пример \ (\ PageIndex {3} \)
Как называется следующая молекула?
Решение
Правило № 1: Выберите самую длинную и наиболее замещенную углеродную цепь, содержащую функциональную группу.Этот пример не содержит никаких функциональных групп, поэтому нам нужно только позаботиться о выборе самой длинной и наиболее замещенной углеродной цепи. Самая длинная углеродная цепь выделена красным и состоит из восьми атомов углерода.
Правило № 2: Углерод, связанный с функциональной группой, должен иметь наименьшее возможное число атомов углерода. Если функциональных групп нет, то любой присутствующий заменитель должен иметь наименьшее возможное количество. Поскольку этот пример не содержит никаких функциональных групп, нам нужно иметь дело только с двумя присутствующими заместителями, то есть двумя метильными группами.Если мы начнем нумерацию цепочки слева, метилам будут присвоены номера 4 и 7 соответственно. Если мы начнем нумерацию цепи справа, метилам будут присвоены номера 2 и 5. Следовательно, чтобы удовлетворить второму правилу, нумерация начинается с правой стороны углеродной цепи, как показано ниже. Это дает метильным группам самую низкую возможную нумерацию.
Если функциональных групп нет, то любой присутствующий заменитель должен иметь наименьшее возможное количество. Поскольку этот пример не содержит никаких функциональных групп, нам нужно иметь дело только с двумя присутствующими заместителями, то есть двумя метильными группами.Если мы начнем нумерацию цепочки слева, метилам будут присвоены номера 4 и 7 соответственно. Если мы начнем нумерацию цепи справа, метилам будут присвоены номера 2 и 5. Следовательно, чтобы удовлетворить второму правилу, нумерация начинается с правой стороны углеродной цепи, как показано ниже. Это дает метильным группам самую низкую возможную нумерацию.
Правило 3 : В этом примере нет необходимости использовать третье правило. Поскольку два заменителя идентичны, ни один из них не имеет алфавитного приоритета при нумерации атомов углерода.Эта концепция станет более ясной из следующих примеров.
Название этой молекулы — 2,5-диметилоктан
Пример \ (\ PageIndex {4} \)
Как называется следующая молекула?
Решение
Правило № 1 : Выберите самую длинную и наиболее замещенную углеродную цепь, содержащую функциональную группу. Этот пример содержит две функциональные группы, бром и хлор. Самая длинная углеродная цепь выделена красным и состоит из семи атомов углерода.
Этот пример содержит две функциональные группы, бром и хлор. Самая длинная углеродная цепь выделена красным и состоит из семи атомов углерода.
Правило № 2: Углерод, связанный с функциональной группой, должен иметь наименьшее возможное число атомов углерода. Если функциональные группы отсутствуют, то любой присутствующий заместитель должен иметь наименьшее возможное число. В этом примере этому правилу будет соответствовать нумерация цепочки слева или справа. Если пронумеровать цепочку слева, брому и хлору будет присвоено второе и шестое положения углерода, соответственно. Если пронумеровать цепь справа, хлору будет присвоено второе положение, а брому — шестое положение.Другими словами, выбираем ли мы нумерацию слева или справа, функциональные группы занимают вторую и шестую позиции в цепочке. Чтобы выбрать правильную схему нумерации, нам нужно использовать третье правило.
Правило № 3: После применения первых двух правил примите во внимание алфавитный порядок. По алфавиту бром следует за хлором. Следовательно, брому отводится второе углеродное положение, а хлору — шестое углеродное положение.
По алфавиту бром следует за хлором. Следовательно, брому отводится второе углеродное положение, а хлору — шестое углеродное положение.
Название этой молекулы: 2-бром-6-хлоргептан
Пример \ (\ PageIndex {5} \)
Как называется следующая молекула?
Решение
Правило № 1 : Выберите самую длинную и наиболее замещенную углеродную цепь, содержащую функциональную группу. Этот пример содержит две функциональные группы, бром и хлор, и один заместитель, метильную группу. Самая длинная углеродная цепь выделена красным и состоит из семи атомов углерода.
Правило № 2: Углерод, связанный с функциональной группой, должен иметь наименьшее возможное число атомов углерода. После учета функциональных групп любые присутствующие заменители должны иметь минимально возможное углеродное число. Этот конкретный пример иллюстрирует принцип разницы . Если пронумеровать цепь слева, бром, метильная группа и хлор займут вторую, пятую и шестую позиции соответственно. Эта концепция проиллюстрирована на втором рисунке ниже.Если пронумеровать цепь справа, хлор, метильная группа и бром займут вторую, третью и шестую позиции, соответственно, что показано на первом рисунке ниже. Положение метила, таким образом, становится точкой разницы . На первом рисунке метил занимает третью позицию. На втором рисунке метил занимает пятую позицию. Чтобы удовлетворить второму правилу, мы хотим выбрать схему нумерации, которая обеспечивает наименьшую возможную нумерацию этого заменителя.Следовательно, первая из двух углеродных цепей, показанных ниже, является правильной.
Если пронумеровать цепь слева, бром, метильная группа и хлор займут вторую, пятую и шестую позиции соответственно. Эта концепция проиллюстрирована на втором рисунке ниже.Если пронумеровать цепь справа, хлор, метильная группа и бром займут вторую, третью и шестую позиции, соответственно, что показано на первом рисунке ниже. Положение метила, таким образом, становится точкой разницы . На первом рисунке метил занимает третью позицию. На втором рисунке метил занимает пятую позицию. Чтобы удовлетворить второму правилу, мы хотим выбрать схему нумерации, которая обеспечивает наименьшую возможную нумерацию этого заменителя.Следовательно, первая из двух углеродных цепей, показанных ниже, является правильной.
Следовательно, лучше всего использовать первую схему нумерации.
После того, как вы определили правильную нумерацию атомов углерода, часто бывает полезно составить список, включающий функциональные группы, заменители и имя родительской цепи.
Правило № 3: После применения первых двух правил примите во внимание алфавитный порядок.По алфавиту бром следует за хлором. Следовательно, брому отводится второе углеродное положение, а хлору — шестое углеродное положение.
Исходная цепь: гептан Заместители: 2-хлор 3-метил 6-бром
Название этой молекулы: 6-бром-2-хлор-3-метилгептан
Упражнения
3.4 Упражнения
Вопросы
Q3.4.1
Правильно ли названы следующие структуры, и если нет, как правильно назвать?
3 кв.4,2
Назовите следующие молекулы:
Решения
S3.4.1
Они оба обозначены неправильно:
3-бром-2-гидроксипентан
2, 3-диметилпентан
S3.4.2
1 = 3,4-диметилгексан
2 = 2-метилпентан
3 = 2,2,4-триметилпентан
Авторы и авторство
Можете ли вы назвать первые 10 алканов?
Алканы — это простейшие углеводородные цепи. Это органические молекулы, которые состоят только из атомов водорода и углерода в древовидной структуре (ациклической или не кольцевой). Они широко известны как парафины и воски. Вот список первых 10 алканов.
Это органические молекулы, которые состоят только из атомов водорода и углерода в древовидной структуре (ациклической или не кольцевой). Они широко известны как парафины и воски. Вот список первых 10 алканов.
| метан | СН 4 |
| этан | С 2 В 6 |
| пропан | С 3 В 8 |
| бутан | С 4 В 10 |
| пентан | С 5 В 12 |
| гексан | С 6 В 14 |
| гептан | С 7 В 16 |
| октановое число | С 8 В 18 |
| нонан | С 9 В 20 |
| декан | С 10 В 22 |
Как работают алкановые имена
Название каждого алкана состоит из префикса (первая часть) и суффикса (окончание). Суффикс -ane определяет молекулу как алкан, а префикс определяет углеродный скелет. Углеродный скелет — это количество атомов углерода, связанных друг с другом. Каждый атом углерода участвует в 4 химических связях. Каждый водород соединен с углеродом.
Суффикс -ane определяет молекулу как алкан, а префикс определяет углеродный скелет. Углеродный скелет — это количество атомов углерода, связанных друг с другом. Каждый атом углерода участвует в 4 химических связях. Каждый водород соединен с углеродом.
Первые четыре названия происходят от названий метанол, эфир, пропионовая кислота и масляная кислота. Алканы, содержащие 5 или более атомов углерода, именуются с помощью префиксов, указывающих количество атомов углерода. Итак, pent- означает 5, hex- означает 6, hept- означает 7 и так далее.
Алканы с разветвленной цепью
Простые разветвленные алканы имеют префиксы в названиях, чтобы отличать их от линейных алканов. Например, изопентан, неопентан и н-пентан — это названия разветвленных форм алканпентана. Правила именования несколько сложны:
- Найдите самую длинную цепочку атомов углерода. Назовите эту корневую цепь, используя правила алканов.
- Назовите каждую боковую цепь в соответствии с количеством атомов углерода, но измените суффикс ее имени с -ane на -yl.

- Пронумеруйте корневую цепь так, чтобы боковые цепи имели наименьшие возможные номера.
- Укажите номер и имя боковых цепей перед тем, как назвать корневую цепочку.
- Если присутствуют кратные одной и той же боковой цепи, префиксы, такие как ди- (два) и три- (для трех), указывают, сколько из цепей присутствует. Расположение каждой цепочки указывается с помощью номера.
- Имена нескольких боковых цепей (не считая ди-, три- и т. Д. Префиксов) приводятся в алфавитном порядке перед именем корневой цепочки.
Свойства и использование алканов
Алканы, содержащие более трех атомов углерода, образуют структурные изомеры. Алканы с более низким молекулярным весом имеют тенденцию быть газами и жидкостями, в то время как более крупные алканы являются твердыми при комнатной температуре. Алканы, как правило, являются хорошим топливом. Это не очень реактивные молекулы и не обладают биологической активностью. Они не проводят электричество и не сильно поляризованы в электрических полях. Алканы не образуют водородных связей, поэтому они не растворяются в воде или других полярных растворителях.При добавлении к воде они уменьшают энтропию смеси или повышают ее уровень или порядок. Природные источники алканов включают природный газ и нефть.
Алканы не образуют водородных связей, поэтому они не растворяются в воде или других полярных растворителях.При добавлении к воде они уменьшают энтропию смеси или повышают ее уровень или порядок. Природные источники алканов включают природный газ и нефть.
Источники
- Арора, А. (2006). Углеводороды (алканы, алкены и алкины) . Discovery Publishing House Pvt. Ограничено. ISBN 9788183561426.
- ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). «Алканы». DOI: 10.1351 / goldbook.A00222
углеводородов — вводная химия — первое канадское издание
Цели обучения
- Идентифицирует алканы, алкены, алкины и ароматические соединения.
- Перечислить некоторые свойства углеводородов.
Простейшие органические соединения состоят всего из двух элементов: углерода и водорода. Эти соединения называются углеводородами. Сами углеводороды делятся на два типа: алифатические углеводороды и ароматические углеводороды.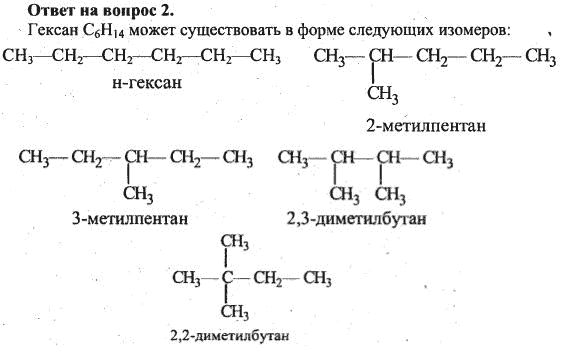 Алифатические углеводороды — это углеводороды, основанные на цепочках атомов C. Есть три типа алифатических углеводородов. Алканы — это алифатические углеводороды только с одинарными ковалентными связями. Алкены — это алифатические углеводороды, содержащие по крайней мере одну двойную связь C – C, а алкины — это алифатические углеводороды, содержащие тройную связь C – C.Иногда мы находим алифатический углеводород с кольцом из атомов углерода; эти углеводороды называются циклоалканами (или циклоалкенами, или циклоалкинами).
Алифатические углеводороды — это углеводороды, основанные на цепочках атомов C. Есть три типа алифатических углеводородов. Алканы — это алифатические углеводороды только с одинарными ковалентными связями. Алкены — это алифатические углеводороды, содержащие по крайней мере одну двойную связь C – C, а алкины — это алифатические углеводороды, содержащие тройную связь C – C.Иногда мы находим алифатический углеводород с кольцом из атомов углерода; эти углеводороды называются циклоалканами (или циклоалкенами, или циклоалкинами).
Ароматические углеводороды, такие как бензол, представляют собой системы с плоским кольцом, которые содержат непрерывно перекрывающиеся p орбиталей. Электроны в бензольном кольце обладают особыми энергетическими свойствами, которые придают бензолу физические и химические свойства, которые заметно отличаются от алканов. Первоначально термин ароматический использовался для описания этого класса соединений, потому что они были особенно ароматными.Однако в современной химии термин «ароматический» означает наличие очень стабильного кольца, которое придает молекуле различные уникальные свойства.
У простейших алканов атомы C связаны в прямую цепь; они называются нормальными алканами . Они названы в соответствии с количеством атомов углерода в цепи. Наименьший алкан — метан:
Рисунок 16.1 Трехмерное представление метана
Молекула метана трехмерна, с атомами H в четырех углах тетраэдра.Источник: «Метан-CRC-MW-3D-шары» Бена Миллса находится в открытом доступе.Чтобы образовать четыре ковалентные связи, атом C связывается с четырьмя атомами H, образуя молекулярную формулу метана CH 4 . Однако двумерная диаграмма для метана вводит в заблуждение; четыре ковалентные связи, образующиеся у атома С, трехмерно ориентированы по направлению к углам тетраэдра. Лучшее представление молекулы метана показано на рисунке 16.1 «Трехмерное представление метана.”
Следующий по величине алкан имеет два атома углерода, ковалентно связанные друг с другом. Чтобы каждый атом C образовал четыре ковалентные связи, каждый атом C должен быть связан с тремя атомами H.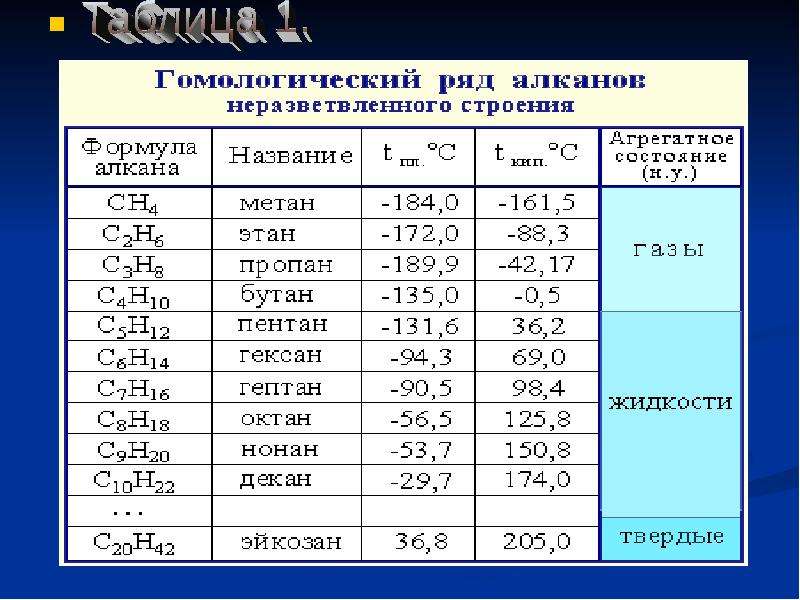 Полученная молекула, формула которой C 2 H 6 , представляет собой этан:
Полученная молекула, формула которой C 2 H 6 , представляет собой этан:
Пропан имеет основу из трех атомов C, окруженных атомами H. Вы должны быть в состоянии убедиться, что молекулярная формула пропана — C 3 H 8 :
Диаграммы, которые мы видели до сих пор, представляющие алканы, являются довольно простыми структурами Льюиса.Однако по мере того, как молекулы становятся больше, структуры Льюиса становятся все более сложными. Один из способов обойти это — использовать конденсированную структуру, в которой перечислены формулы каждого атома углерода в основной цепи молекулы. Например, конденсированная структура для этана — это CH 3 CH 3 , а для пропана — CH 3 CH 2 CH 3 . Таблица 16.1 «Первые 10 алканов» дает молекулярные формулы, сжатые структурные формулы и названия первых 10 алканов.
Таблица 16.1 Первые 10 алканов
| Молекулярная формула | Концентрированная структурная формула | Имя |
|---|---|---|
| CH 4 | СН 4 | метан |
| C 2 H 6 | Канал 3 Канал 3 | этан |
| C 3 H 8 | Канал 3 Канал 2 Канал 3 | пропан |
| C 4 H 10 | Канал 3 Канал 2 Канал 2 Канал 3 | бутан |
| C 5 H 12 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | пентан |
| C 6 H 14 | Канал 3 (Канал 2 ) 4 Канал 3 | гексан |
| C 7 H 16 | Канал 3 (Канал 2 ) 5 Канал 3 | гептан |
| C 8 H 18 | Канал 3 (Канал 2 ) 6 Канал 3 | октановое число |
| C 9 H 20 | Канал 3 (Канал 2 ) 7 Канал 3 | нонан |
| C 10 H 22 | Канал 3 (Канал 2 ) 8 Канал 3 | декан |
Поскольку алканы имеют максимальное количество атомов H, возможное в соответствии с правилами ковалентных связей, алканы также называют насыщенными углеводородами.
Алкены имеют двойную связь C – C. Поскольку в них количество атомов H меньше максимально возможного, их называют ненасыщенными углеводородами. Наименьший алкен — этен — имеет два атома углерода и известен также под своим общим названием этилен:
.Следующий по величине алкен — пропен — имеет три атома углерода с двойной связью C – C между двумя атомами углерода. Он также известен как пропилен:
.Что вы заметили в названиях алканов и алкенов? Названия алкенов такие же, как и соответствующие им алканы, за исключением того, что суффикс (окончание) — ene , а не — ane .Как мы увидим, использование основы, известной как исходная цепь , для обозначения количества атомов C в молекуле и окончания для обозначения типа органического соединения, является обычным явлением в органической химии.
С появлением следующего алкена, бутена, мы начинаем видеть главную проблему с органическими молекулами: выбор. С четырьмя атомами C двойная связь C – C может проходить между первым и вторым атомами C или между вторым и третьим атомами C:
(Двойная связь между третьим и четвертым атомами углерода такая же, как и между первым и вторым атомами углерода, только перевернутая.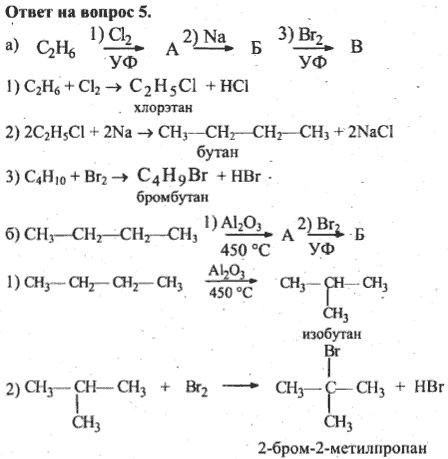 ) Правила наименования в органической химии требуют, чтобы эти два вещества имели разные названия. Первая молекула называется бут-1-ен , а вторая молекула — бут-2-ен . Число между названием родительской цепи и суффиксом известно как локант и указывает, на каком углероде возникает двойная связь. Наименьшее возможное число используется для нумерации особенности в молекуле; следовательно, называть вторую молекулу бут-3-еном было бы неправильно. Числа — общие части названий органических химических веществ, потому что они указывают, какой атом углерода в цепи содержит отличительную особенность.Когда двойная связь (или другая функциональная группа) расположена на первом атоме углерода, некоторые авторы обычно не учитывают локант. Например, если бутен был написан без локанта, вы должны предположить, что он относится к but-1-ene, а не but-2-ene.
) Правила наименования в органической химии требуют, чтобы эти два вещества имели разные названия. Первая молекула называется бут-1-ен , а вторая молекула — бут-2-ен . Число между названием родительской цепи и суффиксом известно как локант и указывает, на каком углероде возникает двойная связь. Наименьшее возможное число используется для нумерации особенности в молекуле; следовательно, называть вторую молекулу бут-3-еном было бы неправильно. Числа — общие части названий органических химических веществ, потому что они указывают, какой атом углерода в цепи содержит отличительную особенность.Когда двойная связь (или другая функциональная группа) расположена на первом атоме углерода, некоторые авторы обычно не учитывают локант. Например, если бутен был написан без локанта, вы должны предположить, что он относится к but-1-ene, а не but-2-ene.
Соединения бут-1-ен и бут-2-ен имеют разные физические и химические свойства, даже если они имеют одинаковую молекулярную формулу — C 4 H 8 . Различные молекулы с одинаковой молекулярной формулой называются изомерами .Изомеры широко распространены в органической химии и способствуют ее сложности.
Различные молекулы с одинаковой молекулярной формулой называются изомерами .Изомеры широко распространены в органической химии и способствуют ее сложности.
Пример 1
На основании названий молекул бутена предложите название для этой молекулы.
Решение
С пятью атомами C мы будем использовать pent — родительское имя, а с двойной связью C – C это алкен, поэтому эта молекула является пентеном. При нумерации атомов C мы используем число 2 , потому что это нижняя возможная метка. Эта молекула называется пент-2-еном.
Проверьте себя
На основании названий молекул бутена предложите название для этой молекулы.
Ответ
шестнадцатеричный-3-ен
Алкины с тройной связью C – C названы аналогично алкенам, за исключением того, что их названия заканчиваются на — yne . Самый мелкий алкин — этин, также известный как ацетилен:
Пропин имеет такую структуру:
С бутином нам нужно начать нумерацию позиции тройной связи, как мы это делали с алкенами:
Бензол — это ароматическое соединение, состоящее из шести атомов углерода в кольце с чередующимися одинарными и двойными связями C – C:
Чередующиеся одинарные и двойные связи C – C придают бензольному кольцу особую стабильность, и оно не реагирует как алкен, как можно было бы ожидать.
Какими бы фундаментальными ни были углеводороды для органической химии, их свойства и химические реакции довольно банальны. Большинство углеводородов неполярны из-за близкой электроотрицательности атомов C и H. По существу, они очень мало растворяются в H 2 O и других полярных растворителях. Небольшие углеводороды, такие как метан и этан, являются газами при комнатной температуре, тогда как более крупные углеводороды, такие как гексан и октан, являются жидкостями. Даже более крупные углеводороды, такие как хентриаконтан (C 31 H 64 ), являются твердыми веществами при комнатной температуре и имеют мягкую воскообразную консистенцию.
Углеводороды довольно инертны, но они участвуют в некоторых классических химических реакциях. Одной из распространенных реакций является замещение атомом галогена путем объединения углеводорода с элементарным галогеном. Иногда для ускорения реакции используют свет, например, между метаном и хлором:
Галогены также могут реагировать с алкенами и алкинами, но реакция другая. В этих случаях молекулы галогена реагируют с двойной или тройной связью C – C и присоединяются к каждому атому C, участвующему в кратных связях.Эта реакция называется реакцией присоединения . Один из примеров —
В этих случаях молекулы галогена реагируют с двойной или тройной связью C – C и присоединяются к каждому атому C, участвующему в кратных связях.Эта реакция называется реакцией присоединения . Один из примеров —
Условия реакции обычно мягкие; во многих случаях галоген самопроизвольно реагирует с алкеном или алкином.
Водород также можно добавлять по кратной связи; эта реакция называется реакцией гидрирования . Однако в этом случае условия реакции могут быть не мягкими; может потребоваться высокое давление газа H 2 . Платиновый или палладиевый катализатор обычно используется для того, чтобы реакция протекала с разумной скоростью:
Наиболее распространенной реакцией углеводородов является горение, которое представляет собой комбинацию углеводорода с O 2 с образованием CO 2 и H 2 O.Сжигание углеводородов сопровождается выделением энергии и является основным источником производства энергии в нашем обществе (рис. 16.2 «Горение»). Например, реакция горения бензина, которую можно представить как C 8 H 18 , выглядит следующим образом:
16.2 «Горение»). Например, реакция горения бензина, которую можно представить как C 8 H 18 , выглядит следующим образом:
2 C 8 H 18 + 25 O 2 → 16 CO 2 + 18 H 2 O + ~ 5060 кДж
Рисунок 16.2 Сгорание
Сжигание углеводородов — это основной источник энергии в нашем обществе.Первый газ с модуля Осельвар на платформе Ула в Норвегии 14 апреля 2012 года компанией Varodrig по лицензии CC BY SA.Упражнения
Определите углеводород . Какие два основных типа углеводородов?
Какие три различных типа алифатических углеводородов? Как они определены?
Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом. Если он алифатический, идентифицируйте молекулу как алкан, алкен или алкин.
а) б) в) 4. Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом. Если он алифатический, идентифицируйте молекулу как алкан, алкен или алкин.
5. Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом. Если он алифатический, идентифицируйте молекулу как алкан, алкен или алкин.
а) б) в)6. Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом. Если он алифатический, идентифицируйте молекулу как алкан, алкен или алкин.
а) б) в)7. Назовите и нарисуйте структурные формулы для четырех самых маленьких алканов.
8. Назовите и нарисуйте структурные формулы для четырех самых маленьких алкенов.
9. Что термин ароматический означает для органической молекулы?
10. Что означает термин нормальный , когда он используется для алканов?
11. Объясните, почему вы можете видеть проп-1-ен, записанный так же, как пропен.
12. Объясните, почему имя but-3-ene неверно.Какое собственное название этой молекулы?
13. Назовите и нарисуйте структурную формулу каждого изомера пентена.
14. Назовите и нарисуйте структурную формулу каждого изомера гексина.
15. Напишите химическое уравнение реакции метана и брома.
16. Напишите химическое уравнение реакции этана и хлора.
17. Изобразите структуру продукта реакции брома с пропеном.
18.Изобразите структуру продукта реакции хлора с бут-2-еном.
19. Изобразите структуру продукта реакции водорода с бут-1-еном.
20. Изобразите структуру продукта реакции водорода с пент-2-еном.
21. Напишите вычисленное химическое уравнение горения гептана.
22. Напишите вычисленное химическое уравнение горения нонана.
ответы
1. органическое соединение, состоящее только из углерода и водорода; алифатические углеводороды и ароматические углеводороды
3.
а) алифатический; алкан
б) ароматический
в) алифатический; алкен
5.
а) алифатический; алкан
б) алифатический; алкен
в) ароматический
7.
9. Ароматический означает, что молекула имеет плоскую кольцевую систему с непрерывными p орбиталями (например,г., бензол).
11. 1 не требуется, поскольку двойная связь находится на первом атоме углерода.
13.
15. CH 4 + Br 2 → CH 3 Br + HBr
17.
19.
21. C 7 H 16 + 11 O 2 → 7 CO 2 + 8 H 2 O
углеводородов | Определение, типы и факты
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, которые удовлетворяют общему выражению C n H 2 n + 2 (где n — целое число ).Углерод s p 3 гибридизирован (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь C — C и C — H является сигма-связью ( см.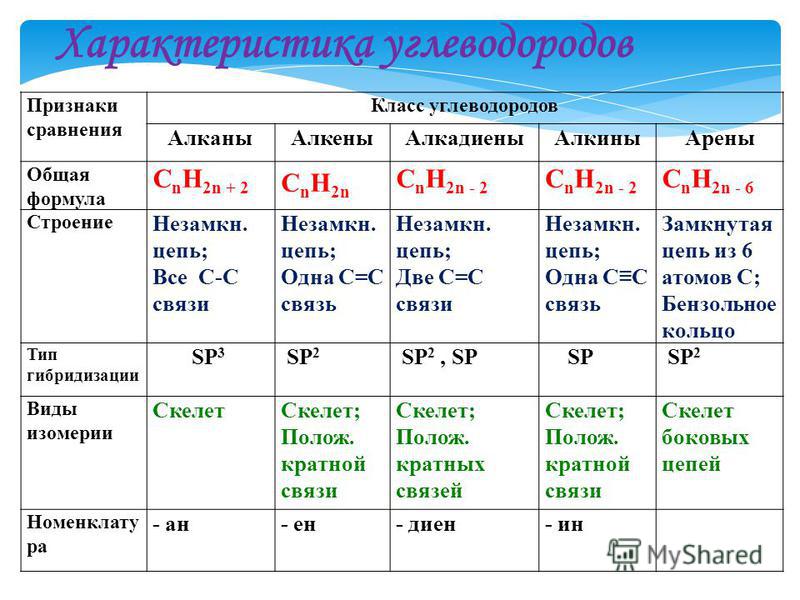 химическая связь ). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
химическая связь ). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые их молекулярной формулой.Для C 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, что углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — обозначает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Говорят, что изомеры, которые различаются по порядку соединения атомов, имеют различное строение и называются структурными изомерами.(Старое название — структурные изомеры. ) Соединения n -бутан и изобутан являются конституционными изомерами и единственно возможными для формулы C 4 H 10 . Поскольку изомеры представляют собой разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
) Соединения n -бутан и изобутан являются конституционными изомерами и единственно возможными для формулы C 4 H 10 . Поскольку изомеры представляют собой разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Нет простой арифметической зависимости между числом атомов углерода в формуле и числом изомеров.Теория графов была использована для расчета количества структурно изомерных алканов, возможных для значений n в C n H 2 n + 2 от 1 до 400. Количество структурных изомеров резко увеличивается с увеличением количество атомов углерода увеличивается. Вероятно, не существует верхнего предела возможного количества атомов углерода в углеводородах. Алкан CH 3 (CH 2 ) 388 CH 3 , в котором 390 атомов углерода связаны в непрерывную цепь, был синтезирован в качестве примера так называемого сверхдлинного алкана. Несколько тысяч атомов углерода объединены в молекулы углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
Несколько тысяч атомов углерода объединены в молекулы углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| Молекулярная формула | количество конституционных изомеров |
|---|---|
| C 3 H 8 | 1 |
| C 4 H 10 | 2 |
| C 5 H 12 | 3 |
| C 6 H 14 | 5 |
| C 7 H 16 | 9 |
| C 8 H 18 | 18 |
| C 9 H 20 | 35 |
| C 10 H 22 | 75 |
| C 15 H 32 | 4 347 |
| C 20 H 42 | 366 319 |
| C 30 H 62 | 4,111,846,763 |
Необходимость дать каждому соединению уникальное имя требует более широкого разнообразия терминов, чем это доступно с описательными префиксами, такими как n — и iso-. Присвоение названий органическим соединениям упрощается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общая и систематическая. Общие имена возникают по-разному, но имеют общую черту, заключающуюся в отсутствии необходимой связи между именем и структурой. Имя, которое соответствует определенной структуре, нужно просто запомнить, как и выучить имя человека. Систематические названия, с другой стороны, напрямую связаны с молекулярной структурой в соответствии с общепринятым набором правил.Наиболее широко используемые стандарты для номенклатуры органических веществ возникли на основе предложений, сделанных группой химиков, собранных для этой цели в Женеве в 1892 году, и регулярно пересматриваются Международным союзом чистой и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения из других семейств рассматриваются как производные алканов путем присоединения функциональных групп к углеродному скелету или иным образом его модификации.
Присвоение названий органическим соединениям упрощается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общая и систематическая. Общие имена возникают по-разному, но имеют общую черту, заключающуюся в отсутствии необходимой связи между именем и структурой. Имя, которое соответствует определенной структуре, нужно просто запомнить, как и выучить имя человека. Систематические названия, с другой стороны, напрямую связаны с молекулярной структурой в соответствии с общепринятым набором правил.Наиболее широко используемые стандарты для номенклатуры органических веществ возникли на основе предложений, сделанных группой химиков, собранных для этой цели в Женеве в 1892 году, и регулярно пересматриваются Международным союзом чистой и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения из других семейств рассматриваются как производные алканов путем присоединения функциональных групп к углеродному скелету или иным образом его модификации.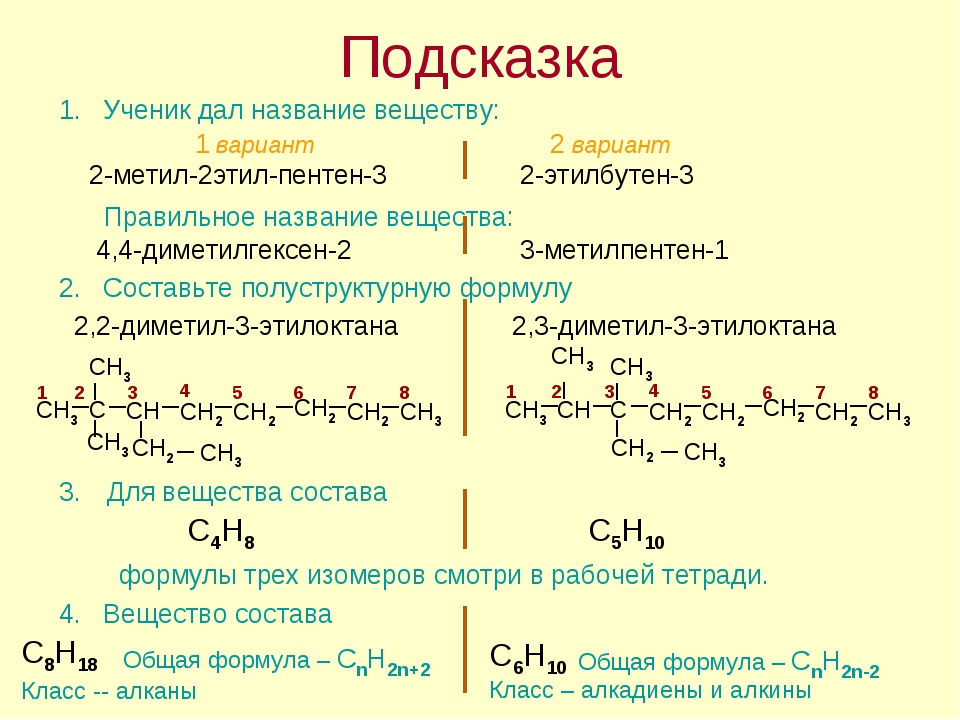
Правила IUPAC присваивают неразветвленным алканам названия в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно. Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан.Начиная с пятиуглеродных цепей, названия неразветвленных алканов состоят из латинского или греческого корня, соответствующего количеству атомов углерода в цепи, за которым следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением групп CH 2 , составляют гомологичный ряд.
| формула алкана | название | формула алкана | название |
|---|---|---|---|
| CH 4 | метан | Канал 3 (Канал 2 ) 6 Канал 3 | октановое число |
| Канал 3 Канал 3 | этан | Канал 3 (Канал 2 ) 7 Канал 3 | нонан |
| Канал 3 Канал 2 Канал 3 | пропан | Канал 3 (Канал 2 ) 8 Канал 3 | декан |
| Канал 3 Канал 2 Канал 2 Канал 3 | бутан | Канал 3 (Канал 2 ) 13 Канал 3 | пентадекан |
| Канал 3 (Канал 2 ) 3 Канал 3 | пентан | Канал 3 (Канал 2 ) 18 Канал 3 | icosane |
| Канал 3 (Канал 2 ) 4 Канал 3 | гексан | Канал 3 (Канал 2 ) 28 Канал 3 | триаконтан |
| Канал 3 (Канал 2 ) 5 Канал 3 | гептан | Канал 3 (Канал 2 ) 98 Канал 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепи атомов углерода в молекуле, называемой родительской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение (метильного) заместителя CH 3 в семиуглеродной цепи определяется числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в родительской цепи, начиная с конца, ближайшего к ответвлению. Поэтому соединение называется 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение (метильного) заместителя CH 3 в семиуглеродной цепи определяется числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в родительской цепи, начиная с конца, ближайшего к ответвлению. Поэтому соединение называется 3-метилгептаном.
Когда есть два или более идентичных заместителя, реплицирующие префиксы (ди-, три-, тетра- и т. Д.) используются вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этильная (CH 2 CH 3 ) и метильная (―CH 3 ) группы, указаны в алфавитном порядке. При расположении по алфавиту повторяющиеся префиксы игнорируются. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.
Метил и этил являются примерами алкильных групп.Алкильная группа образуется из алкана путем удаления одного из его атомов водорода, тем самым оставляя потенциальную точку присоединения. Метил — единственная алкильная группа, производная от метана, а этил — единственная группа из этана. Имеются две C 3 H 7 и четыре C 4 H 9 алкильные группы. Правила ИЮПАК для наименования алканов и алкильных групп охватывают даже очень сложные структуры и регулярно обновляются. Они недвусмысленны в том смысле, что, хотя одно соединение может иметь более одного правильного названия IUPAC, нет возможности, что два разных соединения будут иметь одно и то же имя.
Лаборатория №1: Органические реакции
3. Серная кислота
Хотя алканы инертны к холодной, концентрированной серной кислоте, алкенам
реагируют добавлением. Продукт, алкилгидросульфат, растворим в концентрированных
серная кислота.
Процедура
К каждой из двух порций концентрированной серной кислоты по 2 мл в отдельных в пробирки добавляют около 10 капель алкана и алкена соответственно.
 Встряхните
пробирки и обратите внимание на результаты. Выбросьте содержимое, вылив его в
стакан, содержащий не менее 50 мл воды.
Встряхните
пробирки и обратите внимание на результаты. Выбросьте содержимое, вылив его в
стакан, содержащий не менее 50 мл воды. Rxns ароматических углеводородов
Толуол будет использоваться в каждом из следующих экспериментов. Несмотря на то что
формально ненасыщенный, C 6 H 6 CH 3 в смысле
что он имеет несколько двойных углерод-углеродных связей, толуол не дает
обычные реакции, ожидаемые от алкена.Он не окисляется легко, и желательно
претерпевает реакции замещения, а не присоединения.
1. Бром
Добавьте 1 мл толуола в небольшую пробирку. К другому добавить немного железа
опилки, затем 1 мл толуола, используя последний, чтобы промыть опилки
застрял на стенках пробирки. В каждую пробирку добавьте по три капли брома.
Поместите пробирки в стакан с теплой водой на 15 минут. Обратите внимание на цвет
каждой пробирки, и выделился ли бромистый водород, и запишите
результаты, достижения.
2. Перманганат калия водный
В пробирку, содержащую 1 мл толуола, добавить 2 мл разбавленного раствора (2,0% мас.)
раствор перманганата калия, встряхните и запишите результаты.
Rxns спиртов и фенолов
Следующие ниже тесты и эксперименты предназначены для иллюстрации некоторых
свойства и реакции спиртов и фенолов.
R-OH
Ar-OH
спирт
фенол
1. Растворимость
Присутствие гидроксильной группы в спиртах и фенолах позволяет водороду
связь между ним и аналогичным веществом воды, H-OH. Это ведет к
заметная растворимость в воде для этих классов соединений, особенно
нижние члены серии.
Процедура
В шесть отдельных пробирок поместите 0.5 мл или 0,2-0,5 г каждого из
следующие: этанол, н-бутиловый спирт, трет-бутиловый спирт, циклогексанол,
изоамиловый спирт и фенол. ( Осторожно: Избегайте контакта кожи с
фенол. В случае ожога тщательно промыть водой в течение 15 минут.
уведомить учителя.) Добавьте по 2 мл воды в каждую пробирку, перемешайте и наблюдайте. Записывать
результаты на листе отчета.
( Осторожно: Избегайте контакта кожи с
фенол. В случае ожога тщательно промыть водой в течение 15 минут.
уведомить учителя.) Добавьте по 2 мл воды в каждую пробирку, перемешайте и наблюдайте. Записывать
результаты на листе отчета.
2. Реакция с щелочью
Фенолы более кислые, чем спирты, и могут быть превращены в их
натриевые соли реакцией с водным гидроксидом натрия.Натриевые соли
обычно растворимы в воде.
Процедура
В четыре отдельные пробирки поместите 0,5 мл или 0,2-0,5 г каждого из
следующие: n -бутиловый спирт, циклогексанол, фенол и 1-нафтол.
Добавьте 5 мл 10% гидроксида натрия в каждую пробирку, наблюдайте и записывайте результат.
3. Реакция с металлическим натрием
Как и с водой, атом водорода гидроксильной группы в спиртах
и фенолы могут быть замещены натрием:
2 R-OH + 2 Na ——->
2 R-O — Na + + H 2
алкоксид
Полученные алкоксиды представляют собой сильные основания, полезные, когда основной катализатор
нужен для органической реакции.
Процедура
Поместите по 2 мл каждого из следующих веществ в отдельные сухие пробирки :
этанол, 1-пропанол, 2-пропанол и орцинол. Добавьте небольшой кусочек натрия
металл к каждой пробирке и запишите результат. Добавьте несколько капель универсального
индикатор к раствору и запишите результат. ( Осторожно: НЕ выбросить содержимое любой пробирки с непрореагировавшим натрием в канализацию; натрия
бурно реагирует с водой. Добавьте достаточно этанола, чтобы уничтожить все непрореагировавшие
натрия, затем смойте раствор в канализацию.)
Тесты на три класса спиртов
Спирты делятся на первичные, вторичные или третичные, в зависимости от
от того, присоединена ли гидроксильная группа к атому углерода, с которым она связана,
два или три других атома углерода. Спирты, обработанные определенным реагентом
могут отличаться по скорости их реакции или даже по типу продукта
получаются, в зависимости от класса, к которому они принадлежат. Тесты, которые различают
среди трех классов могут быть полезны при определении структуры
неизвестный алкоголь.
Тесты, которые различают
среди трех классов могут быть полезны при определении структуры
неизвестный алкоголь.
The Lucas Test
Реагент представляет собой раствор хлорида цинка в концентрированной соляной
кислота. Тест основан на разных уровнях начальной, средней и средней школы.
а третичные спирты превращаются в их хлориды.
ZnCl 2
R-OH + HCl ———> R-Cl + H 2 O
Третичные спирты мгновенно реагируют с образованием нерастворимого алкилхлорида.
который выглядит как мутная дисперсия или как отдельный слой.Вторичные спирты
раствориться, чтобы получить прозрачный раствор (при условии, что R не содержит слишком много углерода
атомов в цепи.), затем образуют хлориды (мутный раствор) в течение пяти минут.
Первичные спирты не превращаются в хлорид в течение нескольких часов при комнатной температуре.
температура с этим реагентом.
Процедура
Поместите по 2 мл реактива Лукаса в каждую из четырех пробирок. Добавьте около пяти
капли спирта для анализа, встряхните и отметьте, сколько времени
требуется, чтобы смесь стала мутной или разделилась на два слоя.Тест
1-бутанол, 2-бутанол, циклогексанол, н-амиловый спирт, бензиловый спирт и t- бутил
алкоголь и запишите результаты.
Окисление хромовой кислоты (тест Бордвелла-Веллмана)
Первичные и вторичные спирты быстро окисляются хромовой кислотой,
где третичного спирта нет. В этом тесте ацетоновый раствор спирта
испытуемый обрабатывается раствором хромового ангидрида (Cr 5+ )
в серной кислоте.Окисленные спирты восстанавливают хром до Cr 3+ ,
в результате раствор становится непрозрачным и приобретает зеленоватый оттенок.
Процедура
Поместите по 1 мл ацетона в каждую из пяти отдельных пробирок.
В каждую пробирку добавьте одну каплю жидкого спирта или несколько кристаллов (10
мг) тестируемого твердого спирта и встряхивайте, пока раствор не станет прозрачным.
При встряхивании добавляют одну каплю реагента.Проверьте следующие спирты:
1-бутанол, 2-бутанол, t- бутиловый спирт, н-амиловый спирт, бензиловый спирт,
и холестерин.
Реакции фенолов
A. С бромной водой
Гидроксильная группа фенолов активирует кольцо до электрофильного замещения,
так что реакция происходит в очень мягких условиях. С бромной водой и
фенол, продукт представляет собой 2,4,6-трибромфенол, который имеет такую низкую растворимость
в воде, что часто используется не только как качественный тест на фенол
но также как количественная мера количества присутствующего фенола.
Процедура
Примерно к 0,1 г фенола, растворенного в 3 мл воды, добавить бромную воду. при встряхивании до сохранения желтого цвета. Наблюдайте за результатами.
при встряхивании до сохранения желтого цвета. Наблюдайте за результатами.
B. С хлоридом железа
Фенолы и соединения с гидроксильной группой, присоединенной к ненасыщенной
атом углерода (енолы) дает окраску (розовую, зеленую или фиолетовую в зависимости от
структура фенола или енола) с хлоридом железа.Это связано с
образование определенных координационных комплексов с железом. Обычный
спирты не вступают в реакцию. Этот тест может использоваться для различения большинства фенолов.
из спиртов.
Процедура
В трех отдельных пробирках растворите один или два кристалла, или один или
две капли исследуемого соединения в 5 мл воды. В каждую трубку добавить
одну или две капли 1% раствора хлорида железа, встряхните и наблюдайте за результатами.Проверьте фенол, резорцин и 2-пропанол и запишите результаты.
Реакции альдегидов и кетонов
Альдегиды и кетоны имеют в качестве своей функциональной группы углерод-кислородную группу. двойная связь (карбонильная группа). Соответственно, они претерпевают аналогичные реакции.
С одним и тем же реагентом альдегиды обычно реагируют быстрее, чем кетоны, в основном
потому что карбонильный углерод меньше скучен. Альдегиды
также более легко окисляются, чем кетоны.
двойная связь (карбонильная группа). Соответственно, они претерпевают аналогичные реакции.
С одним и тем же реагентом альдегиды обычно реагируют быстрее, чем кетоны, в основном
потому что карбонильный углерод меньше скучен. Альдегиды
также более легко окисляются, чем кетоны.
Окисление
Альдегиды легко окисляются до кислот, которые имеют такое же количество
атомы углерода.
Органические химические вещества: алканы, алкены и ацетилены
1,1,2,2-Тетраметилциклопропан, 99%
1,13-тетрадекадиен, 90 +%
1,1,4,4-Тетрафенил-1,3-бутадиен, 99%
1,1′-Бинафтил, 98%
1,1-Дифенилэтилен, 98%
1,1-дифенилгексан, 98%
1,1-дифенилпентан, 97%
1,1-дифенилпропан, 98 +%
1,2,3,4,5-Пентаметилциклопентадиен, 94%
1,2,3,4-Тетрагидронафталин, 97%
1,2,3,4-Тетраметилбензол, 95%
1,2,4,5-Тетраметилбензол, 97 +%
1,2,4-триметилбензол, 98%
1,2-бис (1-нафтил) этан, 97%
1,2-ди (3-инденил) этан, 98%
1,2-диэтилбензол, 97%
1,2-Диметилнафталин, 98%
1,2-дифенилциклопропан, цис + транс, 97%
1,2-дифенилэтан, 98 +%
1,2-ди (п-толил) этан, 98%
1- (2-Фенилэтил) -4- (фенилэтинил) бензол, 97%
1,3,5,5-Тетраметил-1,3-циклогексадиен, 94%
1,3,5,7-Циклооктатетраен, 98%, стаб. с 0,1% гидрохиноном
с 0,1% гидрохиноном
1,3,5-Триэтилбензол, 95%
1,3,5-Триэтинилбензол, 98%
1,3,5-Триизопропилбензол, 95%
1,3,5-Трифенилбензол, 99 +%
1,3,5-Три-трет-бутилбензол, 97 +%
1,3-Циклогексадиен, 96%, стаб. с 0,1% BHT
с 0,1% BHT
1,3-Циклооктадиен, 97%
1,3-диэтилбензол, 97 +%
1,3-Диизопропилбензол, 96%
1,3-Диизопропилциклогексан, цис + транс, 97 +%
1,3-дифенилпропан, 98%
1,3-ди-трет-бутилбензол, 99%
1,4,6,7-Тетраметилнафталин, 98%
1,4-бис (2-метилстирил) бензол, 99%
1,4-бис (фенилэтинил) бензол, 97%
1,4-Циклогексадиен, 97% стаб. с 0,1% BHT
с 0,1% BHT
1,4-Дициклогексилбензол, 99%
1,4-диэтилбензол, 98%
1,4-диизопропилбензол, 98%
1,4-диизопропилциклогексан, цис + транс, 98%
1,4-ди-н-бутилбензол, 97 +%
1,4-дифенилбутадиин, 99%
1,4-ди-трет-бутилбензол, 98%
1,4-гексадиен, цис + транс, 99%
1,5,9,13-тетрадекатетраен, 95%
1,5,9-декатриен, цис + транс, 97%
1,5-Диметилнафталин, 99%
1. Часть 1. АЛКАНЫ и НЕФТЕХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ Продвинутый уровень Доктора Брауна Примечания к редакции по органической химииЭто это довольно длинная страница, потому что, с помощью алканов, это очень важное введение в аспекты органической химии в целом Много примеров структуры номенклатуры алканов Все, что нужно знать о наименовании алканы Как вы называете алканы? Номенклатура замещенные алканы — примеры строения алканов, наименования алканы, допустимые названия, отображаемая формула молекул алканов с именами, графикой формула алканов, молекулярная формула алканов, скелетная формула алканов, структурные формулы гомологический ряд алканов, линейных алканов, разветвленных алканов, алкила замещенные циклоалканы и др.Все, что вам нужно по названию и структуре алканы доуниверситетские! Базовое введение в
структура и химия
алканы (включая диаграммы, которые не повторялись на этой странице). Органический уровень Подиндекс Chemistry Part 1 только для этой страницы: 1.1.1 Объяснение номенклатуры алканов и изомерии 1.1.2 Различные способы представления молекул и классы формулы 1.1.3 Сравнение алифатических / алициклических / ароматических соединений — определение и примеры 1.1.4 Объяснение изомерии алканов 1.1.5 Гомологичный серия примеров алканов, общая формула C n H 2n + 2 , включая изомеры молекулярных формул до C 7 H 16 (до n = 7) 1.1.6 Примеры циклоалканов ‘алициклические’ соединения общей формулы C n H 2n 1.1.7 Все 18 изомеров алканов C 8 H 18 * 1.1.8 Примеры изомеров алканов C 9 H 20 1. Важные примечания по как вывести эмпирические и молекулярные формулы, включая примеры алканов
а также
[ПОИСК ВСТАВКА] Алканы и нефтехимическая промышленность INDEX Все продвинутые органические продукты Химические заметки Индекс GCSE / IGCSE Oil — Полезные продукты Примечания к редакции химии 1.
Как назвать алканы (введение в номенклатуру алканов)
Некоторые «старые»
имена указаны в кавычках ( курсив, ), хотя по возможности их следует избегать [но
многие все еще используются — просто поместите один в GOOGLE!]. Названия алканов выделены жирным шрифтом. предпочитал имена ИЮПАК. 1.1.2 Подробнее о способах представления структуры молекул и классов формулы Это можно проиллюстрировать, посмотрев на строение молекул пропана, 2-метилпропана и бутана. Следовать последовательность пунктов маркера вниз, а затем назад, так что вы достаточно четко понимаете взаимосвязь между всеми структурными стилями и стилями формул.
1.1.3 Упрощенная конструкция сравнение алифатические, алициклические и ароматические УГЛЕВОДОРОДЫ
1. Названия алканов, выделенные жирным шрифтом, являются предпочтительными. Имена ИЮПАК.
1.1.5 Гомологический ряд алканов — нециклических предельных углеводородов с до 7 атомов углерода для общей формулы C n H 2n + 2 Названия алканов, выделенные жирным шрифтом, являются предпочтительными.
1. Названия алканов выделены жирным шрифтом. предпочитал имена ИЮПАК.
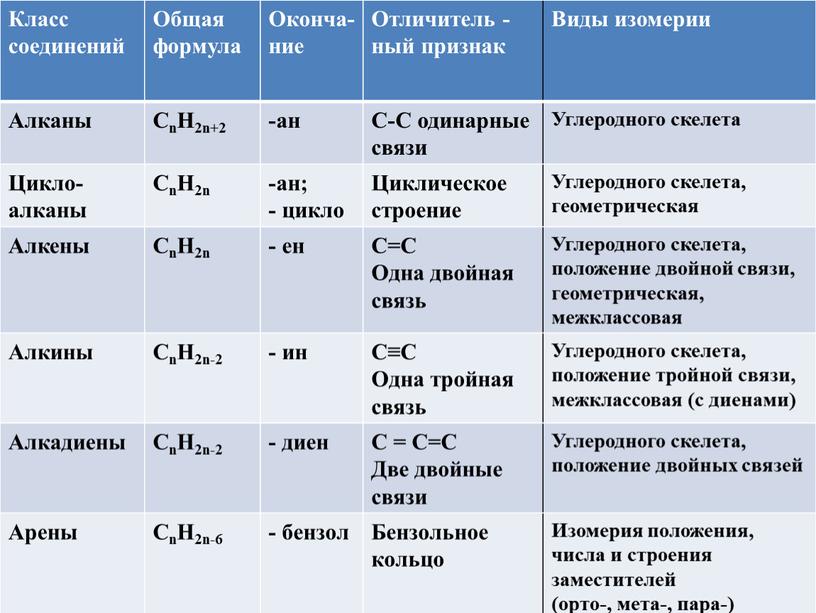 Это
означает, что связь C-C-C очень напряжена и легко разрывается в отличие от
большинство связей C-C-C в молекулах алканов. Это
означает, что связь C-C-C очень напряжена и легко разрывается в отличие от
большинство связей C-C-C в молекулах алканов. 1. 1.1.7 Представлено как краткое руководство по разработка 18 изомеров нециклоалканов C 8 H 18 Названия алканов, выделенные жирным шрифтом, являются предпочтительными. Имена ИЮПАК. (1) октан, CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3
(2) 2-метилгептан, (CH 3 ) 2 CHCH 2 CH 2 CH 2 CH 2 CH 3 (3) 3-метилгептан, CH 3 CH 2 CH (CH 3 ) CH 2 CH 2 CH 2 CH 3 (4) 4-метилгептан , Канал 3 Канал 2 Канал 2 Канал (Канал 3 ) Канал 2 Канал 2 Канал 3
(5) 2,2-диметилгексан, , (6) 2,3-диметилгексан, , (7) 2,4-диметилгексан, , (8) 2,5-диметилгексан, , (9) 3,3-диметилгексан, , (10) 3,4-диметилгексан, ,
(11) 3-этилгексан, ,
(12) 3-этил-2-метилпентан, , (13) 3-этил-3-метилпентан, ,
(14) 2,2,3-триметилпентан , (канал 3 ) 3 CCH (канал 3 ) канал 2 канал 3 (15) 2,2,4-триметилпентан (изооктан) , (CH 3 ) 3 CCH 2 CH (CH 3 ) 2 , , г. (16) 2,3,3-триметилпентан , (CH 3 ) 2 CHC (CH 3 ) 2 CH 2 CH 3 (17) 2,3,4-триметилпентан, (Канал 3 ) 2 Канал (Канал 3 ) Канал (Канал 3 ) 2
(18) 2,2,3,3-тетраметилбутан, (CH 3 ) 3 CC (CH 3 ) 3 1.1.8 Примеры изомеров C 9 H 20 Названия алканов выделены жирным шрифтом. предпочитал имена ИЮПАК.
1. Названия алканов, выделенные жирным шрифтом, являются предпочтительными. Имена ИЮПАК.
НАЧАЛО СТРАНИЦЫ [ПОИСК ВСТАВКА] Органический уровень Субиндекс химии, часть 1: 1.1.1 Объяснение номенклатуры алканов 1. 1.1.3 Сравнение алифатических / алициклических / ароматических соединений — определение и примеры 1.1.4 Объяснение изомерии алканов 1.1.5 Гомологичный серия примеров алканов, общая формула C n H 2n + 2 , включая изомеры молекулярных формул до C 7 H 16 (до n = 7) 1.1.6 Примеры циклоалканов ‘алициклические’ соединения общей формулы C n H 2n 1.1.7 Все 18 изомеров алканов C 8 H 18 * 1.1.8 Примеры изомеров алканов C 9 H 20 1.1.9 Примеры изомеров алканов C 10 H 22 а также
Алканы и нефтехимическая промышленность INDEX Все продвинутые органические продукты Химические заметки Индекс GCSE / IGCSE Oil — Полезные продукты Примечания к редакции химии ключевых слов формулы: как сделать
название название номенклатура эмпирическая молекулярная формула графическая формула
отображаемая формула скелетная формула структурные изомеры изомерия Ch5 C2H6
Ch4Ch4 Ch4-Ch4 C3H8 Ch4Ch3Ch4 Ch4-Ch3-Ch3-Ch4 C4h20 Ch4Ch3Ch3Ch4
Ч4-Ч3-Ч3-Ч4 C4H8 C5h22
C5h20 C6h24 C6h22 C7h26 C8h28 C9h30 C10h32 Примечания по химии структура алканов AS AQA
GCE Уровень химии как назвать алканы? AS Edexcel GCE A level
химия правила номенклатуры алканов AS OCR GCE Уровень химии что такое
молекулярная структура алканов? AS Salters GCE Уровень химии как
для разработки изомеров алканов 11 и 12 классов США по химии ИЮПАК
алканов примечания для пересмотра структуры и наименования линейных и
циклические алканы как назвать алканы
для химии AQA AS, как назвать алканы
для Edexcel A level AS chemistry, как назвать алканы для A level OCR AS chemistry A,
как назвать алканы для химии B OCR Salters AS,
как назвать алканы для химии уровня AQA A, как назвать
алканы для химии A level Edexcel A level,
как назвать алканы для OCR Химия уровня A
A, как назвать алканы для A level OCR Salters A
уровень химии B как называть алканы для США с отличием 11 класс 12 как
назвать алканы для
довузовские курсы химии довузовские курсы пересмотр уровня
примечания о том, как называть алканы Руководство по уровню
заметки о том, как называть алканы для школ, колледжей, академий, преподавателей курсов естественных наук, изображения
рисунки диаграммы для того, как назвать алканы примечания к пересмотру химии уровня
как называть алканы для пересмотра примечаний к темам модуля, чтобы помочь понять
как назвать университетские курсы алканов по науке
карьера в науке работа в промышленности лаборант
стажировки технические стажировки США США 11 класс 11 класс AQA A
химия уровня
примечания о том, как называть алканы Edexcel
Примечания по химии уровня A о том, как называть алканы для распознавания текста Химия уровня A
Заметки WJEC Уровень химии Заметки о том, как называть алканы
CCEA / CEA A level Химические заметки о том, как называть алканы
Эти подробные заметки о
структура и названия алканов включают общую формулу алкана
молекул, эмпирическая формула молекул алканов, структурная формула
молекулы алканов, скелетная формула молекул алканов, отображается
формула молекул алканов, формы молекул алканов, изомеры
молекулы алканов Правила IUPAC для номенклатуры алканов. Leave a Reply |





 1 Что такое АЛКАНЫ? Их м олекулярный структура и номенклатура — наименования алканов
1 Что такое АЛКАНЫ? Их м олекулярный структура и номенклатура — наименования алканов 
 1.9
Примеры алкановых изомеров C 10 H 22
1.9
Примеры алкановых изомеров C 10 H 22 
 гомологические ряды и функциональные группы).
гомологические ряды и функциональные группы). ..ane)
..ane) грамм. CH 3 CH 3 (этан), CH 3 CH 2 CH 2 CH 2 CH 3 или CH 3 (CH 2 ) 3 CH 3 пентан
грамм. CH 3 CH 3 (этан), CH 3 CH 2 CH 2 CH 2 CH 3 или CH 3 (CH 2 ) 3 CH 3 пентан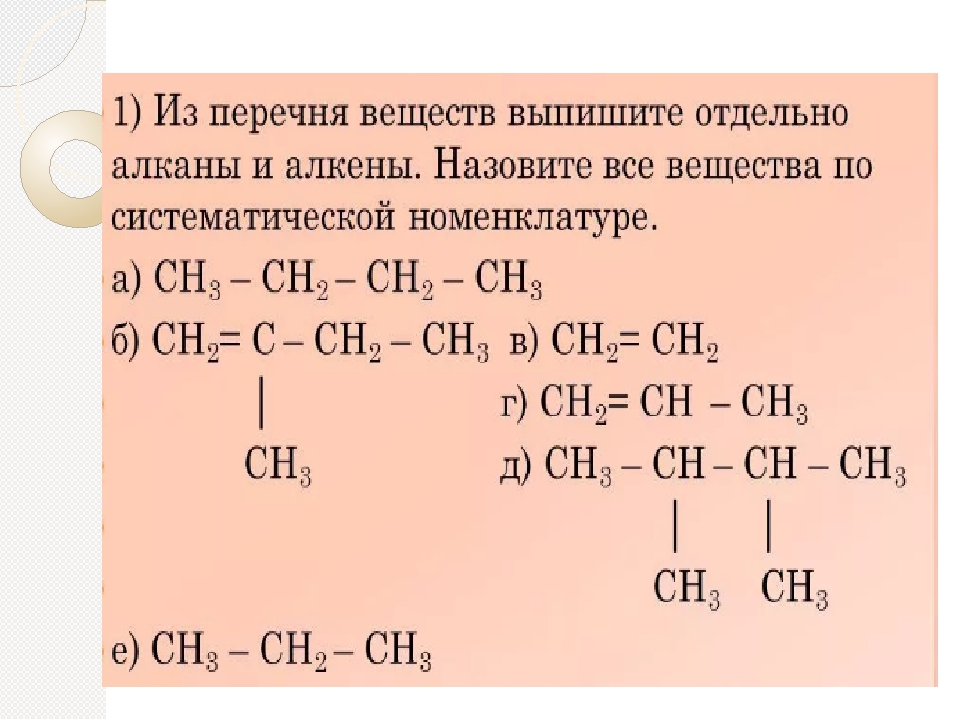 потому что нет боковых цепей или ответвлений.
потому что нет боковых цепей или ответвлений.
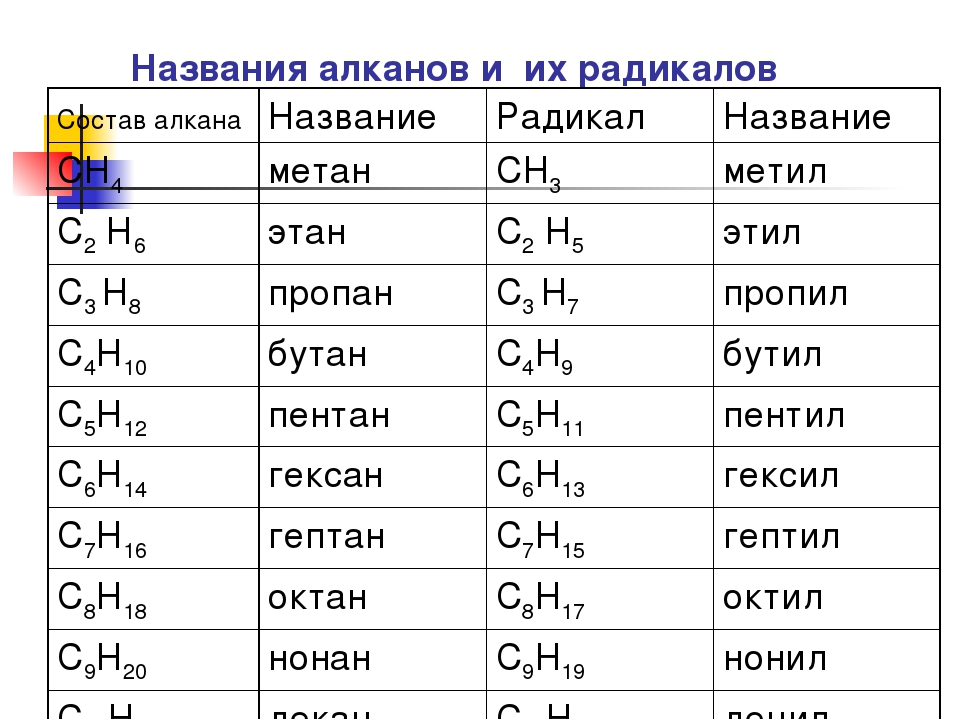 откуда возможна изомерия структурной цепи.
откуда возможна изомерия структурной цепи.  Здесь
показаны три связи C-C, но только одна из связей C-H.
Здесь
показаны три связи C-C, но только одна из связей C-H. д. для связанных атомов углерода в основной цепи, где 1-й
атом углерода в цепи рассматривается как атом C 1 и не может иметь алкил
заместитель, поскольку он просто удлиняет самую длинную углеродную цепь.
д. для связанных атомов углерода в основной цепи, где 1-й
атом углерода в цепи рассматривается как атом C 1 и не может иметь алкил
заместитель, поскольку он просто удлиняет самую длинную углеродную цепь.
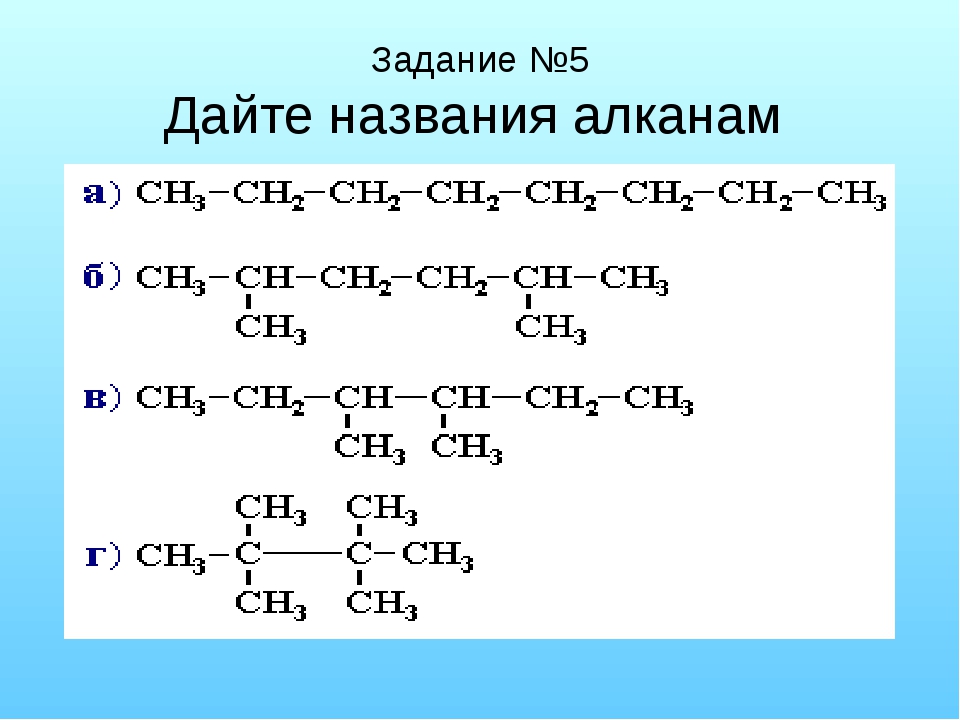 (отличается от молекулярной формулы, 2).
(отличается от молекулярной формулы, 2).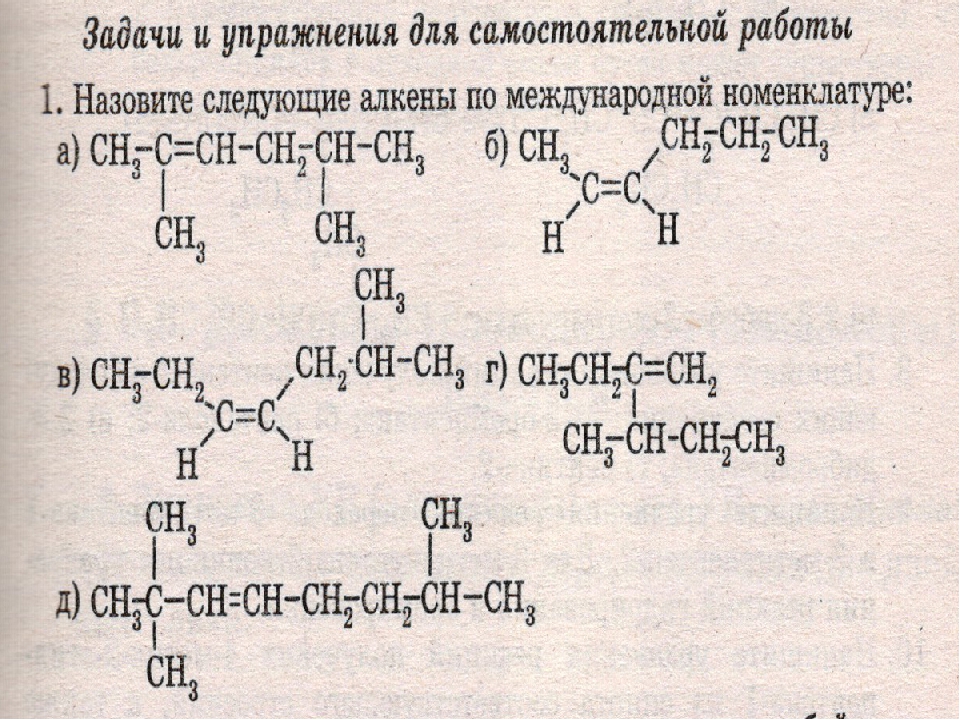



 Вау, это просто!
Вау, это просто!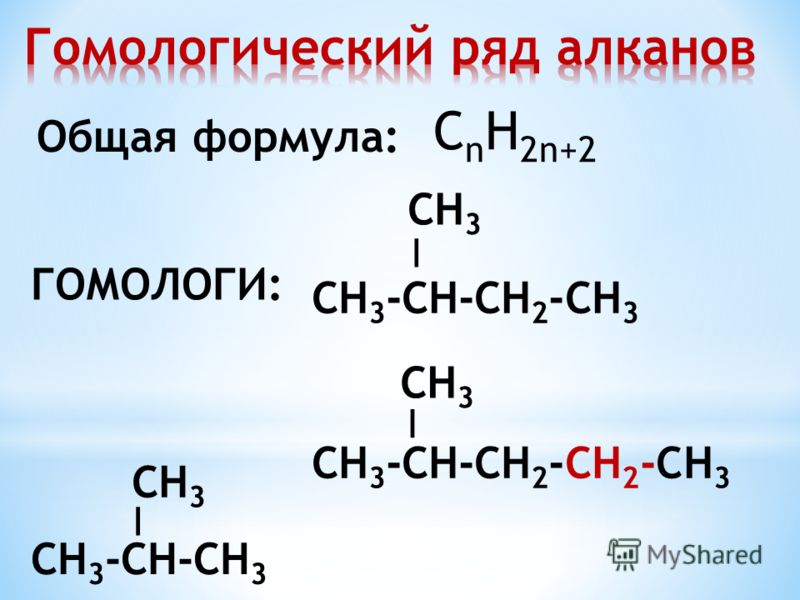
 Также модели с шариком и клюшкой / шариком и пружиной
и объемные модели для этана .
Также модели с шариком и клюшкой / шариком и пружиной
и объемные модели для этана .


 д., некоторые из которых могут иметь
алифатическая / алициклическая кольцевая структура.
д., некоторые из которых могут иметь
алифатическая / алициклическая кольцевая структура.
 1.4 Краткое руководство по разработка изомеров нециклоалканов C n H 2n + 2
1.4 Краткое руководство по разработка изомеров нециклоалканов C n H 2n + 2 
 д. Я описал множество примеров алканов на
эта страница.
д. Я описал множество примеров алканов на
эта страница.
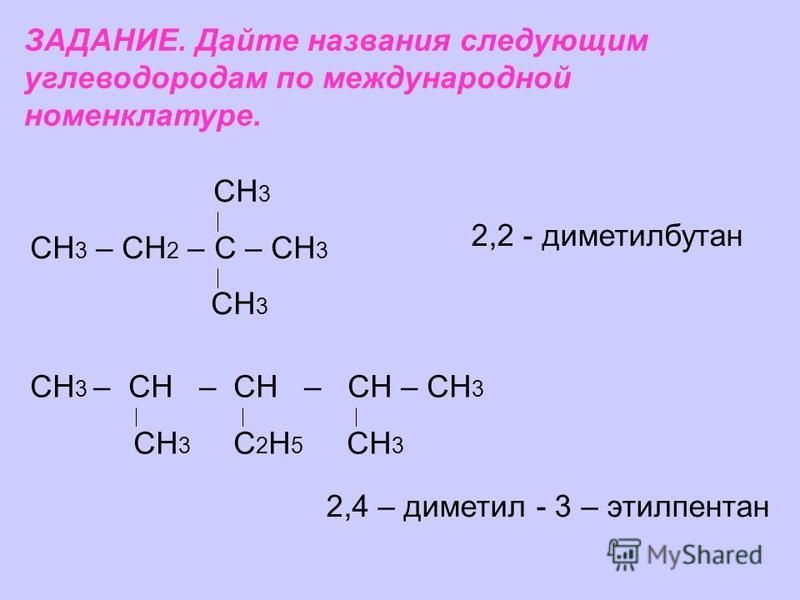 Имена ИЮПАК.
Имена ИЮПАК.

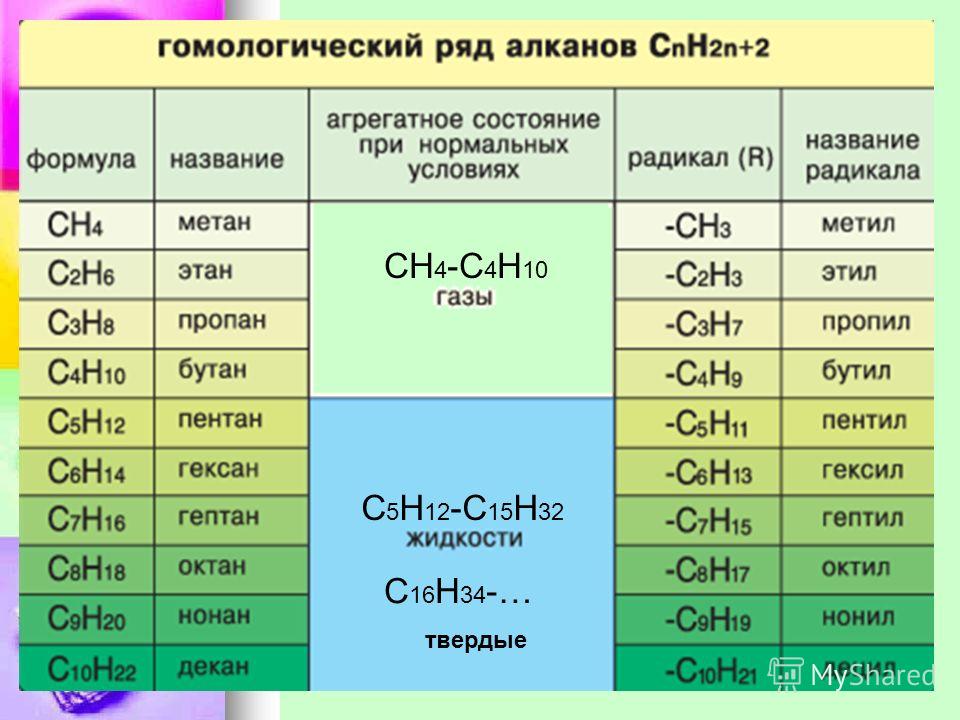 НО можно добавить для
ясность, особенно для новичков,
НО можно добавить для
ясность, особенно для новичков,
 ),
),
 1.6 Циклоалканы
(общая формула C n H 2n & изомерный с нециклическим алкены )
1.6 Циклоалканы
(общая формула C n H 2n & изомерный с нециклическим алкены )  Другими словами, атомы углерода НЕ находятся в одной плоскости, которая является
случай для каждого циклоалкана, кроме циклопропана (см. выше). Связь H-C-H
углы составляют ~ 107 o в циклобутане.
Другими словами, атомы углерода НЕ находятся в одной плоскости, которая является
случай для каждого циклоалкана, кроме циклопропана (см. выше). Связь H-C-H
углы составляют ~ 107 o в циклобутане.

 1,7–1,1,9
Алканы большего размера с 8-10 атомами углерода C n H 2n + 2 продолжение
1,7–1,1,9
Алканы большего размера с 8-10 атомами углерода C n H 2n + 2 продолжение  ..
.. ..
.. ..
.. 1.2 Различные способы представления молекул
и классы формулы
1.2 Различные способы представления молекул
и классы формулы