




РЕФЕРАТ
Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
/>Для простейших представителей класса, а также высших жирных
кислот (см. тему «Жиры»), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета — на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода — жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
/>Окисление углеводородов:
/>Окисление первичных спиртов и альдегидов КMпО4 или К2Сr2О7:
Оксосинтез (см. тему «Химические свойства алкенов»).
/>Нитрильный синтез:
/>Магнийорганический синтез:
Гидролиз сложных эфиров — см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
/>Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾®(RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾®(RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾®RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾®2RCOONa + СO2+ Н2О.
/>Сравнение силы кислот:
/>Взаимодействие со спиртами (реакция этерификации).
/>Образование галогенангидридов:
/>Образование ангидридов (действием водоотнимаюших средств):
/>Взаимодействие с аммиаком с образованием амидов и нитрилов:
Непредельные карбоновые кислоты
Способы получения
/>Гидролиз галогенопроизводных:
/>Дегидратация гидроксикислот:
Нитрильный синтез:
/>Химические свойства
/>Гидрогалогенирование:
/>Гидратация:
Двухосновные кислоты
Химические свойства
/>Пиролиз щавелевой и малоновой кислот:
/>Синтез с малоновым эфиром:
Двухосновные непредельные кислоты
/>Способ получения
/>Химические свойства
/>Оксикислоты
Способы получения
/>Гидролиз галогенпроизводных:
Нитрильный синтез:
/>/>Реакция Реформатского (получение b-оксикислот):
Химические свойства
/>Дегидратация a-гидроксикислот:
/>Дегидратация b-гидроксикислот:
/>Дегидратация c-гидроксикислот:
Оптическая изомерия гидроксикислот
/>Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
/>
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Альдегидо- и кетокислоты
Способы получения
/>Окисление двухатомных спиртов с одной концевой группировкой:
/>Окисление оксикислот:
/>Гидролиз вицинальных дигалогенопроизводных карбоновах кислот:
/>Пиролиз винной кислоты:
Химические свойства
/>Пиролиз:
Кето-енольная таутомерия ацетоуксусного эфира.
/>Таутомерия – динамическая изомерия: с повышением температуры увеличивается содержание енольной формы:
Сложные эфиры
/>Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
/>Простейшие по составу сложные эфиры — бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры — воскообразные вещества. Все сложные эфиры в воде растворяются плохо.
Способы получения
Реакция этерификации (см. тему «Химические свойства одноосновных карбоновых кислот»).
/>Взаимодействие хлорангидридов кислот и алкоголятов щелочных металлов:
Изоамилацетат – запах груши.
/>Взаимодействие солей карбоновых кислот и галогензамещенных углеводородов:
Этилформиат – запах рома.
/>Реакция ангидридов карбоновых кислот со спиртами:
Этилбутират – запах ананаса.
Химические свойства
/>Гидролиз (омыление):
/>Реакция переэтерификации:
/>3) Образование амидов кислот под действием аммиака:
Жиры
/>Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры — вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях.
Жиры, образованные предельными кислотами — твердые вещества, а непредельными — жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Получение
/>Из природных источников.
Реакция этерификации глицерина:
Химические свойства
I) Гидролиз (омыление).
В зависимости от условий гидролиз бывает: водный (без катализатора, при высоких температуре и давлении), кислотный (в присутствии кислоты в качестве катализатора), щелочной (под действием щелочей) и ферментативный (в живых организмах).
/>Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Реакции присоединения: гидрирование или гидрогенизация — получение твердых жиров из жидких. Характерна для жидких жиров, содержащих кратные связи.
/>
www.ronl.ru
ВВЕДЕНИЕ
Органические карбоновые кислоты характеризуются наличием карбоксильной группы -COOH или -СO2 H. Все производные карбоновых кислот содержат ацильную группу R-CO-. По этой причине их часто называют также ацильными соединениями .
К основным производным карбоновых кислот (ацильным соединениям) относятся:





хлорангидриды кислот ангидриды сложные эфиры амиды нитрилы
Карбоксильная группа формально состоит из карбонильной и гидроксильной групп, однако, взаимодействие между ними до такой степени изменяет поведение каждой из них, что в единстве они уже представляют собой новую функциональную группу, обладающую своими собственными свойствами.
По числу карбоксильных групп различают одно-, двух-, трех- и вообще многоосновные кислоты. Карбоновые кислоты могут быть предельными (насыщенными) — карбоксил связан с алкилом, — непредельными (ненасыщенными) — карбоксил связан с непредельным радикалом и ароматическими — карбоксил связан с ароматическим радикалом.
Для карбоновых кислот чаще всего используются традиционные названия. По систематической номенклатуре кислоты называют по соответствующим углеводородам с добавлением окончания -овая и слова кислота, причем счет атомов цепи начинается от карбоксильной группы.
Упр.1. Напишите формулы кислот: (а) пропионовой, (б) масляной, (в) изомас-ляной, (г) триметилуксусной, (д) валериановой, (е) пальмитиновой, (ж) стеариновой. Назовите их по номенклатуре IUPAC.
Упр.2. Напишите формулы следующих кислот: (а) бензойной, (б) метилбензой-ных (толуиловых), (в) фталевых, (г) фенилуксусной, (д) коричной.
Гидроксильная группа в карбоновых кислотах образует водородные связи, причем более прочные, чем в спиртах. Кроме того, в карбоновых кислотах в образовании водородной связи может участвовать карбонильная группа. В твердом и жидком состоянии кислоты существуют в основном в виде димеров:

Такие димерные структуры сохраняются даже в газообразном состоянии и в растворах в воде. Способность карбоновых кислот образовывать водородные связи с водой обусловливает растворимость низжих кислот в воде. По мере увеличения длины углеродной цепи растворимость кислот в воде быстро уменьшается.
1. Свойства кислот
Свойства кислот обусловлены наличием в них карбоксильной группы, состоящей из гидроксильной и карбонильной групп.
1.1. Кислотность
В водных растворах карбоновые кислоты существуют в равновесии с карбоксильным ионом:
 (7)
(7)






pKa 4,76 2,86 1,48 0,7 4,19
Степень диссоциации карбоновых кислот в воде относительно не велика. Тем не менее карбоновые кислоты на много порядков сильнее, чем спирты.
Упр.6. Укажите, какая из пары кислот сильнее: (а) бензойная или п -нитробензойная, (б) 2-гидроксипропановая (молочная) или пропановая (пропионовая), (в) 2-оксопропановая (пировиноградная) или пропановая (пропионовая).
Ответ: (а) п -нитробензойная из-за –I-эффекта нитрогруппы, (б) молочная из-за –I-эффекта гидроксильной группы, (в)…
Электролизом солей карбоновых кислот получают алканы. При нагревании серебряных или ртутных солей карбоновых кислот с бромом образуются алкилбромиды.
 (8)
(8)
стеариновая кислота 1-бромгептадекан
 (9)
(9)
Эта реакция открыта русским химиком и композитором А.П. Бородиным (1861). Она протекает по радикальному иеханизму. Многие функциональные группы не мешают протеканию реакции.
Упр.7. Завершите реакции:
(а)  (б)
(б) 
(в)  (г)
(г) 
1.2. Нуклеофильное замещение ацильных соединений
Основной реакцией карбонильных соединений является реакция нуклеофильного присоединения, протекающая по механизму:
 (15 М 3)
(15 М 3)
Ацильная группа включает карбонильную группу. Реакции ацильных соединений проходят по механизму нуклеофильного присоединения — элиминирования:
 (м 2)
(м 2)
Реакционная способность ацильных соединений зависит от основности уходящей группы. По реакционной способности их можно расположить в следующий ряд:

Приведенный порядок реакционной способности ацильных соединений позволяет судить о том, какие из них могут быть получены из данного ацильного соединения, а какие нет. Менее реакционноспособные ацильные соединения могут быть получены из более реакционноспособных, обратные же реакции или затруднены или требуют особых условий.
2. Способы получение
Большинство из многочисленных методов получения кислот нами уже были рассмотрены в предыдущих главах.
А. Муравьиную кислоту получают в промышленности взаимодействием окиси углерода с водным раствором гидроксида натрия при высокой температуре и давлении:
 (1)
(1)
Формиат натрия муравьинаякислота
Б. Карбонилирование метанола. Разработан способ получения уксусной кислоты из метанола и окиси углероа в присутствии небольшого количества родия (III), HI и h3 O.
 (2)
(2)
Реакция проходит по следующему механизму:
 (М 1)
(М 1)

метил-родийкарбонильный комплекс

ацетил-родийкарбонильный комплекс

В. Алкены реагируют с окисью углерода и водяным паром в присутствии тетракарбонила никеля и других катализаторов при нагревании под давлением с образованием карбоновых кислот:
 (3)
(3)
Аналогичная реакция с ацетиленом приводит к образованию акриловой кислоты.
 (4)
(4)
акриловая кислота
Г. Окисление углеводородов кислородом воздуха является основным источником дешевых карбоновых кислот. Окислением толуола воздухом в присутствии марганцевого катализатора в промышленности получают бензойную кислоту.
В лабораторных условиях в качестве окислителя используется перманганат калия:
 (5)
(5)
Д. Металлоорганические соединения легко реагируют с диоксидом углерода, давая соли, которые далее разлагают сильной кислотой:
 (6)
(6)
Упр.3. Напишите реакцию получения пропионовой кислоты (а) по реакции Гриньяра и (б) методом оксосинтеза.
Упр.4. Напишите реакции получения бензойной кислоты из (а) толуола, (б) этил-бензола, (в) стирола, (г) бромбензола, (д) бензилового спирта, (е) бензальдегида.
Упр.5. При окислении циклогексана кислородом воздуха (100о С, 5-6 атм ) образуется смесь циклогексанола и циклогексанона. При дальнейшем окислении этой смеси азотной кислотой получают адипиновую кислоту, необходимую для синтеза найлона. Напишите уравнения реакций, приводящих к адипиновой кислоте.
3. Ангидриды карбоновых кислот
Ангидриды карбоновых кислот представляют собой продукты отщепления молекулы воды от двух молекул кислоты.
3.1. Способы получения ангидридов карбоновых кислот
Ангидриды карбоновых кислот, как мы только что видели (3.1), могут быть получены из хлорангидридов и солей карбоновых кислот. Кроме того они могут быть получены из ацилхлоридов и карбоновых кислот в присутствии пиридина:

ацилхлоорид кислота пиридин ангидрид пиридинийхлорид
Ангидриды многих карбоновых кислот образуются при нагревании соответствующих карбоновых кислот, причем при этом часто используются водоотнимающие средства. Так, уксусный ангидрид получают нагреванием уксусной кислоты с концентрированной серной кислотой:
 (28)
(28)
уксусный ангидрид
 (29)
(29)
В качестве дегидратирующего агента иногда используют дешевый уксусный ангидрид:
 (30)
(30)
Упр.19. Ангидрид бензойной кислоты может быть получен добавлением одного мольэквивалента воды к двум мольэквивалентам бензоилхлорида. Напишите эту реакцию.
Циклические ангидриды дикарбоновых кислот часто образуются при простом их нагревании:
 (31)
(31)
янтарная кислота янтарный ангидрид
Промышленным методом получения малеинового ангидрида служит окисление бензола или 2-бутена воздухом:
 (32)
(32)
Фталевый ангидрид получают в промышленности окислением нафталина или о -ксилола:
 (33)
(33)
Уксусный ангидрид в промышленности получают окислением уксусного альдегида
кислородом воздуха в присутствии медно-кобальтового катализатора:
 (34)
(34)
Упр.20. Малеиновая кислота превращается в малеиновый ангидрид при 200о С. Для получения малеинового ангидрида из фумаровой кислоты требуется значительно более высокая температура. Чем это объясняется? Напишите сооветствующие реакции.
Упр.21. Напишите реакции пропионового ангидрида с (а) водой, (б) этанолом, (в) аммиаком, (г) этиламином и опишите их механизм.
Упр.22. Каковы техничесие методы получения уксусного ангидрида? Каково его промышленное применение?
Упр.23. Завершите реакции



3.2. Реакции ангидридов карбоновых кислот
Ангидриды карбоновых кислот вступают в те же реакции, что и хлорангидриды:
 (35)
(35)
 (36)
(36)
метилацетат
 (М 6)
(М 6)
 (37)
(37)
ацетамид
Соединения, содержащие ацетильные группы, чаще всего получают из уксусного ангидрида: он дешев, легко доступен, не очень летуч и не выделяет коррозионного HCl.
 (38)
(38)
уксусный ангидрид нилин ацетанилид

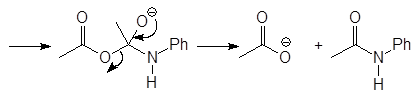 (М 7)
(М 7)
Упр.24. Напишите реакции ацетангидрида (а) с анилином и (б) салициловой кислотой и опишите их механизм.
www.ronl.ru
РЕФЕРАТ
Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
/>Для простейших представителей класса, а также высших жирных
кислот (см. тему «Жиры»), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета — на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода — жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
/>Окисление углеводородов:
/>Окисление первичных спиртов и альдегидов КMпО4 или К2Сr2О7:
Оксосинтез (см. тему «Химические свойства алкенов»).
/>Нитрильный синтез:
/>Магнийорганический синтез:
Гидролиз сложных эфиров — см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
/>Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾®(RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾®(RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾®RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾®2RCOONa + СO2+ Н2О.
/>Сравнение силы кислот:
/>Взаимодействие со спиртами (реакция этерификации).
/>Образование галогенангидридов:
/>Образование ангидридов (действием водоотнимаюших средств):
/>Взаимодействие с аммиаком с образованием амидов и нитрилов:
Непредельные карбоновые кислоты
Способы получения
/>Гидролиз галогенопроизводных:
/>Дегидратация гидроксикислот:
Нитрильный синтез:
/>Химические свойства
/>Гидрогалогенирование:
/>Гидратация:
Двухосновные кислоты
Химические свойства
/>Пиролиз щавелевой и малоновой кислот:
/>Синтез с малоновым эфиром:
Двухосновные непредельные кислоты
/>Способ получения
/>Химические свойства
/>Оксикислоты
Способы получения
/>Гидролиз галогенпроизводных:
Нитрильный синтез:
/>/>Реакция Реформатского (получение b-оксикислот):
Химические свойства
/>Дегидратация a-гидроксикислот:
/>Дегидратация b-гидроксикислот:
/>Дегидратация c-гидроксикислот:
Оптическая изомерия гидроксикислот
/>Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
/>
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Альдегидо- и кетокислоты
Способы получения
/>Окисление двухатомных спиртов с одной концевой группировкой:
/>Окисление оксикислот:
/>Гидролиз вицинальных дигалогенопроизводных карбоновах кислот:
/>Пиролиз винной кислоты:
Химические свойства
/>Пиролиз:
Кето-енольная таутомерия ацетоуксусного эфира.
/>Таутомерия – динамическая изомерия: с повышением температуры увеличивается содержание енольной формы:
Сложные эфиры
/>Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
/>Простейшие по составу сложные эфиры — бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры — воскообразные вещества. Все сложные эфиры в воде растворяются плохо.
Способы получения
Реакция этерификации (см. тему «Химические свойства одноосновных карбоновых кислот»).
/>Взаимодействие хлорангидридов кислот и алкоголятов щелочных металлов:
Изоамилацетат – запах груши.
/>Взаимодействие солей карбоновых кислот и галогензамещенных углеводородов:
Этилформиат – запах рома.
/>Реакция ангидридов карбоновых кислот со спиртами:
Этилбутират – запах ананаса.
Химические свойства
/>Гидролиз (омыление):
/>Реакция переэтерификации:
/>3) Образование амидов кислот под действием аммиака:
Жиры
/>Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры — вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях.
Жиры, образованные предельными кислотами — твердые вещества, а непредельными — жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Получение
/>Из природных источников.
Реакция этерификации глицерина:
Химические свойства
I) Гидролиз (омыление).
В зависимости от условий гидролиз бывает: водный (без катализатора, при высоких температуре и давлении), кислотный (в присутствии кислоты в качестве катализатора), щелочной (под действием щелочей) и ферментативный (в живых организмах).
/>Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Реакции присоединения: гидрирование или гидрогенизация — получение твердых жиров из жидких. Характерна для жидких жиров, содержащих кратные связи.
/>
www.ronl.ru
РЕФЕРАТ
Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
 |
кислот (см. тему «Жиры»), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета — на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода — жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
 |
 |
Оксосинтез (см. тему «Химические свойства алкенов»).
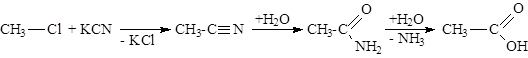 |
 |
Гидролиз сложных эфиров — см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
 Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾® (RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾® (RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾® RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾® 2RCOONa + СO2 + Н2О.
 |
 |
 |
 |
 |
Непредельные карбоновые кислоты
Способы получения
 |
 |
Нитрильный синтез:
 |
 |
 |
Двухосновные кислоты
Химические свойства
 |
 |
Двухосновные непредельные кислоты
 |
 |
 |
Способы получения
 |
Нитрильный синтез:
 |
Химические свойства
 |
 |
 |
Оптическая изомерия гидроксикислот
 Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
 |
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Альдегидо- и кетокислоты
Способы получения
 |
 |
 |
 |
Химические свойства
 |
Кето-енольная таутомерия ацетоуксусного эфира.
 |
Сложные эфиры
 Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
 |
Способы получения
Реакция этерификации (см. тему «Химические свойства одноосновных карбоновых кислот»).
 |
Изоамилацетат – запах груши.
 |
Этилформиат – запах рома.
 |
Этилбутират – запах ананаса.
Химические свойства
 |
 |
 |
Жиры
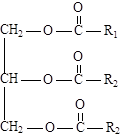 Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры — вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях.
Жиры, образованные предельными кислотами — твердые вещества, а непредельными — жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Получение
 |
Реакция этерификации глицерина:
Химические свойства
I) Гидролиз (омыление).
В зависимости от условий гидролиз бывает: водный (без катализатора, при высоких температуре и давлении), кислотный (в присутствии кислоты в качестве катализатора), щелочной (под действием щелочей) и ферментативный (в живых организмах).
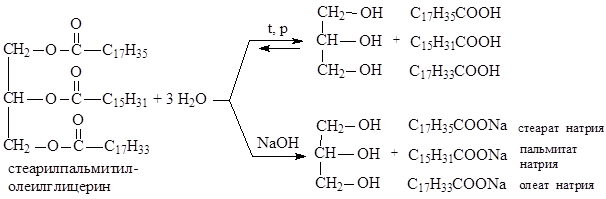 Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Реакции присоединения: гидрирование или гидрогенизация — получение твердых жиров из жидких. Характерна для жидких жиров, содержащих кратные связи.
 |
www.ronl.ru