|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Структура ДНК (дезоксирибонуклеиновой кислоты). Реферат днк
Реферат на тему: Функции ДНК и ее биологическая роль
Значение развития генетики человека очевидно. Можно с полной уверенностью сказать, что, например, в молекулах ДНК клеток человека запрограммирована генетическая информация, контролирующая каждый миг нашей жизни. Это касается здоровья, нормального развития, продолжительности жизни, наследственных болезней, сердечно-сосудистых заболеваний, злокачественных опухолей, предрасположенности к тем или иным инфе6кционным заболеваниям, старости и даже смерти.
Если выделить из ядра одной клетки человека все генетические молекулы ДНК и расположить их в линию одна за другой, то общая длина этой линии составит семь с половиной сантиметров. Такова биохимическая рабочая поверхность хромосом. Это сконцентрированное в молекулярной записи наследие веков прошедшей эволюции.
Правильно и образно сказал об этом в свое время в романе «Лезвие бритвы» писатель Иван Ефремов: «Наследственная память человеческого организма – результат жизненного опыта неисчислимых поколений, от рыбьих наших предков до человека, от палеозойской эры до наших дней. Эта инстинктивная память клеток и организма в целом есть тот автопилот, который автоматически ведет нас через все проявления жизни, борясь с болезнями, заставляя действовать сложнейшие автоматические системы нервной, химической, электрической и невесть какой еще регулировки. Чем больше мы узнаем биологию человека, тем более сложные системы мы в ней открываем».
Впервые ДНК была выделена в 1869 году Фридрихом Мишером, но этому веществу не было придано должного значения. В 1928 году Грифитс проводил опыты на пневмококке и пришел к странным выводам: он обнаружил, что непатогенных бактерий можно превратить в патогенных посредством введения какого-то вещества, которое содержится в клетках и его можно оттуда извлечь. Решение этому курьезу было найдено только через 15 лет.
В годы второй мировой войны в тиши лабораторий Эвери и Мак Карти решали судьбу самого человечества. Ими тогда было показано, что полимерными молекулами дезоксирибонуклеиновой кислоты, т. е. химически очищенным веществом, впервые полученным еще в конце прошлого столетия Мишером, можно передавать наследственные признаки. Вещество является материальным носителем наследственности!!!
Тогда это было сделано на микроорганизмах. Но иллюзий, что такое возможно только для них, уже не питал никто. И когда Уотсон и Крик выбрали для расшифровки пространственной структуры именно ДНК – они знали что делали.
В 1953 году Дж. Уотсон и Ф. Крик создали пространственную модель молекулы ДНК. За эту самую модель они получили Нобелевскую премию.
Строение ДНК
- Нуклеиновые кислоты являются высокомолекулярными нерегулярными полимерами. Их мономеры – нуклеотиды – сложные вещества, состоящие из:
- азотистого основания
- углевода
- остатка фосфорной кислоты
Мономеры соединяются между собой через пентозу в С3 положении и остаток фосфорной кислоты с помощью фосфорной диэфирной связи.
Азотистое основание — пентоза (у РНК – рибоза, у ДНК — дезоксирибоза) – остаток фосфорной кислоты.
- В природе существует всего 5 типов нуклеотидов, т.е. всего 5 типов азотистых оснований входит в состав нуклеиновых кислот. В ДНК это аденин (А), Гуанин (Г), цитозин (Ц), тимин (Т). В РНК вместо тимин – урацил (У). Основания принято обозначать первой буквой их названия.
Основания способны соединяться попарно А-Т(У), Г-Ц. Они комплиментарные, т.е. дополняют друг друга. А-Т связаны двумя водородными связями, а Г-Ц – тремя
- Нуклеиновые кислоты подобно белкам имеют первичную структуру – последовательность нуклеотидов. Расположение нуклеотидов важно, так как задает последовательность аминокислот в кодируемых белках. Вторичную структуру – две комплиментарные цепи, и третичную – пространственную структуру, которую и установили Уотсон и Крик.
- ДНК – уникальнейшие молекулы в природе, благодаря которым возможно хранение, передача, и воспроизведение наследственной информации в разных поколениях клеток, организмов, видов и т.д.
Перед делением ДНК должно удвоиться, для того чтобы каждая клетка получила точно такую же генетическую информацию, какая была в исходной клетке.
Функции ДНК:
- ДНК является носителем генетической информации. Функция обеспечивается фактом существования генетического кода.
- Воспроизведение и передача генетической информации в поколениях клеток и организмов. Функция обеспечивается процессом реплик ации.
Реализация генетической информации в виде белков, а также любых других соединений, образующихся с помощью белков-ферментов. Функция обеспечивается процессами транскр ипции и тран сля ции.
referati-besplatno.ru
Реферат - ДНК - Общая биология
Cпособность клеток поддерживать высокую упорядоченность своей организации зависит от генетической информации, которая сохраняется в форме дезоксирибонуклеиновой кислоты (ДНК). ДНК - это вещество, из которого состоят гены. Размножение живых организмов, передача наследственных свойств из поколения в поколение и развитие многоклеточного организма из оплодотворенной яйцеклетки возможны потому, что ДНК способна к самовоспроизведению. Сам процесс самовоспроизведения ДНК называется репликацией. Иногда используют также название-синоним - редупликация.Матричный синтез ДНК
Как известно, генетическая информация записана в цепи ДНК в виде последовательности нуклеотидных остатков, содержащих одно из четырех гетероциклических оснований: аденин (A), гуанин (G), цитозин (C) и тимин (T). Предложенная Дж. Уотсоном и Ф. Криком в 1953 году модель строения ДНК в форме регулярной двойной спирали сразу же позволила понять принцип удвоения ДНК. Информационное содержание обеих цепей ДНК идентично, так как каждая из них содержит последовательность нуклеотидов, строго соответствующую последовательности другой цепи. Это соответствие достигается благодаря наличию водородных связей между направленными навстречу друг другу основаниями двух цепей - попарно G и C или A и T. Описывая это свойство двойной спирали, молекулярные биологи говорят, что цепи ДНК комплементарны за счет образования уотсон-криковских пар GРC и AРT. Поскольку две цепи имеют противоположную направленность, их называют антипараллельными. Легко представить, что удвоение ДНК происходит вследствие того, что цепи расходятся, а потом каждая цепь служит матрицей, на которой собирается комплементарная ей новая цепь ДНК‚ результате образуются две дочерние, двуспиральные, неотличимые по строению от родительской ДНК молекулы. Каждая из них состоит из одной цепи исходной родительской молекулы ДНК и одной вновь синтезированной цепи. Такой механизм репликации ДНК, при котором от одного поколения к другому передается одна из двух цепей, составляющих родительскую молекулу ДНК, получил название полуконсервативного и был экспериментально доказан в 1958 году М. Мезельсоном и Ф. Сталь. Кроме того, ситезу ДНК характерны такие свойства, как антипараллельность и униполярность. Каждая цепь ДНК имеет определенную ориентацию. Один конец несет гидроксильную группу (ОН), присоединенную к 3'-углероду в сахаре дезоксирибозе, на другом конце цепи находится остаток фосфорной кислоты в 5'-положении сахара. Две комплементарные цепи в молекуле ДНК ориентированы в противоположных направлениях - антипараллельно (при параллельной ориентации напротив 3'-конца одной цепи находился бы 3'-конец другой). Ферменты, синтезирующие новые нити ДНК, называемые ДНК-полимеразами, могут передвигаться вдоль матричных цепей лишь в одном направлении - от их 3'-концов к 5'-концам. Џри этом синтез комплементарных нитей всегда ведется в 5' 3' направлении, то есть униполярно. Поэтому в процессе репликации одновременный синтез новых цепей идет антипараллельно. ДНК-полимеразы могут давать "задний ход", то есть двигаться в направлении 3' 5'. В том случае, когда последнее добавленное при синтезе нуклеотидное звено оказалось некомплементарным нуклеотиду матричной цепи, оно будет замещено комплементарным нуклеотидом. Отщепив "неправильный" нуклеотид, ДНК-полимераза продолжает синтез в 5' 3' направлении. Такая способность к исправлению ошибок получила название корректорской функции фермента (см. ниже).
ДНК-полимеразы
В 1957 году А. Корнберг обнаружил у кишечной палочки фермент, катализирующий процесс полимеризации ДНК из нуклеотидов; он был назван ДНК-полимеразой. Затем ДНК-полимеразы выявили и в других организмах. Было показано, что субстратами всех этих ферментов служат дезоксирибонуклеозидтрифосфаты (дНТФ), полимеризующиеся на одноцепочечной ДНК-матрице. ДНК-полимеразы последовательно наращивают одноцепочечную цепь ДНК, шаг за шагом присоединяя к ней следующие звенья в направлении от 5-' к 3'-концу, причем выбор очередного дНТФ диктуется матрицей. Присоединение каждого нового нуклеотидного остатка к 3'-концу растущей цепи сопровождается гидролизом богатой энергией связи между первым и вторым фосфатными остатками в дНТФ и отщеплением пирофосфата, что делает реакцию в целом энергетически выгодной. В клетках обычно присутствует несколько типов ДНК-полимераз, выполняющих различные функции и имеющих разное строение: они могут быть построены из различного количества белковых цепей (субъединиц), от одной до десятков. Однако все они работают на любых последовательностях нуклеотидов матрицы; задача этих ферментов- сделать точную копию каждой матрицы.
Точность синтеза ДНК и механизм коррекции Генетический материал живых организмов имеет огромные размеры и реплицируется с высокой точностью. В среднем в процессе воспроизведения генома млекопитающего, состоящего из ДНК длиной 3 млрд пар нуклеотидов, возникает не более трех ошибок. При этом ДНК синтезируется чрезвычайно быстро (скорость ее полимеризации колеблется в пределах от 500 нуклеотидов/с у бактерий до 50 нуклеотидов/с у млекопитающих). Высокая точность репликации, наряду с ее высокой скоростью, обеспечивается наличием специальных механизмов, осуществляющих коррекцию, то есть устраняющих ошибки. Суть механизма коррекции заключается в том, что ДНК-полимеразы дважды проверяют соответствие каждого нуклеотида матрице: один раз перед включением его в состав растущей цепи и второй раз перед тем, как включить следующий нуклеотид. Очередная фосфодиэфирная связь синтезируется лишь в том случае, если последний (3'-концевой) нуклеотид растущей цепи ДНК образовал правильную уотсон-криковскую пару с соответствующим нуклеотидом матрицы. Если же на предыдущей стадии реакции произошло ошибочное спаривание оснований, то дальнейшая полимеризация останавливается до тех пор, пока ошибка не будет исправлена. Для этого фермент перемещается в обратном направлении и вырезает последнее добавленное звено, после чего его место может занять правильный нуклеотидпредшественник. Иными словами, многие (но не все) ДНК-полимеразы обладают, помимо 5'-3'-синтетической активности, еще и 3'-гидролизующей активностью, которая обеспечивает удаление ошибочно спаренных с матрицей нуклеотидов.
Основные принципы репликации Основные правила, в соответствии с которыми происходит репликация, были выяснены в опытах с бактериями, однако они справедливы также и для высших организмов.
Инициация цепей ДНК
ДНК-полимеразы не могут начинать синтеза ДНК на матрице, а способны только добавлять новые дезоксирибонуклеотидные звенья к 3'-концу уже имеющейся полинуклеотидной цепи. Такую заранее образованную цепь, к которой добавляются нуклеотиды, называют затравкой. Короткую РНК- затравку синтезирует из рибонуклеозидтрифосфатов фермент, не обладающий корректирующей активностью и называемый ДНК-праймазой (от англ. primer - затравка). Праймазная активность может принадлежать либо отдельному ферменту, либо одной из субъединиц ДНК-полимеразы. Затравка, синтезированная этим неточным ферментом, не умеющим исправлять ошибки, отличается от остальной новосинтезированной цепи ДНК, поскольку состоит из рибонуклеотидов, и далее может быть удалена. Размер рибонуклеотидной затравки невелик (менее 20 нуклеотидов) в сравнении с размером цепи ДНК, образуемой ДНК-полимеразой. Выполнившая свою функцию РНК-затравка удаляется специальным ферментом, а образованная при этом брешь заделывается ДНК-полимеразой, использующей в качестве затравки 3'-ОН-конец соседнего фрагмента Оказаки (см ниже). Удаление крайних РНК-праймеров, комплементарных 3'-концам обеих цепей линейной материнской молекулы ДНК, приводит к тому, что дочерние цепи оказываются короче на 10-20 нуклеотидов (у разных видов размер РНК-затравок различен). В этом заключается так называемая "проблема недорепликации концов линейных молекул". В случае репликации кольцевых бактериальных ДНК этой проблемы не существует, так как первые по времени образованиЯ РНК-затравки удаляются ферментом, который одновременно заполняет образующуюся брешь путем наращивания 3'-ОН-конца растущей цепи ДНК, направленной в "хвост" удаляемому праймеру. Проблема недорепликации 3'-концов линейных молекул ДНК решается эукариотическими клетками с помощью специального фермента - теломеразы. Работа теломеразы В 1985 году он был обнаружен у равноресничной инфузории Tetrahymena thermophila, а впоследствии - в дрожжах, растениях и животных, в том числе в яичниках человека и иммортализованных(бессмертных) линиях раковых клеток HeLa. Теломераза является ДНК-полимеразой, достраивающей 3'-концы линейных молекул ДНК хромосом короткими (6-8 нуклеотидов) повторяющимися последовательностями (у позвоночных TTAGGG). Согласно номенклатуре, этот фермент называют ДНК- уклеотидилэкзотрансферазой или теломерной терминальной трансферазой. Помимо белковой части теломераза содержит РНК, выполняющую роль матрицы для наращивания ДНК повторами. Длина теломеразной РНК колеблется от 150 нуклеотидов у простейших до 1400 нуклеотидов у дрожжей, у человека - 450 нуклеотидов. Сам факт наличия в молекуле РНК последовательности, по которой идет матричный синтез куска ДНК, позволяет отнести теломеразу к своеобразной обратной транскриптазе, то есть ферменту, способному вести синтез ДНК по матрице РНК. В результате того что после каждой репликации дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нуклеотидов), образуются выступающие однонитевые 3'-концы материнских цепей. Они-то и узнаются теломеразой, которая последовательно наращивает материнские цепи (у человека на сотни повторов), используя 3'-ОН-концы их в качестве затравок, а РНК, входящую в состав фермента, в качестве матрицы. Образующиеся длинные одноцепочечные концы, в свою очередь, служат матрицами для синтеза дочерних цепей по традиционному репликативному механизму. Постепенное укорочение ДНК хромосом во время репликации является одной из теорий "старения" клеточных колоний. Еще в 1971 году отечественный ученый А.М. Оловников в своей теории маргинотомии (от лат. marginalis -краевой, tome - сечение) предположил, что это явление лежит в основе ограниченного потенциала удвоения, наблюдаемого у нормальных соматических клеток, растущих в культуре in vitro, так называемого "лимита Хейфлика". Американский ученый Леонард Хейфлик в начале 60-х годов показал, что если для культивирования взять клетки новорожденных детей, то они могут пройти 80-90 делений, в то время как соматические клетки от 70-летних делятся только 20- 30 раз. Ограничение на число клеточных делений и называют лимитом Хейфлика.
Расплетание двойной спирали ДНК
Поскольку синтез ДНК происходит на одноцепочечной матрице, ему должно предшествовать обязательное разделение (хотя бы на время) двух цепей ДНК. Исследования, проведенные в начале 60-х годов на реплицирующихся хромосомах, выявили особую, четко ограниченную область репликации, перемещающуюся вдоль родительской спирали ДНК и характеризующуюся местным расхождением двух ее цепей. Эта активная область из-за своей Y-образной формы была названа репликационной вилкой. Именно в ней ДНК-полимеразы синтезируют дочерние молекулы ДНК. С помощью электронной микроскопии реплицирующейся ДНК удалосьустановить, что область, которая уже реплицирована, имеет вид глазка внутри нереплицировавшейся ДНК. Важно отметить, что репликационный глазок образуется только в тех местах молекулы, где находятся специфические нуклеотидные последовательности. Эти последовательности, получившие название точек начала репликации, состоят приблизительно из 300 нуклеотидов. В зависимости от того, в одном или в двух направлениях происходит репликация (а это зависит от природы организма), глазок содержит одну или две репликационные вилки. Последовательное движение репликационной вилки приводит к расширению глазка. Двойная спираль ДНК весьма стабильна; для того чтобы она раскрылась, необходимы особые белки. Специальные ферменты ДНК-хеликазы быстро движутся по одиночной цепи ДНК, используя для перемещения энергию гидролиза ATФ. Встречая на пути участок двойной спирали, они разрывают водородные связи между основаниями, разделяют цепи и продвигают репликационную вилку. Вслед за этим с одиночными цепями ДНК связываются специальные дестабилизирующие спираль белки, которые не позволяют одиночным цепям ДНК сомкнуться. При этом они не закрывают оснований ДНК, оставляя их доступными для спаривания. Не следует забывать, что комплементарные цепи ДНК закручены друг вокруг друга в спираль. Следовательно, для того чтобы репликационная вилка могла продвигаться вперед, вся еще не удвоенная часть ДНК должна была бы очень быстро вращаться. Эта топологическая проблема решается путем образования в спирали своего рода "шарниров", позволяющих цепям ДНК раскрутиться. Принадлежащие к особому классу белки, называемые ДНК-топоизомеразами, вносят в цепь ДНК одноили двухцепочечные разрывы, позволяющие цепям ДНК разделиться, а затем заделывают эти разрывы. Топоизомеразы участвуют также в расцеплении зацепленных двухцепочечных колец, образующихся при репликации кольцевых двунитевых ДНК. С помощью этих важных ферментов двойная спираль ДНК в клетке может принимать "недокрученную" форму с меньшим числом витков; в такой ДНК легче происходит расхождение двух цепей ДНК в репликационной вилке.
Прерывистый синтез ДНК
Легко вообразить, что репликация происходит путем непрерывного роста нуклеотида за нуклеотидом обеих новых цепей по мере перемещения репликационной вилки; при этом, поскольку две цепи в спирали ДНК антипараллельны, одна из дочерних цепей должна была бы расти в направлении 5'-3', а другая в направлении 3'-5'. В действительности, однако, оказалось, что дочерние цепи растут только в направлении 5'-3', то есть всегда удлиняется 3'-конец затравки, а матрица считывается ДНК-полимеразой в направлении 3'-5'. Это утверждение на первый взгляд кажется несовместимым с движением репликационной вилки в одном направлении, сопровождающемся одновременным считыванием двух антипараллельных нитей. Разгадка секрета заключается в том, что синтез ДНК происходит непрерывно только на одной из матричной цепей. На второй матричной цепи ДНК синтезируется сравнительно короткими фрагментами (длиной от 100до 1000 нуклеотидов, в зависимости от вида), названными по имени обнаружившего их ученого фрагментами Оказаки). Вновь образованная цепь, которая синтезируется непрерывно, называется ведущей, а другая, собираемая из фрагментов Оказаки, отстающей. Синтез каждого из этих фрагментов начинается с РНК-затравки. Через некоторое время РНК-затравки удаляются, бреши застраиваются ДНК-полимеразой и фрагменты сшиваются в одну непрерывную цепь ДНК специальным ферментом.
Кооперативное действие белков репликационной вилки. До сих пор мы говорили об участии отдельных белков в репликации так, как будто бы они работают независимо друг от друга. Между тем в действительности большая часть этих белков объединена в крупный комплекс, который быстро движется вдоль ДНК и согласованно осуществляет процесс репликации с высокой точностью. Этот комплекс сравнивают с крошечной "швейной машиной" : "деталями" его служат отдельные белки, а источником энергии - реакция гидролиза нуклеозидтрифос фатов. Спираль расплетается ДНК-хеликазой; этому процессу помогают ДНК- топоизомераза, раскручивающая цепи ДНК, и множество молекул дестабилизирующего белка, связывающихся с обеими одиночными цепями ДНК. В области вилки действуют две ДНК-полимеразы - на ведущей и отстающей цепи. На ведущей цепи ДНК-полимераза работает непрерывно, а на отстающей фермент время от времени прерывает и вновь возобновляет свою работу, используя короткие РНК-затравки, синтезируемые ДНК-праймазой. Молекула ДНК-праймазы непосредственно связана с ДНК-хеликазой, образуя структуру, называемую праймосомой. Праймосома движется в направлении раскрывания репликационной вилки и по ходу движения синтезирует РНК-затравку для фрагментов Оказаки. В этом же направлении движется ДНК-полимераза ведущей цепи и, хотя на первый взгляд это трудно представить, ДНК-полимераза отстающей цепи. Для этого, как полагают, последня накладывает цепь ДНК, которая служит ей матрицей, саму на себя, что и обеспечивает разворот ДНК-полимеразы отстающей цепи на 180 градусов. Согласованное движение двух ДНК-полимераз обеспечивает координированную репликацию обеих нитей. Таким образом, в репликационной вилке одновременно работают около двадцати разных белков (из которых мы назвали только часть), осуществляя сложный, высокоупорядоченный и энергоемкий процесс.
Согласованность процессов репликации ДНК и клоеточного деления Эукариотическая клетка перед каждым делением должна синтезировать копии всех своих хромосом. Репликация ДНК эукариотической хромосомы осуществляется посредством разделени хромосомы на множество отдельных репликонов. Такие репликоны активируются не все одновременно, однако клеточному делению должна предшествовать обязательная однократная репликация каждого из них. Из сказанного ясно, что по хромосоме эукариот в каждый момент времени может двигаться независимо друг от друга множество репликационных вилок. Остановка продвижения вилки происходит только при столкновении с другой вилкой, движущейся в противоположном направлении, или по достижении конца хромосомы. В результате вся ДНК хромосо мы в короткий срок оказывается реплицированной. После сборки на молекуле ДНК хромосомных белков каждая пара хромосом в процессе митоза упорядоченно разделяется по дочерним клеткам.
Выводы Процесс репликации ДНК согласован с клеточным делением и требуетсовместного действия многих белков. В нем участвуют: 1. ДНК-хеликаза и дестабилизирующие белки; они расплетают двойную спираль родительской ДНК и формируют репликационную вилку. 2. ДНК-полимеразы, которые катализируют синтез полинуклеотидной цепи ДНК в направлении 3'-5, копируя в репликационной вилке матрицу с высокой степенью точности. Поскольку две цепи двойной спирали ДНК антипараллельны, в направлении 5'-3' непрерывно синтезируется лишь одна из двух цепей, ведущая; другая цепь, отстающа, синтезируется в виде коротких фрагментов Оказаки. ДНК-полимераза способна к исправлению собственных ошибок, но не может самостоятельно начать синтез новой цепи. 3. ДНК-праймаза, которая катализирует короткие молекулы РНК-затравки. Впоследствии фрагменты РНК удаляются - их заменяет ДНК. 4.Теломераза, заканчивающая построение недорепликацированых 3'-концов линейных молекул ДНК. 5. ДНК-топоизомеразы, помогающие решить проблемы кручения и спутывания спирали ДНК. 6. Инициаторные белки, связывающиеся в точке начала репликации и способствующие образованию нового репликационного глазка с одной или двумя вилками. В каждой из вилок вслед за инициаторными белками к расплетенной ДНК сначала присоединяется белковый комплекс, состоящий из ДНК-хеликазы и ДНК-праймазы (праймосома). Затем к праймосоме добавляются другие белки и возникает "репликационная машина", которая и осуществляет синтез ДНК.
Литература
1. О. О. Фаворова. Сохранение ДНК в ряду популяций: репликация ДНК. Соросовский образовательный журнал, 1996 г. 2. Г.М. Дымшиц. Проблема раепликации концов линейных молекул и теломераза. Соросовский образовательный журнал, 2000 г. ??
??
??
??
1
1
www.ronl.ru
Реферат ДНК
скачатьРеферат на тему:
План:
- Введение
- 1 История изучения
- 2 Структура молекулы
- 2.1 Нуклеотиды
- 2.2 Двойная спираль
- 2.3 Образование связей между основаниями
- 2.4 Химические модификации оснований
- 2.5 Повреждение ДНК
- 2.6 Суперскрученность
- 2.7 Структуры на концах хромосом
- 3 Биологические функции
- 3.1 Структура генома
- 3.2 Последовательности генома, не кодирующие белок
- 3.3 Транскрипция и трансляция
- 3.4 Репликация
- 4 Взаимодействие с белками
- 4.1 Структурные и регуляторные белки
- 4.2 Ферменты, модифицирующие ДНК
- 4.2.1 Топоизомеразы и хеликазы
- 4.2.2 Нуклеазы и лигазы
- 4.2.3 Полимеразы
- 5 Генетическая рекомбинация
- 6 Эволюция метаболизма, основанного на ДНК ПримечанияЛитература
Введение
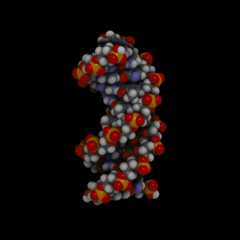
Двойная спираль ДНК

3D модель участка спирали ДНК (для просмотра анимации нажмите на изображении)
Дезоксирибонуклеи́новая кислота́ (ДНК) — один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков.
В клетках эукариотов (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы. В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали».
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции. Кроме того, в геноме эукариот часто встречаются участки, принадлежащие «генетическим паразитам», например, транспозонам.
Расшифровка структуры ДНК (1953 г.) стала одним из поворотных моментов в истории биологии. За выдающийся вклад в это открытие Фрэнсису Крику, Джеймсу Уотсону, Морису Уилкинсу была присуждена Нобелевская премия по физиологии и медицине 1962 г.
1. История изучения
Френсис Крик
Джеймс Уотсон
ДНК была открыта Иоганном Фридрихом Мишером в 1869 году. Вначале новое вещество получило название нуклеин, а позже, когда Мишер определил, что это вещество обладает кислотными свойствами, вещество получило название нуклеиновая кислота [1]. Биологическая функция новооткрытого вещества была неясна, и долгое время ДНК считалась запасником фосфора в организме. Более того, даже в начале XX века многие биологи считали, что ДНК не имеет никакого отношения к передаче информации, поскольку строение молекулы, по их мнению, было слишком однообразным и не могло содержать закодированную информацию.
Постепенно было доказано, что именно ДНК, а не белки, как считалось раньше, является носителем генетической информации. Одно из первых решающих доказательств принесли эксперименты О. Эвери, Колина Мак-Леода и Маклин Мак-Карти (1944 г.) по трансформации бактерий. Им удалось показать, что за так называемую трансформацию (приобретение болезнетворных свойств безвредной культурой в результате добавления в неё мёртвых болезнетворных бактерий) отвечают выделенные из пневмококков ДНК. Эксперимент американских учёных Алфреда Херши и Марты Чейз (эксперимент Херши—Чейз, 1952 г.) с помеченными радиоактивными изотопами белками и ДНК бактериофагов показали, что в заражённую клетку передаётся только нуклеиновая кислота фага, а новое поколение фага содержит такие же белки и нуклеиновую кислоту, как исходный фаг[2].
Вплоть до 50-х годов XX века точное строение ДНК, как и способ передачи наследственной информации, оставалось неизвестным. Хотя и было доподлинно известно, что ДНК состоит из нескольких цепочек, состоящих из нуклеотидов, никто не знал точно, сколько этих цепочек и как они соединены.
Структура двойной спирали ДНК была предложена Френсисом Криком и Джеймсом Уотсоном в 1953 году на основании рентгеноструктурных данных, полученных Морисом Уилкинсом и Розалинд Франклин, и «правил Чаргаффа», согласно которым в каждой молекуле ДНК соблюдаются строгие соотношения, связывающие между собой количество азотистых оснований разных типов[3]. Позже предложенная Уотсоном и Криком модель строения ДНК была доказана, а их работа отмечена Нобелевской премией по физиологии и медицине 1962 г. Среди лауреатов не было скончавшейся к тому времени Розалинды Франклин, так как премия не присуждается посмертно[4].
2. Структура молекулы
2.1. Нуклеотиды
| Аденин | Гуанин | Тимин | Цитозин |
Структуры оснований, наиболее часто встречающихся в составе ДНК
Дезоксирибонуклеиновая кислота (ДНК) представляет собой биополимер (полианион), мономером которого является нуклеотид[5][6].
Каждый нуклеотид состоит из остатка фосфорной кислоты присоединённого по 5'-положению к сахару дезоксирибозе, к которому также через гликозидную связь (C—N) по 1'-положению присоединено одно из четырёх азотистых оснований. Именно наличие характерного сахара и составляет одно из главных различий между ДНК и РНК, зафиксированное в названиях этих нуклеиновых кислот (в состав РНК входит сахар рибоза)[7]. Пример нуклеотида — аденозинмонофосфат — где основание, присоединённое к фосфату и рибозе, это аденин, показан на рисунке.
Исходя из структуры молекул, основания, входящие в состав нуклеотидов, разделяют на две группы: пурины (аденин [A] и гуанин [G]) образованы соединёнными пяти- и шестичленным гетероциклами; пиримидины (цитозин [C] и тимин [T]) — шестичленным гетероциклом[8].
В виде исключения, например, у бактериофага PBS1, в ДНК встречается пятый тип оснований — урацил ([U]), пиримидиновое основание, отличающееся от тимина отсутствием метильной группы на кольце, обычно заменяющее тимин в РНК[9].
Следует отметить, что тимин и урацил не так строго приурочены к ДНК и РНК соответственно, как это считалось ранее. Так, после синтеза некоторых молекул РНК значительное число урацилов в этих молекулах метилируется с помощью специальных ферментов, превращаясь в тимин. Это происходит в транспортных и рибосомальных РНК[10].
2.2. Двойная спираль
В зависимости от концентрации ионов и нуклеотидного состава молекулы, двойная спираль ДНК в живых организмах существует в разных формах. На рисунке представлены формы A, B и Z (слева направо)
Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей в структуру, получившую название двойной спирали [3][7]. Остов каждой из цепей состоит из чередующихся фосфатов и сахаров[11]. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой одной молекулы дезоксирибозы и 5'-фосфатной группой (5'—РО3) другой. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу).
Как уже было сказано выше, у подавляющего большинства живых организмов ДНК состоит не из одной, а из двух полинуклеотидных цепей. Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированной водородными связями, образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3'-конца к 5'-концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу).
Ширина двойной спирали составляет от 22 до 24 Å, или 2,2 — 2,4 нм, длина каждого нуклеотида 3,3 Å (0,33 нм)[12]. Подобно тому, как в винтовой лестнице сбоку можно увидеть ступеньки, на двойной спирали ДНК в промежутках между фосфатным остовом молекулы можно видеть рёбра оснований, кольца которых расположены в плоскости, перпендикулярной по отношению к продольной оси макромолекулы.
В двойной спирали различают малую (12 Å) и большую (22 Å) бороздки[13]. Белки, например, факторы транскрипции, которые присоединяются к определённым последовательностям в двухцепочечной ДНК, обычно взаимодействуют с краями оснований в большой бороздке, где те более доступны[14].
2.3. Образование связей между основаниями
.
Каждое основание на одной из цепей связывается с одним определённым основанием на второй цепи. Такое специфическое связывание называется комплементарным. Пурины комплементарны пиримидинам (то есть, способны к образованию водородных связей с ними): аденин образует связи только с тимином, а цитозин — с гуанином. В двойной спирали цепочки также связаны с помощью гидрофобных связей и стэкинга, которые не зависят от последовательности оснований ДНК[15].
Комплементарность двойной спирали означает, что информация, содержащаяся в одной цепи, содержится и в другой цепи. Обратимость и специфичность взаимодействий между комплементарными парами оснований важна для репликации ДНК и всех остальных функций ДНК в живых организмах.
Так как водородные связи нековалентны, они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться как замок-молния под действием ферментов (хеликазы) или при высокой температуре[16]. Разные пары оснований образуют разное количество водородных связей. АТ связаны двумя, ГЦ — тремя водородными связями, поэтому на разрыв ГЦ требуется больше энергии. Процент ГЦ пар и длина молекулы ДНК определяют количество энергии, необходимой для диссоциации цепей: длинные молекулы ДНК с большим содержанием ГЦ более тугоплавки[17].
Части молекул ДНК, которые из-за их функций должны быть легко разделяемы, например ТАТА последовательность в бактериальных промоторах, обычно содержат большое количество А и Т.

Интеркалированное химическое соединение, которое находится в середине спирали — бензопирен, основной мутаген табачного дыма[18]
2.4. Химические модификации оснований
Структура хроматина влияет на транскрипцию генов: участки гетерохроматина (отсутствие или низкий уровень транскрипции генов) коррелируют с метилированием цитозина. Например, метилирование цитозина с образованием 5-метилцитозина важно для инактивации Х-хромосомы[19]. Средний уровень метилирования отличается у разных организмов, так, у нематоды Caenorhabditis elegans метилирование цитозина не наблюдается, а у позвоночных обнаружен высокий уровень метилирования — до 1 %[20].
Несмотря на биологическую роль, 5-метилцитозин может спонтанно утрачивать аминную группу (деаминироваться), превращаясь в тимин, поэтому метилированные цитозины являются источником повышенного числа мутаций[21]. Другие модификации оснований включают метилирование аденина у бактерий и гликозилирование урацила с образованием «J-основания» в кинетопластах[22].
2.5. Повреждение ДНК
ДНК может повреждаться разнообразными мутагенами, к которым относятся окисляющие и алкилирующие вещества, а также высокоэнергетическая электромагнитная радиация — ультрафиолетовое и рентгеновское излучение. Тип повреждения ДНК зависит от типа мутагена. Например, ультрафиолет повреждает ДНК путём образования в ней димеров тимина, которые возникают при образовании ковалентных связей между соседними основаниями[23].
Оксиданты, такие как свободные радикалы или перекись водорода, приводят к нескольким типам повреждения ДНК, включая модификации оснований, в особенности гуанозина, а также двуцепочечные разрывы в ДНК[24]. По некоторым оценкам, в каждой клетке человека окисляющими соединениями ежедневно повреждается порядка 500 оснований[25][26]. Среди разных типов повреждений наиболее опасные — это двуцепочечные разрывы, потому что они трудно репарируются и могут привести к потерям участков хромосом (делециям) и транслокациям.
Многие молекулы мутагенов вставляются (интеркалируют) между двумя соседними парами оснований. Большинство этих соединений, например, этидий, дауномицин, доксорубицин и талидомид имеют ароматическую структуру. Для того чтобы интеркалирующее соединение могло поместиться между основаниями, они должны разойтись, расплетая и нарушая структуру двойной спирали. Эти изменения в структуре ДНК мешают транскрипции и репликации, вызывая мутации. Поэтому интеркалирующие соединения часто являются канцерогенами, наиболее известные из которых — бензопирен, акридины, афлатоксин и бромистый этидий[27][28][29]. Несмотря на эти негативные свойства, в силу их способности подавлять транскрипцию и репликацию ДНК, интеркалирующие соединения используются в химиотерапии для подавления быстро растущих клеток рака[30].
2.6. Суперскрученность
Если взяться за концы верёвки и начать скручивать их в разные стороны, она становится короче и на верёвке образуются «супервитки». Так же может быть суперскручена и ДНК. В обычном состоянии цепочка ДНК делает один оборот на каждые 10,4 основания, но в суперскрученном состоянии спираль может быть свёрнута туже или расплетена[31]. Выделяют два типа суперскручивания: положительное — в направлении нормальных витков, при котором основания расположены ближе друг к другу; и отрицательное — в противоположном направлении. В природе молекулы ДНК обычно находятся в отрицательном суперскручивании, которое вносится ферментами — топоизомеразами[32]. Эти ферменты удаляют дополнительное скручивание, возникающее в ДНК в результате транскрипции и репликации[33].
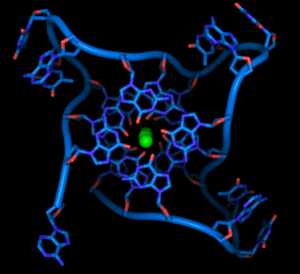
Структура теломер. Зелёным цветом показан ион металла, хелатированный в центре структуры[34]
2.7. Структуры на концах хромосом
На концах линейных хромосом находятся специализированные структуры ДНК, называемые теломерами. Основная функция этих участков — поддержание целостности концов хромосом[35]. Теломеры также защищают концы ДНК от деградации экзонуклеазами и предотвращают активацию системы репарации[36]. Поскольку обычные ДНК-полимеразы не могут реплицировать 3' концы хромосом, это делает специальный фермент — теломераза.
В клетках человека теломеры обычно представлены одноцепочечной ДНК и состоят из несколько тысяч повторяющихся единиц последовательности ТТАГГГ[37]. Эти последовательности с высоким содержанием гуанина стабилизируют концы хромосом, формируя очень необычные структуры, называемые G-квадруплексами и состоящие из четырёх, а не двух взаимодействующих оснований. Четыре гуаниновых основания, все атомы которых находятся в одной плоскости, образуют пластинку, стабилизированную водородными связями между основаниями и хелатированием в центре неё иона металла (чаще всего калия). Эти пластинки располагаются стопкой друг над другом[38].
На концах хромосом могут образовываться и другие структуры: основания могут быть расположены в одной цепочке или в разных параллельных цепочках. Кроме этих «стопочных» структур теломеры формируют большие петлеобразные структуры, называемые Т-петли или теломерные петли. В них одноцепочечная ДНК располагается в виде широкого кольца, стабилизированного теломерными белками[39]. В конце Т-петли одноцепочечная теломерная ДНК присоединяется к двухцепочечной ДНК, нарушая спаривание цепочек в этой молекуле и образуя связи с одной из цепей. Это трёхцепочечное образование называется Д-петля (от англ. displacement loop)[38].
3. Биологические функции
ДНК является носителем генетической информации, записанной в виде последовательности нуклеотидов с помощью генетического кода. С молекулами ДНК связаны два основополагающих свойства живых организмов — наследственность и изменчивость. В ходе процесса, называемого репликацией ДНК, образуются две копии исходной цепочки, наследуемые дочерними клетками при делении, таким образом образовавшиеся клетки оказываются генетически идентичны исходной.
Генетическая информация реализуется при экспрессии генов в процессах транскрипции (синтеза молекул РНК на матрице ДНК) и трансляции (синтеза белков на матрице РНК).
Последовательность нуклеотидов «кодирует» информацию о различных типах РНК: информационных, или матричных (мРНК), рибосомальных (рРНК) и транспортных (тРНК). Все эти типы РНК синтезируются на основе ДНК в процессе транскрипции. Роль их в биосинтезе белков (процессе трансляции) различна. Информационная РНК содержит информацию о последовательности аминокислот в белке, рибосомальные РНК служат основой для рибосом (сложных нуклеопротеиновых комплексов, основная функция которых — сборка белка из отдельных аминокислот на основе иРНК), транспортные РНК доставляют аминокислоты к месту сборки белков — в активный центр рибосомы, «ползущей» по иРНК.
3.1. Структура генома
ДНК генома бактериофага: фотография под трансмиссионным электронным микроскопом
Большинство природных ДНК имеет двухцепочечную структуру, линейную (эукариоты, некоторые вирусы и отдельные роды бактерий) или кольцевую (прокариоты, хлоропласты и митохондрии). Линейную одноцепочечную ДНК содержат некоторые вирусы и бактериофаги. Молекулы ДНК находятся in vivo в плотно упакованном, конденсированном состоянии.[40] В клетках эукариот ДНК располагается главным образом в ядре в виде набора хромосом. Бактериальная (прокариоты) ДНК обычно представлена одной кольцевой молекулой ДНК, расположенной в неправильной формы образовании в цитоплазме, называемым нуклеоидом [41]. Генетическая информация генома состоит из генов. Ген — единица передачи наследственной информации и участок ДНК, который влияет на определённую характеристику организма. Ген содержит открытую рамку считывания, которая транскрибируется, а также регуляторные последовательности, например, промотор и энхансер, которые контролируют экспрессию открытых рамок считывания.
У многих видов только малая часть общей последовательности генома кодирует белки. Так, только около 1,5 % генома человека состоит из кодирующих белок экзонов, а больше 50 % ДНК человека состоит из некодирующих повторяющихся последовательностей ДНК[42]. Причины наличия такого большого количества некодирующей ДНК в эукариотических геномах и огромная разница в размерах геномов (С-значение) — одна из неразрешённых научных загадок[43]; исследования в этой области также указывают на большое количество фрагментов реликтовых вирусов в этой части ДНК.
3.2. Последовательности генома, не кодирующие белок
В настоящее время накапливается всё больше данных, противоречащих идее о некодирующих последовательностях как «мусорной ДНК» (англ. junk DNA). Теломеры и центромеры содержат малое число генов, но они важны для функционирования и стабильности хромосом[36][44]. Часто встречающаяся форма некодирующих последовательностей человека — псевдогены, копии генов, инактивированные в результате мутаций[45]. Эти последовательности нечто вроде молекулярных ископаемых, хотя иногда они могут служить исходным материалом для дупликации и последующей дивергенции генов[46]. Другой источник разнообразия белков в организме — это использование интронов в качестве «линий разреза и склеивания» в альтернативном сплайсинге[47]. Наконец, некодирующие белок последовательности могут кодировать вспомогательные клеточные РНК, например, мяРНК[48]. Недавнее исследование транскрипции генома человека показало, что 10 % генома даёт начало полиаденилированным РНК [49], а исследование и генома мыши показало, что 62 % его транскрибируется[50].
3.3. Транскрипция и трансляция
Генетическая информация, закодированная в ДНК, должна быть прочитана и в конечном итоге выражена в синтезе различных биополимеров, из которых состоят клетки. Последовательность оснований в цепочке ДНК напрямую определяет последовательность оснований в РНК, на которую она «переписывается» в процессе, называемом транскрипцией. В случае мРНК эта последовательность определяет аминокислоты белка. Соотношение между нуклеотидной последовательностью мРНК и аминокислотной последовательностью определяется правилами трансляции, которые называются генетическим кодом. Генетический код состоит из трёхбуквенных «слов», называемых кодонами, состоящих из трёх нуклеотидов (то есть ACT CAG TTT и т. п.). Во время транскрипции нуклеотиды гена копируются на синтезируемую РНК РНК-полимеразой. Эта копия в случае мРНК декодируется рибосомой, которая «читает» последовательность мРНК, осуществляя спаривание матричной РНК с транспортными РНК, которые присоединены к аминокислотам. Поскольку в трёхбуквенных комбинациях используются 4 основания, всего возможны 64 кодона (4³ комбинации). Кодоны кодируют 20 стандартных аминокислот, каждой из которых соответствует в большинстве случаев более одного кодона. Один из трёх кодонов, которые располагаются в конце мРНК, не означает аминокислоту и определяет конец белка, это «стоп» или «нонсенс» кодоны — TAA, TGA, TAG.
3.4. Репликация
Деление клеток необходимо для размножения одноклеточного и роста многоклеточного организма, но до деления клетка должна удвоить геном, чтобы дочерние клетки содержали ту же генетическую информацию, что и исходная клетка. Из нескольких теоретически возможных механизмов удвоения (репликации) ДНК реализуется полуконсервативный. Две цепочки разделяются, а затем каждая недостающая комплементарная последовательность ДНК воспроизводится ферментом ДНК-полимеразой. Этот фермент строит полинуклеотидную цепь, находя правильное основание через комплементарное спаривание оснований и присоединяя его к растущей цепочке. ДНК-полимераза не может начинать новую цепь, а только лишь наращивать уже существующую, поэтому она нуждается в короткой цепочке нуклеотидов (праймере), синтезируемой праймазой. Так как ДНК-полимеразы могут строить цепочку только в направлении 5' --> 3', для копирования антипараллельных цепей используются разные механизмы[51].
4. Взаимодействие с белками
Взаимодействие фактора транскрипции STAT3 с ДНК (показана в виде синей спирали)
Все функции ДНК зависят от её взаимодействия с белками. Взаимодействия могут быть неспецифическими, когда белок присоединяется к любой молекуле ДНК, или зависеть от наличия особой последовательности. Ферменты также могут взаимодействовать с ДНК, из них наиболее важные — это РНК-полимеразы, которые копируют последовательность оснований ДНК на РНК в транскрипции или при синтезе новой цепи ДНК — репликации.
4.1. Структурные и регуляторные белки
Хорошо изученными примерами взаимодействия белков и ДНК, не зависящего от нуклеотидной последовательности ДНК, является взаимодействие со структурными белками. В клетке ДНК связана с этими белками, образуя компактную структуру, которая называется хроматин. У прокариот хроматин образован при присоединении к ДНК небольших щелочных белков — гистонов, менее упорядоченный хроматин прокариот содержит гистон-подобные белки[52][53]. Гистоны формируют дискообразную белковую структуру — нуклеосому, вокруг каждой из которых вмещается два оборота спирали ДНК. Неспецифические связи между гистонами и ДНК образуются за счёт ионных связей щелочных аминокислот гистонов и кислотных остатков сахарофосфатного остова ДНК[54]. Химические модификации этих аминокислот включают метилирование, фосфорилирование и ацетилирование[55]. Эти химические модификации изменяют силу взаимодействия между ДНК и гистонами, влияя на доступность специфических последовательностей для факторов транскрипции и изменяя скорость транскрипции[56]. Другие белки в составе хроматина, которые присоединяются к неспецифическим последовательностям — белки с высокой подвижностью в гелях, которые ассоциируют большей частью с согнутой ДНК[57]. Эти белки важны для образования в хроматине структур более высокого порядка[58]. Особая группа белков, присоединяющихся к ДНК, — это белки, которые ассоциируют с одноцепочечной ДНК. Наиболее хорошо охарактеризованный белок этой группы у человека — репликационный белок А, без которого невозможно протекание большинства процессов, где расплетается двойная спираль, включая репликацию, рекомбинацию и репарацию. Белки этой группы стабилизируют одноцепочечную ДНК и предотвращают формирование стеблей-петель или деградации нуклеазами[59].
В то же время другие белки узнают и присоединяются к специфическим последовательностям. Наиболее изученная группа таких белков — различные классы факторов транскрипции, то есть белки, регулирующие транскрипцию. Каждый из этих белков узнаёт свою последовательность, часто в промоторе, и активирует или подавляет транскрипцию гена. Это происходит при ассоциации факторов транскрипции с РНК-полимеразой либо напрямую, либо через белки-посредники. Полимераза ассоциирует сначала с белками, а потом начинает транскрипцию[60]. В других случаях факторы транскрипции могут присоединяться к ферментам, которые модифицируют находящиеся на промоторах гистоны, что изменяет доступность ДНК для полимераз[61].
Так как специфические последовательности встречаются во многих местах генома, изменения в активности одного типа фактора транскрипции могут изменить активность тысяч генов[62]. Соответственно, эти белки часто регулируются в процессах ответа на изменения в окружающей среде, развития организма и дифференцировки клеток. Специфичность взаимодействия факторов транскрипции с ДНК обеспечивается многочисленными контактами между аминокислотами и основаниями ДНК, что позволяет им «читать» последовательность ДНК. Большинство контактов с основаниями происходит в главной бороздке, где основания более доступны[14].
4.2. Ферменты, модифицирующие ДНК
4.2.1. Топоизомеразы и хеликазы
В клетке ДНК находится в компактном, т. н. суперскрученном состоянии, иначе она не смогла бы в ней уместиться. Для протекания жизненно важных процессов ДНК должна быть раскручена, что производится двумя группами белков — топоизомеразами и хеликазами.
Топоизомеразы — ферменты, которые имеют и нуклеазную и лигазную активности. Эти белки изменяют степень суперскрученности в ДНК. Некоторые из этих ферментов разрезают спираль ДНК и позволяют вращаться одной из цепей, тем самым уменьшая уровень суперскрученности, после чего фермент заделывает разрыв[32]. Другие ферменты могут разрезать одну из цепей и проводить вторую цепь через разрыв, а потом лигировать разрыв в первой цепи[63]. Топоизомеразы необходимы во многих процессах, связанных с ДНК, таких как репликация и транскрипция[33].
Хеликазы — белки, которые являются одним из молекулярных моторов. Они используют химическую энергию нуклеотидтрифосфатов, чаще всего АТФ, для разрыва водородных связей между основаниями, раскручивая двойную спираль на отдельные цепочки[64]. Эти ферменты важны для большинства процессов, где белкам необходим доступ к основаниям ДНК.
4.2.2. Нуклеазы и лигазы
В различных процессах, происходящих в клетке, например, рекомбинации и репарации, участвуют ферменты, способные разрезать и восстанавливать целостность нитей ДНК. Ферменты, разрезающие ДНК, носят название нуклеаз. Нуклеазы, которые гидролизуют нуклеотиды на концах молекулы ДНК, называются экзонуклеазами, а эндонуклеазы разрезают ДНК внутри цепи. Наиболее часто используемые в молекулярной биологии и генетической инженерии нуклеазы — это рестриктазы, которые разрезают ДНК около специфических последовательностей. Например, фермент EcoRV (рестрикционный фермент № 5 из E. coli) узнаёт шестинуклеотидную последовательность 5'-GAT|ATC-3' и разрезает ДНК в месте, указанном вертикальной линией. В природе эти ферменты защищают бактерии от заражения бактериофагами, разрезая ДНК фага, когда она вводится в бактериальную клетку. В этом случае нуклеазы — часть системы модификации-рестрикции[65]. ДНК-лигазы сшивают сахарофосфатные основания в молекуле ДНК, используя энергию АТФ. Рестрикционные нуклеазы и лигазы используются в клонировании и фингерпринтинге.

ДНК-полимераза I (кольцеобразная структура, состоящая из нескольких одинаковых молекул белка, показанных разными цветами), лигирующая повреждённую цепь ДНК
4.2.3. Полимеразы
Существует также важная для метаболизма ДНК группа ферментов, которые синтезируют цепи полинуклеотидов из нуклеозидтрифосфатов — ДНК-полимеразы. Они добавляют нуклеотиды к 3'-гидроксильной группе предыдущего нуклеотида в цепи ДНК, поэтому все полимеразы работают в направлении 5'--> 3' [66]. В активном центре этих ферментов субстрат — нуклеозидтрифосфат — спаривается с комплементарным основанием в составе одноцепочечной полинуклеотидной цепочки — матрицы.
В процессе репликации ДНК ДНК-зависимая ДНК-полимераза синтезирует копию исходной последовательности ДНК. Точность очень важна в этом процессе, так как ошибки в полимеризации приведут к мутациям, поэтому многие полимеразы обладают способностью к «редактированию» — исправлению ошибок. Полимераза узнаёт ошибки в синтезе по отсутствию спаривания между неправильными нуклеотидами. После определения отсутствия спаривания активируется 3'--> 5' экзонуклеазная активность полимеразы, и неправильное основание удаляется[67]. В большинстве организмов ДНК-полимеразы работают в виде большого комплекса, называемого реплисомой, которая содержит многочисленные дополнительные субъединицы, например, хеликазы[68].
РНК-зависимые ДНК-полимеразы — специализированный тип полимераз, которые копируют последовательность РНК на ДНК. К этому типу относится вирусный фермент обратная транскриптаза, который используется ретровирусами при инфекции клеток, а также теломераза, необходимая для репликации теломер[69]. Теломераза — необычный фермент, потому что она содержит собственную матричную РНК[36].
Транскрипция осуществляется ДНК-зависимой РНК-полимеразой, которая копирует последовательность ДНК одной цепочки на мРНК. В начале транскрипции гена РНК-полимераза присоединяется к последовательности в начале гена, называемой промотором, и расплетает спираль ДНК. Потом она копирует последовательность гена на матричную РНК до тех пор, пока не дойдёт до участка ДНК в конце гена — терминатора, где она останавливается и отсоединяется от ДНК. Также как ДНК-зависимая ДНК-полимераза человека, РНК-полимераза II, которая транскрибирует большую часть генов в геноме человека, работает в составе большого белкового комплекса, содержащего регуляторные и дополнительные единицы [70].
5. Генетическая рекомбинация
Рекомбинация происходит в результате физического разрыва в хромосомах (М) и (F) и их последующего соединения с образованием двух новых хромосом (C1 and C2)
Двойная спираль ДНК обычно не взаимодействует с другими сегментами ДНК, и в человеческих клетках разные хромосомы пространственно разделены в ядре[71]. Это расстояние между разными хромосомами важно для способности ДНК действовать в качестве стабильного носителя информации. В процессе рекомбинации с помощью ферментов две спирали ДНК разрываются, обмениваются участками, после чего непрерывность спиралей восстанавливается, поэтому обмен участками негомологичных хромосом может привести к повреждению целостности генетического материала.
Рекомбинация позволяет хромосомам обмениваться генетической информацией, в результате этого образуются новые комбинации генов, что увеличивает эффективность естественного отбора и важно для быстрой эволюции новых белков[72]. Генетическая рекомбинация также играет роль в репарации, особенно в ответе клетки на разрыв обеих цепей ДНК.[73]
Самая распространённая форма кроссинговера — это гомологичная рекомбинация, когда принимающие участие в рекомбинации хромосомы имеют очень похожие последовательности. Иногда в качестве участков гомологии выступают транспозоны. Негомологичная рекомбинация может привести к повреждению клетки, поскольку в результате такой рекомбинации возникают транслокации. Реакция рекомбинации катализируется ферментами, которые называются рекомбиназы, например, Cre. На первом этапе реакции рекомбиназа делает разрыв в одной из цепей ДНК, позволяя этой цепи отделиться от комплементарной цепи и присоединиться к одной из цепей второй хроматиды. Второй разрыв в цепи второй хроматиды позволяет ей также отделиться и присоединиться к оставшейся без пары цепи из первой хроматиды, формируя структуру Холлидея. Структура Холлидея может передвигаться вдоль соединённой пары хромосом, меняя цепи местами. Реакция рекомбинации завершается, когда фермент разрезает соединение, а две цепи лигируются.[74]
6. Эволюция метаболизма, основанного на ДНК
ДНК содержит генетическую информацию, которая делает возможной жизнедеятельность, рост, развитие и размножение всех современных организмов. Однако как долго в течение четырёх миллиардов лет истории жизни на Земле ДНК была главным носителем генетической информации, неизвестно. Существуют гипотезы, что РНК играла центральную роль в обмене веществ, поскольку она может и переносить генетическую информацию, и осуществлять катализ с помощью рибозимов[75][76][77]. Кроме того, РНК — один из основных компонентов «фабрик белка» — рибосом. Древний РНК-мир, где нуклеиновая кислота была использована и для катализа, и для переноса информации, мог послужить источником современного генетического кода, состоящего из четырёх оснований. Это могло произойти в результате того, что число оснований в организме было компромиссом между небольшим числом оснований, увеличивавшим точность репликации, и большим числом оснований, увеличивающим каталитическую активность рибозимов [78].
К сожалению, древние генетические системы не дошли до наших дней. ДНК в окружающей среде в среднем сохраняется в течение 1 миллиона лет, а потом деградирует до коротких фрагментов. Извлечение ДНК и определение последовательности их 16S рРНК генов из заключённых в кристаллах соли, образовавшихся 250 млн лет назад, бактериальных спор[79] служит темой оживлённой дискуссии в научной среде[80][81].
Примечания
- Dahm R (2005). «Friedrich Miescher and the discovery of DNA». Dev Biol 278 (2): 274–88. PMID 15680349 - www.ncbi.nlm.nih.gov/pubmed/15680349?dopt=Abstract.
- Hershey A, Chase M (1952). «Independent functions of viral protein and nucleic acid in growth of bacteriophage - www.jgp.org/cgi/reprint/36/1/39.pdf». J Gen Physiol 36 (1): 39–56. PMID 12981234 - www.ncbi.nlm.nih.gov/pubmed/12981234?dopt=Abstract.
- ↑ 12Watson J, Crick F (1953). «Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid - profiles.nlm.nih.gov/SC/B/B/Y/W/_/scbbyw.pdf». Nature 171 (4356): 737 – 8. PMID 13054692 - www.ncbi.nlm.nih.gov/pubmed/13054692?dopt=Abstract.
- The Nobel Prize in Physiology or Medicine 1962 - nobelprize.org/nobel_prizes/medicine/laureates/1962/ Nobelprize .org Accessed 22 Dec 06
- Alberts Bruce Molecular Biology of the Cell; Fourth Edition - www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=mboc4.TOC&depth=2. — New York and London: Garland Science. — ISBN ISBN 0-8153-3218-1
- Butler, John M. (2001) Forensic DNA Typing «Elsevier». pp. 14 — 15. ISBN 978-0-12-147951-0
- ↑ 12 Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents - www.chem.qmul.ac.uk/iupac/misc/naabb.html IUPAC-IUB Commission on Biochemical Nomenclature (CBN) Accessed 03 Jan 2006
- Takahashi I, Marmur J. (1963). «Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis». Nature 197: 794 – 5. PMID 13980287 - www.ncbi.nlm.nih.gov/pubmed/13980287?dopt=Abstract.
- Agris P (2004). «Decoding the genome: a modified view - www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=14715921». Nucleic Acids Res 32 (1): 223 – 38. PMID 14715921 - www.ncbi.nlm.nih.gov/pubmed/14715921?dopt=Abstract.
- Ghosh A, Bansal M (2003). «A glossary of DNA structures from A to Z». Acta Crystallogr D Biol Crystallogr 59 (Pt 4): 620 – 6. PMID 12657780 - www.ncbi.nlm.nih.gov/pubmed/12657780?dopt=Abstract.
- Mandelkern M, Elias J, Eden D, Crothers D (1981). «The dimensions of DNA in solution». J Mol Biol 152 (1): 153 – 61. PMID 7338906 - www.ncbi.nlm.nih.gov/pubmed/7338906?dopt=Abstract.
- Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson R (1980). «Crystal structure analysis of a complete turn of B-DNA». Nature 287 (5784): 755 – 8. PMID 7432492 - www.ncbi.nlm.nih.gov/pubmed/7432492?dopt=Abstract.
- ↑ 12Pabo C, Sauer R. «Protein-DNA recognition». Annu Rev Biochem 53: 293 – 321. PMID 6236744 - www.ncbi.nlm.nih.gov/pubmed/6236744?dopt=Abstract.
- Ponnuswamy P, Gromiha M (1994). «On the conformational stability of oligonucleotide duplexes and tRNA molecules». J Theor Biol 169 (4): 419–32. PMID 7526075 - www.ncbi.nlm.nih.gov/pubmed/7526075?dopt=Abstract.
- Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub H (2000). «Mechanical stability of single DNA molecules - www.pubmedcentral.nih.gov/picrender.fcgi?artid=1300792&blobtype=pdf». Biophys J 78 (4): 1997–2007. PMID 10733978 - www.ncbi.nlm.nih.gov/pubmed/10733978?dopt=Abstract.
- Chalikian T, Völker J, Plum G, Breslauer K (1999). «A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques - www.pubmedcentral.nih.gov/picrender.fcgi?artid=22151&blobtype=pdf». Proc Natl Acad Sci U S A 96 (14): 7853–8. PMID 10393911 - www.ncbi.nlm.nih.gov/pubmed/10393911?dopt=Abstract.
- Created from PDB 1JDG - rcsb.org/pdb/cgi/explore.cgi?pdbId=1JDG
- Klose R, Bird A (2006). «Genomic DNA methylation: the mark and its mediators». Trends Biochem Sci 31 (2): 89 – 97. PMID 16403636 - www.ncbi.nlm.nih.gov/pubmed/16403636?dopt=Abstract.
- Bird A (2002). «DNA methylation patterns and epigenetic memory». Genes Dev 16 (1): 6 – 21. PMID 11782440 - www.ncbi.nlm.nih.gov/pubmed/11782440?dopt=Abstract.
- Walsh C, Xu G. «Cytosine methylation and DNA repair». Curr Top Microbiol Immunol 301: 283 – 315. PMID 16570853 - www.ncbi.nlm.nih.gov/pubmed/16570853?dopt=Abstract.
- Gommers-Ampt J, Van Leeuwen F, de Beer A, Vliegenthart J, Dizdaroglu M, Kowalak J, Crain P, Borst P (1993). «beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei». Cell 75 (6): 1129 – 36. PMID 8261512 - www.ncbi.nlm.nih.gov/pubmed/8261512?dopt=Abstract.
- Douki T, Reynaud-Angelin A, Cadet J, Sage E (2003). «Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation». Biochemistry 42 (30): 9221 – 6. PMID 12885257 - www.ncbi.nlm.nih.gov/pubmed/12885257?dopt=Abstract.
- Cadet J, Delatour T, Douki T, Gasparutto D, Pouget J, Ravanat J, Sauvaigo S (1999). «Hydroxyl radicals and DNA base damage». Mutat Res 424 (1 – 2): 9 – 21. PMID 10064846 - www.ncbi.nlm.nih.gov/pubmed/10064846?dopt=Abstract.
- Shigenaga M, Gimeno C, Ames B (1989). «Urinary 8-hydroxy-2′-deoxyguanosine as a biological marker of in vivo oxidative DNA damage - www.pnas.org/cgi/reprint/86/24/9697». Proc Natl Acad Sci U S A 86 (24): 9697 – 701. PMID 2602371 - www.ncbi.nlm.nih.gov/pubmed/2602371?dopt=Abstract.
- Cathcart R, Schwiers E, Saul R, Ames B (1984). «Thymine glycol and thymidine glycol in human and rat urine: a possible assay for oxidative DNA damage - www.pnas.org/cgi/reprint/81/18/5633.pdf». Proc Natl Acad Sci U S A 81 (18): 5633 – 7. PMID 6592579 - www.ncbi.nlm.nih.gov/pubmed/6592579?dopt=Abstract.
- Ferguson L, Denny W (1991). «The genetic toxicology of acridines». Mutat Res 258 (2): 123 – 60. PMID 1881402 - www.ncbi.nlm.nih.gov/pubmed/1881402?dopt=Abstract.
- Jeffrey A (1985). «DNA modification by chemical carcinogens». Pharmacol Ther 28 (2): 237 – 72. PMID 3936066 - www.ncbi.nlm.nih.gov/pubmed/3936066?dopt=Abstract.
- Stephens T, Bunde C, Fillmore B (2000). «Mechanism of action in thalidomide teratogenesis». Biochem Pharmacol 59 (12): 1489 – 99. PMID 10799645 - www.ncbi.nlm.nih.gov/pubmed/10799645?dopt=Abstract.
- Braña M, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (2001). «Intercalators as anticancer drugs». Curr Pharm Des 7 (17): 1745 – 80. PMID 11562309 - www.ncbi.nlm.nih.gov/pubmed/11562309?dopt=Abstract.
- Benham C, Mielke S (2005). «DNA mechanics». Annu Rev Biomed Eng 7: 21–53. PMID 16004565 - www.ncbi.nlm.nih.gov/pubmed/16004565?dopt=Abstract.
- ↑ 12Champoux J (2001). «DNA topoisomerases: structure, function, and mechanism». Annu Rev Biochem 70: 369–413. PMID 11395412 - www.ncbi.nlm.nih.gov/pubmed/11395412?dopt=Abstract.
- ↑ 12Wang J (2002). «Cellular roles of DNA topoisomerases: a molecular perspective». Nat Rev Mol Cell Biol 3 (6): 430–40. PMID 12042765 - www.ncbi.nlm.nih.gov/pubmed/12042765?dopt=Abstract.
- Created from NDB UD0017 - ndbserver.rutgers.edu/atlas/xray/structures/U/ud0017/ud0017.html
- Greider C, Blackburn E (1985). «Identification of a specific telomere terminal transferase activity in Tetrahymena extracts». Cell 43 (2 Pt 1): 405–13. PMID 3907856 - www.ncbi.nlm.nih.gov/pubmed/3907856?dopt=Abstract.
- ↑ 123Nugent C, Lundblad V (1998). «The telomerase reverse transcriptase: components and regulation - www.genesdev.org/cgi/content/full/12/8/1073». Genes Dev 12 (8): 1073–85. PMID 9553037 - www.ncbi.nlm.nih.gov/pubmed/9553037?dopt=Abstract.
- Wright W, Tesmer V, Huffman K, Levene S, Shay J (1997). «Normal human chromosomes have long G-rich telomeric overhangs at one end - www.genesdev.org/cgi/content/full/11/21/2801». Genes Dev 11 (21): 2801–9. PMID 9353250 - www.ncbi.nlm.nih.gov/pubmed/9353250?dopt=Abstract.
- ↑ 12Burge S, Parkinson G, Hazel P, Todd A, Neidle S (2006). «Quadruplex DNA: sequence, topology and structure - www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=17012276». Nucleic Acids Res 34 (19): 5402–15. PMID 17012276 - www.ncbi.nlm.nih.gov/pubmed/17012276?dopt=Abstract.
- Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T (1999). «Mammalian telomeres end in a large duplex loop». Cell 97 (4): 503–14. PMID 10338214 - www.ncbi.nlm.nih.gov/pubmed/10338214?dopt=Abstract.
- Teif V.B. and Bohinc K. (2010). «Condensed DNA: condensing the concepts». Progress in Biophysics and Molecular Biology. DOI:10.1016/j.pbiomolbio.2010.07.002 - dx.doi.org/10.1016/j.pbiomolbio.2010.07.002.
- Thanbichler M, Wang S, Shapiro L (2005). «The bacterial nucleoid: a highly organized and dynamic structure». J Cell Biochem 96 (3): 506 – 21. PMID 15988757 - www.ncbi.nlm.nih.gov/pubmed/15988757?dopt=Abstract.
- Wolfsberg T, McEntyre J, Schuler G (2001). «Guide to the draft human genome». Nature 409 (6822): 824 – 6. PMID 11236998 - www.ncbi.nlm.nih.gov/pubmed/11236998?dopt=Abstract.
- Gregory T (2005). «The C-value enigma in plants and animals: a review of parallels and an appeal for partnership - aob.oxfordjournals.org/cgi/content/full/95/1/133». Ann Bot (Lond) 95 (1): 133 – 46. PMID 15596463 - www.ncbi.nlm.nih.gov/pubmed/15596463?dopt=Abstract.
- Pidoux A, Allshire R (2005). «The role of heterochromatin in centromere function - journals.royalsociety.org/content/px7ahm740dq5ueuk/fulltext.pdf». Philos Trans R Soc Lond B Biol Sci 360 (1455): 569 – 79. PMID 15905142 - www.ncbi.nlm.nih.gov/pubmed/15905142?dopt=Abstract.
- Harrison P, Hegyi H, Balasubramanian S, Luscombe N, Bertone P, Echols N, Johnson T, Gerstein M (2002). «Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22 - www.genome.org/cgi/content/full/12/2/272». Genome Res 12 (2): 272 – 80. PMID 11827946 - www.ncbi.nlm.nih.gov/pubmed/11827946?dopt=Abstract.
- Harrison P, Gerstein M (2002). «Studying genomes through the aeons: protein families, pseudogenes and proteome evolution». J Mol Biol 318 (5): 1155 – 74. PMID 12083509 - www.ncbi.nlm.nih.gov/pubmed/12083509?dopt=Abstract.
- Soller M (2006). «Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22 - springerlink.com/content/y12529875j170122». Cell Mol Life Sci 63 (7-9): 796 – 819. PMID 16465448 - www.ncbi.nlm.nih.gov/pubmed/16465448?dopt=Abstract.
- Michalak P. (2006). «RNA world - the dark matter of evolutionary genomics - www.blackwell-synergy.com/doi/abs/10.1111/j.1420-9101.2006.01141.x» 19 (6): 1768 – 74. PMID 17040373 - www.ncbi.nlm.nih.gov/pubmed/17040373?dopt=Abstract.
- Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S et al. (2005). «RNA world - the dark matter of evolutionary genomics - sciencemag.org/cgi/content/full/308/5725/1149» 308: 1149 – 54. PMID 15790807 - www.ncbi.nlm.nih.gov/pubmed/15790807?dopt=Abstract.
- Mattick JS (2004). «RNA regulation: a new genetics? - www.nature.com//nrg/journal/v5/n4/abs/nrg1321_fs.html;jsessionid=38CA337C2CE6EC04821E4D35AD67995C». Nat Rev Genet 5: 316–323. PMID 15131654 - www.ncbi.nlm.nih.gov/pubmed/15131654?dopt=Abstract.
- Albà M (2001). «Replicative DNA polymerases - www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=11178285». Genome Biol 2 (1): REVIEWS3002. PMID 11178285 - www.ncbi.nlm.nih.gov/pubmed/11178285?dopt=Abstract.
- Sandman K, Pereira S, Reeve J (1998). «Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome». Cell Mol Life Sci 54 (12): 1350 – 64. PMID 9893710 - www.ncbi.nlm.nih.gov/pubmed/9893710?dopt=Abstract.
- Dame RT (2005). «The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin». Mol. Microbiol. 56 (4): 858–70. PMID 15853876 - www.ncbi.nlm.nih.gov/pubmed/15853876?dopt=Abstract.
- Luger K, Mäder A, Richmond R, Sargent D, Richmond T (1997). «Crystal structure of the nucleosome core particle at 2.8 A resolution». Nature 389 (6648): 251 – 60. PMID 9305837 - www.ncbi.nlm.nih.gov/pubmed/9305837?dopt=Abstract.
- Jenuwein T, Allis C (2001). «Translating the histone code». Science 293 (5532): 1074 – 80. PMID 11498575 - www.ncbi.nlm.nih.gov/pubmed/11498575?dopt=Abstract.
- Ito T. «Nucleosome assembly and remodelling». Curr Top Microbiol Immunol 274: 1 – 22. PMID 12596902 - www.ncbi.nlm.nih.gov/pubmed/12596902?dopt=Abstract.
- Thomas J (2001). «HMG1 and 2: architectural DNA-binding proteins». Biochem Soc Trans 29 (Pt 4): 395 – 401. PMID 11497996 - www.ncbi.nlm.nih.gov/pubmed/11497996?dopt=Abstract.
- Grosschedl R, Giese K, Pagel J (1994). «HMG domain proteins: architectural elements in the assembly of nucleoprotein structures». Trends Genet 10 (3): 94–100. PMID 8178371 - www.ncbi.nlm.nih.gov/pubmed/8178371?dopt=Abstract.
- Iftode C, Daniely Y, Borowiec J (1999). «Replication protein A (RPA): the eukaryotic SSB». Crit Rev Biochem Mol Biol 34 (3): 141 – 80. PMID 10473346 - www.ncbi.nlm.nih.gov/pubmed/10473346?dopt=Abstract.
- Myers L, Kornberg R. «Mediator of transcriptional regulation». Annu Rev Biochem 69: 729 – 49. PMID 10966474 - www.ncbi.nlm.nih.gov/pubmed/10966474?dopt=Abstract.
- Spiegelman B, Heinrich R (2004). «Biological control through regulated transcriptional coactivators». Cell 119 (2): 157–67. PMID 15479634 - www.ncbi.nlm.nih.gov/pubmed/15479634?dopt=Abstract.
- Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B (2003). «A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells - www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=12808131». Proc Natl Acad Sci U S A 100 (14): 8164 – 9. PMID 12808131 - www.ncbi.nlm.nih.gov/pubmed/12808131?dopt=Abstract.
- Schoeffler A, Berger J (2005). «Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism». Biochem Soc Trans 33 (Pt 6): 1465 – 70. PMID 16246147 - www.ncbi.nlm.nih.gov/pubmed/16246147?dopt=Abstract.
- Tuteja N, Tuteja R (2004). «Unraveling DNA helicases. Motif, structure, mechanism and function - www.blackwell-synergy.com/links/doi/10.1111/j.1432-1033.2004.04094.x». Eur J Biochem 271 (10): 1849–63. PMID 15128295 - www.ncbi.nlm.nih.gov/pubmed/15128295?dopt=Abstract.
- Bickle T, Krüger D (1993). «Biology of DNA restriction - www.pubmedcentral.nih.gov/picrender.fcgi?artid=372918&blobtype=pdf». Microbiol Rev 57 (2): 434 – 50. PMID 8336674 - www.ncbi.nlm.nih.gov/pubmed/8336674?dopt=Abstract.
- Joyce C, Steitz T (1995). «Polymerase structures and function: variations on a theme? - www.pubmedcentral.nih.gov/picrender.fcgi?artid=177480&blobtype=pdf». J Bacteriol 177 (22): 6321 – 9. PMID 7592405 - www.ncbi.nlm.nih.gov/pubmed/7592405?dopt=Abstract.
- Hubscher U, Maga G, Spadari S. «Eukaryotic DNA polymerases». Annu Rev Biochem 71: 133 – 63. PMID 12045093 - www.ncbi.nlm.nih.gov/pubmed/12045093?dopt=Abstract.
- Johnson A, O'Donnell M. «Cellular DNA replicases: components and dynamics at the replication fork». Annu Rev Biochem 74: 283 – 315. PMID 15952889 - www.ncbi.nlm.nih.gov/pubmed/15952889?dopt=Abstract.
- Tarrago-Litvak L, Andréola M, Nevinsky G, Sarih-Cottin L, Litvak S (1994). «The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention - www.fasebj.org/cgi/reprint/8/8/497». FASEB J 8 (8): 497–503. PMID 7514143 - www.ncbi.nlm.nih.gov/pubmed/7514143?dopt=Abstract.
- Martinez E (2002). «Multi-protein complexes in eukaryotic gene transcription». Plant Mol Biol 50 (6): 925 – 47. PMID 12516863 - www.ncbi.nlm.nih.gov/pubmed/12516863?dopt=Abstract.
- Cremer T, Cremer C (2001). «Chromosome territories, nuclear architecture and gene regulation in mammalian cells». Nat Rev Genet 2 (4): 292–301. PMID 11283701 - www.ncbi.nlm.nih.gov/pubmed/11283701?dopt=Abstract.
- Pál C, Papp B, Lercher M (2006). «An integrated view of protein evolution». Nat Rev Genet 7 (5): 337 – 48. PMID 16619049 - www.ncbi.nlm.nih.gov/pubmed/16619049?dopt=Abstract.
- O'Driscoll M, Jeggo P (2006). «The role of double-strand break repair - insights from human genetics». Nat Rev Genet 7 (1): 45 – 54. PMID 16369571 - www.ncbi.nlm.nih.gov/pubmed/16369571?dopt=Abstract.
- Dickman M, Ingleston S, Sedelnikova S, Rafferty J, Lloyd R, Grasby J, Hornby D (2002). «The RuvABC resolvasome». Eur J Biochem 269 (22): 5492 – 501. PMID 12423347 - www.ncbi.nlm.nih.gov/pubmed/12423347?dopt=Abstract.
- Joyce G (2002). «The antiquity of RNA-based evolution». Nature 418 (6894): 214 – 21. PMID 12110897 - www.ncbi.nlm.nih.gov/pubmed/12110897?dopt=Abstract.
- Orgel L. «Prebiotic chemistry and the origin of the RNA world - web.archive.org/web/20070628064747/http://www.crbmb.com/cgi/reprint/39/2/99.pdf». Crit Rev Biochem Mol Biol 39 (2): 99 – 123. PMID 15217990 - www.ncbi.nlm.nih.gov/pubmed/15217990?dopt=Abstract.
- Davenport R (2001). «Ribozymes. Making copies in the RNA world». Science 292 (5520): 1278. PMID 11360970 - www.ncbi.nlm.nih.gov/pubmed/11360970?dopt=Abstract.
- Szathmáry E (1992). «What is the optimum size for the genetic alphabet? - www.pnas.org/cgi/reprint/89/7/2614.pdf». Proc Natl Acad Sci U S A 89 (7): 2614 – 8. PMID 1372984 - www.ncbi.nlm.nih.gov/pubmed/1372984?dopt=Abstract.
- Vreeland R, Rosenzweig W, Powers D (2000). «Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal». Nature 407 (6806): 897 – 900. PMID 11057666 - www.ncbi.nlm.nih.gov/pubmed/11057666?dopt=Abstract.
- Hebsgaard M, Phillips M, Willerslev E (2005). «Geologically ancient DNA: fact or artefact?». Trends Microbiol 13 (5): 212 – 20. PMID 15866038 - www.ncbi.nlm.nih.gov/pubmed/15866038?dopt=Abstract.
- Nickle D, Learn G, Rain M, Mullins J, Mittler J (2002). «Curiously modern DNA for a "250 million-year-old" bacterium». J Mol Evol 54 (1): 134 – 7. PMID 11734907 - www.ncbi.nlm.nih.gov/pubmed/11734907?dopt=Abstract.
Литература
- Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3.
- Докинз Р. Эгоистичный ген. — М.: Мир.
- История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
- Льюин Б. Гены. — М.: Мир, 1987. — 1064 с.
- Пташне М. Переключение генов. Регуляция генной активности и фаг лямбда. — М.: Мир, 1989. — 160 с. Все форумы > Книга «переключение генов» М. Пташне - molbiol.ru/forums/lofiversion/index.php/t7803.html
- Уотсон Дж. Д. Двойная спираль: воспоминания об открытии структуры ДНК. - www.chem.msu.ru/rus/books/watson/welcome.html — М.: Мир, 1969. — 152 с.
wreferat.baza-referat.ru
Реферат Биология ДНК
Литература
1. О. О. Фаворова. Сохранение ДНК в ряду популяций: репликация ДНК. Соросовский образовательный журнал, 1996 г. 2. Г.М. Дымшиц. Проблема раепликации концов линейных молекул и теломераза. Соросовский образовательный журнал, 2000 г.works.tarefer.ru
Реферат - ДНК. Основы генетического материал
Челябинский Государственный Университет
Юридический факультет
Контрольная работа
По предмету: «Концепции современного естествознания»
На тему: «ДНК. Основы генетического материал»
Выполнил:
студент гр. ЗЮ-
Проверил:
____________________
Челябинск 2009
Содержание
Введение
1. Общие понятия о дезоксирибонуклеиновых кислотах
2. Способы получения ДНК
3. Химический состав и физико-химические свойства ДНК
4. Методы количественного и качественного определения и исследования
5. Содержание в клетках и тканях
6. Биосинтез
7. Биологическая роль
8. Гистохимические методы обнаружения в тканях
Заключение
Литература
Введение
Нуклеиновые кислоты имеют первостепенное биологическое значение и представляют собой сложные высокомолекулярные биополимеры, мономерами которых являются нуклеотиды.
Они впервые были обнаружены в ядрах клеток, откуда и их название (нуклеус — ядро).
Существует два типа нуклеиновых кислот: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая.
Важные открытия были сделаны учеными, они открыли молекулу ДНК. На основе этой молекулы строится вся жизнь.
Немного из истории. ДНК впервые были открыты Мишером (F. Micscher, 1869), который назвал полученное вещество нуклеином (лат. nucleus ядро). Впоследствии было показано, что нуклеин представляет собой высокомолекулярную, содержащую фосфор кислоту, находящуюся в комплексе с белками, поэтому стали различать собственно нуклеиновую кислоту [Альтманн (R. Altmann), 1889] и ее комплексы с белками — нуклеопротеиды. Вскоре нуклеиновая кислота была получена из вилочковой железы (тимуса) теленка, оказавшейся богатым источником итого вещества. Вещество, близкое но свойствам, но отличающееся от нуклеиновой кислоты, полученной из тимуса, выделили из дрожжей. Выяснилось, что нуклеиновая кислота из дрожжей содержит аденин, гуанин, цитозин и урацил, тогда как нуклеиновая кислота. выделенная из тимуса теленка, вместо урацила содержит тимин. В качестве углеводного компонента в дрожжевой нуклеиновой кислоте нашли пентозу, а в препарате из тимуса — дезоксипентозу. В зависимости от источника получения эти нуклеиновые кислоты получили названия тимонуклеиновой и зимонуклеиновой. Поскольку первый тип нуклеиновой кислоты находили в животных объектах, а второй — в растительных, употребляли также названия «животная» и «растительная» нуклеиновые кислоты. Однако, когда Фейльген (R. Feulgen) разработал гистохимическую реакцию на «животную» нуклеиновую кислоту, оказалось, что она обнаруживается в ядре как животных, так и растительных клетоколо С другой стороны, «дрожжевая» нуклеиновая кислота была найдена Ж. Браше главным образом в цитоплазме клеток и растений, и животных. Наконец, А. Н. Белозерским наличие ДНК у растений было доказано химически. Названия «дезоксирибонуклеиновая кислота» (ДНК) и «рибонуклеиновая кислота» (РНК) были предложены после того, как Левином (Р.A. Levenе) было установлено, что дезоксипентоза в тимонуклеиновой кислоте является дезоксирибозой, а пентоза в зимонуклеиновой кислоте — рибозой .
1. Общие понятия о дезоксирибонуклеиновых кислотах
Дезоксирибонуклейновые кислоты (ДНК; устаревшие названия: дезоксипентозонуклеиновые кислоты, ядерные нуклеиновые кислоты, тимонукленновые кислоты, животные нуклеиновые кислоты) — нуклеиновые кислоты, содержащие в качестве углеводного компонента дезоксприбозу, а в качестве одного из пиримидиновых оснований — тимин, которым в молекулах рибонуклеиновых кислот соответствуют рибоза и урацил. ДНК представляют собой линейные полимеры дезоксирибонуклеотидов, в последовательности азотистых оснований которых закодирована вся наследственная информация.
Таким образом, ДНК данного организма содержит в себе информацию о всех признаках вида и особенностях индивидуума — его генотип — и передает эту информацию потомству, воспроизводя определенную последовательность оснований в строении индивидуальных ДНК. Поскольку молекулы ДНК очень больших размеров и существует огромное множество возможных неодинаковых последовательностей из четырех различных нуклеотидов, число разных молекул ДНК практически бесконечно.
В природе ДНК содержатся во всех организмах за исключением РНК-содержащих вирусов. ДНК являются типичным компонентом клеточного ядра, в котором они находятся в комплексе с белками, главным образом гистонами, образуя дезоксприбонуклеопротеиды, составляющие основу цитологической структуры хроматина и вещества хромосом. ДНК обнаружена также в хлоропластах растительной клетки и в митохондриях животных и растений, в которых она кодирует часть белков этих структур, благодаря чему они обладают некоторой автономией и лишь частично зависят от ДНК ядра.
2. Способы получения ДНК
Методика выделения ДНК зависит от состава и характера используемого источника (ткани животных или растений, микроорганизмы, вирусы). Для лабораторного и промышленного получения ДНК обычно используют вилочковую железу теленка, а также сперму (молоки) рыб, селезенку млекопитающих, ядерные эритроциты птиц.
Препараты ДНК, получаемые обычно в виде натриевой соли ДНК, имеют вид белых волокон. Для сохранения нативных свойств ДНК обработку тканей и клеток проводят на холоду, по возможности быстро, в условиях, исключающих или уменьшающих действие дезоксирибонуклеаз, как правило, содержащихся в тканях и вызывающих ферментативный распад ДНК. Помимо сохранения нативных свойств, важнейшей задачей является очистка ДНК от других веществ, в первую очередь — от белков и РНК. В связи с этим методы получения ДНК различаются главным образом способами депротеинизации и очистки препаратов от примесей РНК. Для этих целей применяют обработку клеток и тканей различными детергентами, фенолами и другими депротеинизирующими агентами.
При получении ДНК из животных и растительных тканей чаще всего предварительно изолируют фракцию клеточных ядер или выделяют дезоксирибонуклеопротеиды, отмывая их солевыми растворами в физиологических концентрациях в присутствии ЭДТА или других соединений, связывающих двухвалентные катионы, необходимые для проявления ферментативной активности дезоксирибонуклеаз. После удаления основной массы белков препараты дополнительно депротеинизируют хлороформом с октанолом или фенолом. Нередко их обрабатывают также рибонуклеазами и протеолитическими ферментами, обычно проназой.
Для получения ДНК из бактерий обычно пользуются методом Мармура. который заключается в отмывании бактериальной массы 0,15 М Nad, содержащим 0,015 М цитрат натрия, лизисе клеток при 60° и рН 8,0 в 0,15 М NaCI, содержащем ЭДТА и 2% додецилсульфат натрия, депротепнизации их хлороформом, содержащим изоамиловый спирт, переосаждении спиртом, повторной многократной депротеинизации, обработке рибонуклеазой и осаждении изопропиловым спиртом. Этот метод в различных модификациях также успешно применяют для получения ДНК из животных и растительных тканей и изолированных клеточных структур, например, митохондрий.
3. Химический состав и физико-химические свойства ДНК
ДНК представляют собой многоосновные сильные кислоты, щелочные соли которых образуют в воде очень вязкие прозрачные коллоидные растворы, застывающие при концентрации выше 0,25%. Растворы ДНК характеризуются аномальной (структурной) вязкостью, объясняющейся удлиненной формой молекул, и в потоке обладают двойным, лучепреломлением .
Химически ДНК представляют собой высокомолекулярные полимеры монодезоксирибонуклеотидов (мононуклеотидов), являющиеся мономерами, из которых построены молекулы
ДНК. Каждый мононуклеотид ДНК состоит из остатков фосфорной кислоты, 2-П-дезоксирибозы и пуринового или пиримидинового азотистого основания. Углеводно-фосфатный остаток одинаков во всех мономерах ДНК, азотистое основание же может быть представлено аденином (А), гуанином (Г), цитозином (Ц) или тимином (Т). В ДНК разных организмов имеется некоторое количество так называемых, минорных оснований, например 5-метил-цитозина, частично заменяющего цитозин. У высших животных и человека содержание этого основания достигает 1,5%, у высших растений 5—7%, у бактерий — не более 0,6%. В ДНК бактерий встречается также 6-метиладенин и иногда другие метилированные азотистые основания. В ДНК Т-четных бактериофагов (Т2, Т4 и Т6) цитозин полностью замещен 5-оксиметилцитозином, в ДНК вирусов SP01 и SP8 тимин замещен 5-оксиметилурацилом, а у фага PBS1 — урацилом.
В мононуклоотидах 2-П-дезокси-рибоза присоединена гликозидной связью через первый углеродный атом к атому азота в 9-м положении пуринового основания (аденина или гуанина) или в 3-м положении пиримидинового основания (цитозина или тимина). Остаток фосфорной кислоты присоединен эфирной связью к 5'-му или З'-му атому углерода дезоксирибозы. Таким образом, мононуклеотидные остатки соединены между собой через фосфорную кислоту, которая соединена с 5'-С-атомом дезоксирибозы одного нуклеотида и с 3'-С-атомом дезоксирибозы соседнего нуклеотида и т. д. (схема 1).
Схема 1. Соединение нуклеотидов в молекуле ДНК.
ДНК из различных источников отличаются друг от друга по соотношению входящих в их состав азотистых оснований, то есть по нуклеотидному составу, однако нуклеотидный состав всех ДНК подчиняется определенным закономерностям — правилам Чаргаффа, согласно которым:
1) число молекул аденина равно числу молекул тимина; 2) число молекул гуанина равно числу молекул цитозина; 3) число молекул пуриновых оснований равно числу молекул пиримидиновых оснований;
4) число 6-аминогрупп в молекуле ДНК равно числу 6-кетогрупп, то есть сумма аденин + цитознн равна сумме гуанин + тимин. Записав правила Чаргаффа буквенными обозначениями, получим следующие выражения: 1) А — Т; 2) Г — Ц; 3) А + Г = Т + Ц; 4) А + Ц = Г + Т. Эти правила сохраняют силу и в том случае, если приведенные азотистые основания замещены их метилированными или другими производными (минорными основаниями). Таким образом, нуклеотидный состав ДНК характеризуется молярным отношением (фактором специфичности) или процентом ГЦ-пар, т.е. . Величинаэтого показателя одинакова для ДНК различных органов и тканей одного организма и практически не отличается у разных видов животных и растений в пределах одного класса. Она достаточно близка у высших растений и животных (позвоночных) — от 0,55 до 0,93. У бактерий, по данным А. С. Спирина и А. Н. Белозерского, величина фактора специфичности колеблется от 0,35 до 2,73 или от 26,8 до 74,2% ГЦ-пар.
Рентгеноструктурный анализ ДНК показал, что пуриновые и пиримидиновые основания нуклеотидных остатков ДНК лежат в одной плоскости, перпендикулярной продольной оси молекулы, тогда как циклы дезоксирибозы находятся в плоскости, почти перпендикулярной той, в которой лежат циклы оснований. Расстояния между азотистыми основаниями отдельных нуклеотидов составляют 3,4 А. В соответствии с этими данными и с правилами Чаргаффа Дж. Уотсон и Ф. Крик построили модель молекулы ДНК (схема 2). Дальнейшие исследования подтвердили их правоту. Установление строения молекулы ДНК явилось крупнейшим открытием в области молекулярной биологии. Согласно модели Уотсона — Крика, молекула ДНК представляет собой двойную спираль, построенную из двух полинуклеотидных цепочек, направленных антипараллельно, то есть если в одной цепочке остаток фосфорной кислоты связывает отдельные нуклеотиды от 5'- к 3'-С-атомам снизу вверх, то в другой цепочке эти связи направлены сверху вниз. Каждая цепочка состоит из углеводно-фосфорного скелета, присоединенные к углеводному компоненту азотистые основания ориентированы внутрь и соединены между собой попарно водородными связями, а именно А– с Т и Г – с Ц. Аденин с тимином соединены двумя Н-связями, тогда как гуанин с цитозином соединены еще третьей водородной связью (схема 3). Двойная спираль закручена вправо, причем полному витку спирали соответствуют 10 пар нуклеотидных остатков, занимающих расстояние в 34 А,— В-форма. В-форма устойчива в среде с высокой влажностью (97% насыщенного пара). Вся молекула ДНК представляет собой жесткий, неветвящийся линейный полимер. В условиях низкой влажности (с 76% насыщения) двойная спираль ДНК принимает А-форму, в которой полный виток спирали занимает расстояние в 28 А, причем меняется также положение плоскости, в которой расположены азотистые основания, и число оснований на полный виток (один виток содержит 11 нуклеотидов).
В хроматине ДНК образует комплексы с гистонами. Такие нуклеогистоны находятся в сверхспирализованном состоянии, причем суперспираль имеет радиус 50 А и расстояние между витками 120 А. В хромосомах и частично в хроматине такие суперспирали дезоксирибонуклеопротеида закручены в спирали высших порядков с диам. 250 и 500 А.
Молекулярный вес (масса) ДНК неодинаков и зависит от источников получения образца ДНК. Помимо этого, даже при самых тщательных и щадящих процедурах выделения ДНК подвергается некоторой деградациии ее молекулярный вес может быть ниже, чем в клетках. Препараты, получаемые современными методами из тканей животных н растений, имеют мол. вес 6-106—10-106, однако истинный мол. вес ДНК животных и растений, как показывают методы определения мол. веса по вязкости и по длине молекул (lA двуспиральной ДНК в В-форме соответствует 197 единицам молекулярного веса), значительно выше и может достигать десятков миллиардов. Таким образом. молекулы ДНК хромосом являются самыми крупными молекулами из всех известных биополимеров.
Схема 2. Двойная спираль молекулы ДНК (модель Уотсона—Крика): А — аденин; Т — тимин, Г — гуанин; Ц — цитозин; Д — дсзоксирибоза; Ф — фосфат; 34 А — величина витка, спирали; 10 А — радиус спирали; 3, 4 А — расстояние между нуклеотидами; стрелки указываютнаправление витка спирали.
Схема 3. Соединение пуриновых и пиримидиновых оснований в молекуле ДНК(точками обозначены водородные связи).
У некоторых вирусов, например у бактериофагов Ф Х174, fd и М13, ДНК представлена одной полинуклеотидной цепью, замкнутой в кольцо и имеющей сравнительно небольшой мол. вес — 1,7-106. У большинства вирусов ДНК представляет собой двойную спираль, линейную пли замкнутую в кольцо; нередко такие формы переходят друг в друга, причем эти молекулы имеют так называемые «липкие концы», содержащие однонитчатые комплементарные друг другу нуклеотидные последовательности, при помощи которых молекула замыкается в кольцо. Для ДНК характерно сильное поглощение в ультрафиолетовой части спектра при длине волны около 260 нм. Удельное поглощение высокополимерной ДНК в растворе, содержащем выше 10-3 М NaCI, при рН 7,0 составляет около 6000 на 1 г-атом фосфора. ДНК сравнительно легко деполимеризуются под действием некоторых химических соединений, ультразвука, ионизирующей и ультрафиолетовой радиации; нагревание ДНК с разведенными минеральными кислотам приводит к отщеплению пуринов (аденина и гуанина) и образованию «апуриновой кислоты», содержащей только пиримидиновые основания. Нагревание растворов ДНК, а также их подщелачивание и т.п. вызывают денатурацию ДНК, заключающуюся в плавлении двойной спирали (разрыве водородных и гидрофобных связей) и расхождении полинуклеотидных цепочек. Денатурация сопровождается понижением вязкости раствора и повышением поглощения в ультрафиолете, по чему можно контролировать этот процесс. Температура плавления (температура, при которой денатурирована половина ДНК) тем выше, чем больший процент ГЦ-пар содержится в ДНК; этот показатель может служить для определения нуклеотидного состава ДНК. Установлено, что (не линейно связана с составом ДНК: 1° соответствует 2,5 молярным % ГЦ-пар. Гомогенные препараты ДНК (например, вирусной ДНК) характеризуются плавлением с резким переходом, тогда как гетерогенные препараты дают сравнительно широкую зону плавления, что может служить мерой гетерогенности ДНК. При быстром охлаждении после денатурации ДНК не восстанавливает своих нативных свойств, однако при медленном охлаждении полинуклеотидные цепочки реассоциируются по принципу комплементарности и таким образом происходит ренатурация молекул ДНК. При медленном охлаждении денатурированной ДНК в присутствии РНК полинуклеотидные нити ДНК и РНК могут ассоциироваться но принципу комплементарности пар гуанина с цитозином и аденина с урацилом (вместо тимина), образуя двунитчатые гибриды ДНК — РНК. Метод гибридизации широко применяется для исследования комплементарности и структуры двух типов нуклеиновых кислот, а также ДНК из разных источников. Изучение ренатурации ДНК показало, что ДНК высших организмов содержат повторяющиеся последовательности, которые можно разделить на очень часто повторяющиеся последовательности и относительно часто повторяющиеся. Кроме того, имеются и уникальные последовательности. К повторяющимся последовательностям, по-видимому, относятся регуляторные гены, а также гены, кодирующие рибосомные РНК, транспортные РНК и гистоны. Структурные гены, как правило, относятся к уникальным последовательностям, что доказано для таких активных генов, как гены глобина в эритробластах и гены фиброина в шелкоотделительной железе шелкопряда. У низших организмов (прокариотов) — вирусов и бактерий, а также в митохондриях ДНК не содержит или почти не содержит повторяющихся последовательностей. В ДНК ряда организмов обнаружены участки, в каждой из нуклеотидных цепей которых имеются последовательности оснований, повторяющиеся далее, но в обратном порядке. Поскольку такие последовательности читаются одинаково с обоих концов, как, например, слово «потоп», они получили название палиндромов. Палиндромы в ДНК и в синтезированных на их матрице РНК могут образовывать крестообразные структуры, физиологическую роль которых, возможно, связана с инициацией (началом) синтеза РНК или белков.
Методом молекулярной гибридизации показано, что в ядерной ДНК плодовой мушки Drosophilamelanogaster около 75% всей ДНК представлено уникальными последовательностями, около 15% — очень часто (до 1 000 000 раз) повторяющимися и около 10% — относительно часто (1000—100 000 раз) повторяющимися нуклеотидными последовательностями. Очень часто повторяющиеся последовательности расположены главным образом в плотном хроматине, цитологически описываемом как гетерохроматин; они встречаются чаще всего в так называемой сателлитной ДНК, обычно отличающейся от основной массы ДНК по нуклеотидному составу и отделяемой от нее при равновесном центрифугировании в градиенте плотности хлористого цезия. Такие сателлиты содержатся почти у всех эукариотов и составляют от 1% до половины всей массы генома. Даже у близкородственных видов количество сателлитной ДНК может существенно отличаться. Относительно часто повторяющиеся последовательности распределены между гетеро- и эухроматином. Значительная часть дезоксирибонуклеопротеида хроматина состоит из чередующихся участков повторяющихся и уникальных последовательностей ДНК. Заметные количества ДНК, содержащей относительно часто повторяющиеся последовательности, находятся также в хроматине, ассоциированном с ядрышками и кодирующем рибосомные РНК.
Первичная структура ДНК трудно поддается изучению уже потому, что молекулы ДНК имеют огромные размеры. Некоторую информацию о последовательности нуклеотидов дает изучение пиримидиновых блоков. При обработке ДНК концентрированной муравьиной кислотой, содержащей дифениламин, происходит отщепление пуриновых оснований и дальнейший гидролиз ДНК. В молекуле сохраняются пиримидиновые последовательности, остающиеся в блоках, представляющих собой олигодезоксинуклеотиды, лишенные пуриновых мономеров. Такие блоки разделяют с помощью хроматографии на изоплиты — олигомеры, содержащие одинаковое число нуклеотидных остатков, затем их в свою очередь разделяют и анализируют. Подобным образом изучают пуриновые блоки, получаемые обработкой ДНК гидразином. Однако наибольший прогресс в изучении структуры ДНК достигнут в результате применения дезоксирибонуклеаз, расщепляющих определенные последовательности нуклеотидов, и в особенности рестриктаз, обладающих узкой специфичностью в отношении коротких нуклеотидных последовательностей в 6—7 нуклеотидов. Более детальную информацию в отношении нуклеотидной последовательности в молекулах ДНК, представляющих собой структурные гены, получают путем анализа нуклеотидной последовательности в соответствующих им РНК и белках. Удалось установить последовательность нуклеотидов в небольших молекулах сателлитной ДНК у высших организмов, выяснена также нуклеотидная последовательность в довольно значительных участках ДНК у некоторых вирусов, бактерий и др.
Метилирование азотистых оснований в составе ДНК происходит уже после синтеза молекулы и относится к так называемом постсинтетическим изменениям или модификациям.
У Е. coli метилируется аденин, находящийся как раз в той короткой последовательности нуклеотидов, которая «узнается» рестрикислотазой R1. По-видимому, рестриктазы избирательно разрушают чужеродные ДНК, попадающие в бактерию, в собственной же ДНК «узнаваемые» ими последовательности защищены метильными группами.
4. Методы количественного и качественного определения и исследования
Большинством цветных химических реакций ДНК обязаны своему углеводному компоненту — дезоксирибозе. Под действием кислот ДНК легко отщепляет пуриновые основания, причем освобождается альдегидная группа дезоксирибозы. В результате дальнейшего действия кислоты дезоксирибоза претерпевает превращения с образованием w-оксилевулинового альдегида: ответственного, по-видимому, за образование окраски с реактивами на ДНК.
Чаще других реакций для обнаружения и количественного определения ДНК применяют нагревание с дифениламином в концентрированной уксусной кислоте в присутствии концентрированной серной кислоты. Эту реакцию обычно применяют в модификации Бертона (К. Burton) при 30° в присутствии уксусного альдегида. Реже применяются менее чувствительные цветные реакции с цистеином, с триптофаном или индолом, а также с карбазолом. Иногда применяют также цветную реакцию с ганитрофенилгидразином. Весьма чувствительным является флюориметрический метод, позволяющий определять до 3.10-9 г ДНК.
Для количественного определения ДНК необходимо ее предварительное отделение от РНК и (по возможности) от других веществ, мешающих применяемой реакции. Для этих целей обычно пользуются методом Шмидта и Таннгаузера (G. Schmidt, S. J. Thannhauser) в различных модификациях. Принцип метода заключается в осаждении нуклеиновых кислот вместе с белками трихлоруксусной или хлорной кислотой, отмывании кислоторастворимых фосфорных соединений, экстрагировании липидов и извлечении нуклеиновых кислот при помощи гидролиза 5% трихлоруксусной кислотой при 90° в течение 15—20 мин. Белки при этом остаются в осадке; из раствора, содержащего нуклеиновые кислоты и подвергнутого гидролизу 0,3— 1,0 н. щелочью, вызывающей распад РНК до нуклеотидов, ДНК осаждают подкислением трихлоруксусной или хлорной кислотой. Осадок отмывают и ДНК экстрагируют горячей хлорной кислотой. Содержание ДНК определяют по фосфору, спектрофотометрически или при помощи специфических цветных реакций, но спекислотрофотометрический метод является наиболее простым и быстрым для определения ДНК после отделения ее от других веществ, характеризующихся максимумом поглощения при 260 нм.
При определении нуклеотидного состава ДНК последнюю подвергают гидролизу хлорной кислотой и отщепившиеся пуриновые и пиримидиновые основания разделяют хроматографией на бумаге или на ионообменниках. Хорошие результаты дает также хроматография в тонком слое на производных целлюлозы и др. Поскольку в обычных двуспиральных ДНК нуклеотидный состав подчиняется определенным правилам (правила Чаргаффа), он может быть выражен в виде процентного содержания ГЦ-пар. Молярный процент ГЦ-пар вычисляют, используя температуру плавления ДНК (температура, при которой денатурирована половина ДНК), по формуле: процент ГЦ-пар = 2,44 ((°пл — 69,3°). Коэффициенты, приведенные в формуле, рассчитаны эмпирически и варьируют в зависимости от ионной силы, ионного состава и величины рН раствора. Хорошие результаты при определении нуклеотидного состава ДНК дает метод улътрацентрифугирования в градиенте плотности хлористого цезия. Плавучая плотность ДНК при этом линейна связана с молярным содержанием ГЦ-пар (изменение содержания ГЦ-пар на 1% изменяет плавучую плотность на 0,001 единицы) и определяется по уравнению: молярное содержание ГЦ-пар = 10,2 .(р — 1,660), где р — плавучая плотность исследуемого препарата ДНК. Для чистых препаратов ДНК нуклеотидный состав можно определить также по спектру поглощения в 0,1 М уксусной кислоте по формуле, предложенной Фредериком (Е. Fredericq).
5. Содержание в клетках и тканях
Содержание ДНК в органах и тканях животных и человека колеблется в широких пределах и, как правило, тем выше, чем больше клеточных ядер приходится на единицу массы ткани. Особенно много ДНК (около 2,5% сырого веса) в вилочковой железе, состоящей главным образом из лимфоцитов с крупными ядрами. Довольно много ДНК в селезенке (0,7—0,9%), мало (0,05—0,08%) в мозге и мышцах, где ядерное вещество составляет значительно меньшую долю. На ранних стадиях эмбрионального развития в этих органах содержится больше ДНК, но содержание ее уменьшается в процессе онтогенеза по мере дифференцировки. Однако количество ДНК на одно клеточное ядро, содержащее диплоидный набор хромосом, практически постоянно для каждого биологического вида. Соответственно количество ДНК в ядрах половых клеток вдвое ниже. По этой же причине различные физиологические и патологические факторы почти не влияют на содержание ДНК в тканях, а при голодании, например, относительное содержание ДНК даже возрастает за счет снижения концентрации других веществ (белков, углеводов, липидов, РНК). У всех млекопитающих количество ДНК в диплоидном ядре почти одинаково и составляет около 6 1012 г, у птиц — около 2,5 10-12, у разных видов рыб, амфибий и простейших оно колеблется в значительных пределах.
Содержание ДНК в бактериях довольно велико и достигает нескольких процентов в пересчете на сухой вес; в вирусах оно может доходить до 50%. Вместе с тем абсолютное количество ДНК в бактериальной клетке в среднем на два порядка ниже, чем в клеточном ядре высших организмов, а в ДНК-содержащих вирусах оно ниже еще на два порядка.
У бактерий одна гигантская молекула ДНК образует генофор, соответствующий хромосоме высших организмов. Так, у кишечной палочки Escherichiacoli молекулярный вес такой кольцеобразной двуспиральной молекулы достигает около 2,5-Ю9 и длины, превышающей 1,2 мм . Эта огромная молекула плотно упакована в небольшой «ядерной области» бактерии и соединена с бактериальной мембраной.
В хромосомах высших организмов (эукариотов) ДНК находится в комплексе с белками, главным образом гистонами; в каждой хромосоме содержится, по-видимому, одна молекула ДНК длиной до нескольких сантиметров и молекулярным весом до нескольких десятков миллиардов. Такие огромные молекулы умещаются в клеточном ядре и в митотических хромосомах длиной в несколько микрометров. Часть ДНК остается не связанной с белками; участки несвязанной ДНК перемежаются с блоками ДНК, связанной с гистонами. Показано, что в таких блоках содержится по две молекулы гистонов 4 типов: Нда, Hab, Hg и Н4.
Помимо клеточного ядра, ДНК содержится в митохондриях и в хлоропластах. Количество такой ДНК обычно невелико и составляет небольшую долю общей ДНК клетки. Однако в ооцитах и на ранних стадиях эмбрионального развития животных подавляющая часть ДНК локализована в цитоплазме, главным образом в митохондриях. В каждой митохондрии содержится по поскольку молекул ДНК. У животных мол. вес митохондриальной ДНК составляет около 10-106; ее двуспиральные молекулы замкнуты в кольцо и находятся в двух основных формах: сверхскрученной и открытой кольцевой. В митохондриях и в хлоропластах ДНК не находится в комплексе с белками, она ассоциирована с мембранами и напоминает бактериальную ДНК Небольшие количества ДНК обнаружены также в мембранах и некоторых других структурах клеток, однако их особенности и биологического роль остаются неясными.
6. Биосинтез
В процессе биологического синтеза ДНК на матрице аналогичной молекулы ДНК образуется такая же молекула, и количество ДНК удваивается. Поэтому процесс биосинтеза ДНК получил название редупликации или репликации .
Принцип комплементарности (дополнительности), по Уотсону и Крику, заложен в самом строении: ДНК.
Дж. Уотсоном и Ф. Криком было постулировано, что репликация ДНК должна происходить полуконсервативным способом, то есть путем раскручивания двойной спирали и синтеза новых, комплементарных исходной полинуклеотидных цепочек на каждой нити. Именно этот механизм и был доказан экспериментально путем введения в ДНК-матрицу тяжелого азота (радиоактивной метки) и анализа ДНК последующих поколений при помощи центрифугирования в градиенте плотности хлористого цезия или методом авторадиографии.
ДНК синтезируетсяиз дезоксинуклеозидтрифосфатов, которые соединяются в полинуклеотидную цепь с отщеплением пирофосфата. Эта реакция протекает на матрице одноцепочечной предобразованной ДНК под действием фермента ДНК-полимеразы, причем синтезирующаяся: дезоксирибополинуклеотидная цепь дочерней ДНК строго комплементарна матричной цепи. ДНК-полимераза, впервые выделенная из Е. coli, хорошо изучена. Ее молекулярный вес составляет 110 000 дальтонов, под действием трипсина она распадается на 2 фрагмента — активный и неактивный. Для протекания реакции, катализируемой ДНК-полимеразой, необходимы матричная ДНК, обязательное присутствие всех четырех дезоксинуклеозидтрифосфатов и ионов Mg2+. Равновесие реакции сильно смещено в сторону синтеза, оптимальная величина рН 7,5; реакция ингибируется пирофосфатом: концентрация пирофосфата 2•10-3 М угнетает реакцию синтеза на 50%. Показано, что двуспиральная молекула ДНК неактивна в качестве матрицы, однако для инициации репликации на активной матрице одноцепочечной ДНК необходим участок комплементарной ей полинуклеотидной цепи со свободным 3'-ОН-кон-цом рибозы, служащий затравкой для роста вновь синтезирующейся цепи. Эта затравка состоит из рибонуклеотидных остатков, которые удаляются по завершении синтеза комплементарной цепи ДНК. К 3'-ОН-концу затравки ДНК-полимераза последовательно присоединяет дезокспрпбонуклеотидные остатки, соединяющиеся водородными связями с комплементарными основаниями матричной цепи. Рост синтезирующейся цепи происходит в направлении 3'-ОН — 3'-ОН-концам, антипараллельно матричной цепи. Репликация ДНК приводит к удвоению количества генетического материала клетки и, как правило,— к клеточному делению. Поэтому репликация происходит тем чаще, чем короче время генерации вируса или бактерии и чем чаще делятся клетки у высших организмов. Темп репликации высок у эмбрионов, в особенности во время дробления, и замедляется по мере развития и дифференцировки. Вообще темп репликации соответствует митотической активности ткани и поэтому низок в не делящихся клетках, например в клетках мозга пли мышц, и относительно высок в часто делящихся клетках костного мозга или опухолей. Репликация ДНК имеет место и при эндомптозах, приводящих к полиидоидизации ядер. Репликация происходит не во время собственно митоза, а в интеркинетической фазе во время синтетического S-периода клеточного цикла между периодами gi и Ga.
У бактерийи вирусов репликация начинается в одной точке молекулы ДНК. В каждой хромосоме высших организмов таких точек обычно бывает по нескольку сот. В точке начала синтеза ДНК могут образоваться одна пли две репликационные вилки. В первом случае репликация протекает в одном направлении; обычно же образуются две вилки, которые движутся по молекуле ДНК в противоположных направлениях. 'Такая двунаправленная репликация показана авторадиографическим методом на кольцевых ДНК бактерий, а также у высших организмов. По мере продвижения репликационных вилок образуются дочерние двуспиральные молекулы ДНК, состоящие наполовину из старых цепей и наполовину из комплементарных им новых цепей ДНК.
Исследование Окадзаки (R. Oka-zaki) биосинтеза ДНК у бактерий показало, что сначала синтезируются сравнительно короткие фрагменты дезоксирибополинуклеотидных цепей длиной до 1000 нуклеотидных остатков, которые затем сшиваются между собой ферментом ДНК-лигазой (полинуклеотидлигазой). Одна из двух цепей ДНК при этом растет непрерывно, а другая прерывисто. Образование фрагментов Окадзаки показано и у высших организмов. Показано, что разъединение и раскручивание двух полинуклеотидных цепей двойной спирали ДНК, необходимое для репликации, осуществляется при помощи особого ДНК-связывающего белка.
Репликация вирусных и нескольких кольцевых молекул ДНК имеет некоторые особенности. Так, одноцепочечная ДНК вируса Ф Х174 сначала синтезирует на своей матрице комплементарную цепь — так называемый минус-цепь. Эта цепь замыкается в кольцо ДНК-лигазой и образует биологически активную репликативную форму ДНК бактериофага. А. Корнбергом эта последовательность реакций была воспроизведена вне организма, и таким образом впервые была получена синтетическая биологически активная репликативная форма ДНК. У кольцевых молекул ДНК митохондрий обнаружено присутствие небольшого фрагмента длиной около 450 нуклеотидных остатков, комплементарного одной («легкой») цепи двуспиральной молекулы ДНК. Другая («тяжелая») цепь в этом участке смещается и образует так называемую D-петлю. Названный фрагмент служит начальным участком синтезирующейся «тяжелой» цепи ДНК, «легкая» цепь синтезируется на освободившейся «тяжелой» цепи исходной ДНК. Репликация происходит асимметрически в одном направлении и начинается с предобразованных фрагментов. В ДНК паповавирусов, например вируса SV 40 и вируса папилломы, репликация идет сразу в двух направлениях. У бактерий репликация, по всей вероятности, начинается в месте прикрепления ДНК к мембране. У высших организмов ДНК хромосом также связана с внутренней мембраной ядра, однако значение этой связи в процессе репликации пока не ясно.
Помимо репликации ДНК, в организме происходит репарация ДНК, то есть восстановление поврежденных, разрушенных или измененных участков полинуклеотидных цепей. Разрывы в одной из полинуклеотидных цепей ДНК, по-видимому, репарируются под действием ДНК-лигазы. Более сложные повреждения, например образование димеров тимина под действием ультрафиолетовой радиации, ликвидируются следующимоб разом: поврежденный участок, содержащий димер тимина, «вырезается» при помощи эндонуклеазы (обычно это олигонуклеотид, три-илп тетрануклсотид), а брешь заполняется нормальным нуклеотидным блоком. В процессе репарации участвует ряд ферментов: эндо-, экзо-1 и экзо-11 нуклсазы и ДНК-полимераза. Расшифровка механизмов повреждения и репарации ДНК несомненно приведет к более эффективной профилактике и терапии болезней, вызванных радиационными и химическими мутагенами.
При изучении мутанта Е. coli, чувствительного к ультрафиолетовому облучению, выяснилось, что он дефектен и в отношении ДНК-полимеразы. Однако у этого мутанта (Ро1А~) продолжалась репликация ДНК. На этом основании возникло предположение, что описанная А. Корнбергом полимераза участвует в репарации и не участвует в репликации. Вскоре из мутанта Ро1А" была выделена другая ДНК-полимераза, сходная по механизму действия с ранее известной, но отличная от нее по некоторым свойствам. ДНК-полимеразу II стали считать ответственной за репликацию. Затем была выделена ДНК-полимераза III, по своим свойствам напоминающая ДН1-?-полимеразу I. Таким образом, обнаружено три ДНК-полпмеразы, причем, по-видимому, для репликации необходима именно ДНК-полимераза III.
В онкогенных РНК-содержащих вирусах (онкорнавирусах) обнаружен фермент, катализирующий синтез комплементарной цепи ДНК на матрице, то есть процесс, обратный процессу переноса информации от ДНК к РНК. Этот фермент получил название «РНК-зависимая ДНК-полимераза» или «обратная транскриптаза». Открытие этого фермента означало успех науки о злокачественных опухолях — онкологии. Ранее было установлено, что при злокачественном перерождении клеток под действием онкогенных вирусов происходит включение ДНК вируса в хромосому клетки хозяина. Однако из этой закономерности выпадали РНК-содержащие онкогенные вирусы. Оказалось, что они содержат обратную транскриптазу, которая сразу после заражения по вирусной РНК синтезировала вирусную ДНК, которая и внедрялась в хромосому клетки хозяина.
В ряде случаев, например в ооцитах для рибосомной ДНК, имеет место амплификация (умножение) определенных участков ДНК. Механизм амплификации не совсем ясен; по-видимому, происходит репликация отдельных участков ДНК, содержащих цистроны тех РНК, которые усиленно синтезируются в данных условиях.
Катаболизм ДНК не представляет каких-либо особенностей. В кишечном тракте и в тканях ДНК гидролизуются под действием дезоксирибонуклеаз; образовавшиеся нуклеотиды гидролизуются нуклеотидазами, а образующиеся пуриновые и пиримидиновые основания и сахара расщепляются обычными путями.
7. Биологическая роль
Цитогенетические исследования в 20—30-х гг. 20 в. свидетельствовали о том, что передача и хранение наследственных признаков связаны с хромосомами, находящимися в ядерном веществе. То, что наследственным веществом является именно ДНК, а не белок, стало ясным в результате исследований, проведенных в 40-х гг. 20 в. на бактериях и бактериофагах (см. Ген).
В 1944 г. Эйвери, Мак-Лауд и Мак-Карти (О. Т. Avery, С. М. Мас-Leod, М. McCarty) установили природу трансформирующего фактора у бактерий. Им оказалась ДНК. Процесс трансформации состоит, несомненно, из ряда стадий: обратимой сорбции молекул ДНК бактериальной клеткой; внедрения этих молекул внутрь клетки; интеграции молекулы чужой ДНК в хромосому клетки, расщепления образовавшейся сложной структуры и ее перехода в рекомбинанты.
При исследовании бактериальных вирусов под электронным микроскопом пли при помощи радиоактивной метки, вводимой в белок или в ДНК бактериофага, было показано, что вирус, фиксируясь на поверхности бактериальной клетки, вводит в нее только молекулу ДНК, оставляя снаружи свою белковую оболочку. Молекула ДНК вируса, попавшая в клетку, несущая в себе всю наследственную информацию (геном) вируса, вызывает образование в клетке новых вирусных частиц, их размножение и гибель клетки от лизиса.
Некоторые, так называемые умеренные, фаги у части бактериальных клеток не вызывают явных признаков заражения, однако их ДНК, попадая в клетку, прочно связывается с геномом самой бактерии, интегрируясь с ДНК бактериальной клетки. Многие поколения таких бактерий несут в себе бактериофаг в скрытом виде, не проявляя признаков нарушения жизнедеятельности. Однако при неблагоприятных условиях и при действии каких-либо повреждающих факторов, например ионизирующей или ультрафиолетовой радиации, вирус в таких бактериях начинает размножаться и вызывает лизис (гибель) бактерий. ДНК вируса настолько прочно связывается с ДНК бактерий, что заражение вирусом, полученным от лизогенных бактерий, сопровождается переносом вместе с ДНК вируса части ДНК бактерий, с которой передаются некоторые наследственные свойства этих бактерий, отсутствующие и у вновь заражаемых бактерий, и у самого вируса. Это явление, сходное с трансформацией, получило название трансдукции .
Последовательность нуклоотидов в цепи ДНК переписывается в комплементарную ей последовательность нуклеотидов в молекуле РНК — так называемая транскрипция. Процесс этот осуществляется при участии фермента РНК-полимеразы. Генетическая информация, переписанная с ДНК на РНК, в конечном счете определяет первичную структуру (последовательность аминокислотных остатков в строящейся молекуле белка). При помощи электронной микроскопии удалось увидеть рост цепей РНК на матрице ДНК, то есть работу гена на уровне транскрипции.
В процессе реализации или выражения генов имеет место кодирование генетической информации. Показано, что три последовательно расположенных нуклеотидных остатка (триплет) в цепи ДНК кодируют комплементарный триплет в цепи РНК, который в свою очередь контролирует включение одной, строго определенной аминокислоты в полипептидную цепь синтезирующегося белка. Установлено, что полипептидная цепь синтезируется колинеарно с ДНК, то есть в соответствии с линейным расположением триплетов ДНК. Известно, какие именно триплеты кодируют включение каждой аминокислоты.
Последовательность нуклеотидов ДНК, кодирующая образование определенной полипептидной цепи, представляет собой структурный ген, или цистрон. Изменение даже одной пары нуклеотидов в цистроне (точковая мутация) может привести к изменению структуры белка и потере им биологического активности. Такие точковые мутации могут представлять собой транзиции (замену пары нуклеотндов ГЦ на AT или наоборот), трансверсии (замена AT на ТА или ГЦ на Ц Г, то есть перемещение комплементарных оснований из одной цепи в другую), вставки пары нуклеотидов или их делецию (выпадение). Трансверсии и транзиции приводят обычно к замене одной аминокислоты в строящейся полипептидной цепи, тогда как вставки и делении вызывают изменение порядка считывания и приводят к глубокому нарушению структуры белка. Вставка же или делеция сразу трех пар нуклеотидов, то есть целого триплета, восстанавливает последовательность считывания, что и послужило одним из важнейших доказательств триплетности кода.
У высших организмов количество ДНК на геном достаточно для кодирования миллионов белков. В действительности число генов у человека и высших животных по крайней мере на порядок ниже и находится, по-видимому, между 10 000 и 100 000. Огромное количество избыточной ДНК, таким образом, не несет структурных генов и выполняет иные функции. Оказалось, что часть ДНК вообще не участвует в процессе транскрипции, а преобладающая часть РНК, синтезированной на матрице ДНК у высших организмов, претерпевает распад внутри клеточного ядра, не участвуя в синтезе клеточных белков. В связи с этим Г.П. Георгиевым была высказана гипотеза, согласно которой оперон (последовательность генов, контролирующих синтез ферментов, участвующих в катализе всех этапов одного и того же процесса) у высших организмов содержит большое число регуляторных генов, расположенных в начале считывания. Синтезирующаяся на таком опероне гигантская молекула РНК распадается в процессе ее переноса в цитоплазму, куда поступает только собственно информационная РНК, содержащая структурные гены и кодирующая синтез клеточных белков. Остальная часть этой РНК имеет регуляторные функции и распадается внутри ядра.
Особенностью высших организмов является также дифференцировка клеток и тканей. Гены, содержащиеся в ДНК каждой диплоидной клетки одного и того же организма (геном), качественно и количественно совершенно одинаковы, однако тот факт, что разные ткани и клетки резко различны по своему составу, строению и функциям, объясняется тем, что в них синтезируются неодинаковые белки. Таким образом, помимо регуляции активности действующих генов, при дифференцировке имеет место выключение или блокирование большей части генов, причем обычно активной остается небольшая часть генома, а в некоторых случаях синтезируется лишь один или несколько белков, например синтез гемоглобина в ретикулоцитах. Механизмы диффе-ронцпровкп во многом не ясны, однако показано, что белки, входящие в состав дезокснрибонуклеопро-теидов хроматина, оказывают выраженное действие на транскрипцию. Гистоны подавляют этот процесс, а кислые белки могут активировать его. Неактивные участки хроматина цитологически представляются более плотными, а в процессе транскрипции, напротив, хроматин выглядит более рыхлым и нити ДНК, по-видимому, частично отделяются от гистонов. Различными методами показано, что транскрипция ДНК происходит в разрыхленных участках хроматина, в так называемых пуфах, представляющих собой вздутие хромосом в области действующих генов.
8. Гистохимические методы обнаружения в тканях
В основе гистохимических методов выявления нуклоиновых кислот лежат реакции на все компоненты, входящие в их состав. В растущих тканях происходит быстрое обновление пуринов, пиримидинов, фосфорных соединений и Сахаров. Этим пользуются для избирательного выявления в них ДНК авторадпографическим методом с помощью 3Н-тимпдпна. ДНК образует соли с щелочноземельными и тяжелыми металлами. Остатки фосфорной кислоты, которые обычно связаны с ядерными белками (чаще всего гистонами), при вытеснении последних легко вступают в химические реакции с основными красителями. Для этого могут быть использованы сафранин О, янус зеленый В, толуидиновый синий, тионин, азур А и не которые другие красители, разведенные растворы которых в уксусной кислоте избирательно окрашивают хроматин. Для количественного гистохимические определения ДНК рекомендуется метод с применением галлоцианин-хромосовых квасцов, который обладает двумя ценными качествами. Галлоцианинхромовые квасцы дают устойчивую окраску, которая не меняется при обезвоживании и просветлении срезов в ксилоле. Окрашивание можно проводить при любом значении рН от 0,8 до 4,3, однако рекомендуется работать при оптимальном значении рН для этого красителя — 1,64, так как при нем происходит максимальное специфическое выявление ДНК. При окрашивании галлопианинхромовыми квасцами ДНК соединяется с красителем в стехиометрическом соотношении, причем отношение краситель: ДНК составляет 1:3,7.
Наиболее распространенной реакцией на ДНК считается реакция Фейльгена. Она проводится после мягкого гидролиза предварительно фиксированной ткани в 1 и. НС1 при 60°, в результате чего от дезоксирибозофосфата отщепляются пурины, а затем и ппрпмпдины, освобождая тем самым реакционноспособные альдегидные группы, которые реактивом Шиффа окрашиваются в красный цвет. Время гидролиза зависит от природы объекта и метода фиксации. Для получения хороших результатов необходимо в каждом отдельном случае время гидролиза подбирать экспериментально.
Для проверки специфичности реакции Фейльгена существует метод ферментативного и кислотного экстрагирования ДНК. Ферментативное расщепление ДНК проводят дезоксирибонукдеазой при концентрации ферментного препарата 2 мг на 100 мл 0,01 М трисбуфера рН 7,6; раствор перед употреблением разводят диетической водой в соотношении 1:5. Рекомендуется инкубировать срезы при 37° в течение 2 час. Другим способом удаления ДНК служит обработка гистохимических препаратов 5% водным раствором трихлоруксуснои кислоты в течение 15 мин. при 90° или 10% горячей (70°) хлорной кислотой в течение 20 мин., после чего реакция Фейльгена должна дать отрицательные результаты.
Заключение
Молекула ДНК – очень длинная двойная цепочка, спирально закрученная вокруг своей продольной оси. Длина ее во многие сотни раз превышает длину цепочки белковой молекулы. Каждая одинарная цепочка представляет собой полимер и состоит из отдельных соединенных между собой мономеров – нуклеотидов. В состав любого нуклеотида входят два постоянных химических компонентов (фосфорная кислота и углевод дезоксирибоза) и один переменный, который может быть представлен одним из четырех азотистых оснований: аденином, гуанином, тимином или цитозином. Поэтому в молекулах ДНК всего четыре разных нуклеотида. Разнообразие же молекул ДНК огромно и достигается благодаря различной последовательности нуклеотидов в цепочке ДНК.
Две цепи ДНК соединены в одну молекулу азотистыми основаниями. При этом аденин соединяется только с тимином, а гуанин – с цитозином. В связи с этим последовательность нуклеотидов в одной цепочке жестко определяет последовательность их и в другой цепочке. Строгое соответствие нуклеотидов друг другу в парных цепочках молекулы ДНК получило название комплементарности. Это свойство лежит в основе образования новых молекул ДНК на базе исходной молекулы.
Редупликация сводится к тому, что под действием специального фермента исходная двойная цепочка молекулы ДНК постепенно распадается на две одинаковые – и тут же к каждой из них по принципу химического сродства (аденин к тимину, гуанин к цитозину) присоединяются свободные нуклеотиды. Так восстанавливается двойная спираль ДНК. Но теперь таких двойных молекул еще две. Поэтому синтез ДНК и получил название редупликации (удвоения): каждая молекула ДНК как бы сама себя удваивает. Роль ДНК заключается в хранении, воспроизведении и передаче из поколения в поколение наследственной информации.
Литература
1. Ашмарин И.П. Молекулярная биология, М., 2004;
2. Бреслер С.Е. Молекулярная биология, СП-Б., 2003,
3. Георгиев Г.П. О структуре единиц транскрипции в клетках эукариотов, Усл. биологического химии, под ред. Б. Н. Степаненко, т. 14, с. 3, М., 2003,
4. Дэвилсон Дж. Биохимия нуклеиновых кислот, пер. с англ., М., 2006:
5. Клеточное ядро, Морфотогия, физиология, биохимия, под ред. И. Б. Збарского и Г. П. Георгиева, М., 2002;
6. Лилли Р. Д. Патологическая техника и практическая гистохимия, пер. с англ., М., 1969,
7. Методы исследования нуклеиновых кислот, пер. с англ., под ред. А. Н. Белозерского, М., 2000;
8. Пирс Э. Гисточимия, пер. с англ., М., 1962:
9. Строение ДНК и положение организмов в системе, под ред. А. Н. Белозерского и А. С. Антонова, М., 2002;
10. Уотсон Дж. Молекулярная биология гена, пер. с англ., М., 1967;
11. Химия и биохимия нуклеиновых кислот, под ред. И. Б. Збарского и С.С. Дебова, Л., 1968;
www.ronl.ru
Реферат - ДНК - материальный носитель наследственности
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ УПРАВЛЕНИЯ
Институт заочного обучения
Специальность: управление персоналом
КУРСОВАЯ РАБОТА
по специальности: КОНЦЕПЦИЯ СОВРЕМЕННОГО ЕСТЕСТВОЗНАНИЯ
на тему: ДНК – МАТЕРИАЛЬНЫЙ НОСИТЕЛЬ НАСЛЕДСТВЕННОСТИ
Выполнена студенткой Максимовой М.И.
Студенческий билет № 1908
Группа № УП 3-1-99/2
Адрес: Москва, ул. Пронская д.3, кв. 160
МОСКВА 2000
СОДЕРЖАНИЕ.
ВВЕДЕНИЕ. | стр. 3 |
| 1. СТРУКТУРА ДНК. | стр. 4 |
2. ХРОМОСОМЫ ЭУКАРИОТ. | стр. 6 |
2.1. Митоз. 2.2. Мейоз. 2.3. Кариотип. | стр. 7 стр. 8 стр. 11 |
3.СЕКРЕТЫ ГЕНЕТИЧЕСКОГО КОДА. 3.1. История доказательства, что ДНК – носитель генетической информации. 3.2. Расшифровка генетической информации. | стр. 13 стр. 14 стр. 15 |
4. КАК ЖЕ РАБОТАЮТ ГЕНЫ? | стр. 17 |
5. ПЕРЕДАЧА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ ОТ РОДИТЕЛЕЙ К ПОТОМКАМ. | стр. 18 |
ЗАКЛЮЧЕНИЕ. | стр. 19 |
СПИСОК ЛИТЕРАТУРЫ | стр. 21 |
ВВЕДЕНИЕ.
Наследуемые признаки заложены в материальных единицах, генах, которые располагаются в хромосомах клеточного ядра. Химическая природа генов известна с 1944 г.: речь идет о дезоксирибонуклеиновой кислоте (ДНК). Физическая структура была выяснена в 1953 г. Двойная спираль этой макромолекулы объясняет механизм наследственной передачи признаков.
Присматриваясь к окружающему нас миру, мы отмечаем великое разнообразие живых существ – от растений до животных. Под этим кажущимся разнообразием в действительности скрывается удивительное единство живых клеток – элементов, из которых собран любой организм и взаимодействием которых определяется его гармоничное существование. С позиции вида сходство между отдельными особями велико, и все-таки не существует двух абсолютно идентичных организмов (не считая однояйцовых близнецов). В конце XIX века в работах Грегора Менделя были сформулированы основные законы, определившие наследственную передачу признаков из поколения в поколение. В начале ХХ века в опытах Т.Моргана было показано, что элементарные наследуемые признаки обусловлены материальными единицами (генами), локализованными в хромосомах, где они располагаются последовательно друг за другом.
В 1944 г. работы Эвери, Мак-Леода и Мак-Карти определили химическую природу генов: они состоят из дезоксирибонуклеиновой кислоты (ДНК). Через 10 лет Дж. Уотсон и Ф. Крик предложили модель физической структуры молекулы ДНК. Длинная молекула образована двойной спиралью, а комплиментарное взаимодействие между двумя нитями этой спирали позволяет понять, каким образом генетическая информация точно копируется (реплицируется) и передается последующим поколениям.
Одновременно с этими открытиями ученые пытались проанализировать и «продукты» генов, т.е. те молекулы, которые синтезируются в клетках под их контролем. Работы Эфрусси, Бидла и Татума накануне второй мировой войны выдвинули идею о том, что гены «продуцируют» белки. Итак, ген хранит информацию для синтеза белка (фермента), необходимого для успешного осуществления в клетке определенной реакции. Но пришлось подождать до 60-х годов, прежде чем был разгадан сложный механизм расшифровки информации, заключенной в ДНК, и ее перевода в форму белка. В конце концов, во многом благодаря трудам Ниренберга (США), был открыт закон соответствия между ДНК и белками – генетический код.
1. СТРУКТУРА ДНК.
Еще в 1869 году швейцарский биохимик Фридрих Мишер обнаружил в ядре клеток соединения с кислотными свойствами и с еще большей молекулярной массой, чем белки. Альтман назвал их нуклеиновыми кислотами, от латинского слова «нуклеус» — ядро. Так же, как и белки, нуклеиновые кислоты являются полимерами. Мономерами их служат нуклеотиды, в связи с чем нуклеиновые кислоты можно еще назвать полинуклеотидами.
Нуклеиновые кислоты были найдены в клетках всех организмов, начиная от простейших и кончая высшими. Самое удивительное, что химический состав, структура и основные свойства этих веществ оказались сходными у разнообразных живых организмов. Но если в построении белков принимают участие около 20 видов аминокислот, то разных нуклеотидов, входящих в состав нуклеиновых кислот, всего четыре.
В живых клетках содержится два типа нуклеиновых кислот – дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Как ДНК, так и РНК несут в себе нуклеотиды, состоящие из трех компонентов: азотистого основания, углевода, остатка фосфорной кислоты. Однако комбинация этих компонентов в ДНК и РНК несколько различны.
Фосфорная кислота в молекулах ДНК и РНК одинакова. Углевод же имеется в двух вариантах: у нуклеотидов ДНК – дезоксирибоза, а у нуклеотидов РНК – рибоза. И рибоза, и дезоксирибоза – пятичленные, пятиуглеродистые соединения – пентозы. У дезоксирибозы, в отличие от рибозы, лишь на один атом кислорода меньше, что и определяет ее название, так как дезоксирибоза в переводе с латинского означает лишенная кислорода рибоза. Строгая локализация дезоксирибозы в ДНК, а рибозы в РНК, как раз и определяет название этих двух видов нуклеиновых кислот.
Третий компонент нуклеотидов ДНК и РНК – азотистые соединения, то есть вещества, содержащие азот и обладающие щелочными свойствами. В нуклеиновые кислоты входят две группы азотистых оснований. Одни из них относятся к группе пиримидинов, основу строения которых составляет шестичленное кольцо, а другие к группе пуринов, у которых к пиримидинову кольцу присоединено еще и пятичленное кольцо.
В состав молекул ДНК и РНК входят два разных пурина и два разных пиримидина. В ДНК имеются пурины – аденин, гуанин и пиримидины – цитозин, тимин. В молекулах РНК те же самые пурины, но из пиримидинов – цитозин и вместо тимина – урацил. В зависимости от содержания того или иного азотистого основания нуклеотиды называются адениловыми, тимиловыми, цитозиловыми, урациловыми, гуаниловыми.
Как же соединяются между собой нуклеотиды в длинные полинуклеотидные цепи? Оказывается, что такое соединение осуществляется путем установления связи между остатком молекулы фосфорной кислоты одного нуклеотида и углеводом другого. Образуется сахаро-фосфорный скелет молекулы полинуклеотида, к которому сбоку один за другим присоединяются азотистые основания.
Если учесть, что в каждой нуклеиновой кислоте по четыре вида азотистых оснований, то можно представить себе множество способов расположения их в цепи, подобно тому, как можно в самой разной последовательности нанизать на нитку бусинки четырех цветов – красные, белые, желтые. Зеленые. Последовательность расположения нуклеотидов в цепях молекул нуклеиновых кислот так же, как и аминокислот в молекулах белков, строго специфична для клеток разных организмов, то есть носит видовой характер.
ДНК представляет свою двойную спираль.
Полинуклеидные цепи достигают гигантских размеров. Вполне понятно, что в связи с этим они так же, как и белки, определенным образом упакованы в клетке.
Модель структуры молекулы ДНК впервые создали биохимики из Кембриджского университета в Англии Джеймс Уотсон и Френсис Крик. Было показано, что молекула ДНК состоит из двух полинуклеотидных цепей, закрученных одна вокруг другой, с образованием двойной спирали. Причем контакты существуют между обеими полинуклеотидными цепями, точнее, между пурином одного нуклеотида и пиримидином другого. Так что внешне молекулу ДНК можно представить как своего рода перекрученную веревочную лестницу.
Образование связей в молекуле ДНК – процесс строго закономерный. Адениловый нуклеотид может образовывать связи лишь с тимиловым, а гуаниловый только с цитозиловым. Эта закономерность получила название принципа комплиментарности, то есть дополнительности. В самом деле, такая строгая последовательность в выборе пары наводит на мысль, что в двойной молекуле ДНК аденин как бы дополняет тимин и наоборот, а гуанин соответственно – цитозин, как две половинки разбитого зеркала.
Принцип комплиментарности позволяет понять механизм уникального свойства молекул ДНК – их способность самовоспроизводиться. ДНК – это единственное вещество в живых клетках, обладающее подобным свойством. Процесс самовоспроизведения молекул ДНК происходит при активном участии ферментов. Особые расплетающие белки последовательно как бы проходят вдоль системы водородных связей, соединяющих азотистые основания обеих полинуклеотидных цепей, и разрывают их. Образовавшиеся в результате одиночные полинуклеотидные цепи ДНК достраиваются согласно принципу комплиментарности с помощью фермента за счет свободных нуклеотидов, всегда находящихся в цитоплазме и ядре. Напротив гуанилового нуклеотида становится свободный цитозиловый нуклеотид, а напротив цитозилового, в свою очередь, гуаниловый и так далее. Во вновь образовавшейся цепи возникают углеводно-фосфатные и водородные связи. Таким образом, в ходе самовоспроизведения ДНК из одной молекулы синтезируются две новые.
ДНК в клетке локализована в основном в ядре, в его структурных компонентах – хромосомах.
2. ХРОМОСОМЫ ЭУКАРИОТ.
В 80-х годах прошлого столетия в ядрах эукариотических клеток были открыты нитевидные структуры (В. Флемминг, Э. Страсбургер, Э. Ван Бенеден), названные В. Вальдейером (1888 г.) хромосомами (от греч. chroma – цвет, окраска, soma – тело). Этим термином было подчеркнуто сильное сходство хромосом по сравнению с другими клеточными органеллами к основным красителям. В течение последующих 10 – 15 лет большинством биологов было подтверждено, что именно хромосомы служат материальным носителем наследственности.
Хромосомы особенно четко видны во время делений клеток, однако факт непрерывности их существования и в неделящихся ядрах сомнений не вызывает. Основная особенность функциональных превращений хромосом состоит в цикле компактизации – декомпактизации. В компактизованном состоянии хромосомы представляют собой короткие толстые нити, видимые в световой микроскоп. В результате декомпактизации хромосомная нить становится невидимой в световой микроскоп, поэтому ядра многих живых клеток выглядят оптически пустыми. Превращения хромосом строго зависят от фаз клеточного цикла, поэтому их особенности могут рассматриваться только применительно к той или иной фазе цикла. Промежуток времени между окончанием одного клеточного деления – митоза и окончанием последующего называется митотическим циклом (рис. 1). Таким образом, митотический цикл включает митоз и промежуток между митозами – интерфазу. Интерфаза состоит из трех периодов: центрального – фазы синтеза ДНК (S), когда генетический материал удваивается, а также предсинтетического (G1) и постсинтетического (G2), после которого клетка вступает в митоз (М). После фазы синтеза ДНК в G2-периоде и в митозе, вплоть до анафазы, в хромосоме обнаруживаются две нити, называемые сестринскими хроматидами (рис. 2).
Рис.1. Схематическое изображение рис.2. Основные элементы мито-
митотического цикла тических хромосом, состо-
эукариотических клеток ящих из двух хроматид:
1-короткое плечо, 2-центромера, 3-длинное плечо
Основной химический компонент хромосом – молекулы ДНК. Содержание ее в ядрах соматических клеток в два раза больше, чем в ядрах зрелых половых клеток. Эти два типа клеток отличаются друг от друга и по числу хромосом. Число хромосом – п в соматических клетках и количество ДНК – с (от англ. content – содержание) в них обозначают как диплоидное (2п хромосом, 2с ДНК), а в зрелых половых клетках как гаплоидное (п хромосом,с ДНК). После фазы синтеза ДНК в соматических клетках число хромосом не изменяется (2п ), однако каждая из них содержит две сестринские хроматиды, т.е. идентичные молекулы ДНК, поэтому содержание ДНК в ядрах G2-фазы 4 с.
2.1.Митоз.
Митоз, или непрямое деление, — основной способ размножения эукариотических клеток, обусловливающий, в частности, возможность увеличения их биомассы, рост и регенерацию. Митоз состоит из четырех фаз (рис. 3).
Рис.3. Схематическое изображение основных процессов в животной клетке во время митоза. Клетка содержит четыре хромосомы:
1-интерфаза, 2-ранняя профаза, 3-средняя профаза, 4-поздняя профаза, 5-метафаза, 6-ранняя анафаза, 7-анафаза, 8-ранняя телофаза, 9-поздняя телофаза, 10-дочерние клетки.
Первая – профаза – характеризуется началом цикла компактизации хромосом, который продолжается в течение всей этой фазы. Вследствие этого хромосомы становятся видимыми под микроскопом, причем уже в средней профазе митоза они представляются двойными структурами – сестринскими хроматидами, закрученными одна вокруг другой. К концу профазы исчезают ядрышко и ядерная мембрана.
Вторая –метафаза. Процесс компактизации хромосом продолжается и ведет к еще большему укорочению их длины. Хромосомы выстраиваются по экватору клетки. Хроматиды соединены между собой между собой в центромере, называемой также первичной перетяжкой. Появляются нити митотического веретена, которые присоединяются к ценромерам. Каждая ценромера испытывает напряжение, поскольку нити веретена тянут ее к противоположным полюсам.
Полюса клетки формируются специальными органеллами – центросомами.
Третья – анафаза – начинается с разрыва ценромеры, в результате чего сестринские хроматиды расходятся к разным полюсам клетки. С этого момента каждая пара сестринских хроматид получает название дочерних хромосом.
Четвертая – телофаза. Хромосомы достигают полюсов клетки, появляются ядерная мембрана, ядрышко. Происходят декомпактизация хромосом и восстановление структуры интерфазного ядра. Заканчивается митоз делением цитоплазмы и в типичных случаях – восстановлением исходной биомассы дочерних клеток.
Биологическая роль митоза состоит в обеспечении идентичной генетической информацией двух дочерних клеток. Это достижимо только благодаря циклу компактизации – декомпактизации, который и позволяет распределить наследственные молекулы в минимальном объеме митотических хромосом. В противном случае, учитывая размеры клетки (десятки или сотни кубических микрометров) и длину декомпактизованной хромосомы (сантиметры), каждое клеточное деление сопровождалось бы хаотичным переплетением хромосомного материала.
В эволюции эукариотических клеток, видимо, это обстоятельство и послужило причиной становления столь сложного генетического процесса, как митоз.
2.2. Мейоз.
Термином «мейоз» обозначают два следующих друг за другом деления, в результате которых из диплоидных клеток образуются гаплоидные половые клетки – гаметы (рис. 4) Если бы оплодотворение происходило диплоидными гаметами, то плоидность потомков в каждом следующем поколении должна была бы возрастать в геометрической прогрессии. В то же время благодаря мейозу зрелые гаметы всегда гаплоидны, что позволяет сохранять диплоидность соматических клеток вида. Возможность существования подобного мейозу деления при созревании гамет животных и растений была предсказана А. Вейсманом еще в 1887 г. Мейотические деления не эквивалентны митозу. Обоим мейотическим делениям предшествует только одна фаза синтеза ДНК. Продолжительность ее, как и профазы I деления мейоза, во много раз превосходит соответствующие показатели митотического цикла любых соматических клеток данного вида. Главные события мейоза развертываются в профазе I деления. Она состоит из пяти стадий.
Рис.4. Схематическое изображение основных процессов в мейозе (сперматогенезе). В клетке четыре хромосомы (черные – отцовские, светлые – материнские):
1-предмейотическая интерфаза, 2-лептотена, 3-зиготена, 4-пахитена, 5-диплотена, 6-диакинез, 7-метафаза I , профаза II , 9-метафаза II , 10-анафаза II , 11-телофаза II
В первой стадии – лептотене, следующей непосредственно за окончанием предмейотического синтеза ДНК, выявляются тонкие длинные хромосомы. Они отличаются от в профазе митоза двумя особенностями: во-первых, в них не обнаруживается двойственность, т.е. не видно сестринских хроматид, во-вторых, лептотенные хромосомы имеют выраженное хромомерное строение. Хромомеры – узелки. Участки плотной компактизации ДНК, размеры и расположение которых строго видоспецифично. Хромомеры встречаются как в мейотических, так и в митотических хромосомах, однако в последних без специфической обработки они не видны.
Во второй стадии профазы I деления – зиготене – происходит тесное сближение по всей длине (конъюгация) гомологичных хромосом. Гомологичными называются хромосомы, имеющие одинаковую форму и размер, но одна из них получена от матери, другая – от отца. Гаплоидный набор равен числу пар гомологов. Конъюгация гомологичных хромосом происходит по принципу действия застежки-молнии. По окончании конъюгации число хромосом как бы уменьшается вдвое. Каждый элемент, состоящий из двух гомологов, называют бивалентом или тетрадой. Последний термин подчеркивает, что бивалент содержит четыре хроматиды, образующиеся в ходе предмейотического синтеза ДНК.
Третья стадия профазы I деления – пахитена – у большинства видов самая длительная. Под световым микроскопом видны конъюгировавшие хромосомы с более или менее четко выраженным хромомерным строением. Приблизительно в середине пахитены между хроматидами гомологичных хромосом появляется продольная щель, которая ясно показывает, что бивалент – это, по существу, четверная хромосомная структура. В пахитене происходит важное генетическое событие – кроссинговер, или перекрест хроматид гомологичных хромосом. В результате этого в каждом гомологе смешиваются отцовский и материнский наследственный материал(см. рис. 4)
Результаты кроссинговера становятся заметными лишь в четвертой и пятой стадиях профазы I деления – диплотене и диакинезе. Диплотена начинается с момента расхождения гомологичных хромосом. В это время в точках кроссинговера видны перекрещенные хроматиды. Область перекреста хроматид называют хиазмой. Число хиазм в целом соответствует количеству актов кроссинговера в биваленте и пропорционально длине гомологичных хромосом, его составляющих. Для диплотены и диакинеза характерно прогрессирующее укорочение хромосом в результате компактизации; поэтому хиазмы постепенно терминализуются, т.е. приближаются к концам бивалента и спадают с него. Таким образом, по мере приближения к метафазе первого деления число хиазм уменьшается.
В метафазе I деления мейоза район центромеры каждой хромосомы соединен (в отличие от метафазы митоза) нитью веретена только с одним полюсом клетки, причем центромеры разошедшихся гомологов всегда связаны с противоположными полюсами. Анафазе I деления мейоза не предшествует расщепление центромеры, как при митозе, и поэтому к полюсам отходят не хроматиды, а целые хромосомы, состоящие из двух хроматид. Однако, поскольку гомологичные хромосомы расходятся к разным полюсам, первое мейотическое деление приводит к редукции числа хромосом. Другими словами, по числу хромосом продукты I деления мейоза становятся гаплоидными. Однако в связи с тем, что хромосомы в них сохраняют двойственность, т.е. содержат две хроматиды, количество ДНК уменьшается лишь до 2с.
Второе деление мейоза, следующее после краткого промежутка – интеркинеза, приводит в соответствие число хромосом и содержание ДНК. Формально оно напоминает митоз (рис.4). В начале анафазы происходит разделение центромеры, сестринские хроматиды становятся дочерними хромосомами и расходятся к полюсам. Таким образом, каждая из четырех клеток, образовавшихся вследствие двух мейотических делений одной клетки, прошедшей предмейотическую S-фазу, будет содержать п хромосом и с ДНК.
Итак, главное отличие мейоза от митоза – конъюгация гомологичных хромосом с последующим расхождением их в разные гаметы. Точность расхождения обусловлена точностью конъюгации, а последняя – идентичностью молекулярной структуры ДНК гомологов.
В заключение отметим, что цитологами доказано независимое расхождение негомологичных хромосом в профазе I деления мейоза. Это означает, что любая отцовская хромосома может попасть в гамету с любой, в крайнем варианте – со всеми материнскими негомологичными хромосомами. Однако если речь идет о дочерних хромосомах (во II делении мейоза), образовавшихся из перекрещенных, т.е. претерпевших кроссинговер, или кроссоверных хроматид (рис.4), то их, строго говоря, нельзя рассматривать ни как чисто отцовские, ни как чисто материнские.
2.3 Кариотип.
Кариотипом называется хромосомный комплекс вида со всеми его особенностями: числом хромосом, их формой, наличием видимых под световым микроскопом деталей строения отдельных хромосом. Иногда термин «кариотип» употребляют по отношению к хромосомному набору единичной клетки или группы тканевых клеток.
О некоторых элементах кариотипа – гомологах – уже упоминалось. Группируя их попарно, можно по микрофотографии профазных или метафазных хромосом, после специальной предфиксационной обработки клеток, построить идиограмму, т.е. расположить хромосомы в порядке уменьшения их длины. Еще недавно попарная группировка хромосом, особенно видов с 10 хромосомами и более, была затруднена вследствие их сходства по размерам и морфологии при равномерной окраске. В начале 70-х годов были разработаны методы дифференциальной окраски, которые позволили выявить в каждой хромосоме любого вида специфическое чередование различно окрашенных (светлых и темных) полос. В принципе, гомологичные хромосомы имеют одинаковую картину дифференциальной окрашиваемости. Специфичность поперечной исчерченности хромосом заключается в числе и размерах этих полос.
Среди методов выявления полос наиболее распространены С-метод и G-метод. В обоих случаях в качестве красителя используют реактив Гимза, а различия в расположении полос проявляются вследствие особенностей предфиксационной обработки.
В составе хромосом в виде темных полос С-метод позволяет выявить гетерохроматические районы, т.е. участки, которые в ядрах интерфазных клеток остаются компактными и под микроскопом выглядят как плотно окрашенные глыбки. Темные С-полосы располагаются чаще всего в прицентромерных участках хромосом, что указывает на внутрихромосомное распределение гетерохроматических районов.
Гетерохроматические районы в функциональном отношении слабоактивны. Различают конститутивный (истинный) и факультативный гетерохроматин. Первый имеет специфичную структуру и постоянно находится в идентичных участках гомологичных хромосом: в прицентромерных районах и возле уплотнений на концах плеч – так называемых теломеров, реже в других, характерных для каждой хромосомы местах. Второй появляется лишь в определенные периоды жизни клетки либо содержится в хромосомах клеток некоторых тканей. Факультативный гетерохроматин – это целые хромосомы или эухроматические районы хромосом, находящиеся в состоянии компактизации, подобно конструктивному гетерохроматину, и вследствие этого почти лишенные генетической активности. Из двух гомологичных хромосом такой хроматин, как правило, содержит лишь одна.
Неокрашенные С-методом участки хромосом (светлые полосы) соответствуют эухроматическим районам, составляющим у большинства видов 80-90% всего генетического материала клетки. В отличие от гетерохроматических эухроматические районы декомпактизуются в телофазе митоза.
Природа G-окрашенных полос пока не ясна, однако регулярность их расположения в хромосомах и их видоспецифичность дают основание полагать, что G-полосы отражают строго определенные черты хромосомной организации. Чем длиннее одни и те же хромосомы, например в профазе по сравнению с метафазой, тем больше полос можно идентифицировать методами дифференциального окрашивания. Это обстоятельство имеет значение для медицинской цитогенетики; с ним связана точность картирования малых хромосомных перестроек, обусловливающих некоторые наследственные болезни.
Как отмечалось ранее, каждая хромосома имеет центромеру, или первичную перетяжку, — место прикрепления нитей веретена. Иногда наблюдаются вторичные перетяжки, не связанные с функциями митотических движений хромосом. Первая перетяжка делит хромосомы на плечи. ЕЕ положение в середине, близко к середине или почти у концевых участков хромосомы, называемых теломерами, позволяет классифицировать хромосомы на метацентрические, субметацинтрические и акроцентрические соответственно. У некоторых хромосом во всех или в большинстве клеток бывают видны спутники – небольшие, как правило, специфические фрагменты тела хромосомы, соединенные с теломерами участком декомпактизованной ДНК – спутничной нитью.
Число хромосом видоспецифично. Хотя закономерности, характеризующие кариотип, иногда и отражают эволюцию определенных видов, в целом по структуре кариотипа прямо судить о систематическом положении вида нельзя.
У большинства высших животных и растений одна пара хромосом у особей одного из полов гетероморфна. Эти непохожие хромосомы называются половыми. В частности, у млекопитающих и у дрозофилы клетки мужских организмов имеют Х- и Y-хромосомы. У многих видов Y-хромосома отсутствует. Все остальные хромосомы называются аутосомами.
Таким образом, благодаря исследованиям цитологов в конце XIX – начале ХХ в. была обоснована роль ядра в наследственности, а наблюдения за поведением хромосом в митозе и мейозе привели к заключению, что именно с ними связана передача наследственных признаков.
3. СЕКРЕТЫ ГЕНЕТИЧЕСКОГО КОДА.
В организме каждого человека – своя наследственная конституция, характерная лишь для него. Именно с этим связана тканевая несовместимость, проявляющаяся, в частности, при пересадке органов и тканей от одного организма другому. «Чужая» кожа, например, со своими особенными молекулами вступает в нежелательные реакции с организмом «хозяина». Она вызывает появление белков – антител – и в результате не «приживается». Аналогичное явление наблюдается и при пересадке отдельных органов.
По-иному проходят эти процессы у однояйцевых близнецов, которые развиваются из двух клеток, образовавшихся из одной оплодотворенной яйцеклетки – зиготы. Такие близнецы всегда однополы и внешне поразительно похожи друг на друга. У однояйцевых близнецов пересадка тканей и органов вполне возможна, никакого отторжения их не происходит. Иначе и быть не может. Один и тот же комплекс всех наследственных факторов не провоцирует появления антител в их организмах.
Эти и многие другие факты показали, что программирование синтеза белков – главное свойство ДНК. Однако, прежде чем прийти к такому заключению, необходимо было доказать, что именно ДНК – носитель генетической информации. Первое подтверждение тому было получено при изучении явлений трансформации.
3.1. История доказательства, что ДНК – носитель генетической информации.
Явление это было открыто в опытах с пневмококками, то есть с бактериями, вызывающими воспаление легких. Известны две формы
пневмококков: А-форма с полисахаридной капсулой и Б-форма без капсулы. Оба эти признака наследственны.
Пневмококки А-формы при заражении ими мышей вызывают воспаление легких, от которого мыши погибают. Б-форма для них безвредна.
В 1928 году английский бактериолог Ф.Гриффитс заражал мышей смесью, состоящей из убитых нагреванием пневмококков А-формы и живых пневмококков Б-формы. Ученый предполагал, что мыши не заболеют. Но вопреки ожиданиям подопытные животные погибли. Ф. Гриффитсу удалось выделить из тканей погибших мышей пневмококки. Все они оказались капсулированными, то есть А-формы. Следовательно, убитая форма каким-то образом передавала свои свойства живым клеткам Б-формы. Но как? С помощью какого именно вещества: полисахарида, из которого состоит капсула, белка или ДНК?
От решения этого вопроса зависело многое, так как, установив вещество, передающее наследственный признак – образование капсулы, можно было получить нужный ответ. Однако сделать это не удавалось довольно долго. Лишь спустя 16 лет после опытов Ф. Гриффитса, в 1944 году, американский ученый А. Эвери с сотрудниками, поставив ряд четких экспериментов, сумел с полным обоснованием доказать, что полисахарид и белок не имеют никакого отношения к передаче наследственных свойств пневмококка А-формы.
В процессе этих экспериментов с помощью специального фермента растворили полисахаридную капсулу убитых пневмококков А-формы и проверили, продолжают ли остатки клетки формы А передавать наследственную информацию клеткам формы Б. Оказалось, что продолжают. Стало ясно, что полисахарид как источник генетической информации отпадает.
Далее ученые при помощи других ферментов удалили из остатков пневмококков А белки и снова проверили их действие. Передача наследственной информации от А к Б продолжалась. Следовательно, и белок ни при чем.
Таким образом, методом исключения было установлено, что наследственную информацию в клетке хранит и передает молекула ДНК. И действительно, когда разрушили ДНК, образование капсульных форм А из бескапсульных Б прекратилась.
Явление преобразования, то есть наследственного изменения свойств одной формы бактерий под воздействием веществ другой формы, было названо трансформацией. Вещество же, вызывающее трансформацию, получило название трансформирующего агента. Им, как было установлено, служит ДНК.
3.2. Расшифровка генетической информации.
Полимерные цепи белков состоят из мономерных звеньев – аминокислот и последовательность расположения их в белковой молекуле строго специфична. В связи с этим очевидно, Что в ДНК должна храниться информация не только о качественном и количественном составе аминокислот в молекуле данного белка, но и о последовательности их расположения. Соответственно каким-то образом должны быть закодированы в полинуклеотидной цепи ДНК каждая аминокислота и белок в целом.
Зная, что аминокислот всего 20, а нуклеотидов – 4, легко представить себе, что 4 нуклеотидов явно недостаточно для кодирования 20 аминокислот. Недостаточно также и кода из двух нуклеотидов на каждую кислоту (4 = 16). Для кодирования 20 аминокислот необходимы группы по меньшей мере из трех нуклеотидов (4 = 64). Подобная группа, несущая информацию об одной аминокислоте в молекуле белка, называется кодоном. Весь же участок ДНК, ответственный за синтез одной молекулы белка, в целом как раз и есть ген. Значит, в гене столько кодонов, сколько аминокислот входит в состав данного синтезируемого белка.
Синтез белков происходит на рибосомах. ДНК же локализована в ядре, в его хромосомах. Возникает вопрос: каким образом генетическая информация из ядра переносится в цитоплазму на рибосому? Предположить, что ДНК сама поступает через поры ядерной мембраны, нельзя: Ведь ДНК ядер обладает огромной молекулярной массой и в связи с этим просто не может проникнуть через крошечные поры ядерной мембраны. Поэтому должны быть какие-то более мелкие молекулы – посредники, передающие генетическую информацию от ДНК к белкам. А.Н. Белозерский и А.Г. Спирин выдвинули соображение, что эту роль играют молекулы РНК.
Но сразу же возникает другой вопрос: как копируется информация с ДНК на более короткие молекулы РНК? Чтобы ответить на него, надо вспомнить, что в строении нуклеотида ДНК и РНК много общего. В частности, из-за сходства азотистых оснований информация с ДНК на РНК может переноситься по принципу комплиментарности, согласно которому образовывать пары могут не только нуклеотиды в системе ДНК-ДНК, но и нуклеотиды в системе ДНК-РНК.
Поскольку РНК так же, как и ДНК, содержит пуриновые и пиримидиновые основания, на участках одной их цепей ДНК при помощи фермента РНК – полимеразы строятся комплиментарные короткие цепи РНК. Этот процесс синтеза РНК на матрице ДНК, происходящий с помощью ферментов, носит название транскрипции. В результате процесса транскрипции закодированная в ДНК последовательность нуклеотидов, которая и представляет собой определенную генетическую информацию, передается на РНК. Транскрипция происходит на отдельных участках ДНК – генах, каждый из которых содержит набор кодонов, программирующих последовательности аминокислот в данной молекуле белка.
Рибонуклеиновая кислота, на которой сделана копия ДНК, состоит из одной цепи нуклеотидов, у которых дезоксирибоза заменена на рибозу., а тимин (Т) заменен на урацил (У).
Таким образом, в каждом кодоне ДНК транскрибируется в комплиментарный кодон РНК. В результате получается как бы негатив РНК с позитива – ДНК. Эта РНК, снимающая информацию с ДНК, называется информационной РНК (и-РНК).
К настоящему времени ученым удалось расшифровать кодоны для всех аминокислот. Оказалось, что одной аминокислоте зачастую соответствует несколько кодонов. Такой код называется вырожденным. Наряду с этим обнаружилось, что некоторые кодоны не кодируют ни одну аминокислоту. Их называют бессмысленными. Бессмысленные кодоны имеют очень важное значение, так как определяют границы начала и конца транскрипции, то есть границы генов в данной молекуле ДНК.
Если у прокариот гены по своей записи непрерывны, то у эукариот это далеко не так. Информация необходимая для синтеза белка, оказывается записанной с пропусками, прерывисто: гены составлены из кодирующих участков (экзонов), разделенных некодирующими последовательностями (интронами). При транскрипции таких генов интроны копируются вместе с экзонами в общую молекулу пре-мРНК. Последняя подвергается в ядре серии реакций, в ходе которых интроны вырезаются, а экзоны соединяются друг с другом своими краями. Получившаяся молекула м-РНК покидает ядро и оказывается уже во власти системы трансляции, дешифрующей нуклеотидную последовательность. Соединение аминокислот с образованием белка происходит в цитоплазме на особых частицах-рибосомах. Все это можно сравнить с фабрикой (клетка), в которой чертежи (гены) хранятся в библиотеке (ядро), а для выпуска продукции (белки) используются не сами чертежи (ДНК), а их фотокопия (мРНК). Копировальная машина (РНК-полимераза) выпускает или по одной страничке фотокопии (ген), или сразу целую главу (оперон). Изготовленные копии выдаются через специальные окошки (поры ядерной мембраны). Их затем используют на монтажных линиях (рибосомы) с дешифратором (генетический код) для получения из заготовок (аминокислот) окончательной продукции (белки).
Как же происходит сам процесс синтеза белка?
Первый его этап связан с функционированием транспортной РНК (т-РНК). Число разновидностей этих молекул РНК равно числу основных аминокислот, то есть их 20 видов. Каждой аминокислоте соответствует определенная т-РНК и определенный фермент.
В цитоплазме клетки всегда в достаточном количестве имеются разные аминокислоты. Из них молекула т-РНК отбирает соответствующую аминокислоту. Каждая аминокислота, прежде чем вступить в белковую цепь, с помощью специального фермента соединяется с АТФ и запасается энергией. «Подзарядившись» таким образом аминокислота связывается с т-РНК, которая переносит ее к рибосомам. Характерной чертой молекул т-РНК является наличие в их структурах антикодонов. Эта особенность обеспечивается расположением соответствующих аминокислот в той последовательности кодонов, которая зашифрована в молекуле и-РНК. Между рядом расположенными аминокислотами возникают пептидные связи и синтезируется молекула белка.
Таким образом, генетическая информация, заключенная в ДНК, реализуется разными видами РНК в молекулах соответствующих белков.
Процесс передачи программы, принесенной с собою молекулами и-РНК, получил название трансляции.
4. КАК ЖЕ РАБОТАЮТ ГЕНЫ?
Биосинтез белков, протекающий под генетическим контролем, — это только начало сложных, многоступенчатых биохимических процессов клетки.
При изучении вегетативно размножающихся растений получены доказательства того, что отдельные части организма, такие как клубень, лист, луковица, черенок и так далее, дают начало нормальному растению. А это значит, что все клетки данного организма несут полную генетическую информацию, так же как и исходная оплодотворенная яйцеклетка, из которой развивается животное. Вместе с тем в любом организме содержатся дифференцированные клетки с определенной формой и функцией. Например, у человека есть клетки нервные, мышечные, половые и т.д. Но, несмотря на то, что каждая клетка нашего тела несет полную генетическую информацию, то есть полный набор генов, полученных от родителей, функционируют лишь определенные гены, остальные находятся в неактивном состоянии. Каким же образом в клетке регулируется деятельность тех или иных генов?
Во всех процессах жизнедеятельности клетки роль биологических катализаторов играют ферменты. Без их участия не протекает практически ни одна химическая реакция синтеза или распада веществ. В каждой клетке (с ее характерными функциями) должны находиться регуляторные механизмы, контролирующие не только качественный состав ферментов, но и их количество. В противном случае беспрерывно синтезируемые макромолекулы белков накапливались бы в клетке ненужным балластом, загромождая ее.
И действительно, подобный регуляторный механизм был обнаружен в клетках бактерий в 1961 году французскими учеными Франсуа Жакобом и Жаком Моно.
Что же это за механизм?
Ф. Жакоб и Ж. Моно доказали, что не все гены бактерий одинаковы по своему назначению. Одна группа – структурные гены, выдающие информацию о синтезе определенных полипептидных цепей, другая – регуляторные гены, ведающие активностью структурных генов путем их «включения» и «выключения».
Регуляторные гены представлены геном-оператором, непосредственно сцепленным с группой структурных генов, и геном-регулятором, который может находиться в некотором отдалении от них.
Ген-оператор с группой регулируемых им структурных генов был назван опероном. Оперон служит единицей транскрипции, то есть с него списывается одна молекула и-РНК.
Ген регулятор действует не путем непосредственного контакта со структурными генами, а при помощи белка репрессора.
При наличии достаточно накопившихся молекул синтезируемого вещества белок-репрессор, соединяясь с этими молекулами, активизируется и связывается с геном-оператором. В результате синтез данного вещества прекращается. Свое название белок-репрессор получил из-за того, что подавляет деятельность гена-оператора, то есть ставит его в положение «выключено».
При малом количестве синтезируемых молекул белок-репрессор остается неактивным. В таких условиях действие оперона – гена-оператора и структурных генов – не подавляется, и синтез будет продолжаться беспрепятственно.
5. ПЕРЕДАЧА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ ОТ РОДИТЕЛЕЙ К ПОТОМКАМ.
Как известно, особенности, характеризующие потомков, передаются им от родителей через половые клетки: мужскую – сперматозоид и женскую – яйцеклетку. Слияние их при оплодотворении приводит к образованию единой клетки зиготы, из которой развивается зародыш человека. Очевидно, что именно в этих двух половых клетках и в образовавшейся при их слиянии зиготе хранится наследственная информация о физических, биохимических и физиологических свойствах, с которыми появляется новый человек.
Материальной основой наследственности служат нуклеиновые кислоты, а именно ДНК. Но каким же образом генетическая информация передается от родителей к потомству? Как известно, новые клетки появляются в результате деления исходных материнских.
Для большинства клеток характерно физиологически полноценное клеточное деление, состоящее из ряда фаз, во время которых ядро претерпевает закономерные изменения, в результате чего образуются два ядра, совершенно идентичные исходному. Цитоплазма при этом делится на две полвины. Такое сложное деление получило название митоза, и характерно оно для клеток тела, то есть соматических клеток. (Подробнее см. п.2, п/п 2.1)
Однако, в организмах растений, животных и человека, помимо соматических, имеются и половые клетки. Их образование происходит в результате особого деления. Преобразование же, которое вызывается этим делением, получило название мейоза. (Подробнее см. п.2, п/п 2.2)
Во время и митоза, и мейоза ядро теряет округлые очертания и в нем отчетливо вырисовываются его структурные компоненты, называемые хромосомами. Хромосомы имеют самые различные формы: палочек, коротких стерженьков, капель и т.д. (Подробнее см. п.2)
ЗАКЛЮЧЕНИЕ.
Изучение генетики человека, несмотря на всю сложность, важно не только с точки зрения науки. Трудно переоценить и прикладное значение проводимых исследований.
Достижения в этой области оказывают заметное влияние на другие отрасли наук о человеке – медицину, психиатрию, психологию, педагогику.
В частности, велика роль развивающейся генетики человека в решении проблем наследственных болезней. Современные данные свидетельствуют, что человеком наследуются многие болезни, такие, как несвертываемость крови, цветовая слепота, ряд психических заболеваний. Кроме того, генетика человека призвана решать и другие вопросы.
Значение развития генетики человека очевидно. Можно с полной уверенностью сказать, что, например, в молекулах ДНК клеток человека запрограммирована генетическая информация, контролирующая каждый миг нашей жизни. Это касается здоровья, нормального развития, продолжительности жизни, наследственных болезней, сердечно-сосудистых заболеваний, злокачественных опухолей, предрасположенности к тем или иным инфе6кционным заболеваниям, старости и даже смерти.
Если выделить из ядра одной клетки человека все генетические молекулы ДНК и расположить их в линию одна за другой, то общая длина этой линии составит семь с половиной сантиметров. Такова биохимическая рабочая поверхность хромосом. Это сконцентрированное в молекулярной записи наследие веков прошедшей эволюции.
Правильно и образно сказал об этом в свое время в романе «Лезвие бритвы» писатель Иван Ефремов: «Наследственная память человеческого организма – результат жизненного опыта неисчислимых поколений, от рыбьих наших предков до человека, от палеозойской эры до наших дней. Эта инстинктивная память клеток и организма в целом есть тот автопилот, который автоматически ведет нас через все проявления жизни, борясь с болезнями, заставляя действовать сложнейшие автоматические системы нервной, химической, электрической и невесть какой еще регулировки. Чем больше мы узнаем биологию человека, тем более сложные системы мы в ней открываем».
Исследования последних лет доказали, что любая живая клетка, в том числе и клетка человеческого организма, представляет собой целостную систему, все составные элементы которой обнаруживают тесное взаимодействие между собой и окружающей средой, оказывающей на гены огромное влияние. Поэтому различают два понятия: генотип – комплекс всех наследственных фактов – генов, получаемых потомками от родителей, и фенотип – совокупность признаков, возникающих при взаимодействии генотипа и внешней среды.
Следовательно, в формировании фенотипа важны как генотип, так и внешняя среда, в которой происходит развитие особи. Без этого взаимодействия невозможна была бы жизнь, связанная с реализацией генетической информации, заключенной в нуклеиновых кислотах.
Закономерности генетики в большинстве случаев носят универсальный характер. Они одинаково важны для растений, для животных. Велико их значение и для человека.
СПИСОК ЛИТЕРАТУРЫ.
1. ГЕНЕТИКА И НАСЛЕДСТВЕННОСТЬ. Сборник статей. Г.34. Пер. с франц. М.: Мир. 1987 г.
2. ОБЩАЯ ГЕНЕТИКА. Алихонян С. И. И др. М.: Высшая школа. 1985 г.
3. ГЕНЕТИКА ВЧЕРА, СЕГОДНЯ И ЗАВТРА. Дубинин Н.П. М.: Советская Россия. 1981 г.
4. БИОЛОГИЧЕСКИЙ ЭНЦЕКЛОПЕДИЧЕСКИЙ СЛОВАРЬ.
5. БОТАНИКА: Морфология и анатомия растений. Васильев А.Е. М.: Просвещение. 1988 г.
www.ronl.ru
Структура ДНК (дезоксирибонуклеиновой кислоты) | Биохимия. Реферат, доклад, сообщение, кратко, презентация, лекция, шпаргалка, конспект, ГДЗ, тест
Дезоксирибонуклеиновая кислота (ДНК) — это важнейшее вещество в живой клетке, так как несёт в себе систему генетической информации, закодированную в последовательности азотистых оснований.
Дезоксирибонуклеиновая кислота является наиболее высокомолекулярным соединением из всех известных в природе. В клетках эукариот основная масса молекул ДНК находится в ядре в составе хромосом и имеет линейную форму, а часть молекул ДНК имеет форму кольца и содержится в митохондриях и пластидах. В прокариотных клетках ДНК организована в единственную хромосому и имеет форму кольца. У животных в цепях ДНК нуклеотиды могут содержаться в количестве 107—108. Будучи вытянутой в прямую линию, молекула ДНК может достигать 1 см. В ядре ДНК всегда связана с белками четвертичной структуры — гистонами. Такая совместная структура (нуклеопротеид) представляет собой хроматин.
У всех живых существ молекулы ДНК построены по одному и тому же типу. Они состоят из двух полинуклеотидных цепочек. Объединяются две цепи в единую полимерную молекулу ДНК водородными связями между азотистыми основаниями нуклеотидов. При этом аденин (А) соединяется только с тимином Т, а гуанин (Г) — с цитозином (Ц). Данные нуклеотиды в молекуле ДНК всегда располагаются друг против друга. Такая способность к избирательному соединению нуклеотидов была названа правилом комплементарности, а соответствующие друг другу азотистые основания и нуклеотиды (А-Т и Г-Ц) — комплементарными. В результате у всякого организма число адениловых нуклеотидов равно числу тимидиловых, а число гуаниловых — числу цитидиловых. Благодаря комплементарности последовательность нуклеотидов в одной цепочке определяет последовательность в другой, т. е. цепи ДНК являются как бы зеркальным отражением друг друга. В 1962 г. американские учёные Д. Уотсон и Ф. Крик и английский исследователь М. Уилкинс за открытия, касающиеся молекулярной структуры нуклеиновых кислот и их значения для передачи генетической информации, были удостоены Нобелевской премии.
Комплементарность определяет не только соответствующий выбор той или иной пары нуклеотидов в химическом строении молекулы ДНК, но обеспечивает последовательность азотистых оснований в каждой цепи и равное расстояние между сахарофосфатными остатками по всей длине молекулы.
При этом следует учесть, что между А и Т замыкаются две водородные связи, а между Г и Ц — три, поэтому связь Г-Ц оказывается энергетически более прочной. Если известен порядок расположения нуклеотидов в одной цепи, то по принципу комплементарности сразу же выясняется и порядок следования нуклеотидов в другой цепи. Однако каждая из этих цепей в молекуле ДНК оказывается как бы антипараллельной друг другу, поскольку они имеют противоположную направленность: у начала цепи напротив нуклеотида с углеродом 3" в дезоксирибозе оказывается комплементарный ему нуклеотид с углеродом 5" в дезоксирибозе. Это обеспечивает антипараллельность цепей молекулы ДНК. Ферменты ДНК-полимеразы могут передвигаться вдоль матричных цепей только от 5"- к 3"- концу, поэтому синтез новых цепей идёт антипараллельно (как бы навстречу друг другу).
Двойная спираль достаточно прочно удерживается многочисленными водородными связями и гидрофобными взаимодействиями. Материал с сайта http://doklad-referat.ru
Последовательность линейного расположения нуклеотидов в ДНК представляет собой систему записи информации о последовательности расположения аминокислот в белках, что является генетическим кодом синтеза молекул белка. Синтез каждого специфического белка определяется генетической информацией, то есть генами.
Ген представляет собой участок ДНК, характеризующийся определённой последовательностью нуклеотидов. Нуклеотиды в цепях молекулы ДНК в количестве трёх представляют собой так называемые триплеты, или кодоны, в каждом из которых зашифрована какая-то одна определённая аминокислота. Последовательный, линейно расположенный ряд кодонов, определяющий состав и структуру гена, направляет синтез белков. Поэтому основной функцией молекул ДНК в клетке и организме является кодирование наследственной информации триплетным кодом. Эта функция обеспечивает состав и структуру белков (особенно ферментов) по принципу «один ген — один фермент».
На этой странице материал по темам:Дезоксирибонуклеиновая кислота днк конспект
Открытие структуры дезоксирибонуклеиновых кислот лауреатами презентация
Структура молекулы днк животного реферат
Днк краткий конспект
Длад по биохимии днк
Назовите отличительные особенности макромолекулы ДНК.
Чем отличается ДНК эукариот от ДНК прокариот?
doklad-referat.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|