|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
ИЗМЕНЕНИЯ БЕЛКОВОГО СОСТАВА ОРГАНИЗМА. Изменения белкового состава при онтогенезе и болезнях реферат
Регуляция белкового обмена — реферат
Регуляция белкового обмена
Обмен белков в организме может существенно изменяться под влиянием различных структур центральной нервной системы, включая кору больших полушарий. Однако ведущая роль в регуляции белкового обмена принадлежит гуморальным факторам — анаболическим гормонам (гормону роста, инсулину, тироксину, стероидным гормонам).
Гормон роста — полипептид, выделяемый передней долей гипофиза. Он стимулирует синтез РНК и белка практически во всех тканях организма. Однако характер его действия и мишени меняются по мере роста организма.
Инсулин, помимо углеводного обмена, регулирует и обмен белков. При повышении содержания аминокислот в крови он стимулирует их поступление в клетки, усиливает анаболизм тканевых белков и подавляет катаболизм аминокислот.
Тироксин — гормон щитовидной железы. Его действие проявляется в периоды, когда организм нуждается в повышении процессов синтеза белка. Он также стимулирует рост и дифференцировку тканей, обладает специфическим усиливающим действием на синтез окислительных митохондриальных ферментов.
Эстрогены — стероидные гормоны, образующиеся в женском организме (в яичниках) и стимулирующие синтез РНК и белка в клетках матки. Андрогены — мужские стероидные гормоны, образующиеся в яичках. По сравнению с женскими стероидами мужские оказывают более широкое влияние, так как стимулируют синтез РНК и белков во многих тканях организма, включая клетки поперечно-полосатых мышц.
Из ряда катаболических гормонов влияние на обмен белков оказывают глюкокортикоиды, вырабатывающиеся корой надпочечников. Эти гормоны усиливают расщепление белков в клетках различных тканей и тормозят синтез белка. В то же время они стимулируют синтез белка в печени.
Гормональная регуляция метаболизма белков обеспечивает обеспечивает динамическое равновесие их синтеза и распада.
Анаболизм белков контролируется гормонами аденогипофиза (соматотропин), поджелудочной железы (инсулин), мужских половых желез (адроген). Усиление анаболической фазы метаболизма белков при избытке этих гормонов выражается в усиленном росте и увеличении массы тела. Недостаток анаболитических гормонов вызывает задержку роста у детей.
Катаболизм белков регулируется гормонами щитовидной железы (тироксин и трийодтиронон), коркового (клюкокортикоиды) и мозгового (адреналин) вещества надпочечников. Избыток этих гормонов усиливает распад белков в тканях, что сопровождается истощением и отрицательным азотистым балансом. Недостаток гормонов, например, щитовидной железы сопровождается ожирением
Проблема белкового оптимума
Минимальное количество белков пищи, необходимое для восполнения разрушающихся белков организма, или величина распада белков организма при исключительно углеводном питании, обозначается как коэффициент изнашивания. У взрослого человека наименьшая величина этого коэффициента около 30 г белков в сутки. Однако этого количества недостаточно.
Жиры и углеводы оказывают влияние на расход белков сверх минимума, необходимого для пластических целей, так как они освобождают то количество энергии, которое требовалось для расщепления белков сверх минимума. Углеводы при нормальном питании уменьшают расщепление белков в 3-3,5 раза больше, чем при полном голодании.
Для взрослого человека при смешанной пище, содержащей достаточное количество углеводов и жиров, и массе тела 70 кг норма белка в сутки равна 105 г.
Количество белка, полностью обеспечивающее рост и жизнедеятельность организма, обозначается как белковый оптимум и равно у человека при легкой работе 100-125 г белка в сутки, при тяжелой работе — до 165 г, а при очень тяжелой — 220-230 г.
Количество белка в сутки должно быть по массе не меньше 17% от общего количества пищи, а по энергии — 14%.
I. Гипопротеинемия — уменьшение содержания белков в плазме крови. Возникает, главным образом, за счет снижения количества альбуминов и может быть приобретенной и наследственной.
К гипопротеинемии приводят голодание, алиментарная белковая недостаточность, заболевания печени, выход белков из кровеносного русла (кровопотеря, плазмопотеря, экссудация, транссудация) и потеря белков с мочой (протеинурия).
Гипопротеинемия приводит к уменьшению онкотического давления плазмы крови, в результате чего жидкость выходит из кровеносных сосудов в интерстициальную ткань — развиваются отеки.
II. Гиперпротеинемия — увеличение содержания белков в плазме крови. Бывает относительной (сгущение крови) и абсолютной. Абсолютная гиперпротеинемия чаще всего обусловлена увеличением синтеза белков плазмы крови и, главным образом, у-глобулинов (антител).
Клинические проявления гиперпротеинемии связаны с увеличением вязкости крови, изменением ее реологических свойств и, как следствие, нарушениями микроциркуляции.
III. Диспротеинемия — изменение соотношения между отдельными белковыми фракциями крови. Может быть наследственной и приобретенной. Часто связана с изменением спектра а- и у-глобулинов. Характерна для острых воспалительных процессов ("белки острой фазы воспаления"), диффузных заболеваний соединительной ткани, аутоиммунных заболеваний.
Иногда в крови появляются качественно измененные белки, в частности, парапротеины и криоглобулины. Парапротеины — это иммуноглобулины, являющиеся продуктами единичных клонов лимфоцитов. Их появление обусловлено пролиферацией отдельных антителосинтезирующих клеток, что бывает при патологических процессах опухолевой природы (миеломная болезнь, макроглобулинемия Вальденстрема). Криоглобулины — это разновидность парапротеинов.
Они представляют собой патологические белки со свойствами иммуноглобулинов, преципитирующие при охлаждении.
Алиментарная белковая недостаточность развивается вследствие нарушений поступления в организм белков, их переваривания и всасывания.
Основными ее причинами являются голодание, несбалансированное по аминокислотному составу питание, воспалительные и дистрофические изменения различных отделов кишок, сопровождающиеся нарушениями их секреторной и моторной функций.
1. Нарушения структуры генов, кодирующих информацию о строении белков (мутации).
2. Яды и специфические ингибиторы мультиферментных комплексов, обеспечивающих процессы транскрипции, трансляции и посттрансляционной модификации белков.
3. Дефицит незаменимых аминокислот.
4. Дефицит АТФ.
5. Нарушения образования транспортных и рибосомальной РНК, белков рибосом.
Важнейшим компонентом полноценного питания являются белки, которые служат основнымпластическим материалом, необходимым для формирования клеток, тканей и органов, образования ферментных систем, гормонов. Дефицит в потреблении белков приводит к отставанию в росте, в работе коры rout итого мозга, вызывает снижение скорости образования антител, гемоглобина, ослабляет иммунную систему и т.д. Благодаря ни утренним резервам организм способен какое-то время подмешивать процессы синтеза и ресинтеза. Однако интенсивность белкового обмена очень велика: так, снижение количества потребляемого белка на 3% вызывает полную остановку роста, снижение массы тела, изменение состава костей. Особенно необходим животный белок, в том числе молочный, обеспечивающий высокий уровень синтеза белков и тканей растущего организма. В процессе жизни в теле человека белки обновляются около 200 раз.
Кроме того, на фоне белковой недостаточности возникают авитаминозы и гиповитаминозы. Избыточное потребление белков приводит к торможению обменных процессов, повышенной возбудимости нервной системы, расстройству пищеварения. Белковый перекорм при недостаточном приеме жидкости сопровождается интоксикацией, высоким риском поражения почек, повышением гидрофильности тканей с умеренной клеточной дегидратацией.
С пищей дети первого года жизни должны получать все незаменимые аминокислоты (в мг на 1 кг массы тела): валин — 93, лейцин — 161, изолейцин — 70, лизин — 161, метионин + цистин — 58—61, триптофан — 17, фенилаланин и тирозин — 125, треонин — 116, гистидин — 28.
Лизин, триптофан, аргинин обладают выраженными ростовыми свойствами, т.е. наряду с витамином А их можно считать факторами роста.
yaneuch.ru
19.Методы количественного измерения белков. Индивидуальные особенности белкового состава органов. Изменения белкового состава органов при онтогенезе и болезнях.
Для определения количества белка в образце используется ряд методик:
Биуретовый метод — один из колориметрическихметодов количественного определениябелковв растворе. Разработан в 1949 году Горналлом, Бардавиллом и Дэвидом, ныне мало используется в биохимической лабораторной практике (за исключением медицинских анализов на белок) из-за низкой чувствительности. Основан на образованиибиуретовогокомплекса (имеет фиолетовый цвет) пептидных связей белков с двухвалентными ионами меди. В методе используют т. н. биуретовый реактив, состоящий изKOH,CuSO4ицитрата натрия(илитартрата натрия). В образовавшемся комплексе медь связана с 4 азотами координационными связями, а с 2 кислородами — электростатическими. Полноценный комплекс образуется лишь с пептидами, состоящими более чем из 4 остатков.
Метод Лоури - основан на образовании окрашенных продуктов ароматических аминокислот с реактивом Фолина в сочетании с биуретовой реакцией на пептидные связи. Метод характеризуется высокой чувствительностью. На развитие окраски влияет большое количество веществ: компоненты буферных систем восстановители, комплексоны, детергенты и др. В связи с этим при построении калибровочного графика для определения белка по Лоури в растворитель для стандартного белка необходимо включать все компоненты, содержащиеся в анализируемых пробах. В некоторых случаях целесообразно предварительное осаждение белков из растворов, например трихлоруксусной кислотой, с последующим растворением их в щелочных растворах, или очистка белковых растворов от низкомолекулярных компонентов путем диализа или гель-фильтрации.
Определение по азоту. Определение основано на том, что содержание азота в большинстве белков практически одинаково и может быть принято равным 16%. По количеству определенного азота находят количество белка в пробе. При нагревании органического соединения с концентрированной серной (хлорной) кислотой происходит его минерализация, азот переходит в сернокислый аммоний (перхлорат аммония), и его можно определить количественно.
Спектрометрический метод - Метод основан на способности ароматических аминокислот (триптофана, тирозина и в меньшей степенифенилаланина) поглощать ультрафиолетовый свет с максимумом при 280 нм. Измеряя величину оптической плотности при этой длине волны, находят количество белка в растворе. Поскольку белки отличаются по содержанию ароматических аминокислот, их поглощение в ультрафиолетовой области спектра может сильно различаться.
Наиболее богаты белковыми веществами ткани и органы животных. Источником белка являются также микроорганизмы и растения. Большинство белков хорошо растворимо в воде. Некоторые органические вещества, выделенные из хряща, волос, ногтей, рогов, костной ткани и нерастворимые в воде, также были отнесены к белкам, поскольку по своему химическому составу оказались близки к белкам мышечной ткани, сыворотки крови, яйца. В мышцах, легких, селезенке, почках на долю белков приходится более 70–80% от сухой массы, а во всем теле человека – 45% от сухой массы. В отличие от животных тканей в растениях содержится значительно меньше белков . Для изучения химического состава, строения и свойств белков их обычно выделяют или из тканей, или из культивируемых клеток, или биологических жидкостей, например сыворотки крови, молока, мышц, печени, кожи и др. Элементный состав белков в пересчете на сухое вещество представлен 50–54% углерода, 21–23% кислорода, 6,5–7,3% водорода, 15–17% азота и до 0,5% серы. В составе некоторых белков присутствуют в небольших количествах фосфор, железо, марганец, магний, йод и др.
Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества. Содержание азота более или менее постоянно во всех белках (в среднем 16%), поэтому иногда определяют количество белка в биологических объектах по содержанию белкового азота.
Белковый состав организма здорового взрослого человека относительно постоянен, хотя возможны изменения количества отдельных белков в органах и тканях в зависимости от состава пищи и режима питания, от физиологической активности человека, биологических ритмов. В процессе развития многоклеточного организма, особенно на стадиях дифференцировки клеток, белковый состав значительно изменяется. Для каждого типа специализированных клеток характерно появление специфических белков, которые определяют особенности их биологических функций. Так, только в эритроцитах есть гемоглобин, осуществляющий транспорт кислорода, к тканям, а в клетках сетчатки глаза - белок родопсин, необходимый для улавливания фотонов света. Кроме того, специализированные клетки отличаются и количеством белков, присутствующих практически во всех или во многих клетках организма. При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии.
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. В зависимости от роли дефектного белка в жизнедеятельности организма, от степени нарушения конформации и функции белков, от гомо- или гетерозиготности индивидуума по этому белку наследственные протеинопатии могут вызывать болезни, протекающие с различной степенью тяжести, вплоть до летального исхода ещё до рождения или в первые месяцы после рождения.
Любая болезнь сопровождается изменением белкового состава организма, т.е. развивается приобретённая протеинопатия. При этом первичная структура белков не нарушается, а обычно происходит количественное изменение белков, особенно в тех органах и тканях, в которых развивается патологический процесс. В некоторых случаях приобретённые протеинопатии развиваются в результате изменения условий, в которых функционируют белки. Иногда в результате болезни повышается уровень метаболитов в клетках и сыворотке крови, что приводит к модификации некоторых белков и нарушению их функции. Так, повышенные концентрации глюкозы в крови при сахарном диабете приводят к неферментативному присоединению её к белкам (гликозилированию белков). Кроме того, из клеток повреждённого органа в кровь могут выходить белки, которые в норме определяются там лишь в следовых количествах. При различных заболеваниях часто используют биохимические исследования белкового состава крови для уточнения клинического диагноза.
20.История открытия и изучения ферментов. Особенности ферментативного катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость превращения субстрата по сравнению с неферментативной реакцией в 109-1012 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активационный барьер. Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или несколько близких по структуре веществ. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, которы катализируют идентичные реакции, но отличаются строением и каталитическими свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последовательных превращений вещества Ферментативные реакции чувствительны к внешним условиям, в частности к ионной силе раствора и рН среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для химической реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента.
Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться" . В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔ ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра. Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
абсолютную субстратную специфичность;
групповую субстратную специфичность;
стереоспецифичность.
Абсолютная субстратная специфичность. Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало.
Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них.
Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов).
Зависимость скорости ферментативной реакции от количества ферментов. При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.  .
.
Количество единиц активности nME определяют по формуле:
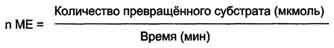
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани.
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Зависимость скорости ферментативной реакции от температуры среды. Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы .
Зависимость скорости ферментативной реакции от рН среды Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (Nh4+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
Зависимость скорости ферментативной реакции от количества субстрата. Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Ферментативный процесс можно выразить следующим уравнением:

где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
studfiles.net
ИЗМЕНЕНИЯ БЕЛКОВОГО СОСТАВА ОРГАНИЗМА
Глава I. Строение, свойства и функции белков | 5 9 |
активность будет возрастать; по степени возрастания удельной активности можно судить об эффективности каждой стадии очистки. Если начиная с какой-тостадии очистки удельная активность больше не увеличивается, то можно считать, что уда лены все посторонние белки, т. е.получен индивидуальный (гомогенный) белок. Величина, показывающая, во сколько раз возросла удельная активность в процес се очистки, называется степенью очистки (см. табл. 1.9).
ш я ш ш ш я т я я » | I l l i i i e i | Обшяи |
| У'1С.1Ы1яя |
|
| |
Объем | концент | Актив | Выход, | Степень | |||
ак1иинм.п. | |||||||
ШЯтшШШШШШЩШ0аВтМ | раствора, | рация | ность, | ||||
Cia.iHH OHticiKH | ед. на I mi | ИММИИМЙ | ОЧНСГКИ | ||||
| M .I | белков, | ед/м.1 | ||||
|
|
|
| ||||
|
| MI/мл |
|
|
|
| |
Экстракт | 440.0 | 3,00 | 15 | 5 | 100 | 1,0 | |
Нагревание при 55 0C | 420,0 | 1,25 | 15 | 24 | 95 | 4,8 | |
в течение 5 мин | 3,6 | 1,00 | 80 | 80 | 45 | 16,0 | |
Осаждение сульфатом | |||||||
аммония (40-70% |
|
|
|
|
|
| |
насыщения) |
|
|
|
|
|
| |
Хроматография на | 1,5 | 0,45 | 120 | 260 | 28 | 52.0 | |
сефадексе G -100 |
| 0,90 | HO | 1200 | 25 | 240,0 | |
Аффинная | 1,5 | ||||||
хроматография |
|
| 130 | 2600 | 20 | 520,0 | |
Кристаллизация | 1,0 | 0,05 | |||||
Перекристаллизация | 1,0 | 0,05 | 130 | 2600 | 20 | 520,0 |
В процессе очистки неизбежны потери выделяемого белка: они связаны с де натурацией, а также с частичным попаданием выделяемого белка во фракции, которые отбрасываются.
При очистке каждого белка приемы и их последовательность подбираются эмпирически, методом проб и ошибок. Поэтому разработка процедуры выделения нового белка остается сложной и трудоемкой задачей.
Общая концентрация белков в клетке, как правило, близка к 20 %, а в некоторых клетках заметно больше (например, в эритроцитах 35 %). В клеточных органеллах концентрация белков еще больше (например, в матриксе митохондрий около 40% ).
Белковый состав организма взрослого здорового человека более или менее постоянен, однако возможны изменения содержания отдельных белков в зависи мости от физиологической активности, состава пищи и режима питания, цикли ческие изменения (биоритмы). В процессе развития организма, особенно на са мых ранних стадиях (от зиготы до формирования дифференцированных органов со специализированными функциями), белковый состав изменяется значительно. В основе различий структуры и функции специализированных клеток лежат раз личия их химического состава, прежде всего белкового. Например, эритроциты содержат гемоглобин, обеспечивающий транспорт кислорода кровью; мышечные
60 | Часть I. Строение информационных молекул и матричные биосинтезы |
клетки содержат сократительные белки актин и миозин; в клетках сетчатки глаза есть белок родопсин, способный улавливать фотоны, и т. д. Многие белки содер жатся во всех или почти во всех клетках, но могут быть в разных количествах. При болезнях белковый состав тканей изменяется. Эти проявления болезней называ ют протеинопатиями. Различают протеинонатии двух типов — наследственные и приобретенные.
Наследственные протеинопатии — результат первичного повреждения в ге нетическом аппарате организма. При этом или какой-либобелок не образуется во обще, или синтезируется измененный по структуре, «неправильный» белок. При мером может служитьсерповидно-клеточнаяанемия (одна из гемоглобинопатий), при которой вместо HbA образуется HbS, хуже выполняющий функцию транспор та кислорода. Во многих случаях нарушение синтеза даже одного белка является фатальным для организма или приводит к тяжелой болезни. Например, индиви ды, гомозиготные по HbS, погибают от малокровия в раннем детском возрасте.
Приобретенные протеинопатии, по-видимому,сопровождают любую из болез ней, однако в клинической практике имеют значение лишь достаточно выражен ные случаи. При приобретенных протеинопатиях первичная структура белков не изменяется, изменяется количество белка или его распределение в тканях, или нарушается функция белка в связи с изменением условий в клетке. Например, при некоторых формах гастрита в клетках слизистой желудка прекращается образова ние белка, обеспечивающего всасывание витамина B12. В результате развивается тяжелая форма анемии (злокачественная анемия, см. гл. 7).
Определение содержания в тканях и жидкостях организма того или иного белка нередко служит удобным, а часто, особенно в случае наследственных протеинопатий, и наиболее точным методом диагностики заболевания. Например, на личие HbS в эритроцитах указывает на серповидно-клеточнуюанемию, а не накакую-либодругую форм)' анемии.
studfiles.net
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


