Реферат на тему:
Helicobacter pylori (хе́ликоба́ктер пило́ри, традиционная транскрипция — ге́ликоба́ктер пило́ри[1]) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки, гастритов, дуоденитов, и, возможно, некоторые случаи лимфом желудка и рака желудка этиологически связаны с инфицированием Helicobacter pylori. Однако у большинства (до 90 %[2]) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний.
Спиралеобразная форма бактерии, от которой, собственно, и произошло родовое название Helicobacter, как полагают, связана с приобретением этим микроорганизмом в ходе эволюции способности проникать в слизистую оболочку желудка и двенадцатиперстной кишки, и с тем, что такая форма облегчает её движение в слизистом геле, покрывающем слизистую оболочку желудка.[3]
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Эта бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было в конце концов забыто.[4]
В 1893 году итальянский исследователь Джулио Биззоцеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак.[5]
В 1899 году польский профессор Валерий Яворский из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил, помимо бактерий, напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка». Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке.[6]
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и о найденных бактериях просто забыли почти на десять лет.[7][8]
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах.[9] В оригинальной публикации[10] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее.[11]
Гистологический препарат слизистой желудка, демонстрирующий хеликобактерный гастрит и колонизацию слизистой хеликобактером. Окраска серебром по Warthin-Starry.
Медицинское и научное сообщество медленно и неохотно признавали патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит.[12] Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой хеликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом.[12] Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки.[12]
В 1994 году Американский Национальный Институт Здравоохранения опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью.[13] Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori.[14][15]
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине.[16]
До того как стала понятна роль инфекции Helicobacter pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы h3-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был висмута субсалицилат (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Сегодня стало понятно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на Helicobacter pylori как антибиотик. На сегодняшний день большинство случаев язв желудка и двенадцатиперстной кишки, гастритов и дуоденитов с доказанной лабораторными тестами хеликобактерной этиологией, особенно в развитых странах, лечат антибиотиками, эффективными против Helicobacter pylori.[17]
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них способны заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени.[18]
Бактерия была вначале названа Campylobacter pyloridis в 1985 году, затем название было исправлено в соответствии с правилами латинской грамматики на Campylobacter pylori в 1987 году[19], и только в 1989 году, после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter, её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989.[20] Название pylōri происходит от «pylorus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от греческого слова πυλωρός, означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделов кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis)).[21] Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae.[21]
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую.[22]
Разработано много методов определения как внутривидовой дифференциации штамов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК[21] Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах, а также крупных внутригеномных перестройках, и высоких частотах трансформации.[21]
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637.[21]
Размеры и схематическое строение H. pylori
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4-6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями.[23] Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки , способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина.[24] Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии.[25] Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1,4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия).[26]
Электронно-микроскопическая фотография H. pylori
Известно несколько штаммов Helicobacter pylori, и геном трех из них полностью секвенирован.[27][28][29][30]
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований, и содержит 1630 генов, из которых 1576 кодируют белки, доля Г+Ц пар составляет 38 моль %. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований, и содержит 1535 генов, из которых 1489 кодируют белки, доля Г+Ц пар составляет 39 моль %. Два изученных штамма демонстрируют значительные генетические различия, до 6 % нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности хеликобактера) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori.
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV.[31]. После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток.[32] Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса.[33]
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника.[34] Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с хеликобактерной инфекцией и могут служить возможными диагностическими маркерами.[35]
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида).[36] Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок.[37]
Факторы вирулентности геликобактера
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии.[38]
Одним из важных факторов вирулентности хеликобактер является наличие у неё жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Молекулярная модель уреазы H. pylori
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6-7).
Продукция хеликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у хеликобактер, предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление, повышение продукции интерлейкина-8[39], угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при геликобактерной инфекции гиперплазия париетальных (кислотообразующих) клеток желудка, гиперсекреция соляной кислоты и пепсина, и в конечном итоге повышение вероятности рака желудка.[40]
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей.[38] В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей.[41][42]
Схематическое изображение патогенеза язвы желудка
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Экзотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка.[43] Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»[44]). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка.[45]
Иммуногистохимическая окраска H. pylori в биоптате слизистой желудка.
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов, и затем выполнения тестов, которые могут помочь подтвердить или опровергнуть факт наличия хеликобактерной инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие хеликобактерной инфекции включают в себя определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченой 14C- или 13C-углеродом мочевины, которую бактерия расщепляет с образованием меченой, соответственно, 14C- или 13C- двуокиси углерода, которая затем может быть обнаружена в выдыхаемом воздухе при помощи масс-спектрометрии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе.[46] Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами.
Однако самым надёжным и «референсным» методом диагностики хеликобактерной инфекции остаётся биопсия, производимая во время эндоскопического обследования желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов геликобактера, гистологическому исследованию, а также культуральному исследованию с выделением хеликобактера на искусственных питательных средах.
Ни один из методов диагностики хеликобактерной инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике хеликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам хеликобактера имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой хеликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
H. pylori в слизистой желудка. Окраска по Романовскому-Гимзе.
Хеликобактерная инфекция может сопровождаться симптомами или протекать бессимптомно (без каких-либо жалоб со стороны инфицированного). Предполагается, что до 70 % случаев хеликобактерной инфекции протекают бессимптомно и что около 2/3 человеческой популяции в мировом масштабе инфицированы геликобактером, что делает геликобактерную инфекцию самой распространённой инфекцией в мире. Истинная частота встречаемости бессимптомного носительства хеликобактера варьирует от страны к стране. В развитых странах Запада (Западная Европа, США, Австралия) эта частота составляет примерно 25 %, и значительно выше в странах так называемого «третьего мира», а также в посткоммунистических странах Восточной Европы и в особенности в странах бывшего Советского Союза. В странах третьего мира и в посткоммунистических странах, вследствие сравнительно низких санитарных стандартов и условий, не редкостью является обнаружение геликобактерной инфекции у детей и подростков. В Соединённых Штатах и Западной Европе хеликобактерная инфекция чаще всего встречается в старших возрастных категориях (около 50 % у лиц старше 60 лет, по сравнению с 20 % у лиц моложе 40 лет) и в наиболее бедных социально-экономических слоях.
Разница в частоте встречаемости хеликобактерной инфекции в развитых странах Запада и в странах «третьего мира» приписывается более строгому соблюдению гигиенических стандартов и широкому использованию антибиотиков. Однако со временем стала проявляться проблема антибиотикоустойчивости H. pylori.[47] В настоящее время многие штаммы хеликобактера в Европе, США и даже в развивающихся странах, уже устойчивы к метронидазолу.
Хеликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой или анилингусе). Возможно (и весьма часто встречается) заражение хеликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
H. pylori в слизистой желудка. Окраска гематоксилин-эозином.
Считается, что в отсутствие лечения хеликобактерная инфекция, однажды колонизировав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммуный ответ хозяина.[48][49] Однако у пожилых людей, а также у больных с давно существующим гастритом, хеликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее пригодной для колонизации хеликобактером, менее благоприятной для обитания микроба. Вместе с тем, атрофический гастрит у пожилых, или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем хеликобактерные гастриты.
Процент острых хеликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно не известен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя).[50][51]
У пациентов с язвой желудка, язвой двенадцатиперстной кишки, атрофическим гастритом, MALTомой, состоянием после резекции желудка, близким родством с больными, страдающими раком желудка с доказанной хеликобактерной этиологией обязательным является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке.[52] В тоже время, эрадикация доказанной инфекции Helicobacter pylori в отсутствии перечисленных выше заболеваний (состояний) не всегда целесообразна, так как возможный вред от приема антибиотиков может перевесить возможную пользу от эрадикации. Некоторые источники к числу обязательных для эрадикации Helicobacter pylori заболевавний (при наличии инфекции Нр) относят только язвенную болезнь.[2]
Австралийский гастроэнтеролог Томас Бороди в 1987 году ввёл первый известный режим «трёхкомпонентной терапии» (англ. triple therapy).[53]
Состоявшаяся в 2000 году конференция в г. Маастрихте (так называемый «Маастрихт II») отметила, что конкретная схема эрадикации H. pylori не всегда достигает результат. Поэтому, кроме трёхкомпонентной эрадикационной схемы первой линии, были предложены схемы второй линии, применяемые при неудачи эррадикации по первой линии. «Маастрихт II» определил, что стандартной «тройной терапией первой линии» является комбинация амоксициллина, кларитромицина и ингибитора протонного насоса или ранитидина висмута цитрата. При отсутствии результатов трёхкомпонентной терапии для эрадикации H. pylori назначается терапия второй линии — «квадротерапия», включающая ингибитор протонного насоса, висмута трикалия дицитрат (или висмута субнитрат) и антибиотики тетрациклин и метронидазол.[52]
Возрастающая резистентность H. pylori к «стандартным» антибиоткам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса.[54][55]
Отмечены случаи непродуктивности антибиотикотерапии хеликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков.[56] Отмеченно появление полирезистентных к антибиотикам изолятов H. pylori[57], в том числе и кларитромицин-резистентных штаммов.[58] Также отмечены случаи появления хинолон-резистентных штаммов H. pylori.[59]
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44[60], препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori.[61] Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели.[62]
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы:[63]
Отмечается, что в связи большим число носителей H. pylori (в России — до 75 % населения) после эрадикации отсутствуют какие-либо гарантии отсутствия реинфекции, более того, она весьма вероятна. Критики инфекционной теории обычно подходят к язвенной болезни, как к системному гастроэнтерологическому заболеванию, в развитии которого играют важнейшую роль, в том числе, психосоматические и психосоциальные факторы.[63]
wreferat.baza-referat.ru
Реферат на тему:
Helicobacter pylori (хе́ликоба́ктер пило́ри, традиционная транскрипция — ге́ликоба́ктер пило́ри[1]) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки, гастритов, дуоденитов, и, возможно, некоторые случаи лимфом желудка и рака желудка этиологически связаны с инфицированием Helicobacter pylori. Однако у большинства (до 90 %[2]) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний.
Спиралеобразная форма бактерии, от которой, собственно, и произошло родовое название Helicobacter, как полагают, связана с приобретением этим микроорганизмом в ходе эволюции способности проникать в слизистую оболочку желудка и двенадцатиперстной кишки, и с тем, что такая форма облегчает её движение в слизистом геле, покрывающем слизистую оболочку желудка.[3]
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Эта бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было в конце концов забыто.[4]
В 1893 году итальянский исследователь Джулио Биззоцеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак.[5]
В 1899 году польский профессор Валерий Яворский из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил, помимо бактерий, напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка». Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке.[6]
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и о найденных бактериях просто забыли почти на десять лет.[7][8]
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах.[9] В оригинальной публикации[10] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее.[11]
Гистологический препарат слизистой желудка, демонстрирующий хеликобактерный гастрит и колонизацию слизистой хеликобактером. Окраска серебром по Warthin-Starry.
Медицинское и научное сообщество медленно и неохотно признавали патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит.[12] Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой хеликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом.[12] Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки.[12]
В 1994 году Американский Национальный Институт Здравоохранения опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью.[13] Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori.[14][15]
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине.[16]
До того как стала понятна роль инфекции Helicobacter pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы h3-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был висмута субсалицилат (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Сегодня стало понятно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на Helicobacter pylori как антибиотик. На сегодняшний день большинство случаев язв желудка и двенадцатиперстной кишки, гастритов и дуоденитов с доказанной лабораторными тестами хеликобактерной этиологией, особенно в развитых странах, лечат антибиотиками, эффективными против Helicobacter pylori.[17]
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них способны заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени.[18]
Бактерия была вначале названа Campylobacter pyloridis в 1985 году, затем название было исправлено в соответствии с правилами латинской грамматики на Campylobacter pylori в 1987 году[19], и только в 1989 году, после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter, её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989.[20] Название pylōri происходит от «pylorus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от греческого слова πυλωρός, означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделов кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis)).[21] Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae.[21]
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую.[22]
Разработано много методов определения как внутривидовой дифференциации штамов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК[21] Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах, а также крупных внутригеномных перестройках, и высоких частотах трансформации.[21]
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637.[21]
Размеры и схематическое строение H. pylori
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4-6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями.[23] Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки , способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина.[24] Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии.[25] Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1,4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия).[26]
Электронно-микроскопическая фотография H. pylori
Известно несколько штаммов Helicobacter pylori, и геном трех из них полностью секвенирован.[27][28][29][30]
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований, и содержит 1630 генов, из которых 1576 кодируют белки, доля Г+Ц пар составляет 38 моль %. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований, и содержит 1535 генов, из которых 1489 кодируют белки, доля Г+Ц пар составляет 39 моль %. Два изученных штамма демонстрируют значительные генетические различия, до 6 % нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности хеликобактера) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori.
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV.[31]. После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток.[32] Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса.[33]
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника.[34] Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с хеликобактерной инфекцией и могут служить возможными диагностическими маркерами.[35]
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида).[36] Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок.[37]
Факторы вирулентности геликобактера
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии.[38]
Одним из важных факторов вирулентности хеликобактер является наличие у неё жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Молекулярная модель уреазы H. pylori
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6-7).
Продукция хеликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у хеликобактер, предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление, повышение продукции интерлейкина-8[39], угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при геликобактерной инфекции гиперплазия париетальных (кислотообразующих) клеток желудка, гиперсекреция соляной кислоты и пепсина, и в конечном итоге повышение вероятности рака желудка.[40]
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей.[38] В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей.[41][42]
Схематическое изображение патогенеза язвы желудка
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Экзотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка.[43] Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»[44]). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка.[45]
Иммуногистохимическая окраска H. pylori в биоптате слизистой желудка.
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов, и затем выполнения тестов, которые могут помочь подтвердить или опровергнуть факт наличия хеликобактерной инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие хеликобактерной инфекции включают в себя определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченой 14C- или 13C-углеродом мочевины, которую бактерия расщепляет с образованием меченой, соответственно, 14C- или 13C- двуокиси углерода, которая затем может быть обнаружена в выдыхаемом воздухе при помощи масс-спектрометрии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе.[46] Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами.
Однако самым надёжным и «референсным» методом диагностики хеликобактерной инфекции остаётся биопсия, производимая во время эндоскопического обследования желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов геликобактера, гистологическому исследованию, а также культуральному исследованию с выделением хеликобактера на искусственных питательных средах.
Ни один из методов диагностики хеликобактерной инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике хеликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам хеликобактера имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой хеликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
H. pylori в слизистой желудка. Окраска по Романовскому-Гимзе.
Хеликобактерная инфекция может сопровождаться симптомами или протекать бессимптомно (без каких-либо жалоб со стороны инфицированного). Предполагается, что до 70 % случаев хеликобактерной инфекции протекают бессимптомно и что около 2/3 человеческой популяции в мировом масштабе инфицированы геликобактером, что делает геликобактерную инфекцию самой распространённой инфекцией в мире. Истинная частота встречаемости бессимптомного носительства хеликобактера варьирует от страны к стране. В развитых странах Запада (Западная Европа, США, Австралия) эта частота составляет примерно 25 %, и значительно выше в странах так называемого «третьего мира», а также в посткоммунистических странах Восточной Европы и в особенности в странах бывшего Советского Союза. В странах третьего мира и в посткоммунистических странах, вследствие сравнительно низких санитарных стандартов и условий, не редкостью является обнаружение геликобактерной инфекции у детей и подростков. В Соединённых Штатах и Западной Европе хеликобактерная инфекция чаще всего встречается в старших возрастных категориях (около 50 % у лиц старше 60 лет, по сравнению с 20 % у лиц моложе 40 лет) и в наиболее бедных социально-экономических слоях.
Разница в частоте встречаемости хеликобактерной инфекции в развитых странах Запада и в странах «третьего мира» приписывается более строгому соблюдению гигиенических стандартов и широкому использованию антибиотиков. Однако со временем стала проявляться проблема антибиотикоустойчивости H. pylori.[47] В настоящее время многие штаммы хеликобактера в Европе, США и даже в развивающихся странах, уже устойчивы к метронидазолу.
Хеликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой или анилингусе). Возможно (и весьма часто встречается) заражение хеликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
H. pylori в слизистой желудка. Окраска гематоксилин-эозином.
Считается, что в отсутствие лечения хеликобактерная инфекция, однажды колонизировав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммуный ответ хозяина.[48][49] Однако у пожилых людей, а также у больных с давно существующим гастритом, хеликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее пригодной для колонизации хеликобактером, менее благоприятной для обитания микроба. Вместе с тем, атрофический гастрит у пожилых, или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем хеликобактерные гастриты.
Процент острых хеликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно не известен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя).[50][51]
У пациентов с язвой желудка, язвой двенадцатиперстной кишки, атрофическим гастритом, MALTомой, состоянием после резекции желудка, близким родством с больными, страдающими раком желудка с доказанной хеликобактерной этиологией обязательным является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке.[52] В тоже время, эрадикация доказанной инфекции Helicobacter pylori в отсутствии перечисленных выше заболеваний (состояний) не всегда целесообразна, так как возможный вред от приема антибиотиков может перевесить возможную пользу от эрадикации. Некоторые источники к числу обязательных для эрадикации Helicobacter pylori заболевавний (при наличии инфекции Нр) относят только язвенную болезнь.[2]
Австралийский гастроэнтеролог Томас Бороди в 1987 году ввёл первый известный режим «трёхкомпонентной терапии» (англ. triple therapy).[53]
Состоявшаяся в 2000 году конференция в г. Маастрихте (так называемый «Маастрихт II») отметила, что конкретная схема эрадикации H. pylori не всегда достигает результат. Поэтому, кроме трёхкомпонентной эрадикационной схемы первой линии, были предложены схемы второй линии, применяемые при неудачи эррадикации по первой линии. «Маастрихт II» определил, что стандартной «тройной терапией первой линии» является комбинация амоксициллина, кларитромицина и ингибитора протонного насоса или ранитидина висмута цитрата. При отсутствии результатов трёхкомпонентной терапии для эрадикации H. pylori назначается терапия второй линии — «квадротерапия», включающая ингибитор протонного насоса, висмута трикалия дицитрат (или висмута субнитрат) и антибиотики тетрациклин и метронидазол.[52]
Возрастающая резистентность H. pylori к «стандартным» антибиоткам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса.[54][55]
Отмечены случаи непродуктивности антибиотикотерапии хеликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков.[56] Отмеченно появление полирезистентных к антибиотикам изолятов H. pylori[57], в том числе и кларитромицин-резистентных штаммов.[58] Также отмечены случаи появления хинолон-резистентных штаммов H. pylori.[59]
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44[60], препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori.[61] Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели.[62]
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы:[63]
Отмечается, что в связи большим число носителей H. pylori (в России — до 75 % населения) после эрадикации отсутствуют какие-либо гарантии отсутствия реинфекции, более того, она весьма вероятна. Критики инфекционной теории обычно подходят к язвенной болезни, как к системному гастроэнтерологическому заболеванию, в развитии которого играют важнейшую роль, в том числе, психосоматические и психосоциальные факторы.[63]
wreferat.baza-referat.ru
Реферат на тему:
Helicobacter pylori (хе́ликоба́ктер пило́ри, традиционная транскрипция — ге́ликоба́ктер пило́ри[1]) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки, гастритов, дуоденитов, и, возможно, некоторые случаи лимфом желудка и рака желудка этиологически связаны с инфицированием Helicobacter pylori. Однако у большинства (до 90 %[2]) инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболеваний.
Спиралеобразная форма бактерии, от которой, собственно, и произошло родовое название Helicobacter, как полагают, связана с приобретением этим микроорганизмом в ходе эволюции способности проникать в слизистую оболочку желудка и двенадцатиперстной кишки, и с тем, что такая форма облегчает её движение в слизистом геле, покрывающем слизистую оболочку желудка.[3]
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Эта бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было в конце концов забыто.[4]
В 1893 году итальянский исследователь Джулио Биззоцеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак.[5]
В 1899 году польский профессор Валерий Яворский из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил, помимо бактерий, напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка». Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке.[6]
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и о найденных бактериях просто забыли почти на десять лет.[7][8]
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах.[9] В оригинальной публикации[10] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее.[11]
Гистологический препарат слизистой желудка, демонстрирующий хеликобактерный гастрит и колонизацию слизистой хеликобактером. Окраска серебром по Warthin-Starry.
Медицинское и научное сообщество медленно и неохотно признавали патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит.[12] Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой хеликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом.[12] Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки.[12]
В 1994 году Американский Национальный Институт Здравоохранения опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью.[13] Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori.[14][15]
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине.[16]
До того как стала понятна роль инфекции Helicobacter pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы h3-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был висмута субсалицилат (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Сегодня стало понятно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на Helicobacter pylori как антибиотик. На сегодняшний день большинство случаев язв желудка и двенадцатиперстной кишки, гастритов и дуоденитов с доказанной лабораторными тестами хеликобактерной этиологией, особенно в развитых странах, лечат антибиотиками, эффективными против Helicobacter pylori.[17]
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них способны заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени.[18]
Бактерия была вначале названа Campylobacter pyloridis в 1985 году, затем название было исправлено в соответствии с правилами латинской грамматики на Campylobacter pylori в 1987 году[19], и только в 1989 году, после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter, её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989.[20] Название pylōri происходит от «pylorus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от греческого слова πυλωρός, означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделов кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis)).[21] Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae.[21]
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую.[22]
Разработано много методов определения как внутривидовой дифференциации штамов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК[21] Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах, а также крупных внутригеномных перестройках, и высоких частотах трансформации.[21]
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637.[21]
Размеры и схематическое строение H. pylori
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4-6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями.[23] Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки , способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина.[24] Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии.[25] Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1,4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия).[26]
Электронно-микроскопическая фотография H. pylori
Известно несколько штаммов Helicobacter pylori, и геном трех из них полностью секвенирован.[27][28][29][30]
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований, и содержит 1630 генов, из которых 1576 кодируют белки, доля Г+Ц пар составляет 38 моль %. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований, и содержит 1535 генов, из которых 1489 кодируют белки, доля Г+Ц пар составляет 39 моль %. Два изученных штамма демонстрируют значительные генетические различия, до 6 % нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности хеликобактера) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori.
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV.[31]. После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток.[32] Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса.[33]
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника.[34] Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с хеликобактерной инфекцией и могут служить возможными диагностическими маркерами.[35]
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида).[36] Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок.[37]
Факторы вирулентности геликобактера
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии.[38]
Одним из важных факторов вирулентности хеликобактер является наличие у неё жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Молекулярная модель уреазы H. pylori
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6-7).
Продукция хеликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у хеликобактер, предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление, повышение продукции интерлейкина-8[39], угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при геликобактерной инфекции гиперплазия париетальных (кислотообразующих) клеток желудка, гиперсекреция соляной кислоты и пепсина, и в конечном итоге повышение вероятности рака желудка.[40]
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей.[38] В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей.[41][42]
Схематическое изображение патогенеза язвы желудка
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Экзотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка.[43] Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»[44]). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка.[45]
Иммуногистохимическая окраска H. pylori в биоптате слизистой желудка.
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов, и затем выполнения тестов, которые могут помочь подтвердить или опровергнуть факт наличия хеликобактерной инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие хеликобактерной инфекции включают в себя определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченой 14C- или 13C-углеродом мочевины, которую бактерия расщепляет с образованием меченой, соответственно, 14C- или 13C- двуокиси углерода, которая затем может быть обнаружена в выдыхаемом воздухе при помощи масс-спектрометрии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе.[46] Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами.
Однако самым надёжным и «референсным» методом диагностики хеликобактерной инфекции остаётся биопсия, производимая во время эндоскопического обследования желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов геликобактера, гистологическому исследованию, а также культуральному исследованию с выделением хеликобактера на искусственных питательных средах.
Ни один из методов диагностики хеликобактерной инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике хеликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам хеликобактера имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой хеликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
H. pylori в слизистой желудка. Окраска по Романовскому-Гимзе.
Хеликобактерная инфекция может сопровождаться симптомами или протекать бессимптомно (без каких-либо жалоб со стороны инфицированного). Предполагается, что до 70 % случаев хеликобактерной инфекции протекают бессимптомно и что около 2/3 человеческой популяции в мировом масштабе инфицированы геликобактером, что делает геликобактерную инфекцию самой распространённой инфекцией в мире. Истинная частота встречаемости бессимптомного носительства хеликобактера варьирует от страны к стране. В развитых странах Запада (Западная Европа, США, Австралия) эта частота составляет примерно 25 %, и значительно выше в странах так называемого «третьего мира», а также в посткоммунистических странах Восточной Европы и в особенности в странах бывшего Советского Союза. В странах третьего мира и в посткоммунистических странах, вследствие сравнительно низких санитарных стандартов и условий, не редкостью является обнаружение геликобактерной инфекции у детей и подростков. В Соединённых Штатах и Западной Европе хеликобактерная инфекция чаще всего встречается в старших возрастных категориях (около 50 % у лиц старше 60 лет, по сравнению с 20 % у лиц моложе 40 лет) и в наиболее бедных социально-экономических слоях.
Разница в частоте встречаемости хеликобактерной инфекции в развитых странах Запада и в странах «третьего мира» приписывается более строгому соблюдению гигиенических стандартов и широкому использованию антибиотиков. Однако со временем стала проявляться проблема антибиотикоустойчивости H. pylori.[47] В настоящее время многие штаммы хеликобактера в Европе, США и даже в развивающихся странах, уже устойчивы к метронидазолу.
Хеликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой или анилингусе). Возможно (и весьма часто встречается) заражение хеликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
H. pylori в слизистой желудка. Окраска гематоксилин-эозином.
Считается, что в отсутствие лечения хеликобактерная инфекция, однажды колонизировав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммуный ответ хозяина.[48][49] Однако у пожилых людей, а также у больных с давно существующим гастритом, хеликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее пригодной для колонизации хеликобактером, менее благоприятной для обитания микроба. Вместе с тем, атрофический гастрит у пожилых, или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем хеликобактерные гастриты.
Процент острых хеликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно не известен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя).[50][51]
У пациентов с язвой желудка, язвой двенадцатиперстной кишки, атрофическим гастритом, MALTомой, состоянием после резекции желудка, близким родством с больными, страдающими раком желудка с доказанной хеликобактерной этиологией обязательным является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке.[52] В тоже время, эрадикация доказанной инфекции Helicobacter pylori в отсутствии перечисленных выше заболеваний (состояний) не всегда целесообразна, так как возможный вред от приема антибиотиков может перевесить возможную пользу от эрадикации. Некоторые источники к числу обязательных для эрадикации Helicobacter pylori заболевавний (при наличии инфекции Нр) относят только язвенную болезнь.[2]
Австралийский гастроэнтеролог Томас Бороди в 1987 году ввёл первый известный режим «трёхкомпонентной терапии» (англ. triple therapy).[53]
Состоявшаяся в 2000 году конференция в г. Маастрихте (так называемый «Маастрихт II») отметила, что конкретная схема эрадикации H. pylori не всегда достигает результат. Поэтому, кроме трёхкомпонентной эрадикационной схемы первой линии, были предложены схемы второй линии, применяемые при неудачи эррадикации по первой линии. «Маастрихт II» определил, что стандартной «тройной терапией первой линии» является комбинация амоксициллина, кларитромицина и ингибитора протонного насоса или ранитидина висмута цитрата. При отсутствии результатов трёхкомпонентной терапии для эрадикации H. pylori назначается терапия второй линии — «квадротерапия», включающая ингибитор протонного насоса, висмута трикалия дицитрат (или висмута субнитрат) и антибиотики тетрациклин и метронидазол.[52]
Возрастающая резистентность H. pylori к «стандартным» антибиоткам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса.[54][55]
Отмечены случаи непродуктивности антибиотикотерапии хеликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков.[56] Отмеченно появление полирезистентных к антибиотикам изолятов H. pylori[57], в том числе и кларитромицин-резистентных штаммов.[58] Также отмечены случаи появления хинолон-резистентных штаммов H. pylori.[59]
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44[60], препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori.[61] Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели.[62]
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы:[63]
Отмечается, что в связи большим число носителей H. pylori (в России — до 75 % населения) после эрадикации отсутствуют какие-либо гарантии отсутствия реинфекции, более того, она весьма вероятна. Критики инфекционной теории обычно подходят к язвенной болезни, как к системному гастроэнтерологическому заболеванию, в развитии которого играют важнейшую роль, в том числе, психосоматические и психосоциальные факторы.[63]
wreferat.baza-referat.ru
Этот файл взят из коллекции Medinfo
http://www.doktor.ru/medinfo
http://medinfo.home.ml.org
E-mail: [email protected]
FidoNet 2:5030/434 Andrey Novicov
Пишем рефераты на заказ - e-mail: [email protected]В Medinfo для вас самая большая русская коллекция медицинских
рефератов, историй болезни, литературы, обучающих программ, тестов.Заходите на http://www.doktor.ru - Русский медицинский сервер для всех!
ИНФЕКЦИЯ HELICOBACTER PYLORI (HP)
ЭПИДЕМИОЛОГИЯ, ДИАГНОСТИКА И МЕТОДЫ ЛЕЧЕНИЯ
Этиологическая роль бактерий в развитии пептической язвы предпологается уже давно. В 1893 году впервые заговорили об обнаружении спирохет в желудке животных, а в 1940-х годах данные микроорганизмы были обнаружены в желудках лиц, страдающих язвенной болезнью или раком этого органа.
Лишь в 1983 году было подтверждено наличие патогенетической связи между бактериальной инфекцией и пептической язвой.
Исследователи Робин Уоррен и Барри Маршалл из Австралии сообщили о наличии бактерий спиралевидной формы, в дальнейшем полученных ими в культуральной среде, у больных с хроническим гастритом и пептической язвой. Первоначально полагали, что указанные бактерии принадлежат к роду Campylobacter, однако позднее они были отнесены к отдельному, новому роду. С 1989 года во всем мире этот микроорганизм называют Helicobacter pylor (Нр).
БИОЛОГИЯ МИКРООРГАНИЗМА
Нр - грамотрицательная микроаэрофильная бактерия изогнутой или спиралевидной формы с множеством жгутиков. Она обнаруживается в глубине желудочных ямок и на поверхности эпителиальных клеток, в основном под защитным слоем слизи, выстилающим слизистую оболочку желудка. Несмотря на столь необычное окружение, конкуренции Hp со стороны других микроорганизмов нет.
рН среды обитания Нр примерно равно 7, концентрация кислорода низкая, а содержание питательных веществ вполне достаточно для жизнедеятельности микроба.ВИРУЛЕНТНОСТЬ
Сегодня известно несколько факторов вирулентности, позволяющих Нр заселять, а затем персистировать в организме хозяина:
· Спиралевидная форма и наличие жгутиков
· Наличие ферментов адаптации
· Адгезивность
· Подавление иммунной системы.Спиралевидная форма и наличие жгутиков
Спиралевидная форма Нр хорошо приспособлена к передвижению в вязком слое желудочной слизи, что позволяет микроорганизму полностью заселять слизистую оболочку. Кроме того, наличие покрытых оболочкой жгутиков позволяет быстро передвигаться как в желудочном соке, так и в слизи.
Ферменты адаптации
Нр вырабатывает ферменты - уреазу и каталазу. Уреаза, содержащаяся в желудочном соке, катализирует мочевину в диоксид углерода (СО2) и ион аммония (Nh5+), что еще больше нейтрализует рН непосредственного окружения микроба и защищает Нр от бактерицидного действия соляной кислоты желудка. Таким образом, микроорганизм, сохранившись в желудочном соке, проникает в защитный слой слизи на поверхности эпителия желудка.
Выделение каталазы, а также, возможно, и супероксиддисмутосмутазы, позволяет Нр подавлять иммунный ответ организма хозяина. Эти ферменты катализируют реакцию превращения бактерицидных соединений кислорода, высвобождаемых активированными в результате инфекции нейтрофилами, в такие безвредные вещества, как кислород и вода.
Адгезивность
Способность Нр прикрепляться к олигосахаридным компонентам специфических фосфолипидов и гликопротеинов на мембранах эпителиальных клеток желудка обусловливает его избирательное заселение этих слизесекретирующих клеток. В некоторых случаях слипание ведет к образованию характерной структуры, называющейся "пьедесталом". В тех местах, где мембраны бактериальных клеток примыкают друг к другу, наблюдается разрушение микроворсин и разрыв компонентов цитоскелета. Другими возможными рецепторами связывания Нр являются внеклеточные компоненты матрикса, например, ламинин, фибронектин и различные виды коллагена.
Предполагают, что лишь очень небольшая часть микроорганизмов (менее 10%) имеющихся в желудке, находится в связанном состоянии в каждый конкретный момент времени. Относительно необходимости адгезии Нр не существует единой точки зрения, и уж если адгезия не является обязательным условием колонизации слизистой оболочки желудка, то ее, по-видимому, можно рассматривать как чрезвычайно важный этап развития заболевания.
Подавление иммунной системы
Нр стимулирует иммунную систему организма хозяина к выработке системных антител. Однако, как показали результаты исследований, микроорганизмы способны подавлять клеточные реакции иммунитета.
Защита организма от инфекции осуществляется фагоцитами, которые способны захватывать и переваривать чужеродные вещества, в том числе бактерии. В обычных условиях фагоциты не могут пройти сквозь слизистую оболочку желудка, но если это тем не менее происходит, гемаглютинины, находящиеся на поверхности клеток Нр, могут затормозить процесс адгезии или фагоцитоза полиморфно-ядерными лейкоцитами. Кроме того, аммиак, вырабатываемый Нр, способен повредить мембраны фагоцитов. Как уже отмечалось, активность каталазы Нр позволяет ему избежать деструктивного воздействия со стороны нейтрофилов.
Липополисахариды (ЛПС) выступают в роли гидрофильного барьера, связанного с поверхностью бактериальных клеток. ЛПС Нр сформировались в процессе эволюции для защиты от гиперактивности иммунного ответа, что позволяет микроорганизму выжить в желудке. Взятые от больных язвой ЛПС Нр способны стимулировать секрецию пепсиногена, ведущую к избытку пепсина, который является фактором риска в развитии язвенной болезни.
Патогенность
Существует несколько механизмов, с помощью которых Нр вызывает развитие заболевания:
· Токсины и токсические ферменты
· Стимуляция воспаления
Изменение физиологии желудкаТоксины и токсические ферменты
Цитотоксины
Около 65% штаммов Нр вырабатывает вакуолизирующий цитотоксин (Вак А), который способствует образованию вакуолей в эпительных клетках, что ведет к их смерти. Почти все больные с дуоденальными язвами инфицированы Вак А-образующим штаммом Нр. Цитотоксическая активность выше у тех микроорганизмов, которые были получены от больных с дуоденальными язвами, по сравнению с теми, что были взяты от лиц, не страдающих язвенной болезнью. Вак А-образующие штаммы Нр также вырабатывают цитотоксин-ассоциированный белок (ЦагА). Антитела к ЦагА были обнаружены в сыворотке почти всех больных с карциномой и язвенной болезнью желудка.
Уреаза
Кроме фактора вирулентности, активность уреазы может быть связана с токсическими эффектами вырабатываемого аммиака. В высоких концентрациях аммиак вызывает вакуолизацию эпителиальных клеток, аналогичную той, что наблюдается при воздействии вакуолизирующего токсина Нр.
Фосфолипазы А2 и С
Мембраны клеток желудочного эпителия состоят из двух фосфолипидных слоев. В результате действия фосфолипаз А2 и С, вырабатываемых Нр, в них наблюдаются изменения in vitro.
Фосфолипазы из бактериолизатов переводят гидрофобную поверхность фосфолипидного биослоя во "влажное" гидрофильное состояние. Таким образом, в результате действия указанных бактериальных ферментов целостность мембран эпителиальных клеток и их резистентность к повреждениям, например, к соляной кислоте желудка, нарушается.
Фосфолипазы также способны нарушать защитную функцию желудочной слизи. Гидрофобность и вязкость слизи в равной степени зависят от содержания в ней фосфолипидов. В присутствиии Нр слизь становится менее гидрофобной, а ее вязкость при этом уменьшается. Эти изменения могут вести к тому, что в слизистую оболочку из просвета желудка поступает большое количество ионов водорода, что вызывет ее повреждение.
Стимуляция воспаления
Воспалительная реакция, протекающая в организме хозяина в ответ на внедрение Нр, сама по себе способствует нарушению целостности желудочного эпителия. Хемотактические белки, высвобождаемые Нр, привлекают большое число нейтрофилов, лимфо- и моноцитов. Итак, наличие большого количества нейтрофилов в эпителии желудка является типичным для инфекции Нр. Мононуклеары выделяют интерлейкины, факторы некроза опухоли и супероксидные радикалы. Интерлейкины и факторы некроза опухоли не позволяют мононуклеарам мигрировать от места протекания воспалительной реакции. Кроме того, они запускают образование супероксидных радикалов, которые затем превращаются в другие активные промежуточные метаболиты кислорода, токсичные как для Нр, так и для клеток слизистой оболочки.
Другими медиаторами воспаления, связанными с инфекцией Нр, являются, по-видимому, фосфолипаза А2 и фактор активации тромбоцитов (ФАТ). Фосфолипаза А2 участвует в распаде фосфолипидов клеточных мембран организма хозяина, что ведет к образовангию соединений, вызывающих хемотаксис клеток воспаления, а также нарушающих проницаемость мембран. ФАТ способен также вызывать серьезные патологические изменения, в частности, изъязвление желудка, а предшественники ФАТ обнаруживаются в биоптате желудка у больных с Нр-положительными дуоденальными язвами.
Изменение физиологии желудка
Гастрин - пептидный гормон, секретируемый антральными G-клетками. Повышение уровня сывороточного гастрина у больных с Нр - положительными дуоденальными язвами ведет к увеличению секреции кислоты либо непосредственным повышением выработки париетальных клеток, либо увеличением количества обкладочных клеток.
Увеличение высвобождения гастрина антральным отделом желудка в результате инфицирования Нр происходит по следующим причинам:
· Аммиак, образующийся под влиянием уреазы Нр, увеличивает рН слизистого слоя эпителия желудка, вмешиваясь таким образом в физиологичесий механизм отрицательной обратной связи между секрецией гастрина и соляной кислоты желудка.
· Слизистое воспаление у Нр-инфицированных лиц способно стимулировать секрецию гастрина.
· Соматостатин, секретируемый D-клетками антрального отдела, тормозит синтез и секрецию гастрина G-клетками. Исследования, проводимые с участием Нр-инфицированных лиц, выявили у них снижение концентрации антрального соматостатина.Содержание пепсиногена в крови также повышено у Нр-положительных больных с дуоденальными язвами. Пепсиноген вырабатывается кислотообразующими клетками слизистой оболочки дна желудка и секретируется как в его просвет, так и в кровь. Для образования протеолитического фермента - пепсина - необходима активация его предшественника в кислом содержимом желудка. Увеличение сывороточного уровня пепсиногена I является важным фактором риска развития дуоденальной язвы, это имеет место у 30-50% пациентов.
Эпидемиология
Инфицирование Нр обычно происходит в детстве и при отсутствии лечения персистирует в организме неопределенно долго. Частота инфекции Нр среди детей от 2 до 8 лет в развивающихся странах составляет 10% в год и достигает почти 100% к взрослому возрасту. В развитых странах распространенность Нр также увеличивается с возрастом, однако инфицированность у детей относительно невысокая.
Кроме возраста, важным эпидемиологическим фактором Нр является социально-экономическое положение. В целом, чем ниже социально-экономический статус населения, тем выше риск инфицирования. Существует предположение, что преобладание детского населения в обществе является единственным значимым фактором риска, при этом обеспеченность чистой питьевой водой и соблюдение санитарных норм также важны в профилактике Нр-инфекции.
На основании результатов нескольких исследований эксперты пришли к заключению, что на распространенность Нр влияет профессиональный фактор. Было показано, что работники скотобоен (контакт с инфицированными животными) и врачи-гастроэнтерологи являются группами высокого риска.
2.6. Пути передачи
Естественным резервуаром Нр прежде всего является человек, однако инфекция обнаруживается также у домашних кошек, нечеловекоподобных обезьян и свиней. Существуют два возможных пути передачи: фекально-оральный и, в меньшей степени, орально-оральный.
Фекально-оральный путь
· Через зараженную питьевую воду (Нр способен выжить до 2 недель в холодной морской и речной воде).
· При употреблении в пищу сырых овощей, для поливки которых используется необработанная сточная вода.
Орально-оральный путь
· Имеются данные с высокой выживаемости Нр на зубном налете и в слюне.
· В результате заглатывания рвотных масс; Нр способен сохраняться некоторое время в желудочном соке.
· Наименее частый - через недостаточно продезинфицированные эндоскопы и щипцы для биопсии (ятрогенный путь передачи).
Реинфекция
Рецидив дуоденальной язвы после проведения терапии, направленной на эрадикацию Нр, часто связан с реинфекцией (повторным инфицированием).
Из результатов исследований частоты реинфекции в течение первого года после проведения соответствующего лечения (больные повторно обследовались каждые 12 месяцев), вытекает, что она колеблется в пределах от 0 до 35%. Ежегодный процент реинфекции имеет тенденцию уменьшаться до 3% и ниже спустя первый год.
Более высокие цифры частоты реинфекции в течение первого года, приводимые рядом исследователей, можно объяснить тем, что они наблюдали ложную реинфекцию, то есть обострение "старой" инфекции. Ложная реинфекция может наблюдаться:
· Когда после проведения эрадикационной терапии небольшое число микроорганизмов остается, но не выявляется при контрольном обследовании.
· В результате сохранения Нр в других отделах желудочно-кишечного тракта (например, на зубном налете, в слюне или фекалиях), что ведет к аутоинфекции желудка.ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НELICOBACTER PYLORI
Hp обнаруживается у лиц, страдающих следующими заболеваниями:
· Пептическая язва (язвенная болезнь; ЯБ)
· Гастрит
· Неязвенная диспепсия (НЯД)
· Рак желудкаУбедительных данных, свидетельствующих о причинной связи между Hp и развитием рефлюкс-эзофагита, а также язв, индуцированных приемом нестероидных противовоспалительных препаратов (НПВП), в настоящее время не существует.
Пептическая язва
От 90 до 100% лиц с дуоденальными язвами инфицировано Hp.
Изъязвление двенадцатиперстной кишки у Hp- отрицательных лиц обычно является результатом приема НПВП либо проявлением синдрома Золлингера-Эллисона.
При ЯБ желудка инфицированность Hp приближается к 85%.Прием НПВП- еще один важный этиологический фактор ЯБ желудка.Распространенность инфекции Hp становится еще выше, если ринимать в рассчет только подгруппу лиц с ЯБ желудка, отрицающих прием НПВП.
Самым убедительным доказательством роли Hp в патогенезе пептической язвы является положительная динамика в течении заболевания после проведения эрадикационной терапии. Прием антисекреторных препаратов быстро и эффективно заживляет язвы, но сразу после окончания их приема наблюдается рецидив.
Результаты многочисленных исследований подтверждают, что после успешного заживления дуоденальной язвы в течение первых 12 месяцев рецидив наблюдается примерно у 80% лиц, а через 1-2 года после окончания лечения он достигают 100%
После проведения эрадикационной терапии рецидив отмечается не более чем у 10% лиц в течение 1 года после окончания терапии
Гастрит
Чаще всего обострение хронического гастрита связано с Hp.
В ответ на внедрение Hp нейтрофилы мигрируют в интраэпителиальные и интерстициальные пространства, сюда же поступают лимфоциты, в том числе плазматические клетки. В биоптате, полученном в период обострения гастрита, когда в значительном количестве обнаруживаются нейтрофилы, неизменно выявляется Hp. Данная форма гастрита чаще локализуется в антральном отделе и отличается наиболее злокачественным течением. В тяжелых случаях в процесс может вовлекаться и тело желудка.
Неязвенная диспепсия (НЯД)
НЯД определяется как рецидивирующее чувство дискомфорта в области эпигастрия, часто связанное с приемом пищи без наличия морфологических признаков пептической язвы.
По данным статистики, НЯД страдает от 20 до 30% населения планеты.
Этиологическая роль Hp при НЯД остается неясной, существующие по этому поводу данные неоднозначны. Результаты многочисленных исследований свидетельствуют о большей частоте обнаружения Hp у лиц с НЯД по сравнению с теми, у кого последней нет. Однако достоверность результатов большинства этих исследований подвергается большому сомнению вследствие недостаточного количества исследуемых в контрольных группах.
Рак желудка
Между инфицированностью Hp и развитием хронического гастрита существует сильная корреляционная связь. При хроническом гастрите наблюдаются атрофия желудка и кишечная метаплазия, являющаяся предраковым состоянием. Однако обнаружение Нр в биоптатах рака желудка очень проблематично в связи с выраженной атрофией желудка и кишечной метаплазией, при которых невозможно поддержание популяции микроорганизма.
При этом эпидемиологические исследования показали, что распространенность Hp часто выше в регионах с высокой распространенностью рака желудка.
Из результатов проспективных исследований вытекает, что у лиц с серологически доказанным наличием инфекции риск развития рака желудка достоверно выше.
Более того, серологические исследования позволили выявить факт инфицирования Hp в прошлом у большого числа страдающих раком желудка. В связи с наличием вероятной связи между инфицированностью Hp и развитием рака желудка в 1994 году экспертами ВОЗ этот микроорганизм заненсен в 1 класс канцерогенов (класс достоверных канцерогенов).ВОПРОСЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ДИАГНОСТИКА
Диагностические тесты, направленные на выявление Hp,сведены в таблице 3.1.
Существует два типа тестов - инвазивные и неинвазивные. Для подтверждения успешности эрадикационной терапии указанные исследования должны проводиться не ранее пятой недели после ее завершения
Инвазивные тесты
Все эти исследования требуют проведения гастроскопии с биопсией желудка, при этом имеется три метода выявления Hp:
· культуральный
· гистологический
· быстрый уреазный тестКультуральный метод
Наличие даже одной бактерии в биоптате ведет к росту нескольких колоний,что позволяет установить точный диагноз. Культуры бактерий инкубируются в микроаэробной среде при температуре 370 С в течение 10 дней после чего проводится микроскопическая или биохимическая идентификация вида выросших бактерий.
Гистологический метод
Гистологичсекое исследование позволет установить точный диагноз, особенно в сочетании с культуральным методом или быстрым уреазным тестом.
При этом необходимо иметь в виду, что результаты исследований зависят от опытности специалиста, который их проводит. Специфичность гистологического исследования зависит от присутствия в биоптате бактерий других видов и от количества бактерий Hp.
Биоптат фиксируется в формалине. При использовании, например, серебросодержащих красителей, в частности красителя Вартина-Старри, и ткани и микроорганизм селективно окрашиваются, что помогает идентификации. В случае микроскопического исследования биоптата обычно просматривают несколько полей зрения. Исследование более одного препарата увеличивает чувствительность исследования.
Быстрый уреазный тест
Используемый в качестве скринингового метода во время проведения эндоскопического исследования уреазный тест позволяет получить результат в течение часа.
При инкубировании биоптата в течение 24 часов чувствительность теста увеличивается.
Биоптат желудка инкубируется в агаровой среде, содержащей мочевину. При наличии в биоптате Hp его уреаза превращает мочевину в аммиак, что изменяет рН среды и, следовательно, цвет индикатора. Тест-система CLOtest™ (Campylobacter-like Organism test, Delta West Ltd) позволяет производить уреазный тест.
www.coolreferat.com
висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день).
Вариант 4
Если пожилым больным невозможна полноценная эрадикационная терапия, применяют усечённые схемы:
Вариант 4А, длительность терапии 14 дней:
один из ИПН в «стандартной дозировке» +
амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день).
Вариант 4Б: висмута трикалия дицитрат по 120 мг 4 раза в день в течение 28 дней. При наличии болей в области желудка — короткий курс ИПН.
Вариант 5
При наличии аллергии к большому числу антибиотиков или если пациент отказывается от приёма антибактериальных препаратов, назначают курс продолжительностью 14 дней без антибиотков:
один из ИПН в «стандартной дозировке» +
30%-ный водный раствор прополиса (100 мл два раза в день натощак).
Вторая линия
Эрадикация Нр по схемам второй линии проводится в случае неуспеха терапии по одной их схем первой линии.
Вариант 1
Классическая четырёхкомпонентная схема, длительность терапии 10-14 дней:
один из ИПН в «стандартной дозировке» +
висмута трикалия дицитрат (по 120 мг 4 раза в день) +
метронидазол (по 500 мг 3 раза в день) +
тетрациклин (500 мг 4 раза в день).
Вариант 2
Четырёхкомпонентная схема, длительность терапии 10-14 дней:
один из ИПН в «стандартной дозировке» +
висмута трикалия дицитрат (по 120 мг 4 раза в день) +
амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
нитрофурановый препарат: нифурател (400 мг 2 раза в день) или фуразолидон (100 мг 4 раза в день).
Вариант 3
Четырёхкомпонентная схема, длительность терапии 14 дней:
один из ИПН в «стандартной дозировке» +
висмута трикалия дицитрат (по 120 мг 4 раза в день) +
амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
рифаксимин (400 мг 2 раза в день).
Третья линия
Проводится только при отсутствии результата от эрадикации Нр по второй линии и после определения чувствительности микроорганизма к определённым антибиотикам.
Возрастающая резистентность H. pylori к «стандартным» антибиоткам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса.
Отмечены случаи непродуктивности антибиотикотерапии хеликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков. Отмеченно появление полирезистентных к антибиотикам изолятов H. pylori, в том числе и кларитромицин-резистентных штаммов. Также отмечены случаи появления хинолон-резистентных штаммов H. pylori.
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44, препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori. Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели.
Критика теории решающей роли Helicobacter pylori в возникновении и развитии язвенной болезни желудка и двенадцатиперстной кишки
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы:
Ни сам Барри Маршалл, ни его последователи после самозаражения H. pylori ни разу не заболели язвенной болезнью, а только гастритом.
Как правило, язвенные дефекты встречаются в виде одиночных образований, хотя инфекция H. pylori может затрагивать значительную часть органа.
Инфекционная теория не объясняет цикличность заболевания: «рецидив-ремиссия-рецидив».
Процент заражённых H. pylori при тяжёлых формах язвенной болезни значительно меньше, чем при неосложнённых. Некоторые исследователи называют такие цифры: если при неосложнённой язвенной болезни двенадцатиперстной кишки инфицированные H. pylori составляют около 95 %, инфицированные H. pylori при неосложнённой язве желудка — 75-80 %, то при осложнённой рубцово-язвенным пилородуоденальным суб- и декомпенсированным стенозом язве, H. pylori имеются только у 50 % больных, осложнённых кровотечением — у 40 %, перфорацией — у 40-70 %.
Инфекционная теория не объясняет сезонность обострений язвенной болезни.
Имеются исследования, доказывающие на большом статистическом материале, что полная эрадикация H. pylori почти в два раза увеличивает вероятность развития рефлюкс-эзофагита, пищевода Баррета и кардиоэзофагеальной аденокарциномы, а также то, что наличие H. pylori в теле желудка снижает риск развития онкологических заболеваний кардиального отдела желудка.
Инфекционная теория не объясняет и не учитывает известные факты о нарушении секреции мелатонина у язвенных больных.
Отмечается, что в связи большим число носителей H. pylori (в России — до 75 % населения) после эрадикации отсутствуют какие-либо гарантии отсутствия реинфекции, более того, она весьма вероятна. Критики инфекционной теории обычно подходят к язвенной болезни, как к системному гастроэнтерологическому заболеванию, в развитии которого играют важнейшую роль, в том числе, психосоматические и психосоциальные факторы.
Вывод
Таким образом Helicobacter pylori– это бактерия, которая населяет слизистую желудка как у здоровых людей так и у больных. Трудно сказать, почему у одних хеликобактер пилори приживается и приводит к болезни, а у других мирно существует всю жизнь. Но именно хеликобактер пилори приписывают 95% всех случаев хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки.
Далеко не все микроорганизмы могут жить в такой среде как соляная кислота, многие из них погибают в течение нескольких минут, но только не хеликобактер. Бактерия очень хорошо приспособлена к жизни в среде с повышенной кислотностью, а вот при снижении последней она может и погибнуть.
Геликобактер пилори паразитирует в защитной слизи желудка и на его клетках, оказывая прямое повреждающее действие. Кроме этого геликобактер пилори для выживания в кислой среде вынуждена создавать вокруг себя щелочную среду, таким образом, бактерия может разрушать защитный барьер, тем самым открывая доступ соляной кислоты к незащищенным участкам желудка.
Геликобактер пилори обнаруживается у 20% людей старше 40 лет и у 50% людей старше 60 лет. Заражение геликобактер пилори происходит так же, как и любой другой кишечной инфекцией: грязные руки, бытовой путь и даже при поцелуях, ведь источником этой инфекции является больной человек.
Список литературы:
referat911.ru
1. Андерсен Л.П. Новые виды рода Helicobacter у человека. //Росс. журн. гастроэнтерол. гепатол. колопрактол. -2003. -Т. 13. -№ 2. -С. 19-23
2. Аруин JI. И. Helicobacter pylori и предраковые изменения желудка. //Диагностика и лечение.- М.-1999.- С. 33-35.
3. Аруин Л.И. Helicobacter pylori в патогенезе язвенной болезни: что известно и что понять предстоит. //Материалы 6-ой сессии Росссийской группы по изучению Helicobacter pylori. -Омск. -1997.-С. 2-3.
4. Аруин Л.И. Новая классификация гастрита. //Арх. патологии.-1997.-№3.-С. 1-10.
5. Аруин Л.И. Роль Helicobacter pylori в формировании морфологического субстрата язвенной болезни. //Материалы 6-ой темат. сессии Российской группы по изучению Helicobacter pylori. -Уфа.- 1999.-С.' 7-10.
6. Аруин Л.И., Григорьев П.Я., Исаков В.В. и др. Хронический Гастрит. //Амстердам.-1993. -362 с.
7. Аруин Л.И., Исаков В.А. Метод оценки обсемененности слизистой оболочки желудка Н. pylori. //Арх. патологии.- 1995.-№ З.-С. 75-76.
8. Аруин Л.И., Капуллер Л.Л., Исаков В.А. //Морфологическая диагностика болезней желудка и кишечника. М.-1998 -481 с.
9. Возбудители эширихиозов, дезинтерии, геликобактериозов и кампилобактериозов. //Руководство к практическим зханятиям по микробиологии, вирусологии и иммунологии. Под ред. В. В. Тец. —М.: Медицина. -2002.
10. Выхристюк О.Ф., Щербаков П.Л., Самсыгина Г.А. и др. Эпидемиологический взрыв у детей из социально неблагополучных семей, воспитывающихся в условиях изолята. //Матер. 6 конф. «Актуальные проблемы абдоминальной патологии у детей»- М. — 1999.-С. 92.
11. Го М. Инфекция Н. pylori: существует ли связь между геномоммикроорганизма и наличием заболевания? //Лечение идиагностика. М-1999 -С. 2-3
12. Говорун В.М., Гущин А.Е., Исаков В.А. и др. Молекулярная диагностика и генотипирование pylori в биопсиях слизистой оболочки желудка. // Росс. журн. гастроэнтерол. гепатол. колопрактол. 2000.-Том 10 .-№2.- .-С. 12-15.
13. Говорун В.М., Мамыпальцев К.Т., Смирнов О.В. и соавт. Современные подходы к молекулярной диагностике и типированию клинических изолятов Helicobacter pylori в России. //Рос. журн. гастроэнтерол. гепатол. колопроктол. -2002. -Т. 12. -№ 3. -Стр. 52-56.
14. Григорьев П.Я. Клинические аспекты пилорического хеликобактериоза.- М. 1996 -№1.-С. 33.
15. Домарадский И.В., Исаков В. А. О персистенции Helicobacter pylori в окружающей среде (гипотеза). //Диагностика и лечение. -М.-1999.-С. 54.
16. Жукова Е.А. Применение омепразола у детей. //Диагностика и лечение.-М.- 1999.-С. 27-29.
17. Заика Г.Е., Постникова Е.И., Бурмистрова А.Д. О некоторых вопросах диагностики хеликобактериоза у детей. //Диагностика и лечение заболеваний.- М. -1999.-С. 86-88.
18. Запруднов A.M. Гастродуодениты у детей (патогенез", клиника,диагностика и лечение). //Диссертация.докт. мед. наук. -М. -1986 386 с.
19. Захаров Н.А., Тарасов В.Н., Лысенко В.Г. Хеликобактер-ассоциированные гастродуодениты у детей. //Росс. журн. гастроэнтерол. гепатол. колопрактол. -1996.-№4 (Приложение 3).-С.274-275.
20. Исаков В.А. Новые технологии в диагностике инфекции Н. pylori. // Материалы 2 международного симпозиума. //Диагностика и лечение. -М.-1999. -С. 12-14.
21. Исаков В.А. Молекулярно- генетические основы патогенности Helicobacter pylori. //Рос. журн. гастроэнтерол. гепатол. колопрактол. -2002. -Т. 12. -№ 6. -Стр. 82-86.
22. Климанская Е.В., Возжаева Ф.С., Новикова А.В. и др. Клинико-эпидемиологическое наблюдение при хроническом- гастодуодените у детей, проживающих в условиях мегаполиса //Росс. журн. гастроэнтерол. гепатол. колопрактол. -1997.(Приложение.№ 4).-С.193.
23. Коваленко Т.В. Сравнительная оценка эффективности уреазного теста для диагностики Helicobacter pylori в слизистой оболочке полости рта и желудка. // Росс. журн. гастроэнтерол. гепатол. колопрактол. -2004. -№ 6. -Стр.
24. Корниенко Е.А., Дмитриенко М.А., Ломакина Е.А. Аммиачный дыхательный тест в диагностике инфекции Helicobacter pylori. //РЖГГК. -2002. -№ 5. -Т. 12.
25. Корсунский А.А., Щербаков П.Л., Исаков В.А. Хеликобактериоз и болезни органов пищеварения у детей. -М. ИД: «Медпрактика». -2002. -168 с.
26. Кудрявцева Л.В. Бактериологическая диагностика H.pylori. //Материалы 3-й Всероссийской научно-практической конференции «Генодиагностика в современной медицине».- М.-2000.-С.45.
27. Кудрявцева Л.В. Динамика резистентности штаммов H.pylori у городского населения России 1996-1998 годах и ее клиническое значение //Материалы тематической сессии Российской группы по изучению H.pylori -Уфа. -1999. -С.23-25.
28. Кудрявцева Л.В. Изучение диагностической ценности различныхметодов диагностики хеликобактериоза. //Авто. дисс.канд. мед. наук.-М. -1999. -23 с.
29. Макаренко Е. В. Клиническое значение факторов патогенности Helicobacter pylori. // Росс. журн. гастроэнтерол. гепатол. колопрактол.-2005.-№3.-Стр. 48-51
30. Минаев В.И., Несвижеский Ю.В., Воробьев А.А. и др. Проблемы диагностики H.pylori при гастродуоденальных заболеваниях.// Матер.б-ой сессии Российской группы по изучению Н. pylori. -Омск.1997,-С. 10-18.
31. Морозов И.А. Морфологическая диагностика хронического гастрита и инфекция Helicobacter pylori в желудке //Диагностика и лечение:,.-1998.-М.-С.2-3.
32. Нургалиева Б.К. Частота и патогенетическое значение. cagA-позитивных штаммов Н. pylori при хроническом гастрите и язвенной болезни в различных возрастных группах. // Росс. журн. гастроэнтерол. гепатол. колопрактол. -2005. -Т. 15. —№ 6. -Стр. 42-45
33. Пасечников В.Д. Полимеразная цепная реакция в диагностике Н. pylori- ассоциированных заболеваний. //Диагностика и лечение. -М1998.-С. 8-10.
34. Пиняева Е.Г. Роль «семейного фактора» в эпидемиологиихеликобактериоза. Дисс. .канд. мед. наук.-М. 1999.-35 с.
35. Род Helicobacter. В кн.: Медицинская микробиология. Под ред. В.И. Покровского, O.K. Поздеева. /М: ГЭОТАР МЕДИЦИНА. -1998. -С. 459-62.
36. Ропкас Ф. Инфекции Helicobacter pylori как фактор риска рака желудка: современные доказательства. //Росс. журн. гастроэнтерол. гепатол.колопрактол. -2002. -Т. 12. -№ 3. -С. 71-74.
37. Самсонов А.А., Маев И.В. Эффективность использования коллоидного субцитрата висмута при язвенной болезни двенадцатиперстной кишки. //Рос. журн. гастроэнтер. гепатол. гастроэнтерол. -2002. —Т. 12. —№ 6. — Стр. 30-36.
38. Саторов С. Микробиологическая и генетическая характеристика возбудителей брюшного тифа, выделенных в различных природно-климатических регионах. //Автореф. дисс. д.м.н., Санкт-Петербург. -1998. -24 с. л.
39. Сафонова Н. В. Актуальные проблемы хеликобактериоза. // Ст.-Пб. -1995.-С. 18.
40. Сафонова Н.В., Жебрун А.Б. Гастрит, язвенная болезнь и хеликобактериоз. //Санкт-Петербург -1995.-С. 35.
41. Семин С.Г. Клиническое значение полимеразной цепной реакции вдиагностике семейного хеликобактериоза. //Дисс. канд. мед. наук 1. Москва. -2000. -128 с.
42. Суворов А.Н. Генетическая характеристика патогенных стрептококков группы А и В. //Автореф. дисс. . д.м.н. -Санкт-Петербург. -1997. -30 с.
43. Херрингтон С., Магки Дж. Молекулярная клиническая диагностика.-М.-«Мир».-1999.-С. 13-14.
44. Ценева Г.Я., Рухляда М.В., Назаров В.Е. и соавт. Патогенез, диагностика и лечебние инфекции, обусловленной Helicobacter pylori.
45. Санкт-Петербург. -2003. -96 с.
46. Шац И.А., Микуева Т.Н, Гончар и др. Распространенность геликобактериозной инфекции при хронической гастродуоденальной патологии у детей. // Росс. журн. гастроэнтерол. гепатол. колопрактол. 1997.- №5.(Приложение 4).-С.67.
47. Шептулин А.А., Марданова О.А. Обсуждение проблемы инфекции Helicobacter pylori в ходе Европейской гастроэнтерологической недели. // Росс. журн. гастроэнтерол. гепатол. колопрактол. -2004. -Т. 14. -№ 1. -Стр. 88-91.
48. Штыгашева О.В., Цуканов В.В. Ассоциация cagA и vacA штаммов Helicobacter pylori и язвенной болезни в организованной популяции г. Абакана. // Росс. журн. гастроэнтерол. гепатол. колопрактол. -2004. -Т. 14.-№2.-Стр. 84-88.
49. Штыгашева О.В., Цуканов В.В. Распространенность инфекции Helicobacter pylori и частота диспептических жалоб у населения Хакасии. // Росс. журн. гастроэнтерол. гепатол. колопрактол. -2004. -Т. 14.-№ 1. -Стр. 33-36.
50. Щербаков П.Л. Резистентность Н. pylori к антибиотикам у детей: причины развития и пути коррекции. //Материалы 2-ого межд. симпозиума //Диагностика и лечение.-М -1999.-С. 20-22.
51. Щербаков П.Л. Хеликобактериоз лечение после эрадикации.// Росс, журн. гастроэнтерол. гепатол. колопрактол. -Том 10. -№2. -М.- 2000.-С. 97-98.
52. Щербаков П.Л., Квиркелия М.А., Волков И.А. и др. Эпидемиология пилорического геликобактериоза. //Диагностика и лечение. -1996- №. 12-С. 25-31.
53. Щербаков П.Л., Филин В.А., Мазурин А.В. Актуальные проблемы пилорического геликобактериоза на современном этапе. //Педиатрия.-1997.-№1.-С. 7-10.
54. Aim R. A., Ling L., Moiz D. Т. et al. Genomic sequence comparison of twounrelated isolates of the human gastric pathogen Helicobacterpylori. //Nature. -1999. V. 397. -P. 176-180.
55. Abasiyanik M.F., Sander E., Salih B.A., Helicobacter pylori anti-CagA antibodies: Prevalence in symptomatic and asymptomatic subjects in Turkey //Canad. Journ. of Gastroenterology -2002.-Vol. 16, -P. 233-238
56. Abasiyanik M.F., Tunc M., Salih B.A., Enzyme immunoassay and immunoblotting analysis of Helicobacter pylori infection in Turkish asymptomatic subjects. //Diagnostic Microbiology and Infectious Disease.-2004. -V. 50. -P. 173-177
57. Aktan S., Salih B.A., Fluorescent in situ hybridization (FISH) for the detection of bacterial community in activated sludge from textile factories. //Environmental Technology. -2005 -Vol.45. -P. 119-123.
58. Ansorg R., Von Heinegg E.H., Von Recklinghausen G. Cat owners' risk of acquiring a Helicobacter pylori infection. //Zentralbl Bakteriol 1995: -283. -№ l.-P. 122—126.
59. Ashour A.A, Collares GH, Nogueira AM ее al. iceA genotypes of Helicobacter pylori strains from Brazilian children and adults. //Clin. Microbiol. -2001. -V. 39. -P. 1746-1750.
60. Aspinal G.O., Monteiro M.A., Pang N. et al. Antigen chains in the Iipolisaccaride ofhelico-bacter pylori NCCT, 11637. Carbohydr. //Left.-1995.-V. l.-P. 151-156.
61. Atherton J.C, Cao P, Peek K.M., at al. Mosaicism in vacuolating cytotoxin alles of Helicobacter pylori: association of specific vacA types with cytotoxin production and peptic ulceration. //J. Rial. Chem. -1995. -V. 270. P. 1771-1777.
62. Atherton J.C, Cover TL, Twells K. Simple and accurate PCR-based system for typing vacuolating cytotoxin alleles of Helicobacler pylori. //J. Clin Microbiol. -1999. -V. 37. P. 2979-2982.
63. Atherton J.C., Peek R. M., Tham K. T.et al. Clinical and pathological importance of heterogeneity in vacA, the vacuolating cytotoxin gene of Helicobacter pylori . //Gastroenterology -1997. -V.112.-P. 92-99.
64. Aucher P., Petit M. L., Mannaht P. R. et al. Use oflmmunoblot assay to define serum antibody patterns associated with Helicobacter pylori infection and with H. pylori -related ulcers.//J.of Clin. Microb. 1998. -April. -P.931-936.
65. Aydin F., Kaklikkaya N., Ozgur O. at al. Distribution of vacA and cagA ststus of Helicobacler pylori in peptic ulcer disaese and non-ulcer dispepsia. //Clin.Microbiol. and Infect. -2004. -V. 10. -N 9. -P. 1102-1104.
66. Bakka AS, Salih BA, "Prevalence of Helicobacter pylori infection in asymptomatic subjects in Libya." // Diagnostic Microbiology and Infectious Disease -2002. Vol. 43. - No. 5. P. 265-268
67. Banatvala N., Clements L., Abodi Y. Et al. Migration and Helicobacter pylori seroprevalence: Bangladeshi migrants in the V. K. //J. Infect-1995.-V. 31.-P.133-135.
68. Bardhan P.K. Epidemiological fentures of Helicobacter pylori infection in developing countries. //Clin. Infect. Dis. -1997. -V.25. -P.973-978.
69. Bauerfeind P., Gamer R.M., Mobley HLT. Allelic exchange mutagenesis of nix A in Helicobacter pylori results in reduced nicked transport and mease activity. //Infect Iuman.-1996.-V. 64. -P. 2877-2880.
70. Beales I., Calam J., Post L. et al. Effect of transforming growth factor 1 and interleuking 8 on somatostatin release from canine fundic D cells. //Gastroenterology -1997. -VI12. -P. 136-143.
71. Bermejo F, Boixeda D, Gisbert JP, et al. Rapid urease test utility for Helicobacter pylori infection diagnosis in gastric ulcer disease. //Hepatogastroenterology. -2002. V. 49. P. 572-575.
72. Bertoni F., Carraniga G., Bosshard G. et al. Immunoglobulin heavy chain diversity genes rearrangement pattern indicates that Malt type gastric lymphome В cells have undergone an antigen selection process. //Br. J. Haematol. -1997. -V. 97. -P. 830-836.
73. Bizzozero G. Ueber die schlauchformigen drusen des magendarmkanals und die bezinhun-gen ihrers epitels zu dem oberflashenepithel der schleimhaut. //Arch F.Mirk.Anayo. -1893. -Bd.42. -P. 82.
74. Bjorkholm B, Lundin A, Sillen A. et al. Comparison of genetic divergence and fitness between two subclones of Helicobacter pylori. //Lnftxt Immun 2001.-V. 69.-P. 7832-7838.
75. Bjorkholm В., Befrits R., Jaup B. et al. Rapid PCR dection of Helicobacter pylori-associated virulence and resistance genes directly from gastric biopsy material. //J. of Clin. Microb. -1998. -№12. -V. 36. -P. 3689-3690.
76. Blaser M. J. Helicobacter pylori and pathogenesis of gastroduodenal inflamation. //J. Infect. Dis.-1990. -V.161. -P. 626-633.
77. Blaser M. J.} Perez-Perez G. I., Kleanthous H. et al. Infection with Helicobacter pylori strains possessing CagA s associated with an increased risk of developing adenocarcinoma of the stomach. //Cancer Res -1995 -V. 55. -P.2111-2115.
78. Bojan Tepes, Marija Gubina. Reasons for therapeutical failure in treatment Helicobacler pylori infection and therapeutic posoibilies. //Zdarv. Vestn. -2004.-V. 73. P. 503-6
79. Bonamico M., Maziani P., Magliocca F.M. et al. Helicobacter pylori: duodenal colonization in children . //Ada Pediatr. -1997. -V. 86. -P. 356-360.
80. Boren Т., Falk P., Roth K.A. et al. Attachment of Helicobacter pylori to human gastric epitelium mediated by blood group antigens. //Science -1993. -V. 262.-P. 1892-1895.
81. Brecker U. Helicobacter pylori- associated gastroduodenal disease in childhood. //South Med J. -1997. -V.90. -P.5 70-576.
82. Breuer Т., Sudhop Т., Hoch J. et al. Prevalence of and risk factors for
83. Helicobacter pylori infection in the western port of Germany. Ev.
84. J. Hepatol -1996. -V. 8 -P. 47-52.
85. Catalano H.I., Matteo M., Barbolla M., et al. Helicobacler pylori vacA genotypes, cagA status and ureAB polymorphism in isolates recovered from an Argentinean population. //Diiign. Microbiol. Infect. Dis. -2002. V. 4. P. 205-210.
86. Censini S. Lange C.,Xiang Z. Y. Et al. Cag, a pathogenicity island of Helicobacter pylori, encodes typil-specitic and disease-associated virulence factors. Proc. //Nate Acad.Sci USA. -1996. -V.93. -P.1448-14653.
87. Censini S., Lange C., Liang Z. Et al. Cag, a pathogenicity island of H. pylori, encodes type 1-specific and disease- associated virulence factors. //Proc. Natl. Acad. Sci USA. -1996. V.93. P. 14684-14653.
88. Cover T.L., Glupczynski Y, Lage A.P. et al. Serologic detection of infection with cagA+ Helicobacler pylori strains. //J.Clin. Microbiol -1995; -V. 33: 1496-1500.
89. Craham D.Y., Klein P.D., Opecun A.R. Effect of ege on the frecuency of active Campylobacter pylori infection diagnosed the 113 (urea breath test in normal subject and patients with peptic ulcer dissease. //Infect.dis., -1998. V.43.-P. 777-780.
90. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. European Helicobacter pylori Study Group. Gut -1997. -V. 4. N 1. -P. 8—13.
91. Cutter A.F.,Havstad S., Ma C. et al. Occurasi of invasive and non-invasiv test to diagnosis Helicobacter pylori infection. //Gastroenterol. -1995. -V.109. -P. 136-141.
92. Day AS, Jones NL, Lynett JT, et al. cagE is a virulence factor associated with Helicobacter pylori-induced duodenal ulceration in children. //J Infect Dis. -2000. -V. 181. -P.1370-1375.
93. De Paole P., Tomasini M.L., Basaglia G. The predective value of Helicobacter pylori in-vitro metranidasole resistance. //Clin. Microbiol, and Infect. -2004.-V. 10. -N 12. -P. 1005-1006.
94. Dixson M.F. Campylobacter pylori and chronik gastritis. -In.: Rathbone B.J., Heatley R.V. (eds). Campylobacter pylori and gaestroduodenal desease. -Blackwell. -Oxford. -1989. -P136-141.
95. Dice R.L. Measures of the amount of ecological association between species. //J. Ecol -1995. -V. 36. -P. 297-302.
96. Drazek E. S., Dubois A., Holmes R. K. et al. Cloning and characterization of hemolitic genes from Helicobacter pylori. //Infect human. -1995. -V. 63. P. 4345-4349
97. Eaton K.A., Krakowka S. Aviralent, ureasa- deficient Helicobacter pylori colonises gastric epitelial explants ex vivo. //J. Gastroenterol. -1995. -V. 30. P.434-437.
98. Eltumi M., Brueton M. J., Francis N. Clinical association of Helicobacter pylori: gastritis in children (leter). //South. Med. J. -1997. -V.90. P.461-462
99. Esk M., Schmanber В., Hass K. et al. MALT-type lymphoma of the stomach is assoieted with Helicobacter pylori straius expressing the Cag A protein. //Gastroeterology -1997.-V. 112.-P.1482-1486.
100. Fallone CA: Epidemiology of the antibiotic resistance of Helicobacter pylori in Canada. //Can J Gastroenterol -2000. -V. 14. -N 10. -P. 879-82.
101. Figueiredo C., Quint W., Nouhan N. et al. Assessment of Helicobacter pylori vacA and cagA genotypes and host serological response. //Clin. Microbiol. -2001.-V. 39. -P. 1339-1344.
102. Figura N., Tabaqchali S. Bacterial pathogenetic factors. Cur. Opin //Gastroenterol -1996. -V. 12. P.33-36.
103. Fischer W, Puis J, Buhrdorf R, et al. Systematic mutagenesis of the Helicobacter pylori cag pathogenicity island: essential genes for CagA translocation in host cells and induction of interleukin-8. //Mol Microbiol. -2001.-V. 42. -P.1337-1348.
104. Fndriks 1., von Bothmer С., Holm M. at al. Water extract of Helicobacter pylori inhibitis duodenal mucosal alka line secretion in anaesthetized rats.//Gastroenterol-1997.-V. 113. -P. 1570-1575.
105. Fox J.G. Non-human reservois of Helicobacter pylori. //Aliment. Pharm.Iher. 1995.(Suppl. 2) -V. 9. -P.93-103.
106. Fujimoto S., Marshall B. and Blaser M.J. PCR-based restriction fragment length polymorphism typing of Helicobacter pylori. //J.Clin.Microbiol. -1994. -V. 32. -N2. -P. 331-334.
107. Gasbarini G.s Pretolani S., Bonvicini F. et al. A population based study of Helicobacter pylori infection in a European country : the San Marino Study Relations with gastrointestinal I disease. //Gut -1995. -V. 36. -P. 838-844.
108. Glupezvnski Y., Megraund F., Anderson L. P. Et al. Antibiotic susceptibility of Helicobacter pylori in Europe in 1998. Results of the third multicentre study. //J. Gut Sept. -1999.( Suppl. № 3 -V. 45. -P. 105.
109. Gold B.D., Khanna В., Huang L.M. et al. Helicobacter pylori: acquisition in infancy after decline of maternal passive immunity. //Pediatr, Res. -1997. Vv У41.-P. 641-646.
110. Goldstoun A.R., Quirke P., Dixon M.F. Helicobacter pylori infection and gastric cancer. //J. Pathol. -1996. -V.179. -P. 129-137.
111. Gonzales-Valencia J.C., Atherton J.C., Munoz O., at al. Helicobacler pylori vacA and cagA genotypes in Mexican adults and children. //J. Infect Dis -2000.-V. 192. -P. 1450-1454.
112. Goodman K. J., Correa P., Tengana A. H. et al. Nutritional factors and Helicobacter pylori infection in Colombian children. //J.
113. Pediatr.Gastrenterol. Nutr. -1997 -V. 25. -P. 507-515
114. Goodwin C.S., Blincow E.D., Warron J.R.et al. Evaluation of cultural techniques for isolating Campilobacter pyloridis from endoscopie biopsies of gastric mucosa. // J.Clinicol Pathol.-1985 -V38. -P. 1 127-1131.
115. Guruge J.L., Falk P.G., Lorens R.G. at al. Epithelial attachment alters the outcome of Helicobacter pylori infection. //Proc. Nalt. Acad Sci. USA.-1998- V. 95. -№ 7. P. 3925-3930.
116. Graham DY, Malaty HM, Cole RA, et al. Simplified 13C-urea breath test for detection of Helicobacter pylori infection. //Am J Gastroenterol. -2001. V. 96.-P. 1741-1745.
117. Grahan D. Y., Ervin A.,Reddy G. et al. Seroepidemiologi of H. pylori infection in Indiia. //Dig. Dis. Sei -1991. -V. 36. -P. 1084-1088.
118. Gramley W., Asghar A., Friezson H. et al. Detection of Helicobacter pylori DNA in fecal samples from infected individuals. //J. of Clin. Microb. -1999. -N 7 -P. 2236-2240.
119. Hamlet A., Olbel. The influence of Helicobacter pylori infection postprandical duodenum acid load and duodenal bulb. //Gastroenterology -1996.-V. 111.-P. 391-400.
120. Han S.R., Zschausch H.C., Meyer H.G.W. et al. Helicobacler pylori clonal population structure and restricted transmission within families revealed by molecular typing. //J. Clin. Microbiol. -2000. -V. 38. -V. 3646-3651.
121. Harris P. R., Mobley H.L.T., Perez-Perez G.I., Blaser M.S.et al. Helicobacter pylori: urease is a poteut stimulus of mononuclear phagocyte activation and inflammatory cytokine production. //Gastroenterology -1996 -V. II l.-P. 49-425.
122. Heep, M. Kist, S. Strobel, D. Beck, N. Lehn. Secondary Resistance Among1.olates of Helicobacter pylori After Failure of Therapy.//Eur. J.
123. Clin. Microbiol. Infect. Dis. -2000. -V. 19. -P. 538-541
124. Hermann В., Volker A., Christa S. at al. Helicobacter pylori Infection a Necessary Condition for Noncardia Gastric Cancer? //Am. J. Epidemiol -2004. -V. 159. -N. 3. -P.252-258
125. Holcombe C. Helicobacter pylori: the African enigma. Gut. -1992. -V.33. -P. 429-431.
126. Instituto National de Estadisticas у Censos (INDEC). //Argentina— Statistical Sinopsis Buenos Aires: INDEC. -1999. P.131.
127. Ito S., Azuma Т., Muzakita H. et al. Profile of Helicobacter pylori cytotoxin derived from two areals of Japan with different prevalence of atrophic gastritis. //Gut -1996. -V. 39. -P. 800-806.
128. Ito S., Kohli Y., Kato T.et al. Differences in urease activity in live Helicobacter pylori cultured from patients with gastroduodenal diseases.// Eur J. Gastroenterol, Hepatol.-1995. -V.7 (Suppl.3). -P.8-88.
129. Ito Y, Azuma T, Ho S. at al. Analysis and typing of me A gene from cagA-positive strains of Helicobacler pylori isolated in Japan. //Clin. Microbiol. -1997.-V. 35.-P. 1710-1714.
130. Ito Y, Azuma T, Ho S. at al. Sequence analysis and clinical significance of iceA gene from Helicobacler pylori strains in Japan. //J. Clin. Microbiol -2000. V. 38.-P. 483-488.
131. Jesch I., Kindermann A., Krauss-Etshmann S. Prevalence of Claritromycin-resistant H. pylori-strain in children: effect on therapy. //J. Gut. -1995. -(suppl.3). -V.4.-P. 93.
132. K.E.L.McColl Screening for early gastric cancer //Gut -2005. V. 54. N 6. P. 740 742
133. Kartia M. Tsuda M., Nakasava T. Essential role of urease in vitro and in vivo. Helicobacer pylori colonisation using a wild-type and isogenic urease mutont strain. //J. Clin. Gastroenterol. -1995. -V.21 (suppl.l). -V. 160, P. 163.
134. Kersulyte D., Chalkauskas H., Berg D.E. Emergence of recombinant strains of Helicobacler pylori during human infection. //Mol. Microbiol -1999. -V. 31. P. 31-43.
135. Kersulyte D., Mukhopadhyay A.K., Velapatino B. at al. Differences in genotypes of -Helicobacter pylori from dillerent human populations. //Bacterial -2000. -V. 182. -P. 3210-3218.
136. Kim S.Y., Than W.W., Young M.et al. Genotyping cagA, vacA subtype, iceA, and babA of Helicobacler pylori isolates from Korean patients, and their association with gastro-duodenal diseases. //Korean Mad. Sci. -2001. V. 16.-P. 579-584.
137. Kivi M., Tindberg Y, Sbrberg M. et al. Concordance of Helicobacler pylori strains within families. //J. Clin. Mikrobiol. -2003. -V. 41. P. 5604-5608.
138. Kivi M., Tindberg Y., Bentsson c. at al. Assessment of the pathogeniciti island status of Helicobacler pylori infection with serology and PCR. //Clin. Microbiol. And Infect. -2005. -V. 111. -P. 66-67
139. Klein P. D., Graham D. Y., Gaillour A.et al. Water sourece as risk factor for Helicobacter pylori infection in Peruvian children. Gastrointestinal Physiology Worning Group. //Lanset -1991. -V. 337. -P. 1503-1506.
140. Klein P.D., Gilmar R.H., Leon B.R. et al. The epidemiology of Helicobater pylori in Peruvian children betwen 6 and 30 moths of age. //Am. J. Gastroenterol. -1994. -V. 89. -P. 2196-2200
141. Konturer P.C., Bzzozowski T, Konturer S.J.et al. Mouse model of Helicobacter pylori infection: studies of gastric infection and ulcer healing .//Aliment. Pharmacol Ther.-1999.-V.13.-P.333-346.
142. Labenz J., Blum A., Bayerdorffer E.et al. Helicobacter pylori infection in \ patients with duodenal ulcer provoke reflux esophagitis. //Gastroenterolagy1997.-V. 112.-P. 1442-1447.
143. Lee A., Correa P., Roa S. et al. The first evidence of displasia and possibly gastric cancer caused by natural Helicobacter infection in an animal model. // Gut. -1998 -V. 43 (Suppl. 2). -P. 66.
144. Lee A., Megrand F., Helycobacter pylori: techniques for clinical diagnosis and besic reserch. //Saunder. -London -1996. -P.305
145. Lehmann F.S, Terracciano L., Carena I. et al. In situ correlation of cytokine secretion and apoptosis in Helicobacter pylori-associated gastritis. //Am J Physiol Gastrointest Liver Physiol. -2002. V. 283. -P.481-488.
146. Li L, Graham DY, Gutierrez О cf nl. Genomic fingerprinting and genotyping of Hclicuhacter pylori strains from patients with duodenal ulcer or gastric cancer from different geographic regions. //Diagn. Dis. Sci. -2002. -V. 47. P. 2512-2518.
147. Logan R. P., Walker M.M., Miseiewicz J.J. et al. Changes in the ingastric distribution of Helicobacter pylori during treatment with omeprasol. .//J. Gut -1995.-V.36.-P. 12-16.
148. Logan R: Epidemiology could yield new ways to manage H. pylori infection. Lancet -1999. -V. 354 -P. 1006
149. Maeda S, Yoshida H, Ogura K, et al. Helicobacter pylori specific nested PCR assay for the detection of 23 S rRNA mutations associated with clarithromycin resistance. //Gut. -1998. V. 43. -P. 317-321.
150. MakkistathisA., Pasching E., Schutze K. at al. Detection of Helicobacter pylori in stool specimens by PCR and antigen immunoassay. //J. of Clin. Mirob. -1998. -№ 9. -P. 2772-2774.
151. Marray L. J., Bamford К. В., O'Reilly D. P., McCrum E. E. et al. Helicobacter pylori infection: relation with cardiovascular risk factors. //Br. Heart J. -1995. -V. 74. P. 497-501.
152. Marshall B. J., Goodwin C.S. Revised nomenclature Campilobacterpyloridis. //Inter. System. Bacter.-1987.-V.37. -P.68.
153. Marshall В., Armstrong J., McGedne D. et al. Attemp to fulfill Koch's postuletes for pylori Campilobacter. //Med.J.Australia.-1985. -V142. -P.436-439
154. Marshall B.J. Experimental models in vitro for Campilobacter pylori. // Gastroenterol. CI in.В iol. -1989. -V13. -P50-52
155. Marshall B.J. Experimental models in vivo for Campilobacter pylori. Gastroenterol Clin Biol -1989. -V.13. -P. 50-52.
156. Marshall B.J., Warren J.R. Unindencifield curved bacilli in the stomach of patient with gastritis and peptic ulceration // Lancet.- 1984.- Vol. 1.- P.l311.
157. Marshall D.G., Dundon WG, Beesley SM, Smyth CJ. Helicobacter pylori—a conundrum of genetic diversity. //Microbiology. -1998. -V. 144. P. 29252939.
158. MisiewiczJ.J., Tytgat G.N., Goodwin C.S. et al. The Sydney system : a new classification of gastritis. 9-th Congress of Gastroenterology. Working party reports.-Blakwell.-Melbum. -1990.-P. 1-10
159. Mitchell H.M., Li Y. Y., Hu P. J. et al . Epidemiology of Helicobacter pylori in southern China: identification of early children of the critical period for acquisition. //J. Infect. Dis. -1992. V. 166. - P. 149-153.
160. Mobley H.L.T., Ysland M. D., Hausinger R. P. Molecular biology of microbiol ureases. //Microbiol Rev -1995. -Y.59. -P. 451-480.
161. Monteiro L., Grass N., Vidal r. at al. of Helicobacler pylori in Human fecesby PCR: applications of a techniqu.to remove PCR inhibitors //J. Gut. Sept. -2002. -V. 45 (Supll/ 3). -P. 124.
162. Mueller A, Falkow S. and Amieva M. R. Helicobacter pylori and Gastric Cancer: What can be Learned by Studyingthe Response of Gastric Epithelial Cells to the Infection?
163. Cancer Epidemiol. Biomarkers Prev. -2005. V. 14. -N 8. P. 1859 1864.
164. Mukhopadhyay A.K., Kersulyte D., Jeong J.Y. et al. Distinctiveness of genotypes of Helicobacter pylori in Calcutta, //India. Bacterial. -2000. V. 182. P. 3219-3227.
165. Muzakita H., Hizai M., Ito S. et al. Cytotoxin and increase activities of Helicobacter pylori isolates from Japanise patients with atrophic gastritis or duodenal ulcer. //J. Gastroenterol. Hepatol.-1996 -V. 11. P. 819-824.
166. Nilsson C., Sillen A., F.riksson L. at al. Correlation between cag pathogenicity island composition and Helicobacler pylori -associated gastroduoderml disease. //Infect. Immun. -2003. V. 71. -P. 6573-65S1.
167. Palmer E.D. Gastritis: a revolution. //Medicine -1954. -V. 33. -P. 199.
168. Park C.Y., Cho Y.K., Kodama T. et al. New serological assay for detection of putative llclicolmcter pylori virulence factors. //Clin. Microbiol. -2002. -V. 40.-P. 4753-4755.
169. Peek R. M., Mass S. F., Tham К. Т., Perez-Perez G. J.et al. Helicobacter pylori Cag+strains and dissociation of gastric epithellial cell proliferation from apoptosis. //J. Natl. Cancer lust. -1997. -V. 89. -P. 863-868.
170. Perez-Perez G. I., Bhat N., Baensboner J et al. Country specific constancy by age in Cag A+proportion of Helcobacter pylori infections. //Int. J. Cancer -1997.-V. 72.-P. 453-456.
171. Perri F, Festa V, Merla A, at al. Amoxicillin/tetracycline combinations are inadequate as alternative therapies for Helicobacter pylori infection. //Helicobacter-2002. V. 7. P. 99-104.
172. Perri F, Festa V, Merla A, Quitadomo M, Clemente R, Andriulli A. Amoxicillin/tetracycline combinations are inadequate as alternative therapies for Helicobacter pylori infection. //Helicobacter -2002. -V. 7.-P. 99-104.
173. Peters T.M., Owen R.L, Slater H., at al. Genetic diversity in the Helicobacter pylori cag pathogenicity island and effect on expression of anti-CagA serum antibody in UK patients with dyspepsia. //Clin. Pathol. -2001. -V. 54. -P. 219-223.
174. Pigueiredo C., Quint W.G.V., Sanna R. el nl. Genetic organisation and heterogeneity of the iceA locus of Helicobacter pylori. //Gene -2000. -V. 246. -P. 59-68.
175. Podtolani S., Bonvicini F.,Gasberini G. Epidemiology In: Helicobacter pylori. //An Atlas. Ed.by P. Malfertheiner, P.Michelt, A. Price. London., -1997 (2.1-2.6).
176. Porwollik S., O'Toole P. W. Molecular characterization of a flagella export locus of Helicobacter pylori. //Gut. -1998. -V. 43.(Suppl. 2). -P. 33-39.
177. Pounder R.E., Ng D. The prevalence of Helicobacter pylori: infection in different countries.//Aliment. Pharmacol.Iher. -1999. -V.9 (Suppl.2). P.33-39.
178. Rodrigues M.N., Queiroz D.M., Bezerra Filho J.G. Prevalence of Helicobacter pylori infection in children from an urban community in northeast Brazil and risk factors for infection. //Eur J Gastroenterol Hepatol -2004. -V. 16. -N. 2. -P. 201-205.
179. Roma-Giannikou E, Karameris A, Balatsos B, Panayiotou J, Manika Z, Van-Vliet C, et al. Intrafamiliar spread of Helicobacter pylori: a genetic analysis. //Helicobacter. -2003. V.8. -P. 15-20.
180. Salih B.A. The role of the putative virulence markers (cagA and vacA) of Helicobacter pylori in peptic ulcer disease. //Saudi Medical Journal -2004. V. 25.-N. 7.-P. 830-836
181. Salih B.A., Abasiyanik M.F. Does regular garlic intake affect the prevalenceof Helicobacter pylori in asymptomatic subjects? //Saudi
182. Medical Journal -2003. Vol. 24. -N. 8.-P. 447-450
183. Salih B.A., Abasiyanik M.F., Saribasak H. at al. A follow-up study on the effect of Helicobacter pylori eradication on the severity of gastric histology. //Digestive Diseases and Science. -2005. -V. 50. -N. 8. -P. 1517-1522
184. Salih B.A., Bughrara F.A., Helicobacter pylori infection, effect on gastric histology and clinical outcome. //Saudi medical Journal -2004. -V. 25. -N. 12.-P. 2053-2054
185. Saribasak H., Salih B.A., Yamaoka Y. at al Analysis of Helicobacter pylori genotypes and correlation with clinical outcome in Turkey //Journal of Clin. Microbiol. -2004. -V. 42. -N 4. -P. 1648-1651
186. Seker S, Abasiyanik M.F., Salih B.A., Rubella immune status of pregnant and non-pregnant women in Istanbul //Saudi Medical Journal -2204. -V. 25. -N5.P. 575-579
187. Sharon N., Kenet G., Toren A. et al. Helicobacter pylori associated gastric lymphome in a girl. //Pediatr. Acuretol. Oucol. -1997. -V.I 4. P. 177-180
188. Shinoyame Т., Fucuda S., Tanaka M. et al. High prevalence of the Cag A-positive Helicobacter pylori strains in Japanese asymptomatic patient ad gastric cancer patients. //Scand. J.Gastroenterol. -1997. -V. 32. -P. 465-468.
189. Sorborg M., Engstrand L., Slrb'm M. at al. The diagnostic value of enzyme immuno-assay and immunoblot in monitoring eradication of Helicobacter pylori. //Scand. J. Infect. Dis. -1997. -V. 29. -P. 147-151.
190. Sozzi M., Valentini M., Figura N. De Padi P. Et al. Atrophic gastric and international metaplasia in Helicobacter pylori infection: the role of Cag A status. //Am. J. Gastroenterol -1998. -V.93. -P. 375-379.
191. Su В., Johanson S., Faalman M. Signal transduction mediated adherence and entry of Helicobacter pylori into cultured cells. //Gastroenterology. -1999. -Vol. 117. -P. 595-604.
192. Suvorov A., Dmitriev A., Ustinovich I., Schalen C., Totolian A.: Molecular analysis of clinical group В streptococcal strains by use of Qand □ gene probes. //FEMS Immunol. Med. Microbiol. -1997. -V. 17. P. 149-154.
193. Tahara E., Semba, Tahara H. Molecular Biological observation in gastric cancer. //Semin. Oncol. -1996. -V.23. -P.307-315.
194. Tamassy K., Simon L., Francis M. Epidemiology of Helicobacter pylori infection in Hungary. (In Hungarian, English abstract). //Ow Hetil -1995, -V. 136. -P. 1387-1391.
195. The European Helicobacter pylori study Group. Current Europen concepts in management of Helicobacter pylori infection. The Macstricht Concensus Report. //J. Gut -1997. -V.41. -P. 8-13
196. Tomasini М.1., Zanussi S., Sozisi M.at al. Heterogeneity of cag genotypes in Helicobacter pylori isolates from human biopsy specimens. //Clin, Microbiol -2003.-V. 41.-P. 976-980.
197. Tomiga K. Biochemical analysis of the bacillary and coccuid'forms of Helicobacter pylori. //Digeestion. -1998. -V. 59.(Suppl.3). -P. 393
198. Tsai C.J, Perry S., Sanchez L., et al: Helicobacter pylori infection in different generations of Hispanics in the San Francisco Bay Area. //Am J Epidemiol -2005. -V. 162. -N 4. -P. 351-7.
199. Vedhuizen Van Zanten S. S.O. Do socio-economic status, marital status and occupation influence the prevalence of Helicobacter pylori infection? // Aliment. Pharmacol. Iher. -1995. -V.9 (Suppl.2). P. 41-44.
200. Velduyzen van Lanten S.J., Sherman P.M. Helycobacter- pylori infection as a cause of gastritis duodenal ulcer, gastric cancer and dyspepsia: a systematic oberview. //Can. Med. Assoc.J. -1994 -V. 150. -P. 177-185.
201. Veralobica J.,Kibler K., Smell S. et al. Mutations in 23-S ribosomal DNA confer Claritromicin resistens in Helicobacter pylori. //J. Gut. -1995. -V. 37(suppl.). -P.67.
202. Versalovic J. Helicobacter pylori Pathology and Diagnostic Strategies. //Am J Clin Pathol -2003. -V. 119. -N 3. P. 403-412.
203. Warren J.R., Marshall B.J. Unidentified curved bacilli on gastric epithelium in active chronic gastritis //Lancet. 1983. -P. 1273-1275.
204. Webb P.M., Knight Т., Elder J.B., Newell D.G., Forman D. Is Helicobacter pylori transmitted from cats to humans? //Helicobacter -1996. -V.l. P. 7981.
205. Wyle F.A., Rathbone A., Dabros W. at al. Campylobacter pylori infections with gastric cell tissue culture. //J. Clin. Gastroenterol.' -1990. -Vol.12 (supll.l). -P.S99 -S103.
206. Yamaoka Y., Malaty H.M., Osato O.R., Graham U.Y. Conservation of Helicobacler pylori genotypes in different ethnic groups in Houston, Texas. //J.Infect Dis. -2000. -V. 181. P. 2083-2086.
www.dissercat.com
Хеликобактер пилори (Helicobacter pylori) и язва. Сейчас в сознании врачей и пациентов – это почти синонимы. Однако так было не всегда.
Содержание статьи Хеликобактер пилориВпервые о хеликобактерии стало известно еще в 19 веке, когда эту спиралевидную бактерию обнаружили в желудке собак. В начале ХХ века у ученых-исследователей возникает мысль о связи этой бактерии с патологией желудочно-кишечного тракта. В 1913 году датскому ученому Дж. Фибигеру удается получить в эксперименте рак желудка у мышей при введении им с пищей этого микроорганизма, который он назвал «раковой спирохетой». За эти труды Фибигер был удостоен Нобелевской премии.
Хеликобактер пилориВпервые о хеликобактерии стало известно еще в 19 веке, когда эту спиралевидную бактерию обнаружили в желудке собак. В начале ХХ века у ученых-исследователей возникает мысль о связи этой бактерии с патологией желудочно-кишечного тракта. В 1913 году датскому ученому Дж. Фибигеру удается получить в эксперименте рак желудка у мышей при введении им с пищей этого микроорганизма, который он назвал «раковой спирохетой». За эти труды Фибигер был удостоен Нобелевской премии.В эти и последующие годы было проведено много работ и исследований учеными разных стран, в ходе которых было выявлено наличие «спирохет» в желудке человека, выделены патологические уреазоположительные штаммы. Однако только к концу ХХ века двумя учеными Робином Уорреном и Барри Маршаллом была доказана связь «спирохет» с гастритом и язвенной болезнью желудка и двенадцатиперстной кишки. Они доказали, что этот микроорганизм, названный ими хеликобактерией пилорис, присутствует у всех больных с язвой двенадцатиперстной кишки и у большинства с язвой желудка. Посеяв биоматериал со слизистой таких пациентов и вырастив колонию микроорганизмов, Барри Маршалл сам заразил себя этой бактерий, чтобы доказать ее ведущую роль в развитии антрального гастрита, которым вследствие самозаражения и заболел.
Надо сказать, что к 70 годам ХХ века резко увеличивается заболеваемость людей разных возрастов язвенной болезнью, причем далеко не все случаи можно было объяснить повышенной кислотностью. Революционное в гастроэнтерологии открытие Р.Уоррена и Б.Маршалла позволило взглянуть на проблему ульцерогенеза (язвообразования) с новой точки зрения, и главное, разработать новые и эффективные принципы терапии этого заболевания. За это открытие ученые в 2005 году получили Нобелевскую премию, а врачи всех стран стали гораздо успешнее бороться с язвенной болезнью. Принцип эрадикации (уничтожения) этой инфекции позволил сократить сроки рубцевания желудочных и дуоденальных язв, уменьшить процент кровотечений из язв, прекратить их рецедивирование.
Есть и еще один, очень важный аспект: хеликобактерная инфекция признана медицинскими экспертами канцерогенной, т.е. безусловно вызывающей рак желудка. Обычно от момента заражения (чаще в детском возрасте) до развития тяжелых осложнений проходят годы, десятилетия. Рак возникает не сразу, а через цепочку «несерьезных заболеваний».
 Хеликобактер пилори под электронным микроскопомВ первую очередь, хронический гастрит, который может иметь клинические проявления, а может и не иметь, развиваться скрытно много лет. Впоследствии, у части из этих людей возникнет язвенная болезнь, у части — лимфома (опухоль) желудка, либо атрофический гастрит с пониженной уже кислотностью, а вот он открывает дорогу раку. По статистике, у приблизительно 8% людей с атрофическим гастритом возникают злокачественные изменения слизистой желудка. Россия относится к странам с высоким уровнем инфицирования хеликобактерией, около 80%, так что вопросы терапии хеликобактер-ассоциированных заболеваний и профилактики серьезных осложнений для нас весьма актуальны.
Хеликобактер пилори под электронным микроскопомВ первую очередь, хронический гастрит, который может иметь клинические проявления, а может и не иметь, развиваться скрытно много лет. Впоследствии, у части из этих людей возникнет язвенная болезнь, у части — лимфома (опухоль) желудка, либо атрофический гастрит с пониженной уже кислотностью, а вот он открывает дорогу раку. По статистике, у приблизительно 8% людей с атрофическим гастритом возникают злокачественные изменения слизистой желудка. Россия относится к странам с высоким уровнем инфицирования хеликобактерией, около 80%, так что вопросы терапии хеликобактер-ассоциированных заболеваний и профилактики серьезных осложнений для нас весьма актуальны.Хеликобактер пилори является причиной хронического гастрита, язвы желудка и двенадцатиперстной кишки.
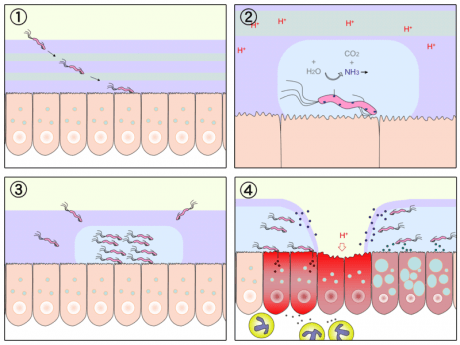 Как хеликобактер пилори повреждает желудокСкажем сразу, что штаммов (рановидностей) хеликобактерий много, далеко не все из них вредные, патогенные. Опасны те, что выделяют фермент уреазу. Посредством уреазы бактерия защищает себя от соляной кислоты и повреждает слизистую желудка. Благодаря высокой подвижности и спиралевидной форме она проникает в слизистую, размножается. Колонии хеликобактерий выделяют продукты своей жизнедеятельности и специальные токсины, вызывающие хроническое воспаление желудка или двенадцатиперстной кишки, подавляют репарацию (восстановление) клеток, изменяют секрецию. При долговременном воспалении неизбежно развивается атрофия слизистой желудка.
Как хеликобактер пилори повреждает желудокСкажем сразу, что штаммов (рановидностей) хеликобактерий много, далеко не все из них вредные, патогенные. Опасны те, что выделяют фермент уреазу. Посредством уреазы бактерия защищает себя от соляной кислоты и повреждает слизистую желудка. Благодаря высокой подвижности и спиралевидной форме она проникает в слизистую, размножается. Колонии хеликобактерий выделяют продукты своей жизнедеятельности и специальные токсины, вызывающие хроническое воспаление желудка или двенадцатиперстной кишки, подавляют репарацию (восстановление) клеток, изменяют секрецию. При долговременном воспалении неизбежно развивается атрофия слизистой желудка.По современным медико-терапевтическим стандартам всем пациентам с язвенной болезнью должны проводиться исследования для выявления хеликобактерной инфекции. Их существует несколько.
При фиброгастроскопии производится забор кусочков слизистой оболочки, которые изучают морфологически и на наличие хеликобактерий:
Быстрый уреазный тест биоптата.Прямо в эндоскопическом кабинете кусочек слизистой помещают в среду с мочевиной и индикатором. Если хеликобактерия в нем присутствует, то она начинает с помощью уреазы расщеплять мочевину, меняется кислотность среды, в течение нескольких часов индикатор меняет цвет и тест считается положительным. Простая, дешевая и в то же время весьма информативная методика, но возможны и ложноположительные результаты.
Микроскопия.Кусочки слизистой можно сразу после взятия посмотреть под микроскопом. Если бактерий в желудке много, то можно увидеть их, так сказать, живьем. Это ориентировочный метод, он не работает при небольшом количестве бактерий, не позволяет определить штамм (вид). Часто материал сначала фиксируют, окрашивают, а затем изучают. Это повышает информативность данного метода.
Посев материала слизистой на питательные среды.Выполняется врачом-лаборантом и требует наличия специального помещения и дорогостоящего оборудования. Хеликобактер «растет» только в малокислородной среде, богатой азотом. Это требует времени – от 3 до 7 дней. Это единственный метод, дающий 100% верный результат, и кроме того, поможет определить, к какому антибиотику чувствительна бактерия.
Иммуногистохимия.Кусочки слизистой фиксируют и обрабатывают высокоспецифичными к патогенной хеликобактерии антителами, что позволяет увидеть именно ее. Позволяет выявить бактерии даже при их небольшом количестве, решить спорные моменты диагностики.
Полимеразная цепная реакция.Метод ПЦР-диагностики позволяет не только обнаружить ДНК (генетический материал) хеликобактерии в биоптате, кале, слюне, но и различить патогенные штаммы от менее «вредных».
Кроме исследования биоптата, можно определить антитела к хеликобактерии в крови. Они появляются примерно через месяц после заражения и их можно обнаружить. Но после лечения антитела долго сохраняются положительными (до года), поэтому для контроля эрадикации (лечения) этот метод не используют. Этот метод также ориентировочный, возможны погрешности в диагностике.
Есть еще дыхательный уреазный тест. При проведении этого теста пациент (натощак, не курить, не принимать спиртное, антибиотики, антисекреторные препараты) дышит в специальную трубочку. Сначала у него берут образец выдыхаемого воздуха, затем дают выпить раствор карбамида с меченным углеродом. По прошествии 15 минут снова дают подышать в трубочку. Хеликобактерия расщепляет карбамид и меченный углерод выделяется легкими с дыханием, а тест-система фиксирует его концентрацию. Простой для пациента способ, но дорогостоящий. В Европе дыхательный уреазный тест часто используется для контроля терапии, т.е. уничтожена бактерия в организме пациента или требуется продолжить лечение.
Как видите, способов диагностики хеликобактер пилори довольно много. Какой метод выбрать, решает врач в зависимости от особенностей пациента, заболевания, цели исследования (первичное или контроль лечения) и технических возможностей больницы. Не всегда выявленную хеликобактерию обязательно надо лечить. Она встречается и у здоровых людей, которые являются носителем этой бактерии, но не чувствительны к ней, и она не может вызвать у них заболевания желудочно-кишечного тракта. А вот если человек страдает клинически выраженным гастритом, язвенной болезнью, или у ближайших родственников имеются случаи злокачественных опухолей желудка, кишечника, то в этом случае проведение эрадикационной терапии необходимо.
Врач-терапевт, К.м.н. Ковальчук М.В.
www.webmedinfo.ru