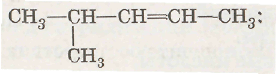Контрольная работа по химии на тему: "Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева" (11 класс). Контрольная работа периодический закон
"Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева" (11 класс)
Контрольная работа.
Тема: «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева»
Вариант 1. I. Выберите один верный ответ: (10 баллов)
Количество электронов на внешнем уровне атома хлора:
а) 1 б) 3 в) 5 г) 7
2. Распределение электронов по энергетическим уровням в атоме магния:
а) 2,8,8,2 б) 2,8,2 в) 2,8,8 г) 2,8,1
3. Тип химической связи в простом веществе литий:
а) ионная б) ковалентная полярная в) ковалентная неполярная г) металлическая
4. Пара формул веществ, в каждом из которых связь только ковалентная полярная:
а) Br2 и I2 б) HCI и HBr в) NaCI и KCI г) CI2 и Ca
5. Алмаз имеет кристаллическую решётку:
а) атомную б) молекулярную в) ионную г) металлическую
6. Скорость химической реакции не зависит от:
а) концентрации б) температуры в) массы г) катализатора
7. Вещества, ускоряющие химические реакции называются:
а) ингибиторы б) катализаторы в) реагенты
8. В три пробирки с соляной кислотой добавили: в первую – железные опилки, во вторую – железные стружки, в третью – железный гвоздь. В какой пробирке реакция идёт быстрее?
а) в первой б) во второй в) в третьей г) одинаково
9. При уменьшении температуры в системе: N2 + 2O2 = 2NO2 + Q химическое равновесие сместится:
а) влево б) вправо в) не сместится
10. При увеличении давления в системе: СО2 + С (т) = 2СО химическое равновесие сместится:
а) влево б) вправо в) не сместится
II. Решите задания:
Проклассифицируйте уравнения реакции по всем шести признакам: (6 баллов)
Fe2O3 + 2AI = 2Fe + AI2O3 + Q
Дописать уравнения реакций, расставить коэффициенты, указать тип реакции: (21 балл) а) Fe + CI2 = б) CuO + h3 = в) AI + HCI = г) Zn(OH)2 + HCI = д) Nh4 + O2 = е) Nh4 + Br2 = N2 + … ж) h3SO3 + CI2 + h3O = h3SO4 + …
Определите объём углекислого газа (СО2), который образуется при сгорании 48г угля (С). (5 баллов)
Контрольная работа.
Тема: «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева»
Вариант 2. I. Выберите один верный ответ: (10 баллов)
Количество электронов на внешнем уровне атома бора:
а) 1 б) 3 в) 5 г) 7
2. Распределение электронов по энергетическим уровням в атоме натрия:
а) 2,8,8,2 б) 2,8,2 в) 2,8,8 г) 2,8,1
3. Тип химической связи в молекуле водорода:
а) ионная б) ковалентная полярная в) ковалентная неполярная г) металлическая
4. Пара формул веществ, в каждом из которых связь только ковалентная неполярная:
а) Br2 и NaCI б) HCI и Br2 в) CI2 и Н2 г) ВаCI2 и I2
5. Графит имеет кристаллическую решётку:
а) атомную б) молекулярную в) ионную г) металлическую
6. Скорость химической реакции не зависит от:
а) концентрации б) температуры в) объёма г) природы вещества
7. Вещества, замедляющие химические реакции называются:
а) ингибиторы б) катализаторы в) реагенты
8. В три пробирки с оксидом цинка добавили: в первую – концентрированную серную кислоту, во вторую – разбавленную серную кислоту, в третью – воду. В какой пробирке реакция идёт быстрее?
а) в первой б) во второй в) в третьей г) одинаково
9. При увеличении давления в системе: N2 + 2O2 = 2NO2 + Q химическое равновесие сместится:
а) влево б) вправо в) не сместится
10. При уменьшении температуры в системе: СО2 + С (т) = 2СО химическое равновесие сместится:
а) влево б) вправо в) не сместится
II. Решите задания:
Проклассифицируйте уравнения реакции по всем шести признакам: (6 баллов)
2Na + 2h3O = 2NaOH + h3 + Q
Дописать уравнения реакций, расставить коэффициенты, указать тип реакции: (21 балл) а) Na + h3O = б) Na2CO3 + HNO3 = в) Ca + h3SO4 = г) Li2O + h3O = д) FeO + C = е) Nh4 + CuO = N2 + … + … ж) KNO3 = KNO2 + …
При сгорании серы израсходовалось 44,8л кислорода, определите массу сгоревшей серы. (5 баллов)
infourok.ru
Контрольная работа по теме: «Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома»
Контрольная работа по теме:
«Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома»
Вариант 1
Часть А:
А 1. Ядро атома заряжено положительно благодаря наличию в нем:
а) протонов, б) нейтронов, в) электронов, г) катионов.
А 2. Номер периода в периодической системе определяется:
а) зарядом ядра, б) числом электронов в наружном слое атома,
в) числом электронных слоев в атоме, г) числом электронов в атоме.
А 3. Число орбиталей на внешнем энергетическом уровне атома азота равно:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Форму объемной восьмерки имеет орбиталь:
а) s, б) p, в) d, г) f.
А 5. Число энергетических уровней в атоме химического элемента совпадает:
а) с порядковым номером, б) с номером группы, в) с относительной атомной массой, г) с номером периода.
А 6. Электронная конфигурация 1s22s22p63s23p63d104s24p2 соответствует атому:
а) титана, б) кальция, в) германия, г) цинка.
А 7. К какому семейству s – элементов относится:
а) кислород, б) гелий, в) хром, г) неодим.
А 8. Максимальная валентность атома углерода в возбужденном состоянии равна:
а) одному, б) двум, в) трем, г) четырем.
А 9. Число свободных орбиталей в атоме хлора в основном состоянии равно:
а) одному, б) трем, в) пяти, г) нулю.
А 10. Наиболее ярко выражены металлические свойства у элемента:
а) калия, б) кальция, в) магния, г) натрия.
А 11. Элемент, электронная конфигурация которого……3s23p4, расположен:
а) во втором периоде, б) в третьем периоде, в) в четвертом периоде, г) в шестом периоде.
А 12. Из приведенных ниже электронных формул выберите ту, которая соответствует p – элементу 4 группы:
а) ….4s24p64d35s2, б) ….4s24p2 , в) ….3s23p63d104s2 4p3, г)….2s22p4.
А 13. Число электронов на внешнем энергетическом уровне атомов в ряду N – P – As –Sb - Bi:
а) увеличивается, б) уменьшается, в) не изменяется, г) изменяется периодически.
А 14. Из приведенных ниже элементов 3 – го периода наиболее ярко выраженные неметаллические свойства имеет:
а) Al, б) S, в) Si, г) Ar.
А 15. Распределение валентных электронов в атоме соответствует конфигурации ….ns2np2. Формулы летучего водородного соединения и высшего оксида этого элемента соответственно:
а) Н2Э и ЭО2, б) ЭН4 и ЭO2, в) ЭН4 и ЭO г) Эh3 и ЭO.
Часть Б:
Б 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 134, причем число нейтронов превышает число электронов на 11. Напишите название элемента.
Б 2. Два атома имеют одинаковое число протонов, но разное число нейтронов в ядре. Как они называются по отношению друг к другу ( в ответе укажите термин во множественном числе)?
Б 3. С атомом калия произошло превращение К0 – х → К+. Как называется частица х, которую отдал атом калия, превращаясь в катион?
Б 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет неподеленную электронную пару: h3, Nh4, Ch5, C2H6.
Б 5. По электронной формуле 1s22s22p63s23p6 3d104s2 определите его положение в периодической системе. Определите к какому семейству принадлежит этот элемент. ( ответ дайте в именительном падеже).
Часть С:
С 1. Охарактеризуйте химический элемент №31 на основании положения в периодической системе по следующему плану:
Состав и заряд ядра, общее число электронов в атоме, их распределение по энергетическим уровням и подуровням (электронная формула), семейство элементов, металл или неметалл, максимальная и минимальная степень окисления, формула водородного соединения, формула и тип высшего оксида, формула и характер соответствующего ему гидроксида.
С2. Как изменяются металлические свойства, неметаллические свойства и радиусы атомов элементов с увеличением их порядкового номера в малых периодах и главных подгруппах в таблице Д.И.Менделеева.
С 3. Определите валентные возможности атома серы в основном и возбужденном состояниях. Напишите формулы соединений этого элемента, в которых нон проявляет указанные вами валентности.
Вариант 2
Часть А:
А 1.Определите химический элемент по составу его атомной частицы – 18p, 20n, 18e:
а) F, б) Ca, в) Ar, г) Sr.
А 2. Общее число электронов у иона хрома Cr3+:
а) S0, б) Si0, в) O2-, г) Ne+.
А 3. Восемь электронов на внешнем электронном слое имеет:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Максимальное число электронов, занимающих 3s – орбиталь, равно:
а) 1, б) 2, в) 6, г) 8.
А 5. Число орбиталей на f-подуровне:
а) 1, б) 3, в) 5, г) 7.
А 6. К p- элементам относится:
а) кремний, б) магний, в) водород, г) хром.
А 7. Элемент, атомы которого имеют электронную конфигурацию 1s22s22p63s23p63d104s1 - это:
а) K, б) Ca, в) Ba, г) Na.
А 8. Из приведенных элементов 4 – го периода наиболее ярко выраженные металлические свойства имеет:
а) Zn, б) Cr, в) K, г) Cu.
А 9. Наименьший радиус атома среди приведенных элементов имеет:
а) Mg, б) Ca, в) Si, г) Cl.
А 10. Из приведенных ниже элементов 3 – го периода наиболее ярко выраженные неметаллические свойства имеет:
а) Al, б) S, в) Si , г) Ar.
А 11. Порядковый номер элементов в периодической системе определяется:
а) зарядом ядра атома, б) числом электронов в наружном слое,
в) числом электронных слоев в атоме, г) числом нейтронов в атоме.
А 12. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
а) B и Si, б) S и Se, в) K и Ca, г) Mn и Fe.
А 13. Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают:
а) 54Fe , б) 56Fe, в) 57Fe, г) 58Fe.
А 14. Ряд элементов, расположенных в порядке усиления металлических свойств:
а) Sr – Rb - K, б) Be – Li - K, в) Na – K - Ca, г) Al – Mg - Be.
А 15. Оксиды бериллия, магния и кальция соответственно относятся:
а) к основным, амфотерным, кислотным, б) только основным,
в) к кислотным, амфотерным, основным , г) к амфотерным, основным, основным.
Часть Б:
Б 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 273, причем число нейтронов превышает число электронов на 117. Напишите название элемента.
Б 2. Формула высшего оксида неметалла имеет формулу Э2О7. Как будет выглядеть формула летучего водородного соединения этого элемента, в какой группе периодической системы он находится?
Б 3. С атомом натрия произошло превращение Na0 – х → Na+. Как называется частица х, которую отдал атом натрия превращаясь в катион?
Б 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет четыре неспаренных электрона, которые участвуют в образовании связи: h3, Nh4, Ch5, C2H6.
Б 5. Расположите элементы: Si, B, O, Mg, P, Al, Cl в порядке возрастания восстановительных свойств.
Часть С:
С 1. Охарактеризуйте химический элемент№29 на основании положения в периодической системе по следующему плану:
Состав и заряд ядра, общее число электронов в атоме, их распределение по энергетическим уровням и подуровням (электронная формула), семейство элементов, металл или неметалл, максимальная и минимальная степень окисления, формула водородного соединения, формула и тип высшего оксида, формула и характер соответствующего ему гидроксида.
С 2. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2,47% водорода. Определите этот элемент. Напишите формулу его соединения с водородом.
С 3. Определите валентные возможности атома хлора в основном и возбужденном состояниях. Напишите формулы соединений этого элемента, в которых нон проявляет указанные вами валентности.
doc4web.ru
Контрольная работа "Периодический закон" 11 класс страница 3
Элемент: I. Бор. II. Бром. III. Фосфор. IV. Литий.
Электронная формула: А.1s22s22p1. Б.1s22s1. В.1s22s22p63 s23p3. Г.1s22s22p63 s23p63d104 s24p5.
Формула высшего оксида: 1. Э2О. 2. Э2О3. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида: а. ЭОН. б. НЭО3. в. Н3ЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
-
(3 балла). На основании положения в Периодической системе расположите элементы: алюминий, калий, кальций, магний – в порядке возрастания восстановительных свойств. Объясните ответ.
-
(6 баллов). Почему заряды ядер атомов элементов, расположенный в порядке возрастания порядковых номеров в Периодической системе, изменяются монотонно, а свойства элементов – периодически?
-
(7 баллов).Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
-
(5 баллов). Какие химические свойства характерны для гидроксидов ? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
-
(2 балла). Протоны были открыты:
А. Г. Паули. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
-
(2 балла).Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру:
А. Группы. Б. Периода. В. Ряда. Г. Порядковому.
-
(2 балла). «Собственное вращение» электрона характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
-
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. Sn и Si. Б. As и Se. В. Zn и Ca. Г. Mo и Te.
-
(2 балла). f – Элементом является: А. Германий. Б. Калий. В. Селен. Г. Уран.
-
(2 балла). Электронная конфигурация … 4s24 р6 соответствует элементу: А. Брому. Б. Железу. В. Неону. Г. Криптону.
-
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Ca(OH)3. Б. Mg(OH)2. В. LiOH. Г. Sc(OH)2.
-
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. K – Rb – Sr. Б. Al – Mg – Be. В. Be – Li – Cs. Г. Ge – Sn – Sb.
-
(2 балла). Элемент Э с электронной формулой 1s22s22p63 s1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. ЭО3.
-
(2 балла). Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают: А. 4020Са. Б. 4220Са. В. 4420Са. Г. 4820Са .
-
(9 баллов). Установите соответствие.
Элемент: I. Азот. II. Кальций. III. Кремний. IV. Сера.
Электронная формула: А. 1s22s22p3. Б. 1s22s22p63s23p4. В. 1s22s22p63 s23p2. Г. 1s22s22p63 s23p64s2.
Формула высшего оксида: 1. ЭО. 2. ЭО2. 3. Э2О5. 4. ЭО3.
Формула высшего гидроксида: а. Н2ЭО. Б. Э(ОН)2. в. Н2ЭО3. г. НЭО3.
ЧАСТЬ Б. Задания со свободным ответом
-
(3 балла). На основании положения в Периодической системе расположите элементы: кислород, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Обоснуйте ответ.
-
(6 баллов). Перечислите основные правила (законы), в соответствии с которыми происходит заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атомов элементов.
-
(7 баллов).Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
-
(5 баллов). Какие химические свойства характерны для гидроксидов неметаллов? Ответ подтвердите, написав уравнения реакций.
infourok.ru
«Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома»
Контрольная работа по теме:
«Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома»
Вариант 1
Часть А:
А 1. Ядро атома заряжено положительно благодаря наличию в нем:
а) протонов, б) нейтронов, в) электронов, г) катионов.
А 2. Номер периода в периодической системе определяется:
а) зарядом ядра, б) числом электронов в наружном слое атома,
в) числом электронных слоев в атоме, г) числом электронов в атоме.
А 3. Число орбиталей на внешнем энергетическом уровне атома азота равно:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Форму объемной восьмерки имеет орбиталь:
а) s, б) p, в) d, г) f.
А 5. Число энергетических уровней в атоме химического элемента совпадает:
а) с порядковым номером, б) с номером группы, в) с относительной атомной массой, г) с номером периода.
А 6. Электронная конфигурация 1s22s22p63s23p63d104s24p2 соответствует атому:
а) титана, б) кальция, в) германия, г) цинка.
А 7. К какому семейству s – элементов относится:
а) кислород, б) гелий, в) хром, г) неодим.
А 8. Максимальная валентность атома углерода в возбужденном состоянии равна:
а) одному, б) двум, в) трем, г) четырем.
А 9. Число свободных орбиталей в атоме хлора в основном состоянии равно:
а) одному, б) трем, в) пяти, г) нулю.
А 10. Наиболее ярко выражены металлические свойства у элемента:
а) калия, б) кальция, в) магния, г) натрия.
А 11. Элемент, электронная конфигурация которого……3s23p4, расположен:
а) во втором периоде, б) в третьем периоде, в) в четвертом периоде, г) в шестом периоде.
А 12. Из приведенных ниже электронных формул выберите ту, которая соответствует p – элементу 4 группы:
а) ….4s24p64d35s2, б) ….4s24p2 , в) ….3s23p63d104s2 4p3, г)….2s22p4.
А 13. Число электронов на внешнем энергетическом уровне атомов в ряду N – P – As –Sb - Bi:
а) увеличивается, б) уменьшается, в) не изменяется, г) изменяется периодически.
А 14. Из приведенных ниже элементов 3 – го периода наиболее ярко выраженные неметаллические свойства имеет:
а) Al, б) S, в) Si, г) Ar.
А 15. Распределение валентных электронов в атоме соответствует конфигурации ….ns2np2. Формулы летучего водородного соединения и высшего оксида этого элемента соответственно:
а) Н2Э и ЭО2, б) ЭН4 и ЭO2, в) ЭН4 и ЭO г) Эh3 и ЭO.
Часть Б:
Б 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 134, причем число нейтронов превышает число электронов на 11. Напишите название элемента.
Б 2. Два атома имеют одинаковое число протонов, но разное число нейтронов в ядре. Как они называются по отношению друг к другу ( в ответе укажите термин во множественном числе)?
Б 3. С атомом калия произошло превращение К0 – х → К+. Как называется частица х, которую отдал атом калия, превращаясь в катион?
Б 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет неподеленную электронную пару: h3, Nh4, Ch5, C2H6.
Б 5. По электронной формуле 1s22s22p63s23p6 3d104s2 определите его положение в периодической системе. Определите к какому семейству принадлежит этот элемент. ( ответ дайте в именительном падеже).
Часть С:
С 1. Охарактеризуйте химический элемент №31 на основании положения в периодической системе по следующему плану:
Состав и заряд ядра, общее число электронов в атоме, их распределение по энергетическим уровням и подуровням (электронная формула), семейство элементов, металл или неметалл, максимальная и минимальная степень окисления, формула водородного соединения, формула и тип высшего оксида, формула и характер соответствующего ему гидроксида.
С2. Как изменяются металлические свойства, неметаллические свойства и радиусы атомов элементов с увеличением их порядкового номера в малых периодах и главных подгруппах в таблице Д.И.Менделеева.
С 3. Определите валентные возможности атома серы в основном и возбужденном состояниях. Напишите формулы соединений этого элемента, в которых нон проявляет указанные вами валентности.
Вариант 2
Часть А:
А 1.Определите химический элемент по составу его атомной частицы – 18p, 20n, 18e:
а) F, б) Ca, в) Ar, г) Sr.
А 2. Общее число электронов у иона хрома Cr3+:
а) S0, б) Si0, в) O2-, г) Ne+.
А 3. Восемь электронов на внешнем электронном слое имеет:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Максимальное число электронов, занимающих 3s – орбиталь, равно:
а) 1, б) 2, в) 6, г) 8.
А 5. Число орбиталей на f-подуровне:
а) 1, б) 3, в) 5, г) 7.
А 6. К p- элементам относится:
а) кремний, б) магний, в) водород, г) хром.
А 7. Элемент, атомы которого имеют электронную конфигурацию 1s22s22p63s23p63d104s1 - это:
а) K, б) Ca, в) Ba, г) Na.
А 8. Из приведенных элементов 4 – го периода наиболее ярко выраженные металлические свойства имеет:
а) Zn, б) Cr, в) K, г) Cu.
А 9. Наименьший радиус атома среди приведенных элементов имеет:
а) Mg, б) Ca, в) Si, г) Cl.
А 10. Из приведенных ниже элементов 3 – го периода наиболее ярко выраженные неметаллические свойства имеет:
а) Al, б) S, в) Si , г) Ar.
А 11. Порядковый номер элементов в периодической системе определяется:
а) зарядом ядра атома, б) числом электронов в наружном слое,
в) числом электронных слоев в атоме, г) числом нейтронов в атоме.
А 12. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
а) B и Si, б) S и Se, в) K и Ca, г) Mn и Fe.
А 13. Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают:
а) 54Fe , б) 56Fe, в) 57Fe, г) 58Fe.
А 14. Ряд элементов, расположенных в порядке усиления металлических свойств:
а) Sr – Rb - K, б) Be – Li - K, в) Na – K - Ca, г) Al – Mg - Be.
А 15. Оксиды бериллия, магния и кальция соответственно относятся:
а) к основным, амфотерным, кислотным, б) только основным,
в) к кислотным, амфотерным, основным , г) к амфотерным, основным, основным.
Часть Б:
Б 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 273, причем число нейтронов превышает число электронов на 117. Напишите название элемента.
Б 2. Формула высшего оксида неметалла имеет формулу Э2О7. Как будет выглядеть формула летучего водородного соединения этого элемента, в какой группе периодической системы он находится?
Б 3. С атомом натрия произошло превращение Na0 – х → Na+. Как называется частица х, которую отдал атом натрия превращаясь в катион?
Б 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет четыре неспаренных электрона, которые участвуют в образовании связи: h3, Nh4, Ch5, C2H6.
Б 5. Расположите элементы: Si, B, O, Mg, P, Al, Cl в порядке возрастания восстановительных свойств.
Часть С:
С 1. Охарактеризуйте химический элемент№29 на основании положения в периодической системе по следующему плану:
Состав и заряд ядра, общее число электронов в атоме, их распределение по энергетическим уровням и подуровням (электронная формула), семейство элементов, металл или неметалл, максимальная и минимальная степень окисления, формула водородного соединения, формула и тип высшего оксида, формула и характер соответствующего ему гидроксида.
С 2. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2,47% водорода. Определите этот элемент. Напишите формулу его соединения с водородом.
С 3. Определите валентные возможности атома хлора в основном и возбужденном состояниях. Напишите формулы соединений этого элемента, в которых нон проявляет указанные вами валентности.
globuss24.ru
Контрольная работа по химии (11 класс) периодический закон
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Электроны были открыты:
А. Н. Бором. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Порядковый номер элемента в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом нейтронов в атоме.
(2 балла). Общий запас энергии электронов в атоме характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего энергетического уровня: А. B и Si. Б. S и Se. В. K и Ca. Г. Cr и Fe.
(2 балла). s – Элементом является: А. Барий. Б. Америций. В. Криптону. Г. Рутению.
(2 балла). Электронная конфигурация … 3d64s2 соответствует элементу: А. Аргону. Б. Железу. В. Криптону. Г. Рутению.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Be(OH)2. Б. Mg(OH)2. В. h3SiO3. Г. Ba(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Sr – Rb – K. Б. Be – Li – K. В. Na – K – Ca. Г. Al – Mg – Be.
(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. Э2О5.
(2 балла). Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают: А. 5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .
(9 баллов). Установите соответствие.
Элемент: I. Бериллий. II. Натрий. III. Хлор. IV. Азот.
Электронная формула: А. 1s22s2. Б. 1s22s22p3. В. 1s22s22p63 s1. Г. 1s22s22p63 s23p5.
Формула высшего оксида: 1. Э2О. 2. ЭО. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида: а. ЭОН. Б. Э(ОН)2. в. НЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: бериллий, бор, магний, натрий – в порядке возрастания восстановительных свойств. Объясните ответ.
(6 баллов). Как и почему в Периодической системе изменяются неметаллические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 31 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для оксида элемента 2-го периода, главной подгруппы I группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Атомные ядра были открыты:
А. Д. Менделеевым. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Номер периода в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом электронов в атоме.
(2 балла). Форму электронных орбиталей характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. S и Cl. Б. Be и B. В. Kr и Xe. Г. Mo и Se.
(2 балла). p – Элементом является: А. Скандий. Б. Барий. В. Мышьяк. Г. Гелий.
(2 балла). Электронная конфигурация … 3d104s2 соответствует элементу: А. Кальцию. Б. Криптону. В. Кадмию. Г. Цинку.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Zn(OH)2. Б. Mg(OH)2. В. Ca(OH)2. Г. Cr(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Mg – Ca – Zn. Б. Al – Mg – Ca. В. Sr – Rb – K. Г. Ge – Si – Sb.
(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104 s24p1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. Э2О5.
(2 балла). Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают: А. 4020Ca. Б. 4220Ca. В. 4420Ca. Г.4820Ca.
(9 баллов). Установите соответствие.
Элемент: I. Алюминий. II. Калий. III. Селен. IV. Магний.
Электронная формула: А. 1s22s22p63s23p1. Б. 1s22s22p63s2. В. 1s22s22p63 s23p63d104 s24p4. Г. 1s22s22p63 s23p64 s1.
Формула высшего оксида: 1. Э2О. 2. Э2О3. 3. ЭО. 4. ЭО3.
Формула высшего гидроксида: а. ЭОН. Б. Э(ОН)2. в. Э(ОH)3. г. Н2ЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Объясните ответ.
(6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для высшего оксида элемента 3 -го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Нейтроны были открыты:
А. Н. Бором. Б. Д. Менделеевым. В. Г. Мозли. Г. Д. Чедвигом.
(2 балла).Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
А. Число протонов в атоме. Б. Число электронов в наружном слое атома.
В. Число электронных слоёв в атоме. Г. Число нейтронов в атоме.
(2 балла). Ориентацию электронных орбиталей в пространстве характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. Ba и K. Б. Sb и Bi. В. Ti и Ce. Г. Kr и Fe.
(2 балла). d – Элементом является: А. Калий. Б. Кремний. В. Аргон. Г. Медь.
(2 балла). Электронная конфигурация … 3d54s2 соответствует элементу: А. Брому. Б. Кальцию. В. Марганцу. Г. Хлору.
(2 балла). Амфотерным оксидом является вещество, формула которого: А. CrO. Б. Cr2O3. В. CrO3. Г. FeO.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Al – Ca – Ge. Б. Ca – Sr – Ba. В. K – Na – Li. Г. Mg – Ca – Zn.
(2 балла). Элемент Э с электронной формулой 1s22s22p63 s23p63d104s24p3 образует высший оксид, соответствующий формуле: А. ЭО. Б. Э2О3. В. Э2О5 Г. ЭО3.
(2 балла). Изотоп железа, в ядре которого содержится 30 нейтронов, обозначают: А. 5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .
(9 баллов). Установите соответствие.
Элемент: I. Бор. II. Бром. III. Фосфор. IV. Литий.
Электронная формула: А.1s22s22p1. Б.1s22s1. В.1s22s22p63 s23p3. Г.1s22s22p63 s23p63d104 s24p5.
Формула высшего оксида: 1. Э2О. 2. Э2О3. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида: а. ЭОН. б. НЭО3. в. Н3ЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: алюминий, калий, кальций, магний – в порядке возрастания восстановительных свойств. Объясните ответ.
(6 баллов). Почему заряды ядер атомов элементов, расположенный в порядке возрастания порядковых номеров в Периодической системе, изменяются монотонно, а свойства элементов – периодически?
(7 баллов).Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для гидроксидов ? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Протоны были открыты:
А. Г. Паули. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру:
А. Группы. Б. Периода. В. Ряда. Г. Порядковому.
(2 балла). «Собственное вращение» электрона характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. Sn и Si. Б. As и Se. В. Zn и Ca. Г. Mo и Te.
(2 балла). f – Элементом является: А. Германий. Б. Калий. В. Селен. Г. Уран.
(2 балла). Электронная конфигурация … 4s24 р6 соответствует элементу: А. Брому. Б. Железу. В. Неону. Г. Криптону.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Ca(OH)3. Б. Mg(OH)2. В. LiOH. Г. Sc(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. K – Rb – Sr. Б. Al – Mg – Be. В. Be – Li – Cs. Г. Ge – Sn – Sb.
(2 балла). Элемент Э с электронной формулой 1s22s22p63 s1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. ЭО3.
(2 балла). Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают: А. 4020Са. Б. 4220Са. В. 4420Са. Г. 4820Са .
(9 баллов). Установите соответствие.
Элемент: I. Азот. II. Кальций. III. Кремний. IV. Сера.
Электронная формула: А. 1s22s22p3. Б. 1s22s22p63s23p4. В. 1s22s22p63 s23p2. Г. 1s22s22p63 s23p64s2.
Формула высшего оксида: 1. ЭО. 2. ЭО2. 3. Э2О5. 4. ЭО3.
Формула высшего гидроксида: а. Н2ЭО. Б. Э(ОН)2. в. Н2ЭО3. г. НЭО3.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: кислород, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Обоснуйте ответ.
(6 баллов). Перечислите основные правила (законы), в соответствии с которыми происходит заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атомов элементов.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для гидроксидов неметаллов? Ответ подтвердите, написав уравнения реакций.
gigabaza.ru
Контрольная работа по темам «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома», «Строение веществ. Химическая связь"
8 класс
Контрольная работа по темам
«Периодический закон и периодическая система химических элементов
Д.И. Менделеева. Строение атома», «Строение веществ. Химическая связь»
1 вариант
1. Порядковый номер щелочного металла
1) 11 2) 23 3) 17 4) 18
2. Элемент 2 периода с формулой оксида состава R2О5
1) гелий 2) бериллий 3) фосфор 4) азот
3. В ряду оксидов MgO → А12О3 → SiО2 свойства изменяются от
1) кислотных к амфотерным
2) амфотерных к основным
3) основных к кислотным
4) кислотных к основным
4. В ряду элементов Li → Na → K
1) уменьшается радиус атомов
2) уменьшается электроотрицательность
3) усиливаются металлические свойства
4) уменьшается число электронных уровней
5. Установите соответствие:
Положение в периодической системе Элемент
А) 2 период, 3 группа 1) магний
Б
В
Г
В) 5 период, 1 группа, побочная подгруппа 3) бром
Г) 4 период, 7 группа, главная подгруппа 4) бор
5) рубидий
6) серебро
6. Установите соответствие:
Б
В
Формула Вид химической связи А) CF4 1) ковалентная неполярная
Б) NaF 2) ковалентная полярная
В) F2 3) ионная
7. Атом элемента имеет на 7 электронов больше, чем ион цинка. Определите элемент.
8. Определите степени окисления атомов элементов
SO3, S , SO2, h3S , h3SO4
9. Определите элемент V группы, молярная масса водородного соединения которого равна 34.
10. Расставьте коэффициенты с помощью схемы электронного баланса, укажите окислитель и восстановитель
K + O2 = K2O
11. Охарактеризуйте по периодической системе магний.
8 класс
Контрольная работа по темам
«Периодический закон и периодическая система химических элементов
Д.И. Менделеева. Строение атома», «Строение веществ. Химическая связь»
2 вариант
1. Порядковый номер галогена
1) 9 2) 18 3) 19 4) 10
2. Элемент 3 периода с формулой водородного соединения состава Rh4
1) алюминий 2) фосфор 3) азот 4) сера
3. Свойства оксидов в ряду А12О3 → SiО2 → P2О5 изменяются от
1) амфотерных к основным
2) основных к кислотным
3) амфотерных к кислотным
4) кислотных к основным
4. В ряду элементов P → S → Cl
1) увеличивается радиус атомов
2) уменьшается электроотрицательность
3) ослабевают неметаллические свойства
4) увеличиваются заряды ядер атомов
5. Установите соответствие:
Положение в периодической системе Элемент
А) 2 период, 5 группа 1) барий
Б
В
Г
В) 6 период, 2 группа, побочная подгруппа 3) ртуть
Г) 4 период, 1 группа, главная подгруппа 4) калий
5) медь
6) сера
6. Установите соответствие:
Б
В
Формула Вид химической связи А) KCl 1) ковалентная неполярная
Б) Cl2 2) ковалентная полярная
В) PCl3 3) ионная
7. Атом элемента имеет на 4 электрона меньше, чем ион хлора. Определите элемент.
8. Определите степени окисления атомов элементов
N2O3 , N2 , Nh4 , N2O5 , KNO3
9. Определите элемент IV группы, молярная масса оксида которого равна 80.
10. Расставьте коэффициенты с помощью схемы электронного баланса, укажите окислитель и восстановитель
h3 + F2 = HF
11. Охарактеризуйте по периодической системе серу.
infourok.ru
«Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома»
Здесь Вы можете скачать Контрольная работа по теме: «Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома» для предмета : Физика. Данный документ поможет вам подготовить хороший и качественный материал для урока.
Контрольная работа по теме:
«Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома»
Вариант 1
Часть А:
А 1. Ядро атома заряжено положительно благодаря наличию в нем:
а) протонов, б) нейтронов, в) электронов, г) катионов.
А 2. Номер периода в периодической системе определяется:
а) зарядом ядра, б) числом электронов в наружном слое атома,
в) числом электронных слоев в атоме, г) числом электронов в атоме.
А 3. Число орбиталей на внешнем энергетическом уровне атома азота равно:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Форму объемной восьмерки имеет орбиталь:
а) s, б) p, в) d, г) f.
А 5. Число энергетических уровней в атоме химического элемента совпадает:
а) с порядковым номером, б) с номером группы, в) с относительной атомной массой, г) с номером периода.
А 6. Электронная конфигурация 1s22s22p63s23p63d104s24p2 соответствует атому:
а) титана, б) кальция, в) германия, г) цинка.
А 7. К какому семейству s – элементов относится:
а) кислород, б) гелий, в) хром, г) неодим.
А 8. Максимальная валентность атома углерода в возбужденном состоянии равна:
а) одному, б) двум, в) трем, г) четырем.
А 9. Число свободных орбиталей в атоме хлора в основном состоянии равно:
а) одному, б) трем, в) пяти, г) нулю.
А 10. Наиболее ярко выражены металлические свойства у элемента:
а) калия, б) кальция, в) магния, г) натрия.
А 11. Элемент, электронная конфигурация которого……3s23p4, расположен:
а) во втором периоде, б) в третьем периоде, в) в четвертом периоде, г) в шестом периоде.
А 12. Из приведенных ниже электронных формул выберите ту, которая соответствует p – элементу 4 группы:
а) ….4s24p64d35s2, б) ….4s24p2 , в) ….3s23p63d104s2 4p3, г)….2s22p4.
А 13. Число электронов на внешнем энергетическом уровне атомов в ряду N – P – As –Sb - Bi:
а) увеличивается, б) уменьшается, в) не изменяется, г) изменяется периодически.
А 14. Из приведенных ниже элементов 3 – го периода наиболее ярко выраженные неметаллические свойства имеет:
а) Al, б) S, в) Si, г) Ar.
А 15. Распределение валентных электронов в атоме соответствует конфигурации ….ns2np2. Формулы летучего водородного соединения и высшего оксида этого элемента соответственно:
а) Н2Э и ЭО2, б) ЭН4 и ЭO2, в) ЭН4 и ЭO г) Эh3 и ЭO.
Часть Б:
Б 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 134, причем число нейтронов превышает число электронов на 11. Напишите название элемента.
Б 2. Два атома имеют одинаковое число протонов, но разное число нейтронов в ядре. Как они называются по отношению друг к другу ( в ответе укажите термин во множественном числе)?
Б 3. С атомом калия произошло превращение К0 – х → К+. Как называется частица х, которую отдал атом калия, превращаясь в катион?
Б 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет неподеленную электронную пару: h3, Nh4, Ch5, C2H6.
Б 5. По электронной формуле 1s22s22p63s23p6 3d104s2 определите его положение в периодической системе. Определите к какому семейству принадлежит этот элемент. ( ответ дайте в именительном падеже).
Часть С:
С 1. Охарактеризуйте химический элемент №31 на основании положения в периодической системе по следующему плану:
Состав и заряд ядра, общее число электронов в атоме, их распределение по энергетическим уровням и подуровням (электронная формула), семейство элементов, металл или неметалл, максимальная и минимальная степень окисления, формула водородного соединения, формула и тип высшего оксида, формула и характер соответствующего ему гидроксида.
С2. Как изменяются металлические свойства, неметаллические свойства и радиусы атомов элементов с увеличением их порядкового номера в малых периодах и главных подгруппах в таблице Д.И.Менделеева.
С 3. Определите валентные возможности атома серы в основном и возбужденном состояниях. Напишите формулы соединений этого элемента, в которых нон проявляет указанные вами валентности.
Вариант 2
Часть А:
А 1.Определите химический элемент по составу его атомной частицы – 18p, 20n, 18e:
а) F, б) Ca, в) Ar, г) Sr.
А 2. Общее число электронов у иона хрома Cr3+:
а) S0, б) Si0, в) O2-, г) Ne+.
А 3. Восемь электронов на внешнем электронном слое имеет:
а) одному, б) трем, в) четырем, г) пяти.
А 4. Максимальное число электронов, занимающих 3s – орбиталь, равно:
а) 1, б) 2, в) 6, г) 8.
А 5. Число орбиталей на f-подуровне:
а) 1, б) 3, в) 5, г) 7.
А 6. К p- элементам относится:
а) кремний, б) магний, в) водород, г) хром.
А 7. Элемент, атомы которого имеют электронную конфигурацию 1s22s22p63s23p63d104s1 - это:
а) K, б) Ca, в) Ba, г) Na.
А 8. Из приведенных элементов 4 – го периода наиболее ярко выраженные металлические свойства имеет:
а) Zn, б) Cr, в) K, г) Cu.
А 9. Наименьший радиус атома среди приведенных элементов имеет:
а) Mg, б) Ca, в) Si, г) Cl.
А 10. Из приведенных ниже элементов 3 – го периода наиболее ярко выраженные неметаллические свойства имеет:
а) Al, б) S, в) Si , г) Ar.
А 11. Порядковый номер элементов в периодической системе определяется:
а) зарядом ядра атома, б) числом электронов в наружном слое,
в) числом электронных слоев в атоме, г) числом нейтронов в атоме.
А 12. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
а) B и Si, б) S и Se, в) K и Ca, г) Mn и Fe.
А 13. Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают:
а) 54Fe , б) 56Fe, в) 57Fe, г) 58Fe.
А 14. Ряд элементов, расположенных в порядке усиления металлических свойств:
а) Sr – Rb - K, б) Be – Li - K, в) Na – K - Ca, г) Al – Mg - Be.
А 15. Оксиды бериллия, магния и кальция соответственно относятся:
а) к основным, амфотерным, кислотным, б) только основным,
в) к кислотным, амфотерным, основным , г) к амфотерным, основным, основным.
Часть Б:
Б 1. Сумма чисел протонов, нейтронов и электронов в атоме равна 273, причем число нейтронов превышает число электронов на 117. Напишите название элемента.
Б 2. Формула высшего оксида неметалла имеет формулу Э2О7. Как будет выглядеть формула летучего водородного соединения этого элемента, в какой группе периодической системы он находится?
Б 3. С атомом натрия произошло превращение Na0 – х → Na+. Как называется частица х, которую отдал атом натрия превращаясь в катион?
Б 4. Назовите вещество из числа предложенных, в котором атом неметалла имеет четыре неспаренных электрона, которые участвуют в образовании связи: h3, Nh4, Ch5, C2H6.
Б 5. Расположите элементы: Si, B, O, Mg, P, Al, Cl в порядке возрастания восстановительных свойств.
Часть С:
С 1. Охарактеризуйте химический элемент№29 на основании положения в периодической системе по следующему плану:
Состав и заряд ядра, общее число электронов в атоме, их распределение по энергетическим уровням и подуровням (электронная формула), семейство элементов, металл или неметалл, максимальная и минимальная степень окисления, формула водородного соединения, формула и тип высшего оксида, формула и характер соответствующего ему гидроксида.
С 2. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2,47% водорода. Определите этот элемент. Напишите формулу его соединения с водородом.
С 3. Определите валентные возможности атома хлора в основном и возбужденном состояниях. Напишите формулы соединений этого элемента, в которых нон проявляет указанные вами валентности.
docbase.org